文章信息
- 刘方春, 邢尚军, 马海林, 杜振宇, 马丙尧
- Liu Fangchun, Xing Shangjun, Ma Hailin, Du Zhenyu, Ma Bingyao
- 干旱胁迫下植物根际促生细菌对侧柏生长及生理生态特征的影响
- Effects of Plant Growth-Promoting Rhizobacteria on Physio-Ecological Characteristics of Platycladus orientalis under Drought Stress
- 林业科学, 2014, 50(6): 67-73
- Scientia Silvae Sinicae, 2014, 50(6): 67-73.
- DOI: 10.11707/j.1001-7488.20140609
-
文章历史
- 收稿日期:2013-06-02
- 修回日期:2013-09-11
-
作者相关文章
全球环境变化引起全球水热格局的重新分布,对全球植物产生严重影响(Mouillon et al.,2006),我国干旱半干旱地区约占国土面积的50%(王宇超等,2010)。通过接种外源基因和人工合成菌剂来提高植物在干旱环境中的适应能力是近年来国内外研究的热点领域(Alvarez1 et al., 2009)。多立安等(2011)利用一些垃圾堆肥复合菌剂来提高草坪植物的抗旱性,证明复合菌剂可缓解干旱胁迫对植物的伤害,提高抗旱性。贺学礼等(2008)研究AM真菌对油蒿(Artemisia ordosica)抗旱性的影响,结果表明,在植物生长前期接种AM真菌可以增强植物抵抗生长中后期环境干旱的能力。尽管植物接种微生物提高植物抗旱性的研究报道很多,但从根际土壤中筛选植物根际促生细菌(PGPR),并应用于植物抗旱性的研究还未见报道。
PGPR是指生存在植物根际范围中,对植物生长有促进或对病原菌有拮抗作用的有益细菌统称,对植物生长及病害防治有极其重要的作用(Verma et al.,2010)。PGPR对植物根际土壤生态环境的改善、植物生长,尤其是植物根系生长具有显著的促进作用(刘方春等,2012;Abbasi et al.,2011;Krey et al.,2011),而在PGPR的研究过程中,有关其在干旱胁迫生境下对植物生长和生理生态特征影响的研究还未见报道。
侧柏(Platycladus orientalis)具有防风固沙、保持水土的效能,是我国营造海岸林和荒山荒滩造林的先锋树种(王玉山等,2011)。本研究从植物根际土壤中筛选出1株PGPR,并对其进行鉴定,然后配制成微生物菌剂接种到侧柏根际土壤中。在正常浇水、轻度干旱、中度干旱和重度干旱4个干旱水平下,研究根际促生细菌对侧柏生理生化特征和干物质积累的影响,旨在为PGPR在植物抗旱中的应用提供理论依据。
1 材料和方法 1.1 菌种的筛选及鉴定利用梯度稀释法和三区划线法从植物根际土壤中分离、纯化出细菌分离物,通过小麦叶片保绿法和萝卜子叶增重法筛选出促生和保绿效果较好的1株细菌分离物。对细菌分离物的菌落形态、菌体细胞形态及生理生化性状进行测定,并结合其16S rDNA基因序列进行分子生物学鉴定(Garrity et al.,2004)。
1.2 盆栽试验地点与供试材料 1.2.1 试验基本情况干旱试验于2011—2012年在山东省林业科学研究院试验苗圃的塑料大棚内进行。盆栽用聚乙烯盆(30 cm× 25 cm),每盆装干土(7.30 ± 0.20)kg,随机排列,重复5次。供试土壤类型为潮土,其碱解氮、速效磷和速效钾含量分别为34.4,34.6和86.2 mg·kg-1,pH7.75,田间持水量为33.2%。试验材料选用山东省林业科学研究院培育的侧柏容器苗,平均株高(54.46 ± 0.19)cm,平均地径(0.91 ± 0.041)cm。
1.2.2 干旱试验设计试验设正常浇水(CK,田间持水量的 60%~70%)、轻度干旱(LD,田间持水量的50%~60%)、中度干旱(MD,田间持水量的 40%~50%)和重度干旱(SD,田间持水量的30%~40%)4个水分处理。
1.2.3 PGPR试验设计将筛选出的PGPR接入牛肉膏蛋白胨培养基(牛肉膏0.3%,蛋白胨1%,氯化钠0.5%,琼脂2%,pH 7.0~7.2,以上均为质量百分比)中,于37 ℃,180 r·min-1条件下振荡培养2天。发酵液 6 000 r·min-1下离心5 min,用无菌生理盐水润洗菌体3次后,无菌生理盐水调节菌悬液(2.0×108 cfu·mL-1)制成接种剂。取菌悬液20 mL用水稀释至500 mL,侧柏苗沾根后定植,剩余的菌液均匀浇灌于侧柏根系周围。4个干旱试验处理均设接种PGPR和浇灌等体积生理盐水(NS)2个处理。利用英国产便携式HH2型(WET-2-K1型探头)土壤水分/盐分/温度计于每天上午9:00定时测量土壤水分含量,如水分含量低于干旱处理的下限,则浇水至不同水分处理的上限,使土壤水分含量始终保持在干旱设计的范围内。在胁迫120天后,分地上部和地下部分别取样,称质量后立即进行植物内源激素及生理生态指标的测定。
1.3 测定项目与方法 1.3.1 菌落基本性质及16S rDNA序列测定依照Garrity等(2004)的方法,对PGPR的菌落形态,菌体细胞形态、生理生化性状及其16S rDNA序列进行测定。PCR反应体系(25 μL)为Taq酶(5U·μL-1)0.5 μL,10×Buffer(Mg2+)2.5 μL,dNTPs(10 mmoL·L-1)0.5 μL,引物(20 μmoL·L-1)0.5 μL,模板1 μL,Depc H2O 18 μL。PCR反应条件为95 ℃ 5 min; 94 °C 1 min,56 °C 1 min,72 ℃ 1.5 min,共30个循环; 72 ℃ 10 min。测序结果用NCBI数据库中的BLAST进行相似性分析。使用MEGA4.0程序包,构建Interior branch test of phylogeny中的Neighbor-Joining Tree,进化距离采用Jukes-Cantor算法,系统树各分枝的置信度经重抽样法(bootstrap)1 000次重复检测。
1.3.2 细胞分裂素(激动素和反式玉米素)、吲哚乙酸和植物内源激素(生长素、玉米素、赤霉素和脱落酸)的测定利用高效液相色谱(HPLC)测定菌液中细胞分裂素和植物内源激素的含量,使用仪器为美国Agilent HP 1100 series型液相色谱仪,紫外检测波长254 nm,过C18柱(250 mm×4.6 mm),流动相为45%甲醇:55%(含0.5%醋酸)水,进样量20 μL,流速1 mL·min-1,外标法定量(Hussain et al.,2010)。参见刘琳等(2010)测定吲哚乙酸方法。
1.3.3 生理指标测定叶片过氧化物酶(peroxidase,POD)活性的测定采用愈创木酚法; 过氧化氢酶(catalase,CAT)活性采用紫外分光光度法测定(李合生,2003); 脯氨酸含量采用磺基水杨酸提取茚三酮显色法测定; 可溶性糖含量采用蒽酮比色法测定; 膜脂过氧化产物(丙二醛,MDA)含量采用硫代巴比妥酸法测定(李合生,2003)。
1.4 数据处理与统计分析采用 SPSS 17. 0 统计软件进行数据统计,用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)比较不同处理组数据的差异(P<0.05),结果为3次重复试验的平均值。
胁迫指数(WSI)=处理器官干物质量/对照器官干物质量(李国龙等,2011)。
2 结果与分析 2.1 植物根际促生细菌的性质及鉴定筛选的植物根际促生细菌的部分特征见表 1,筛选出的植物根际促生细菌在LB平板上培养24 h后形成有光泽白色菌落,不规则圆形,不透明,表面粗糙,扁平,菌体细胞大小为(1~1.2)μm×(3~5)μm;产芽孢,G+,细胞呈杆状。该菌株具有一定的产细胞分裂素和吲哚乙酸的能力,其分泌吲哚乙酸、激动素和反式玉米素的含量分别为14.34 μg·mL-1(OD600)-1、435.38 ng·mL-1和214.72 ng·mL-1。
|
|
从筛选菌株的生化特征可以看出,植物根际促生细菌与Bacillus cereus的模式种生理生化指标上具有相同的特征。将筛选出的根际促生细菌的16S rDNA基因序列提交GenBank,所得收录号为KC428751。菌株的系统进化树构建结果见图 1,KC428751与Bacillus subtilis同处于一个分支,进化距离最近。其16S rRNA基因序列与Bacillus cereus(AE016877)的相似性达98%,综合生理生化结果将其鉴定为蜡样芽孢杆菌(Bacillus cereus)。
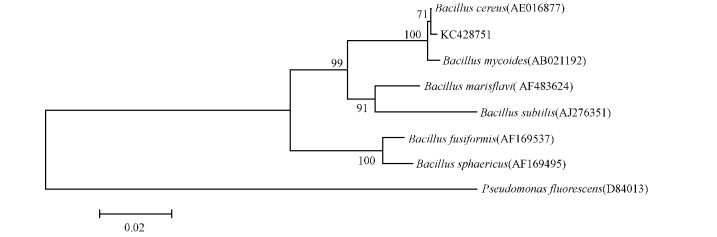 |
图 1 基于16S rRNA基因序列的系统发育树 Fig. 1 Phylogenetic tree based on 16S rRNA genes sequemce |
不同试验处理对侧柏抗氧化酶、渗透调节物质和膜脂过氧化产物的影响。总体来看,无论是否接种PGPR,随着干旱强度的增加,侧柏的抗氧化酶活性、渗透调节物质和膜脂过氧化产物的含量均呈现逐渐增加的趋势(浇灌生理盐水处理的POD活性除外,在中度胁迫时达到最大值,在重度胁迫时显著下降)。同正常浇水处理相比,接种PGPR处理在重度干旱时CAT、脯氨酸、可溶性糖和MDA含量分别增加了60.50%,204.44%,156.21%和73.66%,而浇灌生理盐水处理分别增加了36.89%,288.92%,210.70%和123.07%(表 2)。由此可见,随着干旱强度的变化,PGPR并未改变抗氧化酶、渗透调节物质和膜脂过氧化产物的变化趋势。
|
|
正常浇水的情况下,接种PGPR和浇灌生理盐水的抗氧化酶活性差异不显著。而在轻度胁迫、中度干旱和重度干旱下,同浇灌生理盐水处理相比,接种PGPR处理的POD活性分别提高21.61%,24.11%和44.92%,CAT活性分别增加12.26%,12.67%和21.33%。在正常浇水和干旱胁迫强度较轻时,接种PGPR和浇灌生理盐水的渗透调节物质差异不显著,但随着干旱胁迫强度的增加,两者之间的差异逐渐达到显著水平,在中度干旱时,接种PGPR处理脯氨酸显著低于正常浇水,在重度干旱时,脯氨酸和可溶性糖含量显著低于浇灌生理盐水处理。同渗透调节物质的变化规律相类似,正常浇水和轻度干旱时MDA的含量差异不显著,随着干旱胁迫强度的增加,接种PGPR处理的MDA含量开始显著低于浇灌生理盐水处理。由此可知,正常浇水的情况下,接种PGPR对侧柏抗氧化酶、渗透调节物质和膜脂过氧化产物的影响较小,而随着胁迫强度的增加,接种PGPR可显著提高抗氧化酶活性,降低渗透调节物质和膜脂过氧化产物在侧柏体内的积累。
2.3 干旱胁迫下植物根际促生细菌对内源激素的影响逆境环境下,植物激素会以浓度变化的方式控制着植物生理反应乃至基因表达,对植物的生长发育起到调节作用(Goodger et al.,2005)。随着干旱胁迫强度的增加,侧柏生长素、赤霉素和玉米素的含量逐渐降低(表 3)。同正常浇水处理相比,在重度胁迫时,接种PGPR处理的生长素、赤霉素和玉米素分别降低36.86%,29.11%和22.14%,浇灌生理盐水处理分别降低46.08%,40.23%和33.86%。无论是处于何种水分状态,接种PGPR处理的生长素、赤霉素和玉米素含量均不同程度的高于浇灌生理盐水处理,且随着胁迫强度的增加,这种差异有明显增强的趋势。以生长素为例,在4种水分处理中,接种PGPR处理分别增加11.72%,19.64%,24.56%和30.83%。
|
|
浇灌生理盐水处理中,随着干旱胁迫强度增加,脱落酸含量有逐渐增加的趋势,同正常浇水处理相比,3种干旱处理的脱落酸含量分别增加8.16%,57.14%和71.43%。而在PGPR处理中,正常浇水、轻度干旱和中度干旱时差异不显著,在重度干旱时显著降低。此外,在正常浇水和轻度干旱时,接种PGPR处理的脱落酸含量显著高于生理盐水处理,而在重度干旱时相反,PGPR处理的脱落酸含量显著降低了23.81%。
2.4 干旱胁迫下植物根际促生细菌对干物质积累分配的影响不同干旱强度显著影响侧柏地上部和地下部的干物质积累(图 2)。随着干旱强度的增加,无论是否接种PGPR,侧柏地上部和地下部干物质质量均有逐渐降低的趋势。同正常浇水处理相比,在重度干旱时,接种PGPR处理的地上部和地下部干物质重分别下降20.57%和25.73%,浇灌生理盐水处理则分别下降36.13%和15.32%。无论处于何种水分状态,接种PGPR均可不同程度地提高侧柏的干物质质量。在4种水分处理中,同浇灌生理盐水处理相比,接种PGPR处理的地上部干物质质量分别增加10.92%,16.67%,27.90和37.96%,地下部干物质质量分别增加17.20%,17.58%,8.89%和3.02%。随着干旱胁迫强度的增加,对根系影响越来越小,而对地上部干物质影响越来越大。此外,浇灌生理盐水处理中,4种水分处理的根冠比分别为19.79,20.78,24.86和26.18,即随着干旱胁迫强度的增加,根冠比有逐渐增加的趋势,而接种PGPR处理中,根冠比差异不显著,分别为20.90,20.94,21.01和19.56。
 |
图 2 不同试验处理的干物质及胁迫指数 Fig. 2 Effect of different treatments on dry matter accumulation and water stress index |
在同一种水分状态时,接种PGPR处理的干物质量胁迫指数明显大于浇灌生理盐水处理(图 2),分别增加11.96%,16.82%,24.12%和30.71%。随着胁迫强度增加,PGPR对胁迫指数影响有逐渐增强的趋势。这说明 PGPR可明显促进侧柏干物质积累,减轻干旱胁迫受到的伤害,且随着干旱胁迫强度的增加,PGPR的这种促进作用明显加强。
3 结论和讨论 3.1 叶片调节酶Arorad等(2002)研究指出,植物处于逆境条件时会导致植物细胞产生大量的活性氧物质,而植物可以通过增加或激活抗氧化酶系统来防御活性氧物质对细胞造成伤害(Xu et al.,2004),其中SOD和POD是保护系统的主要酶。酶活性越高,清除自由基的能力越强,植物的抗旱能力也就越强。正常浇水的情况下,接种蜡样芽孢杆菌和浇灌生理盐水处理的酶活性差异不显著,说明此时PGPR对侧柏的酶保护系统影响较小。而在3种干旱胁迫下,接种蜡样芽孢杆菌处理的酶活性都显著高于生理盐水处理,表明在干旱条件下,蜡样芽孢杆菌加速激活植物体内的活性氧清除系统,减少膜脂过氧化产物MDA的合成,从而减轻细胞膜脂过氧化的伤害,提高植物的抗旱性。从MDA在侧柏体内的积累浓度可知,即使在重度胁迫的生境中,接种蜡样芽孢杆菌处理的MDA含量仍然显著低于生理盐水处理,这也从侧面反映侧柏本身就具有较强的抗旱能力。渗透调节是植物适应干旱胁迫的一种重要生理机制。植物在干旱条件下可通过提高细胞内溶质浓度,降低渗透势,维持一定膨压,从而维持细胞各种生理过程正常进行。脯氨酸和可溶性糖是植物体内重要的渗透调节物质,干旱胁迫下脯氨酸和可溶性糖积累的现象已在许多植物上得到证实(黄承玲等,2011)。冯慧芳等(2011)研究发现,随着干旱胁迫强度的增加,尾叶桉(Eucalyptus urophylla)和枫香(Liquidambar formosana)在轻度胁迫时可溶性糖含量最大,而在中度胁迫时下降。而本研究随着干旱强度的增加,脯氨酸和可溶性糖的含量持续增加,并没有出现峰值。这可能与不同植物叶片对干旱胁迫进行适应性代谢调节的差异有关。马宗仁等(1993)提出了“时间差”理论,认为不同树种均存在一个耐受胁迫的极限。同尾叶桉和枫香等树种相比,侧柏的耐受极限明显增强,这可能是本研究的渗透调节物质没有出现峰值的原因之一。对于侧柏而言,本研究设置的重度干旱胁迫处理干旱胁迫程度较轻。在本研究干旱处理中,接种蜡样芽孢杆菌明显降低侧柏脯氨酸和可溶性糖的含量,说明接种蜡样芽孢杆菌后,受干旱胁迫影响较小,较低浓度的渗透调节物质即可维持保护酶的活性,从而提高侧柏的耐干旱能力。
3.2 内源激素内源激素促进植物生长,植物在受到逆境胁迫时,这类激素的含量会发生变化,以协调植株的生理活动(Goodger et al.,2005)。本研究中,接种蜡样芽孢杆菌对植物的内源激素有较大影响。无论处于何种水分状态,接种蜡样芽孢杆菌均显著提高侧柏玉米素的含量,玉米素的主要合成部位是根尖分生组织。植物根际促生细菌可促进植物生长,尤其是可提高根系中毛细根的比例,增强根系活力(Weyens et al.,2009; 刘方春等,2012),这可能是接种蜡样芽孢杆菌大幅提高玉米素含量的原因之一。本研究还发现,随着胁迫强度的增加,PGPR的这种促进作用有逐渐增强的趋势,这可能是由于随着干旱胁迫强度增加,光合产物积累差异越来越大。同时也表明玉米素与生长素和赤霉素之间存在互动的平衡反馈关系,即随着胁迫强度的增加,赤霉素和生长素含量也表现出相似的变化规律。无论是处于何种水分状态,接种PGPR处理的生长素、赤霉素和玉米素含量均不同程度的高于浇灌生理盐水处理,且随着胁迫强度的增加,这种差异逐渐增加。
脱落酸是一种对植物生长发育、抗逆性、气孔运动和基因表达等都有重要调节功能的植物激素(Thompson et al.,2007)。本研究结果表明,浇灌生理盐水处理中,随着干旱胁迫强度增加,脱落酸含量逐渐增加。这是植物为适应干旱环境而进行的正常生理调节(Arkhipova et al.,2007)。植物在干旱胁迫条件下,一定时间内会导致细胞水分状态变化,诱导脱落酸合成增加,有效地促进气孔关闭或部分关闭,降低蒸腾作用,从而提高水分利用效率(Arkhipova et al.,2007)。在正常浇水及轻度干旱时,接种PGPR显著增加脱落酸的含量,而重度干旱时显著降低。正常环境条件下,PGPR对根系生长具有较大的促生作用。而脱落酸主要是由根系产生的,导致在正常浇水和轻度干旱时,接种PGPR处理的脱落酸含量显著高于生理盐水处理。而随着干旱胁迫强度增加,根系生长受到严重限制,导致脱落酸含量在严重胁迫时显著下降。
3.3 侧柏的生长PGPR对植物生长具有显著的促进作用(Abbasi et al.,2011)。植物根际促生细菌的促生机制很多,其中最为重要的促生机制之一是通过产生一些植物生长调节物质来促进植物生长(Weyens et al.,2009)。细胞分裂素是一种重要的植物生长调节物质,可以缓解叶片中叶绿素的流失,具有保绿的作用。本研究利用小麦叶片保绿和萝卜子叶增重法筛选PGPR,既能保证筛选出的细菌分离物具有一定的促生作用,又使其具有产生细胞分裂素的可能。通过测定植物根际促生细菌的激素产生情况可知,本研究所用的细菌可分泌激动素、反式玉米素等不同的细胞分裂素,具备促进植物生长的潜力。细胞分裂素能够促进气孔开张,刺激植物地上部干物质积累,而降低根系生长(Arkhipova et al.,2007),PGPR对植物根系生长具有显著的促进作用(Pereyra et al.,2009; Liu et al.,2013)。本研究结果表明:正常水分环境下,接种蜡样芽孢杆菌大幅度提高了侧柏根系的生长,这与刘方春等(2012)在樱桃(Cerasus pseudocerasus)上的研究结果相类似。而随着干旱胁迫强度的增加,根系的生长逐渐受到抑制,但同浇灌生理盐水处理相比,地上部干物质的增加幅度越来越大,这说明在干旱生境下,接种蜡样芽孢杆菌可大幅提高植物地上部干物质的积累,这可能是PGPR分泌的细胞分裂素促进气孔开张,增强光合产物的积累,最终导致干物质的增加。
| [1] |
多立安,王晶晶,赵树兰.2011.垃圾堆肥复合菌剂对干旱胁迫下草坪植物生理生态特性的影响.生态学报,31(16): 4717-4724.( 1) 1)
|
| [2] |
冯慧芳,薛立,任向荣,等.2011.4种阔叶幼苗对PEG模拟干旱的生理响应.生态学报,31(2): 371-382.( 1) 1)
|
| [3] |
贺学礼,张焕仕,赵丽莉.2008.不同土壤中水分胁迫和AM真菌对油蒿抗旱性的影响.植物生态学报,32(5): 994-1001.( 1) 1)
|
| [4] |
黄承玲,陈训,高贵龙.2011.3种高山杜鹃对持续干旱的生理响应及抗旱性评价.林业科学,47(6): 48-55.( 1) 1)
|
| [5] |
李国龙,吴海霞,温丽,等.2011.甜菜苗期抗旱鉴定指标筛选及其综合评价.干旱地区农业研究,29(4):69-74.( 1) 1)
|
| [6] |
李合生.2003.植物生理生化试验原理和技术.北京:高等教育出版社.( 2) 2)
|
| [7] |
刘方春,邢尚军,马海林,等.2012.PGPR生物肥对甜樱桃(Cerasus pseudocerasus)根际土壤生物学特征的影响.应用与环境生物学报,18(5): 722-727.( 3) 3)
|
| [8] |
刘琳,孙磊,张瑞英,等.2010.春兰根中可分泌吲哚乙酸的内生细菌多样性.生物多样性,18(2): 195-200.( 1) 1)
|
| [9] |
马宗仁,刘荣堂.1993.牧草抗旱生理的基本原理.兰州:兰州大学出版社.( 1) 1)
|
| [10] |
王宇超,王得祥,彭少兵,等.2010.干旱胁迫对木本滨藜生理特性的影响.林业科学,46(1): 61-67.( 1) 1)
|
| [11] |
王玉山,邢世岩,唐海霞,等.2011.侧柏种源遗传多样性分析.林业科学,47(7): 91-96.( 1) 1)
|
| [12] |
Abbasi M K,Sharif S,Kazmi M, et al.2011.Isolation of plant growth promoting rhizobacteria from wheat rhizosphere and their effect on improving growth,yield and nutrient uptake of plants.Plant Biosystems,145(1): 159-168.( 2) 2)
|
| [13] |
Alvarez1 M,Huygens D,Fernandez C,et al. 2009.Effect of ectomycorrhizal colonization and drought on reactive oxygen species metabolism of Nothofagus dombeyi roots.Tree Physiology,29(8): 1047-1057.( 1) 1)
|
| [14] |
Arkhipova T N,Prinsen E,Veselov S U,et al. 2007.Cytokinin producing bacteria enhance plant growth in drying soil.Plant Soil,292(1/2): 305-315.( 3) 3)
|
| [15] |
Arora A,Sairam R K,Srivastava G C.2002.Oxidative stress and antioxidative system in plants.Current Science,82(10): 1227-1238.( 1) 1)
|
| [16] |
Garrity G M,Bell J A,Lilburn T G.2004.Taxonomic outline of the prokaryotes bergey's manual of systematic bacteriology.2nd ed.New York: Heidelberg Springer-verlag.( 2) 2)
|
| [17] |
Goodger J Q D,Sharp R E,Marsh E L,et al. 2005.Relationships between xylem sap constituents and leaf conductance of well-watered and water-stressed maize across three xylem sap sampling techniques.Journal of Experimental Botany,56(419): 2389-2400.( 2) 2)
|
| [18] |
Hussain A,Hasnain S.2010.Phytostimulation and biofertilization in wheat by cyanobacteria.J Ind Microbiol Biotechnol,38(1):85-92.( 1) 1)
|
| [19] |
Krey T,Caus M,Baum C, et al.2011.Interactive effects of plant growth-promoting rhizobacteria and organic fertilization on P nutrition of Zea mays L.and Brassica napus L.J Plant Nutr,Soil Sci,174(4): 602-613.( 1) 1)
|
| [20] |
Liu F C,Xing S J,Ma H L,et al. 2013.Plant growth-promoting rhizobacteria affect the growth and nutrient uptake of Fraxinus americana container seedlings.Appl Microbiol Biotechnol,97(10): 4617-4625.( 1) 1)
|
| [21] |
Mouillon J M,Gustafsson P,Harryson P.2006.Structural investigation of disordered stress proteins comparison of full-length dehydrins with isolated peptides of their conserved segments.Plant Physiology,141(2): 638-650.( 1) 1)
|
| [22] |
Pereyra M A,Ballesteros F M,Creus C M,et al. 2009.Seedlings growth promotion by Azospirillum brasilense under normal and drought conditions remains unaltered in Tebuconazole-treated wheat seeds.Europ J Soil Biol,45(1):20-27.( 1) 1)
|
| [23] |
Thompson A J,Mulholland B J,Jackson A C,et al. 2007.Regulation and manipulation of ABA biosynthesis in roots.Plant Cell and Environment,30(1): 67-68.( 1) 1)
|
| [24] |
Verma J P,Yadav J,Tiwari K N, et al.2010.Impact of plant growth promoting rhizobacteria on crop production.International Journal of Agricultural Research,5(11): 954-983.( 1) 1)
|
| [25] |
Weyens N,Lelie D V D,Taghavi S, et al.2009.Exploiting plant-microbe partnerships to improve biomass production and remediation.Trends Biotechnol,27(10):591-598.( 2) 2)
|
| [26] |
Xu Q,Huang B R.2004.Antioxidant metabolism associated with summer leaf senescence and turf quality decline for creeping bentgrass.Crop Science,44(2): 553-560.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

