文章信息
- 施琼, 胡峰, 黄烈健, 詹妮
- Shi Qiong, Hu Feng, Huang Liejian, Zhan Ni
- 马大杂种相思腋芽高效组培增殖体系
- An Efficient Axillary Bud Multiplication System of Acacia mangium × A. auriculiformis
- 林业科学, 2014, 50(6): 55-60
- Scientia Silvae Sinicae, 2014, 50(6): 55-60.
- DOI: 10.11707/j.1001-7488.20140607
-
文章历史
- 收稿日期:2013-07-23
- 修回日期:2013-09-11
-
作者相关文章
2. 厦门大学生命科学学院 厦门 361005
2. School of Life Sciences, Xiamen University Xiamen 361005
金合欢属(Acacia)植物是一类短轮伐期多用途山地造林速生树种(何文锦等,2007)。马大杂种相思(Acacia mangium× A. auriculiformis)是以马占相思( A. mangium)为母本、大叶相思( A. auriculiformis)为父本的天然杂交种,树干通直、分枝细小,木材性能与马占相思接近,且比马占相思有更高的木材密度和纤维素含量,被广泛用于工业造纸和家具装饰。马大杂种相思还具速生、涵水保土的性能(Nor Asmah et al.,2012),能与土壤中的根瘤菌共生,亦是城市绿化、营造高效生态混交林的优良树种(赵亚林等,2010)。然而,马大杂种相思种子繁殖的后代性状分化严重(Gidiman et al.,2003),不能通过播种大量繁殖苗木。
组织培养既能实现植物个体的快速大量繁殖,又能较好地保持植物的种质特性,在实现马大杂种相思的工厂化育苗、加快其推广应用等方面具有重要意义。增殖培养是组织培养技术的关键环节,目前,对马大杂种相思组培快繁技术的研究主要集中在离体快繁体系的构建(Gidiman et al.,2003; 熊建勇等,2011; 周丽华等,1996; Toda et al.,1995)、人工种子的合成(Nor Asmah et al.,2012; 2011)等方面。这些报导仅研究了单次继代的增殖效率,而工厂化生产中,需多次继代培养以在短时期内获得大量的组培苗,而关于马大杂种相思多次继代的增殖效率相关研究未见报道。此外,马大杂种相思快繁技术还存在增殖时间偏长、增殖苗质量偏差、增殖苗生根率较低等缺陷。本研究通过筛选外植体茎段的腋芽数、调整增殖培养基类型,对如何在多次继代培养中获得高效稳定的增殖效果、健壮的增殖苗、较高的生根率进行了系统的研究,建立了一套快速、高效、高质的马大杂种相思腋芽增殖体系。
1 材料与方法 1.1 供试材料从中国林业科学研究院热带林业研究所马大杂种相思测定试验林中单株选优,剪取16年生优良单株(AMA12001)的当年新生带腋芽枝条,参考黄烈健等(2012)对外植体的处理方法,将消毒后的含腋芽茎段接种在MS培养基上初代培养。约45天后,选择初代培养生长健壮的新萌芽作为试验材料。
1.2 试验方法 1.2.1 增殖时间的确定及茎段腋芽数对增殖的影响以初代培养生长健壮的新萌芽为材料,剪取含1个腋芽、2个腋芽、3个腋芽、4个腋芽的无菌茎段,分别接种在MS+6-BA1.5 mg·L-1 +NAA0.1 mg·L-1培养基上,共4个处理,每组处理接种20个茎段,重复3次,接种第25,35,45天时调查增殖苗生长情况并统计其有效增殖倍数和单株繁殖系数。
单株繁殖系数是指1株完整的无菌苗经过1次增殖培养后,得到新的无菌苗的数目。本研究计算方式为: 单株切取的茎段数×有效增殖倍数。
1.2.2 增殖培养基的筛选1)激素对增殖的影响 以MS为基本培养基,分别添加0.5,1.0,1.5,2.0 mg·L-1的6-BA,附加NAA 0.1 mg·L-1,探讨细胞分裂素对增殖的影响; 以MS为基本培养基,分别添加0.05,0.1,0.5,1.0 mg·L-1的NAA,附加6-BA 1.5 mg·L-1,探讨生长素对增殖的影响。共8个处理,每个处理接种20个茎段,重复3次,35天后调查增殖苗生长情况并统计其有效增殖倍数。
2)基本培养基对增殖的影响 分别以1/2MS、MS、改良MS(大量元素减半)为基本培养基,附加上一步筛选出的最佳激素,共3个处理,每个处理接种20个茎段,重复3次,35天后调查增殖苗的生长情况并统计有效增殖倍数。
3)活性炭对增殖的影响 选择步骤2)筛选出的最佳培养基,分别添加浓度为0.04,0.1,0.5 g·L-1的活性炭,共3个处理,每个处理接种20个茎段,重复3次,35天后调查增殖苗的生长情况并统计有效增殖倍数。
1.2.3 继代次数对增殖的影响以初代培养的新萌芽(含1个腋芽)为第1次继代的材料,后6次继代依次以上一次继代培养的增殖芽茎段(含1个腋芽)为材料,接种在上述步骤中选出的增殖倍数最高的改良MS+6-BA1.5 mg·L-1 +NAA0.1 mg·L-1(I型)和芽长势最好的改良MS+6-BA1.5 mg·L-1 +NAA0.1 mg·L-1+Ac0.04 g·L-1(Ⅱ型)2种培养基上分别进行7次继代培养,每35天继代1次,每个处理接种20个茎段,重复3次,调查第1,3,5,7代增殖苗的生长情况并统计其有效增殖倍数和单株繁殖系数。
1.2.4 2种类型的增殖芽对生根的影响将在2种类型的增殖培养基上经过连续7次继代培养后的增殖芽剪成含2~3个腋芽的茎段,分别接入前期预试验筛选出的生根培养基1/2MS+IBA1.0 mg·L-1+NAA0.5 mg·L-1中,每个处理接种20个茎段,重复3次,15天后调查生根苗的生长情况并统计生根率。
以上试验均添加琼脂7 g·L-1、蔗糖3%,调节pH值至5.5~6.5后,培养基在121 ℃下高压灭菌15 min,培养温度为(25±2)℃,光周期为14 h·d-1。
1.3 统计分析使用Excel,SPSS18.0,Origin pro7.5对数据进行处理和方差分析,以最小显著差数法(LSD)评价差异的显著性。
2 结果与分析 2.1 马大杂种相思腋芽增殖时间的确定及茎段腋芽数对增殖倍数的影响无菌茎段接入培养基约10天后即有新叶形成; 15天左右茎段的腋芽处开始冒出新芽; 25天左右新芽大量冒出,但芽长势较弱、有效芽少; 45天后芽的生长趋势开始下降,有效芽数目趋于稳定。方差分析表明,腋芽数不同的茎段的平均增殖倍数未达到显著差异水平,且3次调查发现(表 1),在各个增殖阶段,4组试验的增殖芽总体长势无明显区别。第35天、45天调查结果表明,虽然含1个腋芽茎段的平均增殖倍数略低于含2个、3个、4个腋芽的茎段,但其单株繁殖系数分别为13.2和15.96,远远高于其他处理,是较为理想的试验材料类型。虽然第45天的有效增殖倍数比第35天的略高,但第35天的芽生长健壮足以进行下一步试验。因此,从缩短增殖时间、提高增殖效率的角度出发,认为 35天是比较适宜的增殖周期。
|
|
经方差分析,不同浓度的细胞分裂素(6-BA)和生长素(NAA)对平均增殖倍数的影响均达显著水平(表 2)。当NAA为0.1 mg·L-1时,腋芽分化现象随着6-BA浓度升高逐渐明显,当6-BA浓度为1.0 mg·L-1,平均增殖倍数达到3.53,显著高于其他浓度诱导的平均增殖倍数,而后随着6-BA浓度升高,芽的质量逐渐下降,有效芽数目减少(图 3A),出现玻璃化现象;当6-BA为1.5 mg·L-1时,平均增殖倍数随着NAA浓度的升高呈现先上升后下降的趋势,但增殖苗的长势随NAA浓度的增加明显改善,NAA为0.1 mg·L-1时,平均增殖倍数最高为3.95。另外,马大杂种相思增殖芽的长势(健壮程度、玻璃化程度等)与激素的比例还存在较大关系,6-BA和NAA比例偏小时(1:1~5:1),苗高大健壮(图 3B),甚至有部分芽生根,但增殖倍数较低;当6-BA和NAA比例过高(20:1~30:1)时,增殖的芽弱小,叶片卷曲,玻璃化现象严重,有效芽少;只有当二者的比例在合适范围内(10:1~15:1)时,诱导芽的增殖和生长均达到最佳效果。当6-BA1.5 mg·L-1,NAA0.1 mg·L-1,二者的比例为15:1时,平均增殖倍数为3.95,且芽长势较好,增殖效果最佳。
|
|
基本培养基MS、1/2MS、改良MS对增殖的影响没有达到显著差异水平,平均增殖倍数分别为3.95,3.81,3.97,差值小于0.2(图 1A)。观察发现,MS培养基诱导的芽虽然较高大,但叶片颜色偏黄,有玻璃化现象存在;1/2MS诱导的芽矮小且叶片颜色偏黄;而改良MS则弥补了MS和1/2MS的缺陷,同时具有较高的增殖倍数和较好的芽长势。因此,改良MS适宜作为增殖培养的基本培养基。
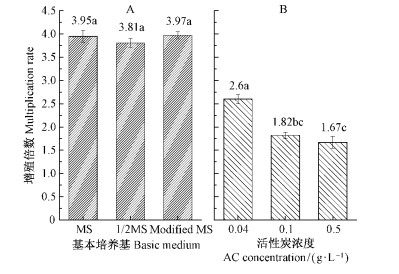 |
图 1 基本培养基和活性炭对马大杂种相思腋芽增殖的影响(P=0.05) Fig. 1 Effect of medium and active carbon on multiplication of axillary buds of Acacia mangium× A. auriculiformis (Significantly at P=0.05) |
活性炭浓度对增殖倍数的影响达到了显著差异水平,随着培养基中活性炭浓度的增加,平均增殖倍数呈下降趋势,当活性炭浓度由0增至0.04 g·L-1时,平均增殖倍数下降了1.37。但含0.04 g·L-1活性炭的培养基上的增殖芽的质量较好,茎段较粗,苗较高,叶片颜色较绿; 而当活性炭浓度上升至0.5 g·L-1时,形成的增殖芽更加健壮,调查还发现有52.8%的芽有生根现象,但此时的平均增殖倍数过低,为1.67(图 1B),不宜选用。
2.4 继代次数对马大杂种相思腋芽增殖的影响图 2(上)为在2种培养基中7次继代培养的增殖倍数的变化趋势。I型培养基诱导的平均增殖倍数由第1代的3.97倍下降至第7代的2.24,呈线性下降,下降率为17.35%。观察发现,该培养基诱导的增殖芽的长势逐次变差,玻璃化趋势增加,有效芽数目减少(图 3C,D)。而Ⅱ型培养基诱导的平均增殖倍数变化趋势不大,平均7次继代的平均增殖倍数为2.52,增殖芽的质量较好,芽健壮高大,叶片舒展(图 3E,F)。
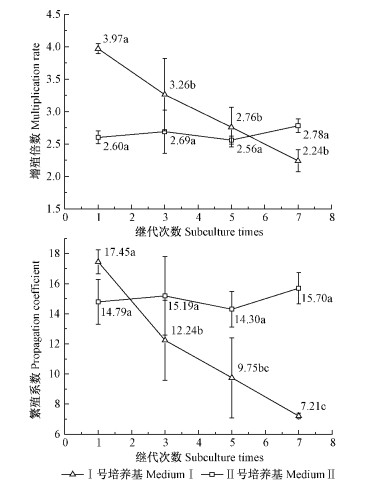 |
图 2 马大杂种相思腋芽在I型和Ⅱ型培养基上7次继代 培养的有效增殖倍数与单株繁殖系数 (P=0.05) Fig. 2 The multiplication rate and propagation coefficient of 7 subculture on medium I and Ⅱ of Acacia mangium× A. auriculiformis (significantly at P=0.05) 培养基 Medium Ⅰ: Modified-MS+6-BA1.5 mg·L-1 +NAA0.1 mg·L-1; Ⅱ: Modified-MS+6-BA1.5 mg·L-1 +NAA0.1 mg·L-1+Ac0.04 g·L-1。 |
图 2(下)为在2种培养基中单株繁殖系数与继代次数的关系。Ⅱ型培养基7次继代的单株繁殖系数较高,均值14.99,且表现较稳定。I型培养基单株繁殖系数下降明显,均值11.66。因此,Ⅱ型培养基是多次继代培养的最佳选择。
2.5 2种类型的马大杂种相思增殖芽对生根的影响将在2种增殖培养基上继代7次的增殖芽接种到生根培养基1/2MS+IBA1.0 mg·L-1+NAA0.5 mg·L-1中进行生根培养,生根培养7天左右,芽的基部及切口处开始陆续长出白色的愈伤组织,10天左右开始生根,15天调查结果(表 3)。
|
|
2种增殖培养基上的芽,生根率相差较大,I型增殖培养基上生长的芽生根率为77.14%,且根系质量较差,基部有大块的愈伤组织形成(图 3G),移栽存活率为89%; 而Ⅱ型增殖培养基上生长的芽生根率为96.56%,且根系较长,部分有须根形成,芽长势较好(图 3H),移栽存活率为95%(图 3I)。
 |
图 3 马大杂种相思增殖、生根及移栽 Fig. 3 The multiplication, rooting and transplantation of Acacia mangium× A. auriculiformis A,B: 分别为含高浓度6-BA(2.0 mg·L-1)和低浓度6-BA(0.5 mg·L-1)的培养基诱导的增殖芽; C,D: 分别为在Ⅰ型培养基上第1次和第7次继代的增殖芽; E,F: 分别为在Ⅱ型培养基上第1次和第7次继代的增殖芽; G,H: 分别为在I型和Ⅱ型培养基上7次继代后的增殖芽生根情况; I: 移栽30天后的马大杂种相思组培苗。 A,B: Multiplication plantlets induced by the medium containing 6-BA with higher concentration (2.0 mg·L-1) and lower concentration (0.5 mg·L-1) respectively; C,D: Multiplication plantlets induced by medium I after being subcultured 1 and 7 times respectively; E,F: Multiplication plantlets induced by medium Ⅱ after being subcultured 1 and 7 times respectively; G,H: Rooting of multiplication plantlets induced by medium I and medium Ⅱ respectively; I: Plantlets of Acacia mangium× A. auriculiformis after being transplanted 30 days. |
马大杂种相思以含1个腋芽的茎段为增殖试验材料时,其增殖倍数和芽体长势效果均较好,单株繁殖系数高,增殖时间短,能有效缩短生长周期,节约生产成本。改良MS+6-BA1.5 mg·L-1 +NAA0.1 mg·L-1+Ac0.04 g·L-1,多次继代的增殖效果稳定,7次继代的平均增殖倍数为2.52,单株繁殖系数高达14.99,且芽的长势较好。此外,将该增殖培养基诱导的芽进行生根培养时,生根率可达96.56%,是马大杂种相思腋芽增殖体系的最佳增殖培养基。
3.2 讨论 3.2.1 影响马大杂种相思腋芽增殖的相关因子植物对激素种类、浓度存在感受性差异(张国裕等,2004),如TDZ和IBA利于尖叶相思(Acacia caesia)的不定芽的诱导(Thambiraj et al.,2012),6-BA和IBA诱导辣椒(Capsicum annuum)增殖和生根效果较佳(Otroshy et al.,2011),6-BA和KIN对大果刺柏(Juniperus oxycedrus)组培苗的高效增殖和芽长势有利(Gómez et al.,1995),而6-BA和NAA则常用于相思类树种的增殖。提高细胞分裂素浓度增殖倍数会增加,同时芽的长势下降,玻璃化现象加重,从而导致有效芽减少(沈海龙,2005)。因此,选择合适的激素浓度对保证较高的增殖倍数和较好质量的芽极为重要。Signe等(2007)的研究表明,芽体的长势是受细胞分裂素和生长素共同刺激的。青钱柳(Cyclocarya paliurus)腋芽的诱导不仅受6-BA和NAA的绝对值影响,还受二者的比值影响,当比值在6~50时,增殖倍数最高(谢寅峰等,2011)。本研究表明:对马大杂种相思而言,细胞分裂素与生长素比为10:1至15:1时,增殖效果较好,以6-BA1.5 mg·L-1和NAA0.1 mg·L-1诱导芽效果最佳。
继代次数也是影响平均增殖倍数的重要因子。马占相思的研究结果表明: 随着继代次数增加,增殖倍数逐渐提高(裘珍飞等,2002)。而杨增海(1987)认为,多次继代的增殖芽长期受高浓度激素的刺激,组织细胞发生遗传性的改变,在培养过程中逐渐消耗了原有母体组织中存在的与器官形成相关的特殊物质,从而使细胞分化能力下降,多次继代的增殖倍数下降、增殖芽长势变弱。本研究结果表明: 马大杂种相思在增殖培养基上进行多次继代培养时,随着继代次数增加,增殖倍数呈下降趋势,这结果与杨增海(1987)的结论相一致。
3.2.2 如何提高增殖倍数、提升苗木质量、节约生产成本通过茎段先诱导出不定芽团,再进行芽的伸长这一途径可以有效地加快银条(Stachys floridana)的繁殖速度(张国裕等,2004),但此途径诱导出的不定芽团矮小,易玻璃化,不便操作。Signe等(2007)认为含1个腋芽的茎段增殖效果与含多个腋芽的茎段差别不大。本研究将不定芽按腋芽数分节进行增殖诱导,操作简便,单株繁殖系数大大提高,且芽长势好,利于多次继代和工厂化生产。
增殖培养不能片面地追求单次继代中的增殖倍数,忽略了植物的自然生长需求,可通过添加一类物质,在保持较高的增殖速度同时,保证芽的健康生长。活性炭作为一种添加剂,具有促进生根(George et al.,1997)、促进根茎生长(Kim et al.,1992)、吸收培养基内的有害物质(Fridborg et al.,1978)等作用。本研究证明,添加0.04 g·L-1活性炭,马大杂种相思多次继代的倍数稳定,增殖芽的玻璃化趋势减缓、生根率和生根苗的移栽存活率明显提高。另外,有关研究表明,在培养基中添加生物素(石大兴等,2003)、赤霉素(顾地周等,2009)等也能有效提高增殖倍数、改善组培苗的质量。
缩短生产周期和提高苗的移栽存活率是节约生产成本的有效方法之一。本试验在增殖35天时有效芽即可进行下一次继代培养。因此,从缩短生产周期的角度考虑,35天为最佳培养周期。选择有效增殖倍数不是最高但芽体较好的增殖培养基,并添加一定量的活性炭,多次继代后,有效增殖倍数保持稳定,组培苗质量未出现退化现象,有效改善了组培苗品质,提高了组培苗的生根率和移栽存活率,一定程度上缩减了生产成本,提高了生产效率。
| [1] |
顾地周,罗微,曹逊,等.2009.松毛翠的离体快繁体系建立及种质试管保存.林业科学,45(7): 140-144.( 1) 1)
|
| [2] |
何文锦,黄骐,陈由强,等.2007.灰木相思离体培养体系的构建.浙江林学院学报,24(6): 775-778.( 1) 1)
|
| [3] |
黄烈健,陈祖旭,张赛群,等.2012.马占相思优树组培快繁技术研究.林业科学研究,25(2): 227-230.( 1) 1)
|
| [4] |
裘珍飞,曾炳山,刘英.2002.马占相思优树组培早期增殖速率研究.林业科学研究,15(1): 61-65.( 1) 1)
|
| [5] |
沈海龙.2005.植物组织培养.北京:中国林业出版社,78-79.( 1) 1)
|
| [6] |
石大兴,王米力,石轶松,等.2003.巨桉芽器官离体培养与快繁体系建立的研究.林业科学,39(1): 69-74.( 1) 1)
|
| [7] |
谢寅峰,张志敏,尚旭岚,等.2011.青钱柳茎段腋芽萌发和丛生芽增殖.林业科学,47(1): 50-55.( 1) 1)
|
| [8] |
熊建勇,宗亦臣,常金财,等.2011.马大相思茎段的组织培养.育苗技术,(9): 29-30.( 1) 1)
|
| [9] |
杨增海.1987.园艺植物组织培养.北京:农业出版社,64.( 2) 2)
|
| [10] |
张国裕,程智慧,李娟,等.2004.银条不定芽诱导及高效增殖体系的建立.西北农林科技大学学报,32(2): 50-52.( 2) 2)
|
| [11] |
赵亚林,张方秋,张卫华,等.2010.不同形态氮素配比对马大杂种相思无性系幼苗生长的影响.广东林业科技,26(4): 18-23.( 1) 1)
|
| [12] |
周丽华,张华通,刘颂颂,等.1996.相思杂种-莞屏1号离体快速繁殖的研究.广东林业科技,12(3): 25-28.( 1) 1)
|
| [13] |
Fridborg G,Eriksson T.1978.Effects of actived charcoal on growth and morphogenesis in cells cultures.Physiol Plantarum,34(4): 306-308.( 1) 1)
|
| [14] |
George P S,Ravishankar G A.1997.In vitro multiplication of Vanilla planifolia using axillaries bud explants.Plant Cell Reports,16(7): 490-494.( 1) 1)
|
| [15] |
Gidiman J,Moo H,Hattah M,et al. 2003.Micropropagation of Acacia mangium ×A.auriculiformis hybrids in Sabah.Boiset Forets des Tropiques,(275): 77-82.( 2) 2)
|
| [16] |
Gómez M P,Segura J.1995.Axillary shoot proliferation in cultures of explants from mature Juniperus oxycedrus trees.Tree Physiology,15(9): 625-628.( 1) 1)
|
| [17] |
Kim J Y,Lee J S.1992.Effect of cultural conditions on rhizome growth and organogenesis of Cimbidium lancifolium native Korea in vitro.Journal of the Korean Society for Horticultural Science,33(6): 471-476.( 1) 1)
|
| [18] |
Nor Asmah H,Nor Hasnida H,Nashatul Zaimah N A,et al. 2011.Synthetic seed technology for encapsulation and regrowth of in vitro-derived Acacia hyrid shoot and axillary buds.African Journal of Biotechnology,10(40): 7820-7824.( 1) 1)
|
| [19] |
Nor Asmah H,Nor Hasnida H,Noraliza A,et al. 2012.In vitro propagation of Acacia hybrid through alginate-encapsulated shoots and axillary buds.African Journal of Biotechnology,11(65): 12814-12817.( 2) 2)
|
| [20] |
Otroshy M,Moradi K,Khayam Nekouei M.2011.The effect of different cytokenins in propogation of Capsicun annuum L.by in vitro nodal cutting.Trakia Journal of Sciences,9(3): 21-30.( 1) 1)
|
| [21] |
Signe Tomsone,rija Galeniece,Agnese Akere,et al. 2007.In vitro propagation of Syringa vulgaris L.Biologija,53(2): 28-31.( 2) 2)
|
| [22] |
Thambiraj J,Paulsamy S.2012.Rapid in vitro multiplication of the ethno-medicinal shrub, Acacia caesia (L.)Willd.(Mimosaceae)from leaf explants.Asian Pacific Journal of Tropical Biomedicine,2(2): 618-622.( 1) 1)
|
| [23] |
Toda T,Tajima M,Brini P B.1995.Tissue culture of Acacia mangium,A.auriculiformis and their hybrid.Bull Natl Forest Tree Breeding,(13): 157-165.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

