文章信息
- 李岳诚, 张大治, 贺达汉
- Li Yuecheng, Zhang Dazhi, He Dahan
- 荒漠景观固沙柠条林地地表甲虫多样性及其与环境因子的关系
- Species Diversity of Ground-Dwelling Beetles and Its Relationship with Environmental Factors in the Artificial Caragana Brushland of Fixed Sandy Lands in Ningxia
- 林业科学, 2014, 50(5): 109-117
- Scientia Silvae Sinicae, 2014, 50(5): 109-117.
- DOI: 10.11707/j.1001-7488.20140514
-
文章历史
- 收稿日期:2013-03-11
- 修回日期:2013-09-04
-
作者相关文章
2. 宁夏大学生命科学学院 银川 750021
2. School of Life Sciences, Ningxia University Yinchuan 750021
地表甲虫是环境变化的重要指示性昆虫之一(Eyre et al.,1996; Bohac,1999; Allegro et al.,2003; 高光彩等,2009)。荒漠景观地表甲虫长期对严酷环境的适应,使其在种类组成、分布和格局等方面具有独特性,成为荒漠生态系统的重要组成部分,在不同分类阶元水平上均表现出一定的环境指示作用(娄巧哲等,2011),而且不同的种类可以作为荒漠沙化程度的生态指示种(张大治等,2012)。由于不同类群所栖息的生物和非生物环境的时空尺度差异,群落多样性在一定的生态尺度范围也存在变异,尤其是人类对生态系统的管理方式直接影响着生物多样性(Magura et al.,2000; Yu et al.,2008)。本研究主要探讨荒漠景观中不同柠条(Caragana spp.)林生境中分布的地表甲虫的多样性差异、不同程度的干扰对地表甲虫的多样性影响和柠条林荒漠景观中哪些生态因子影响地表甲虫多样性的和分布等问题,以期了解荒漠景观柠条林中昆虫的群落分布及结构特征,并为宁夏白芨滩国家级自然保护区昆虫多样性研究、荒漠生态系统的监测与保护提供更多的基础资料。
1 研究区概况与研究方法 1.1 研究地点及样地研究区位于宁夏灵武白芨滩国家级自然保护区东北边缘的磁窑堡地区。该荒漠景观区域属中温带干旱气候,年均气温为6.7~8.8 ℃,年降雨量255.2 mm,年均蒸发量为2 862.2 mm,为年降水量的10.5倍,荒漠化土地面积较大,生态环境十分脆弱(宋朝枢等,1999)。在研究区内选择3种不同类型的生境斑块: 1)干旱型人工固沙柠条林地,地理坐标为106°38'23″—106°38'46″E,38°2'38″—38°38'42″N,海拔1 303~1 309 m。为人工栽植柠条锦鸡儿(C.korshinskii)区,树高均在2 m左右,植株呈不规则带状排列,其间有沙蒿(Artemisia desertorum)、花棒(Hedysarum scoparium)、刺沙蓬(Salsola pestifer)等沙生植被,盖度70%以上,面积约8.7 hm2。2)半湿润型沙地人工植被区,地理坐标为106°37'5″—106°37'31″E,38°2'14″—38°2'29″N,海拔1 330~1 350 m。植被主要有短花针茅(Stipa breviflora)、戈壁针茅(Stipa tianshanica)、沙生针茅(Stipa glareosa)、猫头刺(Oxytropis aciphylla)、川青锦鸡儿(Caragana tibetica)、柠条锦鸡儿、刺旋花(Convolvulus tragacanthoides)等,柠条锦鸡儿呈散生状,数量少,群落盖度为20%~50%,面积约8.4 hm2。3)干旱型半流动沙地,地理坐标为106°38'14″—106°37'58″E,38°2'45″—38°2'25″N,海拔1 315~1 325 m;土壤以风沙土为主,半固定流动沙丘,沙粒均匀,沙丘高2~7 m不等;植被主要为油蒿(A.ordosica)、老瓜头(Cynanchum komarouii)、甘草(Glycyrrhiza uralensis)、苦豆子(Sophora alopecuroides)、白草(Pennisetum centrasiaticum)、蒙古冰草(Agropyron mongolicum)、刺沙蓬、沙米(Agriophyllum squarrosum)、柠条等,少量柠条呈无序散生状,群落盖度30%~50%,面积约5.9 hm2。
1.2 标本的采集与鉴定地表甲虫采用巴氏罐诱法采集(于晓东等,2001; 2006),即使用一次性塑料杯作为陷阱对地表甲虫进行诱捕。塑料杯上口径7.2 cm,下口径5.2 cm,高10 cm,容积300 mL。在埋入地表前用小打孔器距杯口2 cm处打小孔若干,防止雨水灌满巴氏罐。埋入地表的诱杯,杯口与地表保持平齐,在每个塑料杯内加100 mL诱捕剂。诱捕剂的成分为醋、白糖、酒精、水,质量比为1:1:2:20。
每类生境按照5点取样法设置5个10 m×20 m的样方。每样方沿4条边及对角线每隔2 m设置1个诱杯,共40个。同一生境中,每个样方间隔至少300 m(通过手持GPS测量距离和确定方位)。于2009年5月至8月期间,每月采集1次,诱杯埋于样地,3天后收取。
将采集到的所有地表甲虫标本用75%酒精保存,回试验室后根据相关资料进行分科鉴定及优势种鉴定。利用可识别的分类单元(Oliver et al.,1993)进行种类估计,在形态种基础上进行数量统计。本次调查采集到的所有地表甲虫标本均保存在宁夏大学生命科学学院昆虫标本室。
1.3 环境因子的测定7月中下旬对各样地植物物种密度、植被盖度、土壤含水量和pH值等进行调查,并在各样地随机选取1 m×1 m的植被样方,测定植物物种的生物量(杨贵军等,2010)。采用距离法(吴甘霖等,2006)确定人为干扰强度系数。
1.4 数据处理与分析方法地表甲虫的多样性分析采用Margalef物种丰富度指数、Shannon-Wiener多样性指数、Simpson优势度指数、Pielou均匀度指数、McIntosh多样性指数等方法(马克平等,1994; 赵志模等,1990); 群落相似性指数Cj=2c/(a+b),式中a和b分别表示群落A和群落B的物种数,c为2个群落共有物种数。根据相似性系数原理判断相似性程度。若0 <Cj<0.25,表示群落A和群落B极不相似; 若0.25≤Cj <0.50,表示中等不相似; 若0.50≤Cj <0.75,表示中等相似; 若0.75≤Cj <1.00,表示极相似(马克平等,1994; 赵志模等,1990)。
采用既对稀有种敏感又无偏的Rarefaction法评估各生境地表甲虫的采集强度、物种丰富度的分布格局(Solow et al.,2006; 张文军,2007)。
以甲虫数量多少为甲虫对不同栖息地喜好程度的判断标准。在种的水平上将地表甲虫群落划分成不同类群,个体数量大于10%的为优势种,1%~10%的为普通种(常见种),1.0%以下的为稀有类群。
采用单因素方差分析(ANOVE),用最小显著法(LSD)检验比较不同生境(斑块)内地表甲虫物种多样性及个体数量差异。采用典范对应分析(canonical correspondence analysis,CCA)和Spearman秩相关系数分析地表甲虫群落组成特征与各环境因子之间关系(王玉等,2009; 杨贵军等,2010)。
多样性数据使用Excel2003、SPSS13.0统计软件进行处理和分析,Rarefaction曲线采用Estimate S软件(Colwell,2013),用CANOCO 4.5和CANODRAW 4.5软件进行典范对应分析。
2 结果与分析 2.1 不同生境中地表甲虫的物种多样性 2.1.1 物种组成在干旱型人工固沙柠条林地、半湿润型沙地人工植被区和干旱型半流动沙地3类柠条林荒漠景观生境中共获得地表甲虫标本4 778号,共50种,隶属11科30属(表 1),其中拟步甲科为绝对优势类群(占总种数的48.0%),其次为象甲科(占总种数的26.0%)。
|
|
地表甲虫物种数以半湿润型沙地人工植被区生境中最多,有38种,占总种数的76.0%; 其次为干旱型人工固沙柠条林地有32种,占总种数的64.0%; 干旱型半流动沙地生境相对较少,有28种,占总种数的56.0%。个体数量以干旱型半流动沙地生境中最多,有2 600只,占总个体数的54.4%,其次为半湿润型沙地人工植被区生境(有1 399只,占29.3%),干旱型人工固沙柠条林地中地表甲虫个体数量最少(有719只,占16.3%)。
3类生境中稀有种的比例均较高,优势种比例最低,普通种居中(图 1)。不同生境中地表甲虫的优势种类有一定的差异,尖尾东鳖甲、波氏东鳖甲、谢氏宽漠王3种为干旱型人工固沙柠条林地生境中的优势种,克小鳖甲、弯齿琵甲是半湿润型沙地人工植被区生境中的优势种,干旱型半流动沙地生境中的优势种有尖尾东鳖甲、谢氏宽漠王、波氏东鳖甲3种(表 1,2)。
 |
图 1 各生境中地表甲虫优势种、普通种和稀有种组成
Fig. 1 The dominant species, common species and rare
species of ground-dwelling beetles in different habitats
|
|
|
拟步甲科昆虫在干旱型人工固沙柠条林地、半湿润型沙地人工植被区、干旱型半流动沙地3类生境中均为优势类群,分别占总个体数的91.91%,87.71%和95.46%; 象甲科昆虫为普通类群,分别占5.01%,7.22%和2.54%;肖叶甲科、丽金龟科、叶甲科、鳃金龟科、粪金龟科、花金龟科和葬甲科在3类生境中均为稀有类群。
生境异质性影响地表甲虫的多样性,如步甲科在干旱型人工固沙柠条林地、半湿润型沙地中为普通类群(占总个体数的1.16%和1.43%),而在干旱型半流动沙地生境中则为稀有类群; 吉丁虫科在半湿润型沙地生境中为普通种,占总个体数的1.14%,在其他2类生境中为稀有类群(表 3)。
|
|
属种比值系数是反映群落物种丰富度的一个重要指标,其值越小表明丰富度越高。3类生境的属种比值系数(表 3)显示:在干旱型人工固沙柠条林地的生境中,步甲科(0.33)、拟步甲科(0.44)和肖叶甲科(0.50)的属种比值系数小于该生境总属种比值系数(0.58),说明步甲科在该地区有较高的丰富度,其次为拟步甲科昆虫,而叶甲科(1.00)、鳃金龟科(1.00)、花金龟科(1.00)的丰富度相对较低; 在半湿润型沙地人工植被区的生境中,总属种比值系数为0.68,低于该值的科只有拟步甲科(0.50),说明在该区系组成中,拟步甲科昆虫是最活跃的成分,丰富度相对较高; 在干旱型半流动沙地的生境中,拟步甲科(0.47)和步甲科(0.50)属种比值系数小于该生境的总属种比值系数(0.61),表明这2科的甲虫在该地区有较高的丰富度,区域代表性较强,是该区系组成中最活跃的成分。
2.1.3 物种分布格局地表甲虫的物种分布格局(表 4)表明:3类生境中共有种为16种,占总种数的32.00%,代表种类有尖尾东鳖甲、波氏东鳖甲、克小鳖甲、球胸小鳖甲、纳氏东鳖甲、谢氏宽漠王、弯齿琵甲、多毛宽漠甲、谢氏宽漠王、斜纹筒喙象、黑条筒喙象、黑皱鳃金龟等。
|
|
2类生境中共有的种类以干旱型人工固沙柠条林地与半湿润型沙地人工植被区、半湿润型沙地人工植被区与干旱型半流动沙地为最多,各有7种,均占总种数的14.0%;而干旱型人工固沙柠条林区与干旱型半流动沙地共有物种只有2种,仅占总种数的4.0%。在单一生境中,半湿润型沙地人工植被区的物种百分比最高,为16.0%,其次是干旱型人工固沙柠条林区,其物种百分比为14.0%,干旱型半流动沙地物种百分比最小,为6.0%。
干旱型人工固沙柠条林区与半湿润型沙地人工植被区生境中共有种代表种类有宽漠王、沙蒿金叶甲、沙蒿大粒象等。半湿润型沙地人工植被区与干旱型半流动沙地生境中共有种的代表种类有毛喙丽金龟、短毛草象、胖遮眼象、窄吉丁等。只在单一生境中分布的种类:半湿润型沙地人工植被区的物种数有8种,在干旱型半流动沙地的物种数为3种。单一生境中分布的代表种类有内蒙宽漠王、光背方土甲、无边东鳖甲等。
2.2 不同生境中地表甲虫的群落多样性 2.2.1 群落相似性基于物种数的3类生境地表甲虫群落相似性系数均低于0.25,表明这3种类型的生境极不相似(表 5)。其中,干旱型人工固沙柠条林地和干旱型半流动沙地由于植被组成、土壤基质等方面的差异使得地表甲虫群落相似性差异最大(0.067 8)。
|
|
不同生境中地表甲虫群落多样性指数(表 6)显示,物种丰富度指数Ds在半湿润型沙地人工植被区生境中最高,干旱型半流动沙地生境中最低。对常见种比较敏感的Simpson优势度指数在半湿润型沙地人工植被区生境中最高,其次为干旱型人工固沙柠条林地,干旱型半流动沙地生境中最低,半湿润型沙地人工植被区和干旱型人工固沙柠条林地生境无显著差异,但和干旱型半流动沙地有显著差异(F0.05,(2,9)=4.66,P<0.05); 对生境中稀有种比较敏感的Shannon-Wiener多样性指数的变化趋势是半湿润型沙地人工植被区 > 干旱型人工固沙柠条林地> 干旱型半流动沙地,它们之间在统计学上差异不显著(F0.05,(2,9)=3.65,P>0.05)。均匀度指数在半湿润型沙地人工植被区生境中最高,其次为干旱型人工固沙柠条林地生境,在干旱型半流动沙地生境斑块中最低,它们之间差异极显著(F0.05,(2,9)=9.486,P<0.01)。
|
|
基于物种数-个体数构建的Rarefaction曲线在3类生境中均呈上升型且互不相交(图 2),反映了在这3类生境中,如果随机取等量的地表甲虫,在半湿润型沙地人工植被区生境中地表甲虫群落会出现最高的物种多样性,其次为干旱型人工固沙柠条林地生境和干旱型半流动沙地生境。同时,该曲线也反映出地表甲虫群落的均匀度以干旱型半流动沙地最高,干旱型人工固沙柠条林地生境次之,半湿润型沙地人工植被区生境最低。此外,干旱型人工固沙柠条林地生境和半湿润型沙地人工植被区生境的曲线趋于平缓,说明如果继续增加取样,其地表甲虫的种类还会增加;但是在干旱型半流动沙地的曲线已基本接近渐近线,继续抽样增加种类的几率相对较低。半湿润型沙地人工植被区生境Rarefaction曲线位于最上面,表明地表甲虫在植被群落结构相对复杂的半湿润型沙地人工植被区多样性最高,其次为干旱型人工固沙柠条林地;在植被群落结构相对简单的干旱型半流动沙地,曲线位于最下方,表明地表甲虫多样性最低。科-个体数的Rarefaction曲线与种-个体数的变化趋势基本一致(图 3)。
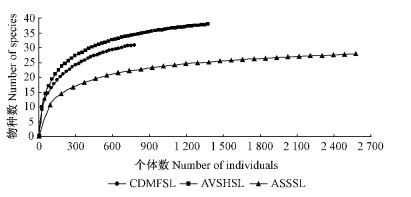 |
图 2 基于物种-个体数的不同生境地表甲虫Rarefaction曲线
Fig. 2 Rarefaction curve based on species-individuals of
ground-dwelling beetles in different habitats
|
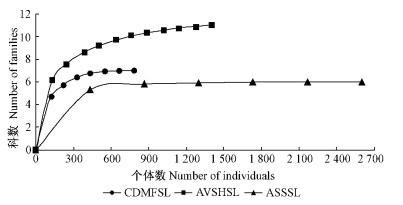 |
图 3 基于科-个体数的不同生境地表甲虫Rarefaction曲线
Fig. 3 Rarefaction curve based on families-individuals of
ground-dwelling beetles in different habitats
|
3类生境中6种环境因子的观测值见表 8。将50种地表甲虫与6种环境因子进行CCA分析,排序结果见图 4。由于本次调查仅有3种类型的生境,CCA只需2个排序轴便可完全分析出物种与环境的关系,这2个排序轴的特征值分别为0.546和0.075,达到总特征值(0.621 03)的87.9%和100.0%,50个物种与6个环境因子排序轴(第1,2排序轴)的相关系数都高达1.000,表明排序结果可靠。
|
|
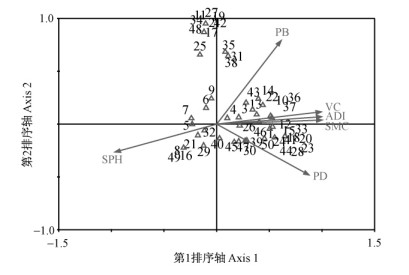 |
图 4 地表甲虫物种与环境因子的CCA排序
Fig. 4 CCA ordination diagram between ground-dwelling
beetles and environmental factors
PD: 植物物种密度Plant density; VC: 植被盖度Vegetation coverage; SMC: 土壤含水量Soil moisture content; SPH: 土壤pH值Soil pH; PB: 植物生物量Plant biomass; ADI: 人为干扰强度Anthropogenic disturbance intensity.△:物种Species,数字为物种序号,同表1 No. of species are given in Tab.1. |
CCA第1排序轴与土壤含水量(SMC)、植被盖度(VC)和人为干扰强度(ADI)呈极强的正相关,相关系数分别为0.999 3、0.993 1和0.997 4; 同时,相关系数分析显示各样地地表甲虫的Shannon-Wiener多样性指数与植被物种密度(r=0.99,P>0.05)、植被盖度(r=0.96,P>0.05)、土壤含水量(r=0.98,P>0.05)和人为干扰强度(r=0.98,P>0.05)呈显著正相关,与土壤pH值和植物生物量呈负相关。这表明影响优势地表甲虫群落多样性的主要因素为植被物种密度、植被盖度、土壤含水量和人为干扰强度。
第2排序轴与植物生物量(PB)呈较强的正相关,相关系数为0.790 7,但与其他环境因子的相关性均较弱。弯齿琵甲、小丽东鳖甲、纳氏东鳖甲、姬小鳖甲、长爪方土甲等12个物种对于环境因子的变化较为敏感,与植被的生物量正相关。
土壤pH值(SPH)与第1、第2排序轴均呈负相关(相关系数为-0.964 2和-0.265 0),尖尾东鳖甲、波氏东鳖甲、谢氏宽漠王、大皱鳃金龟等10个物种受土壤pH值影响较大。
3 讨论 3.1 生境异质性与地表甲虫多样性地表甲虫对生境的选择是研究甲虫与环境之间关系的基础。荒漠生态系统是陆地生态系统中最为脆弱的系统之一,由于其独特的景观生态类型,使荒漠昆虫在其种类组成、分布和格局等方面具有独特性。地表甲虫的多样性主要表现为物种丰富度较低,物种多样性较低,均匀度差,但是优势度较高,优势种的活动密度较高(张大治等,2008; 杨贵军等,2010; 娄巧哲等,2011)。甲虫对生境的选择在一般在科级水平上趋势不是很明显,但是在物种水平上则非常明显(于晓东等,2006)。本研究显示在荒漠生态系统中,地表甲虫对生境的选择不仅在科级水平上很明显,而且在物种水平上也很明显,其中拟步甲科对干燥的沙漠有倾向性。另外,从采集到的地表甲虫种类和数量来看,拟步甲科和象甲科昆虫均为优势种群,占据着绝对优势地位,这与其他荒漠生态系统的研究结果基本一致(黄人鑫,2005; 刘继亮等,2010a; 2010b; 娄巧哲等,2011)。本文与此前张大治等(2008)的研究结果在优势类群组成上有一定的差异,主要与地表甲虫的采集方法、采集频度、采集生境等有关。
生境异质性对物种的分布有重要的影响(Thomas et al.,2001; 于晓东等,2006; Fischer et al.,2007; Heisswolf et al.,2009),同样,植被斑块作为一个有效的自然集水和养分富集系统,它与裸地、流动半流动沙丘斑块形成了一种典型环境资源分配的源-汇关系(Valentin et al.,1999; Whitford,2002; 刘继亮等,2010a)。宁夏灵武白芨滩国家级自然保护区及其周边区域由于多年开展荒漠化环境治理,使地表甲虫栖息环境的空间异质性增大,从而增加了地表甲虫的多样性(张大治等,2008)。本试验研究区域设在3种不同类型的生境中,植被的物种多样性、土壤的含水率等均呈现出较为显著的差异,这种资源分配差异影响地表甲虫的多样性分布。半湿润型沙地人工植被区与矿区较近,近年来矿区周边开展环境绿化治理工作,土壤湿度较大,不仅植被长势良好,而且植物物种的多样性水平也较高,因此地表甲虫物种丰富度、多样性指数、均匀度指数、优势度指数均最高。干旱型人工固沙柠条林地样地主要由人工种植的柠条为主,虽植被盖度大,但由于有大量的柠条吸收水分,使得土壤相对较干燥(程积民等,2005),导致地表甲虫物种丰富度、群落多样性指数低于半湿润型沙地人工植被区。而干旱型半流动沙地中流动半流动沙丘镶嵌分布,水分含量较低,植被密度、盖度以及物种数均较低,从而导致地表甲虫物种丰富度和群落多样性指数偏低。
3.2 环境因子与地表甲虫多样性环境因子是影响地表甲虫多样性分布的重要因素。本研究表明地表甲虫多样性受植被盖度和土壤含水量影响最为强烈,植被物种密度对地表甲虫的影响相对较弱,而土壤pH值与其呈显著的负相关,这与其他荒漠类型生境的研究结果基本相似(杨贵军等,2010; 娄巧哲等,2011; 贺海明等,2012)。在土壤含水量较少的干旱型人工固沙柠条林地和干旱型半流动沙地中,波氏东鳖甲、尖尾东鳖甲与谢氏宽漠王个体数量较多,而半湿润型沙地人工植被区的优势种为弯齿琵甲和克小鳖甲。在更加干旱的干旱型流动半流动沙地生境中,尖尾东鳖甲、波氏东鳖甲和谢氏宽漠王的种群数量则占据着绝对的优势地位,这说明越是荒漠化程度高、处于流动半流动的沙丘地区,且植被稀少、以风沙土为主的荒漠环境,其数量越丰富,这些漠甲亚科的类群对该类环境有一定指示性(张大治等,2008)。在半湿润型沙地人工植被区中,弯齿琵甲和克小鳖甲的种群数量最为庞大,说明其更适宜含水量较高、植被较好的生境,这与杨贵军等(2010)的研究结果基本一致。因此,在特定的环境中,这些对环境因子有趋向性的地表甲虫物种可以作为监测环境变化的一个生物学指标(张大治等,2008)。
人为干扰强度的测定,虽然国内外对于干扰已有较多的研究,但多年来并没有一个较为统一的标准,而且根据干扰强度的定义,确定干扰对生物群落功能的影响也是比较困难的。因此,许多研究都以干扰所去除植物群落生物量的多少、森林的郁闭度和地表枯落物生物量,以及选择与人类活动区域的距离来确定干扰强度(毛志宏等,2006; 张希彪等,2006; 李新彬等,2006)。一般来说,生境中的人为干扰强度会伴随着距干扰源中心距离的增加而逐渐降低,与距离呈负相关,因此本研究采用距离法来确定人为干扰强度,即以干扰源中心与样方之间的距离作为干扰强度系数,如果该生境存在2个或2个以上的干扰源时,分别测量各干扰源与样方间的距离并相加。本文所选的3类型生境均属于荒漠流沙(沙化)人工治理区,都存在人为干扰:半湿润型沙地人工植被区同时还受煤矿矿区环境治理、人为活动等影响,干扰强度最大,其次为干旱型人工固沙柠条林地。但这2类生境在人为植被恢复干扰下其植物密度、植被盖度、土壤含水量等环境因子均优于干旱型半流动沙地,地表甲虫的Shannon-Wiener多样性指数均高于后者,说明适度的干扰能丰富物种的多样性,这也符合 "中度干扰假说"。
| [1] |
程积民,万惠娥,王静,等.2005.半干旱区柠条生长与土壤水分消耗过程研究.林业科学,41(2):38-41.( 1) 1)
|
| [2] |
高光彩,付必谦.2009.步甲作为指示生物的研究进展.昆虫知识,46(2):216-222.( 1) 1)
|
| [3] |
贺海明,贾彦霞.2012.宁夏盐池荒漠草原不同生境对琵甲物种多样性的影响.西北农业学报,21(12):192-197.( 1) 1)
|
| [4] |
黄人鑫.2005.新疆荒漠昆虫区系及其形成与演变.新疆:新疆科学技术出版社.( 1) 1)
|
| [5] |
李新彬,王襄平,罗菊春,等.2006.干扰对长白山北坡次生林群落结构和树种多样性的影响.林业科学,43(2):106-110.( 1) 1)
|
| [6] |
刘继亮,李锋瑞,刘七军,等.2010a.黑河中游荒漠灌丛斑块地面甲虫群落分布与微生境的关系.生态学报,30(23): 6389-6398.( 2) 2)
|
| [7] |
刘继亮,李锋瑞,刘七军,等.2010b.黑河中游干旱荒漠地面节肢动物群落季节变异规律.草业学报,19(5):161-169.( 1) 1)
|
| [8] |
娄巧哲,徐养诚,马吉宏,等.2011.古尔班通古特沙漠南缘地表甲虫物种多样性及其与环境的关系.生物多样性,19(04): 441-452.( 4) 4)
|
| [9] |
马克平,刘玉明.1994.生物群落多样性的测度方法: I.α多样性的测度方法(下).生物多样性,2(4): 231-239.( 2) 2)
|
| [10] |
毛志宏,朱教君.2006.干扰对植物群落物种组成及多样性的影响.生态学报,26(8):2695-2701.( 1) 1)
|
| [11] |
宋朝枢,王有德.1999.宁夏白芨滩自然保护区科学考察集.北京:中国林业出版社.( 1) 1)
|
| [12] |
王玉,高光彩,付必谦,等.2009.北京野鸭湖湿地地表甲虫群落组成与空间分布格局.生物多样性,17(1):30-42.( 1) 1)
|
| [13] |
吴甘霖,黄敏毅,段仁燕,等.2006.不同强度旅游干扰对黄山松群落物种多样性的影响.生态学报,26(12):3924-3930.( 1) 1)
|
| [14] |
杨贵军,贺奇,王新谱.2010.盐池四墩子拟步甲昆虫群落组成与环境因子的相关性.应用生态学报,21(9): 2375-2382.( 5) 5)
|
| [15] |
于晓东,周红章,罗天宏.2001.云南西北部地区地表甲虫的物种多样性.动物学研究,22(6): 454-460.( 1) 1)
|
| [16] |
于晓东,罗天宏,周红章,等.2006.卧龙自然保护区落叶松林不同恢复阶段地表甲虫的多样性.动物学研究,27(1):1-11.( 3) 3)
|
| [17] |
张大治,陈曦,贺答汉.2012.荒漠景观拟步甲科昆虫多样性及其对生境的指示作用.应用昆虫学报,49(1):229-235.( 1) 1)
|
| [18] |
张大治,贺达汉,于有志,等.2008.宁夏白芨滩国家级自然保护区地表甲虫群落多样性.动物学研究,29(5):569-576.( 5) 5)
|
| [19] |
张文军.2007.生态学研究方法.广州:中山大学出版社.( 1) 1)
|
| [20] |
张希彪,上官周平.2006.人为干扰对黄土高原子午岭油松人工林土壤物理性质的影响.生态学报,26(11):3685-3695.( 1) 1)
|
| [21] |
赵志模,郭依泉.1990.群落生态学原理与方法.重庆:科学技术文献出版社重庆分社.( 2) 2)
|
| [22] |
Allegro G,Sciaky R.2003.Assessing the potential role of ground-dwelling beetles as bioindivators in poplar stands,with a newly proposed ecological index(FAI).Forest Ecology and Management,175(1-3): 275-284.( 1) 1)
|
| [23] |
Bohac J.1999.Staphylinid beetles as bioindicators.Agriculture,Ecosystems and Environment,74(1-3):357-372.( 1) 1)
|
| [24] |
Colwell R K.2013.Estimate S: Statistical estimation of species richness and shared species from samples.[2013-03-05].http://viceroy.eeb.ucone.edu/estimates.( 1) 1)
|
| [25] |
Eyre M D,Lott D A,Garside A.1996.Assessing the potential for environmental monitoring using ground-dwelling beetles(Coleoptera,Carabidae)with riverside and Scottish data.Annales Zoologici Fennici,33(3):157-163.( 1) 1)
|
| [26] |
Fischer J,Lindenmayer D B.2007.Landscape modification and habitat fragmentation: a synthesis.Global Ecology and Biogeography,16(3):265-280.( 1) 1)
|
| [27] |
Heisswolf A,Reichmann S,Poethke H J,et al.2009.Habitat quality matters for the distribution of an endangered leaf beetle and its egg parasitoid in a fragmented landscape.Journal of Insect Conserv,13(2):165-175.( 1) 1)
|
| [28] |
Magura T,Tothmeresz B,Bordan Z S.2000.Effects of nature management practice on carabid assemblages(Coleoptera: Carabidae)in a non-native plantation.Biological Conservation,93(1):95-102.( 1) 1)
|
| [29] |
Oliver I,Beattie A J.1993.A possible method for the rapid assessment of biodiversity.Conservation Biology,7(3): 562-568.( 1) 1)
|
| [30] |
Solow A R,Roberts D L.2006.Museum collections,species distributions,and rarefaction.Diversity and Distributions,12(4):423-424.( 1) 1)
|
| [31] |
Thomas J A,Bourn N A D,Clarke R T,et al. 2001.The quality and isolation of habitat patches both determine where butterflies persist in fragmented landscapes.Proceeding Royal Society London B,268(1478):1791-1796.( 1) 1)
|
| [32] |
Valentin C,d'Herbès J M.1999.Niger tiger bush as a natural water harvesting system.Catena,37(1/2): 231-256.( 1) 1)
|
| [33] |
Whitford W G.2002.Ecology of Desert Systems.London: Academic Press.( 1) 1)
|
| [34] |
Yu X D,Luo T H,Zhou H Z.2008.Distribution of carabid beetles among 40-years-old regenerating plantations and 100-years-old naturally regenerated forest in Southwestern China.Forest Ecology and Management,255(7):2617-2625.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

