文章信息
- 程晓甜, 阿地力沙塔尔, 张伟, 李新泉
- Cheng Xiaotian, Adil Sattar, Zhang Wei, Li Xinquan,
- SYBR Green实时荧光PCR快速鉴定枣实蝇技术
- Rapid Identification of Carpomya vesuviana by Real-Time PCR with SYBR Green Chemical
- 林业科学, 2014, 50(4): 60-65
- Scientia Silvae Sinicae, 2014, 50(4): 60-65.
- DOI: 10.11707/j.1001-7488.20140409
-
文章历史
- 收稿日期:2013-06-10
- 修回日期:2013-12-09
-
作者相关文章
2. 新疆出入境检验检疫局技术中心乌鲁木齐 830083
2. Xinjiang Entry-Exit Inspection and Quarantine Bureau Urumqi 830083
枣实蝇(Carpomya vesuviana)是我国2007年新增补的进境植物检疫性有害生物,其入侵可能对我国枣产业生产构成毁灭性危害。枣实蝇目前主要分布在意大利、高加索、毛里求斯、巴基斯坦、泰国、阿富汗等国家和地区,在我国仅分布在新疆的吐鲁番地区,且疫情有向其他地区扩散的趋势(张润志等,2007; 阿地力·沙塔尔等,2008)。在口岸检疫中截获的枣实蝇以幼虫和蛹等虫态为主。实蝇类害虫种的鉴定主要依据成虫的形态特征,因而很难保证鉴定的准确度。即使枣实蝇的幼虫能依据形态学进行鉴定,但很大程度上还依赖鉴定人员丰富的鉴定经验,这就制约了不同地区相关工作的进一步开展。口岸检疫中通常要将枣实蝇的幼虫和蛹培养到成虫再进行鉴定,整个检疫鉴定过程时间长达20天,无法适应实际工作需要。显然,仅仅依靠形态学分析进行枣实蝇的鉴定研究,不能与日益增长的水果蔬菜贸易发展相协调,从而给检疫和防控工作造成相当大的困难。因此,非常有必要研究枣实蝇快速鉴定的新方法,特别是幼虫、蛹等未成熟虫态的快速鉴定方法。近些年来,AFLP和RFLP等分子诊断技术已先后应用于实蝇的分类鉴定(吴佳教等,2005;Naeole et al.,2003; Muraji et al.,2002; Nakahara et al.,2002)。
SYBR Green实时荧光PCR技术是在PCR反应体系中加入过量的SYBR Green荧光染料,在PCR每个循环结束时,利用荧光信号积累实时监测整个PCR反应的进程。SYBR Green是一种小分子DNA染料,游离时不会发射任何荧光信号,但当与双链DNA(dsDNA)特异地结合时,荧光染料掺入DNA双链,发射出强烈的荧光信号(Giulietti et al.,2001),同时PCR产物的特异性可以用熔解曲线分析进一步确认。近年来,SYBR Green实时荧光PCR技术已广泛应用于科学研究和医学临床诊断分析中(Ponchel et al.,2003; Giolio et al.,2003; Tanriverdi et al.,2002)。余道坚(2005)分别建立了SYBRGreen 实时荧光PCR鉴定辣椒实蝇( Bactroceralatifrons)、地中海实蝇( Ceratitis capitata)、杨桃实蝇(B.carambolae)、番石榴实蝇( B.correcta)、桔小实蝇(B.dorsalis)、芒果实蝇( B.occipitalis)、木瓜实蝇(B.papayae)、菲律宾实蝇(B.philippinensis)、瓜实蝇(B.cucurbitae)和南瓜实蝇( B.tau)的方法。然而,自从枣实蝇发生以来,除了形态学鉴定之外,目前国内外还没有一套枣实蝇SYBR Green实时荧光PCR鉴定技术。
本研究应用SYBR Green实时荧光PCR技术,建立了SYBR Green实时荧光PCR快速鉴定枣实蝇的方法。利用枣实蝇(mtDNA)中COⅠ基因序列,筛选出种特异引物CarF /CarR。引物的特异性分别用桔小实蝇、瓜实蝇、南瓜实蝇、番石榴实蝇和桃果实蝇5种实蝇来验证,并分别从引物特异性验证、SYBR Green实时荧光PCR反应的灵敏度和在枣实蝇幼虫、蛹的快速鉴定上的应用3个方面进行研究。实时荧光PCR产物的特异性通过溶解曲线分析和琼脂糖凝胶电泳来验证,从而建立SYBR Green实时荧光PCR快速鉴定枣实蝇方法。该技术打破了常规上仅仅依靠形态学鉴定枣实蝇的方法,建立了从分子方面快速检测枣实蝇的技术,为该虫的检疫提供了一种新的方法。本研究建立的分子生物学方法不仅能鉴定枣实蝇的成虫而且能快速鉴定幼虫、蛹和卵等虫态,使枣实蝇的鉴定周期从传统的形态学鉴定所需20天时间缩短到4 h以内,在植物检疫性枣实蝇的日常鉴定中有极大的优势。
1 材料与方法 1.1 试验材料枣实蝇(幼虫、蛹和成虫)采自新疆吐鲁番。桔小实蝇、瓜实蝇、南瓜实蝇、番石榴实蝇、桃果实蝇为成虫,由福建农林大学提供。所有试验材料都是经专家鉴定的新鲜标本。用于分子生物试验的实蝇标本用100%酒精浸泡并保存于4 ℃冰箱。
1.2 供试试剂动物组织基因组DNA提取试剂盒、2 × SYBRGreen MasterMix、琼脂糖、EB、DL2000DNAMarker 均购自北京庄盟国际生物基因科技有限公司,设计的引物交至北京华大中生科技发展有限公司合成。
1.3 主要仪器荧光定量PCR检测仪(BIOER FQD-48A)(杭州博日科技有限公司)、超微量紫外分光光度计(Thermo NANODROP 1000)、金属浴(HB-1000)(杭州博日科技有限公司)、TGL-1613台式高速离心机(上海)、DYY-12C 多功能电泳仪(北京市六一仪器厂)、D56-26M 型数字图像分析仪(北京市六一仪器厂)、Thermo Nanodrop2000超微量紫外分光光度计(北京科誉兴业科技发展有限公司)、SANYO MLS-3750全自动高压灭菌仪(上海中庸检验设备有限公司)、XMTD-4000水浴锅(北京市永光明医疗仪器厂)、MDF -382 E(N)SANYO 超低温冰箱(上海中庸检验设备有限公司)。
1.4 试验方法 1.4.1 基因组DNA和测序实蝇基因组DNA采用动物组织基因组DNA提取试剂盒提取。DNA浓度通过超微量紫外分光光度计(Thermo NANODROP1000)测定的OD260值来换算得到。引物Uea7 /Uea10(余道坚,2005)用来PCR扩增实蝇COⅠ基因约670 bp的片段和DNA序列分析。PCR反应在BIOER FQD-48A荧光定量PCR检测系统上进行,反应条件为: 预变性94 ℃ 5 min,95 ℃ 40 s,48 ℃30 s,72 ℃ 1 min,重复35个循环,72 ℃ 7 min。测序交至北京华大中生科技发展有限公司,每个样品上下游引物各测1次,序列用Seqman 软件拼接。
1.4.2 引物设计以枣实蝇线粒体DNA(mtDNA)中CO Ⅰ基因部分序列(GenBank 序列号:HQ687210)为目标序列,Mega4软件(DNASTAR 公司,美国)中CLUSTAL 方法,与蔷薇咔实蝇R248FJ571371.1、蔷薇咔实蝇R141 FJ571370.1、樱桃绕实蝇(Rhagoletis cerasi)FJ571369.1、具条实蝇(B.scutellata)AY530890.1、南瓜实蝇AY 398753.1、瓜实蝇(B.cucurbitae)AY398758.1、芒果实蝇AY39875 4.1等己知其他种类的实蝇的COⅠ基因序列(包括本研究和其他公开报道的序列)进行比较分析,人工设计引物,引物用Primer 5软件检查引物错配、二聚体和发夹结构,并用GenBank 中提供的Blast 程序检查同源序列(余道坚等,2006)。
1.4.3 SYBR Green实时荧光PCRSYBR Green实时荧光PCR扩增反应在BIOER FQD-48A荧光定量PCR检测仪的48孔板上进行,PCR反应总体为50 μL,其中25 μL 2 × SYBR GreenMasterMix,上下游引物(10 pmol)各0.5 μL,模板DNA1 μL(≈20nng·μL-1),去离子水23 μL。桔小实蝇、瓜实蝇、南瓜实蝇、番石榴实蝇、桃果实蝇(B.zonata)等口岸检疫中截获几率最高的5种实蝇用来验证引物CarF /CarR 的特异性。为确定SYBR Green实时荧光PCR反应的检测限度,40,20,10,1,0.1,0.01,0.001 ng·μL-17个浓度的枣实蝇成虫DNA作为模板进行试验,同时分别以枣实蝇的幼虫、蛹和成虫DNA作为模板来验证SYBR Green实时荧光PCR的稳定性,所有PCR扩增反应用水作为空白对照。扩增条件为: 95 ℃,10 s; 95 ℃,15 s; 55 ℃,30 s。35个循环,空白设2个重复,每个样本重复5次。
1.4.4 熔解曲线分析SYBR Green实时荧光PCR产物的特异性可用熔解曲线分析来确定,实时荧光PCR反应结束后,直接在BIOER FQD-48A荧光定量PCR检测系统上再运行Melting allias 程序进行熔解曲线分析。程序的反应程序为: 目标温度95 ℃,起始温度60 ℃,恒温时间20 s; 采集模式为台阶,溶解曲线的程序每隔0.5 ℃读取1次。
1.4.5 琼脂凝胶电泳分析将实时荧光PCR产物过夜,等荧光信号散失之后,再次用琼脂糖凝胶电泳检查扩增目标片段的大小。取PCR产物5 μL 加入溴酚蓝1 μL,在含溴化乙锭(EB)的1.5% 琼脂凝胶上电泳分离,凝胶图像分析仪上检查结果。
1.4.6 数据分析在SYBR Green实时荧光PCR扩增反应中,原始数据由SDS 软件(Version 1.7)自动收集。CT 值是指荧光值开始达到指数增长时的循环数。数据以EXCEL 工作表形式导出,在PC 机上作出扩增曲线图。在熔解曲线分析程序中,在PCR产物缓慢从60 ℃增至95 ℃的同时,荧光信号持续被仪器收集,荧光值数据由熔解软件(Version1.0)转换成熔解曲线图和熔解峰值曲线(Tanriverdi et al.,2002)。
2 结果与分析 2.1 引物CarF/CarR特异性验证SYBR Green实时荧光PCR反应扩增曲线(图 1A)显示了6种实蝇样品随反应循环数的增加荧光值的变化关系,当PCR反应开始之初,SYBR GreenI荧光染料信号很弱,ΔRn 未超过仪器设定的基值,所有样品的图形十分一致(余道坚,2005)。到15个循环以后,荧光信号出现分化,枣实蝇样品出现荧光信号的强烈增加,扩增曲线到达指数增长期,CT值为16,说明枣实蝇产生了特异性反应,PCR产物开始急剧增加,而其他实蝇样品和水空白对照没有特异性PCR扩增。实时荧光PCR反应的产物熔解曲线分析结果显示: 所有样品中只有枣实蝇样品出现产物峰(Tm = 75.5 ℃)(图 1B),同时PCR产物的琼脂糖凝胶电泳结果进一步验证了PCR反应的特异性,在205 bp处,枣实蝇样品有一条扩增电泳带,而其他6种实蝇样品和水对照则没有(图 1C)。鉴于枣实蝇的卵、幼虫、蛹与其他实蝇类害虫形态十分相似而难以区分,分别以单头桔小实蝇、番石榴实蝇、瓜实蝇、南瓜实蝇、桃果实蝇的DNA为模板,枣实蝇为阳性对照,检验枣实蝇特异片段扩增引物CarF /CarR 的种特异性。
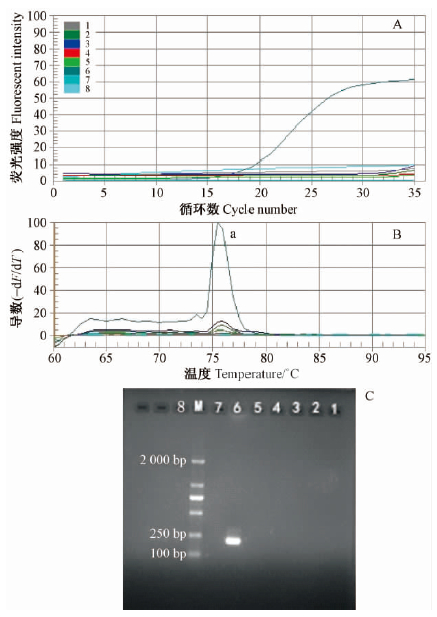 |
图 1 PCR仪上引物CarF/CarR的特异性验证
Fig. 1 The specificity confirmation of primer CarF /CarR
A. SYBR Green 实时荧光PCR 扩增曲线Real-time fluorescentPCR amplification curve; B. 实时荧光PCR 后的熔解曲线分析;( a 为枣实蝇的峰值) Real-time fluorescent PCR melting curveanalysis( a is product peak of C. vesuviana) ; C. PCR 产物的琼脂糖凝胶电泳结果Agarose gel electrophoresis result of PCRproducts. 泳道1-8 Lane 1-8: 桔小实蝇B. dorsalis,桃果实蝇B.zonata,番石榴实蝇B. correcta,瓜实蝇B. cucurbitae,南瓜实蝇B. tau,枣实蝇C. vesuviana,阴性对照( 模板为水) CKNegative control CK; 阴性对照(模板为水) CK Negative controlCK; M: DL2000 DNA. |
分别用枣实蝇成虫7个不同浓度的模板DNA用来确定SYBR Green实时荧光PCR的检测灵敏度。试验结果显示,所有枣实蝇样品均有扩增,CT值与DNA模板浓度有关,模板浓度为40,20,10,1,0.1,0.01,0.001 ng·μL-1时,CT 值分别为9.36,10.34,10.77,15.22,17.06,29。在50 μL 反应体系下,SYBR Green实时荧光PCR的检测限度可达0.01 ng·μL-1以下,模板DNA最适浓度为1~20 ng·μL-1。所有扩增的PCR产物均在预期的熔点处有相同的熔解曲线峰(图 2)。
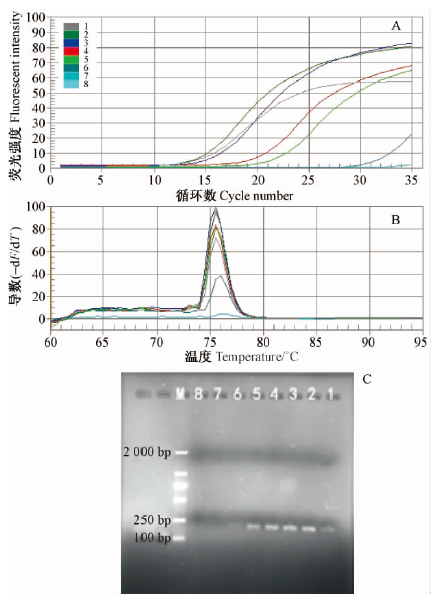 |
图 2 SYBRGreen实时荧光PCR检测的灵敏度
Fig. 2 The sensitivity confirmation of SYBR Green
real-time fluorescent PCR
A. SYBR Green 实时荧光不同浓度的模板DNA PCR 扩增曲线Real-time fluorescent PCR amplification curve of template DNAPCR with different concentrations; B. 实时荧光PCR 后的熔解曲线分析Real-time fluorescent PCR melting curve analysis; C. PCR产物的琼脂糖凝胶电泳结果Agarose gel electrophoresis result ofPCR products. 泳道1-8 Lane 1-8: 40,20,10,1,0. 1,0. 01,0. 001 ng·μL-1,阴性对照(模板为水) CK: 40,20,10,1,0. 1,0. 01,0. 001 ng·μL-1 ; Negative control CK; M: DL2000 DNA Marker. |
SYBR Green实时荧光PCR的可靠性可用枣实蝇不同虫态(幼虫、蛹、成虫)的扩增曲线、熔解曲线及PCR产物的琼脂糖凝胶电泳来检验。图 3A 表明: 枣实蝇的3种虫态均能扩增,CT 值分别是10.79,10.56和11.21,而阴性对照没有扩增反应。枣实蝇成虫、幼虫和蛹的熔解曲线完全一致,均只有单一产物峰,熔点分别为75.5,75.5和75 ℃(图 2B),平均(75.3 ± 0.1)℃。上述试验说明在以枣实蝇成虫DNA为模板基础上建立的SYBR Green实时荧光PCR方法同样适用于幼虫和蛹的种类鉴定。
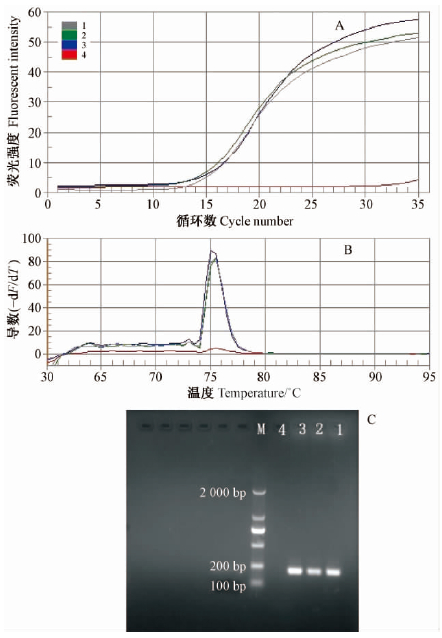 |
图 3 枣实蝇不同虫态下的SYBR Green实时荧光PCR 特异性检测
Fig. 3 SYBR Green real-time PCR specific detection of
C. vesuviana at different stages A. 实时荧光PCR
扩增曲线Real-time PCR amplification curve;; B. PCR 产物的熔解曲线分析Real-time PCR melting curve; C. PCR 产物的琼脂糖凝胶电泳结果Agarose gel electrophoresis result of PCR products.1. 幼虫Larva; 2. 蛹Pupa; 3. 成虫Adult; 4. 阴性对照(模板为水) CK Negative control CK. |
SYBR Green荧光染料能与所有的DNA双链相结合,不必因模板不同而特别定制,试验设计简单,成本低廉,可用于快速检测。通过熔解曲线分析可以识别扩增产物和引物二聚体,因而可以区分非特异扩增(余道坚等,2006; 刘建越等,2006)。与常规PCR相比,SYBR Green实时荧光PCR具有灵敏度高、特异性更强、自动化程度高和有效解决PCR污染问题等优点,其扩增反应灵敏度较常规PCR高,更为重要的是因不需凝胶电泳检查结果,避免了溴化乙锭对环境和人体的危害。SYBR Green实时荧光PCR与另一种应用于医学基因诊断、环境微生物和动植物病原真菌、细菌、病毒、转基因成分的检测等领域中的TagMan探针实时荧光PCR技术相比较,因后者在普通PCR原有的一对引物基础上,增加了一条特异性的荧光双标记探针,可将非特异性产物区分开(易建平等,2005; Weller et al.,2001),因此虽然SYBR Green实时荧光PCR的特异性不如TagMan探针实时荧光PCR,但是溶解曲线分析技术能有效地区分特异性PCR产物,较好地克服特异性缺陷。由于检疫性实蝇种类很多,相对昂贵的TagMan探针,SYBR Green实时荧光PCR不需要合成探针,成本低廉,具广谱性,因此该方法更适用于枣实蝇的快速鉴定。
该技术利用枣实蝇(mtDNA)中COⅠ基因序列,设计筛选出1对种的特异引物CarF /CarR。引物的特异性分别用桔小实蝇、瓜实蝇、南瓜实蝇、番石榴实蝇和桃果实蝇5种实蝇来验证。SYBR GreenPCR实时荧光反应的灵敏度用40,20,10,1,0.1,0.01,0.001 ng·μL-17个浓度枣实蝇DNA模板用来检测。结果显示: SYBR GreenPCR的检测限度达0.01 ng·μL-1以下,最适模板DNA浓度为1~20 ng·μL-1。SYBR Green实时荧光PCR的可靠性可用枣实蝇不同虫态(幼虫、蛹、成虫)的扩增曲线、熔解曲线及PCR产物的琼脂糖凝胶电泳来检验,从而建立了国内外首次快速检测枣实蝇的技术; 首次筛选出枣实蝇种的特异性引物,而且集六大优点于一体——方便、适用、准确、快速、便宜、灵敏。其最大的优点是将以往长达20天的鉴定缩短到4 h,结果分析更加快捷方便,而且不受虫态的限制——4个虫态皆可(枣实蝇卵、幼虫、蛹、成虫)。本试验实蝇材料为桔小实蝇、瓜实蝇、南瓜实蝇、番石榴实蝇、桃果实蝇5种我国口岸检疫中较常见的实蝇类害虫,将这些种类作为检验引物特异性的阴性对照,虽然引物设计过程中尽可能考虑到其他的一些近缘种的同源序列,但试验材料仍有局限,因此以后要收集更多的实蝇类群,对本研究中设计的枣实蝇特异性引物的特异性作进一步验证。该技术可快速准确地鉴定枣实蝇,为检疫性害虫枣实蝇的检疫提供了一种新的方法。
| [1] |
阿地力·沙塔尔, 何善勇, 田呈明, 等.2008.枣实蝇在吐鲁番地区的发生及蛹的分布规律.植物检疫, 22(5): 295-297.( 1) 1)
|
| [2] |
刘建越, 邓欣, 康林, 等. 2006.SYBR-Green实时荧光PCR检测转基因番木瓜.湖南农业大学学报:自然科学版, 32(4): 371-374.( 1) 1)
|
| [3] |
吴佳教, 胡学难, 赵菊鹏, 等. 2005.9种检疫性实蝇PCR-RFLP快速鉴定研究.植物检疫, 19(1): 2-6.( 1) 1)
|
| [4] |
易建平, 刘素萍, 印丽萍, 等. 2005.TaqMan-MGB探针在小麦印度腥黑穗病菌和黑麦草腥黑穗病菌鉴定上的应用.植物检疫, 19(1): 15-19.( 1) 1)
|
| [5] |
余道坚.2005.检疫性实蝇分子生物学快速鉴定技术的研究.上海: 中国科学院上海生命科学研究院博士学位论文.( 3) 3)
|
| [6] |
余道坚, 章桂明, 陈志粦, 等. 2006.SYBR Green实时荧光PCR快速鉴定辣椒实蝇.植物检疫, 20(1): 10-14.( 2) 2)
|
| [7] |
张润志, 汪兴鉴, 阿地力·沙塔尔.2007.检疫性害虫枣实蝇的鉴定与入侵威胁.昆虫知识, 44(6): 928-930.( 1) 1)
|
| [8] |
Giolio S, Monis P T, Saint C P. 2003.Demonstration of preferential binding of SYBR Green I to specific DNA fragments in real-time multiplex PCR.Nucleic Acids Research, 31 (22): 136-137.( 1) 1)
|
| [9] |
Giulietti A, Overbergh L, Valckx D, et al.. 2001.An overview of real-time quantitative PCR: applications to quantify cytokine gene expression.Methods, 25(4): 386-401.( 1) 1)
|
| [10] |
Muraji M, Nakahara S. 2002.Discrimination among pest species of Bactrocera (Diptera, Tephritidae) based on PCR-RFLP of the mitochondrial DNA.Applied Entomology and Zoology, 37(3): 437-446.( 1) 1)
|
| [11] |
Naeole C K M, Haymer D S.2003.Use of oligonucleotide arrays for molecular taxonomic studies of closely related species in the oriental fruit fly (Bactrocera dorsalis) complex. Molecular Ecology Notes, 3(4): 662-66.( 1) 1)
|
| [12] |
Nakahara S, Kato H, Kaneda M, et al.2002. Identification of the Bactrocera dorsalis Complex (Diptera: Tephritidae) by PCR-RFLP Analysis. Ⅲ. Discrimination between B. philippinensis and B. occipitalis.Res Bull Pl Prot Japan, 38(4): 73-80.( 1) 1)
|
| [13] |
Ponchel F, Toomes C, Bransfield K, et al.2003. Real-time PCR based on SYBR-Green I fluorescence: An alternative to the TaqMan assay for a relative quantification of gene rearrangements, gene amplifications and micro gene deletions. BMC Biotech, 3: 18.( 1) 1)
|
| [14] |
Tanriverdi S, Tanyeli A, Baslamish F, et al. 2002.Detection and genotyping of oocysts of Cryptosporidium parvum by real-time PCR and melting curve analysis. Journal of Clinical Microbiology, 40(9): 3237-3244.( 2) 2)
|
 2014, Vol. 50
2014, Vol. 50

