文章信息
- 向泽宇, 张莉, 张全发, 刘伟, 王根绪, 王长庭, 胡雷
- Xiang Zeyu, Zhang Li, Zhang Quanfa, Liu Wei, Wang Genxu, Wang Changting, Hu Lei
- 青海不同林分类型土壤养分与微生物功能多样性
- Soil Nutrients and Microbial Functional Diversity of Different Stand Types in Qinghai Province
- 林业科学, 2014, 50(4): 22-31
- Scientia Silvae Sinicae, 2014, 50(4): 22-31.
- DOI: 10.11707/j.1001-7488.20140404
-
文章历史
- 收稿日期:2013-05-27
- 修回日期:2014-03-03
-
作者相关文章
2. 西南民族大学生命科学与技术学院成都 610041;
3. 内蒙古阿拉善盟林业研究所阿拉善 750306;
4. 中国科学院西北高原生物研究所西宁 810001;
5. 中国科学院水利部成都山地灾害与环境研究所成都 610041
2. College of Life Science and Technology, Southwest University for Nationalities Chengdu 610041;
3. Alxa Forestry Research Institute of Inner Mongolia Alxa 750306;
4. Northwest Institute of Plateau Biology, CAS Xining 810001;
5. Institute of Hazards and Environment, CAS Chengdu 610041
林分类型会影响土壤养分的积累、分布与循环,而土壤养分含量又是植被生长的重要影响因子(姜红梅等,2011)。土壤中的养分和微生物是森林生态系统的重要组分。土壤养分含量直接影响林木的生长,土壤微生物则通过分解动植物残体参与森林生态系统的物质循环和能量流动,影响树木的生长发育,是土壤肥力的重要指标之一(王宏志等,1993;焦如珍等,1997)。土壤有机质的分解速率受土壤微生物种类、数量和活性的影响。有机质经过微生物的分解还可被植物再次利用,提供植物生长所需的养分,在C,N循环过程中具有重要意义(Porazinska et al.,2003)。而且,土壤微生物对植物有效养分具有储备作用,对土壤C,N等养分的有效性及其在地上、地下的循环特征方面起着调控作用(何振立,1997;Spehn et al.,2000)。
相关研究表明,青海省森林在生物多样性保护、固碳制氧、涵养水源、净化环境、保育土壤、营养积累和森林游憩等生态系统服务功能方面有很高的价值,云杉(Picea asperata)、白桦(Betulaplatyphylla)等是青海省森林的主要代表树种,青海森林不同树种提供的服务功能价值也有所不同,其中柏木(Cupressus funebris)、云杉和白桦的价值优于其他树种(张永利等,2007;张向辉等,2002)。目前,针对青海云杉林的研究较多,大多关注于云杉与林下植物多样性关系(邹扬等,2013)及研究云杉林的土壤理化性质和土壤养分等土壤特性的空间变化规律,以期探讨青海云杉在维持森林生态系统稳定性和多样性方面的作用,为青海森林生态系统的健康发展和管理提供科学参考(赵维俊等,2011a;2011b;刘晓敏等,2011;刘贤德等,2013;张学龙等,2013)。本研究选取云杉、白桦、落叶松(Larix gmelinii)和山杨(Populus davidiana)组成的7种林分类型,探讨不同林型土壤养分和土壤微生物的分布规律,以期直接或间接地反映不同林型对土壤的改良保育作用,为退化生态系统的恢复、合理利用森林土壤资源、维护地力及提高森林生态系统生产力和服务功能提供参考依据。
1 研究区概况7种林分类型(A,B,C,D,E,F,G)的地理坐标及森林植被群落类型等信息见表 1。大通县位于青海东部,地处青藏高原与黄土高原过渡地带(100°51'-101°56'E,36°43'-37°23'N),海拔2 280~4 622 m,属于温带高寒大陆性气候,年均气温2.8 ℃,全年无霜期70~120天,年均降雨量508 mm,集中在7-9月,年均蒸发总量1 290 mm(韩磊等,2009);湟中县位于青海东部(101°09'32″-101°54'50″E,36°13'32″-37°03'19″N),海拔2 225~4 489 m,年降水量350~650 mm,集中在7-9月份,年均蒸发量900~1 000 mm,年均气温8 ℃,属高原半干旱气候(李清顺等,2011);乐都县位于青海东北部(102°09'-102°47'E,36°00'-36°40'N),海拔1 850~4 485 m,属典型的高原气候,年均气温6.9 ℃,年均降水量323.6 mm,年蒸发量1 644 mm,全年无霜期80~160天(赵串串等,2009);民和县地处青海东部,是黄土高原和青藏高原的过渡带(102°26'-103°04' E,35°45'-36°26'N),海拔2 100~4 500 m,属高原大陆性干旱气候,年均气温9 ℃,年均降水量292.2 mm,全年无霜期198天(强泰等,2008);循化县位于青海东部,是典型的黄土高原西端向青藏高原的过渡地带(102° 04'-102° 49' E,35°25'-35°56'N),海拔1 780~4 635 m,日照时间长,太阳辐射强,年均气温8.5 ℃,年均降水量257 mm,集中在7-9月,年蒸发量为2 000~2 400 mm,全年无霜期150天(马建华等,2009);尖扎县位于青海东部黄河上游流域,黄南藏族自治州的北部,为黄土高原西端向青藏高原的过渡地带(101°37'43″-102°08'40″E,35°39'20″-36°10'00″N),海拔1 960~4 616 m,属高原大陆性气候,年均气温8.6 ℃,年均降水量340~495 mm,年均无霜期145天(严虎等,2006)。
|
|
本研究于2011年7-8月在青海省大通县、湟中县、乐都县、民和县、循化县和尖扎县进行。在上述各县分别选取环境条件(如坡度、坡向、郁闭度等)相似的7种林分类型,每种林分类型各设3块50 m×20 m样地,各样地间距大于100 m。对样地内所有胸高直径≥5 cm的乔木进行每木检尺,记载其胸径、树高和生长状况;在各样地中随机设置3个2 m×2 m样方,记录灌木种类、株(丛)数、平均高度和平均基径;并在灌木调查样方内,围取1 m×1 m小样方,记录草本植物的种类、盖度、株数和平均高度。
2.2 土壤养品的采集记录土壤类型及发育状况,按照森林土壤发生层次,在每个样地内用土钻法采取表层土壤(0~20 cm)样品各9个,各样地的9个土样充分混合均匀,其中一部分土样过1 mm土壤筛,风干后用于测定土壤pH和养分含量,另一部分捡去石块和杂物,放入保鲜盒,迅速带回实验室,分装到自封袋中(50g),做好标记,放入冰箱(4 ℃)冷藏保存,用于土壤微生物测定。
2.3 土样养分和pH测定丘林法测定土壤有机质含量,凯氏定氮法测定全氮含量,碱解扩散法(康惠法)测定土壤碱解氮含量,钼锑抗比色法测定土壤全磷含量,碳酸氢钠浸提-钼锑抗比色法测定土壤速效磷含量,醋酸铵法测定土壤全钾含量,四苯硼钠法测定土壤速效钾含量,电极法测定土壤pH(王长庭等,2010;李立平等,2004)。
2.4 土壤微生物功能多样性的测定和计算土壤微生物碳源利用代谢活性测定的具体操作方法(Chaerun et al.,2011):
1)称取10 g新鲜土壤(去除杂草与石子等杂物),盛于100 mL灭菌的三角瓶中,加入90 mL灭菌水,封上封口膜。
2)在超声波清洗机中超声振荡5 min,然后在振荡器上150 r·min-1振荡30 min。
3)取0.5 mL悬浊液加到7 mL灭菌离心管中,再加入4.5 mL灭菌水,振荡摇匀。4)取2 mL悬浊液加到30 mL灭菌离心管中,再加入18 mL灭菌水,振荡摇匀。
5)从冰箱内取出Biolog生态板,室温条件下预热,将稀释制备好的土壤悬浊液倒入灭菌的培养皿中,用八道移液器吸取稀释液(10-3)加到Biolog生态板中,每孔加150 μL。
6)测定零小时的平均颜色变化率(AWCD),25 ℃恒温培养,每隔12 h读取590 nm(颜色+浊度)波长和750 nm(浊度)波长下的吸光值,共培养240 h。
在Biolog Reader(Biolog Inc,USA)分析仪中测得的数据即为Biolog生态板每孔的AWCD值,其计算采用Classen等(2003)的方法。即将每孔在590和750 nm下的吸光值分别减去对照孔的吸光值,然后再用每个对应孔的得值减去750 nm的吸光值,即为每孔实际颜色反应而测得的数值。其中数值小于0.06时按0处理(Classen et al.,2003)。
$ \text{AWCD}=\sum \left({{C}_{i}}-R \right)/n $
式中: Ci为第i孔的590和750 nm下的吸光值之差;R为对照孔的吸光值;n为Biolog微孔板的碳源种类数,Biolog生态板含有β-甲基-D-葡萄糖苷(β-Methyl-D-Glucoside)等31种碳源;n取31。利用各样品培养72 h的数据,计算其微生物多样性指数(Zak et al.,1994;Dobranic et al.,1999)。
Shannon-Weiner指数(H):
$ H=-\sum {{P}_{i}}\ln P $
均匀度指数(J):
$ J=\left(-\sum {{P}_{i}}\ln P \right)/\ln S $
McIntosh指数(U):
$ U=\sqrt{\sum n_{i}^{2}} $
式中: Pi为第i孔的相对吸光度值与整个平板相对吸光度值总和的比率;S为产生颜色变化的孔的数目;ni为第i孔的相对吸光度值(Fang et al.,2009)。
2.5 数据处理应用SPSS 16.0和CANOCO for Windows 4.5软件对土壤养分进行方差分析和土壤微生物Biolog的主成分分析。
3 结果与分析 3.1 不同林分类型土壤养分含量由表 2可知,不同林分类型下的土壤有机质含量表现为大通1#、尖扎>湟中>循化、大通2# >乐都>民和,其最大值为大通1 #(200.23 g·kg-1),最小值为民和(64.19 g·kg-1);全氮含量表现为大通1#、尖扎、湟中>大通2#、乐都、循化>民和,其最大值为尖扎(7.42 g·kg-1),最小值为民和(3.15 g·kg-1);碱解氮含量表现为大通1#、尖扎、湟中>大通2#、循化>乐都>民和,其最大值为尖扎(527.33 mg·kg-1),最小值为民和(252 mg·kg-1);速效磷含量表现为循化、尖扎、湟中>大通1#、大通2#、乐都>民和,其最大值为循化(14.06mg·kg-1),最小值为民和(3.87 mg·kg-1);速效钾含量表现为大通2 #、民和>乐都>大通1#、湟中、循化、尖扎,其最大值为大通2 #(291.67 mg·kg-1),最小值为尖扎(116.67 mg·kg-1)。其中土壤全磷和全钾含量不满足方差齐性的前提条件,用非参数检验分析(Kruskal-Wallis Test),结果表明全磷含量表现为民和(0.65 g·kg-1)最低(P<0.05),其他林分类型差异不显著(P>0.05),全钾含量变化均不显著(P>0.05)。
|
|
Biolog方法广泛应用于土壤等环境样品的微生物功能特征的分析,其中根据Biolog数据计算得出的AWCD值是评价土壤微生物利用单一碳源能力的一个重要指标,可作为微生物整体活性的有效指标来反映微生物对碳源的利用程度(Garland et al.,1991),指示土壤微生物的代谢活性。由图 1可以看出,从接种开始到培养24 h,各处理土壤微生物的AWCD值很小,无明显变化,表明微生物几乎没有代谢碳源;而在培养24~168 h内,AWCD值明显增加,由24 h的近于0的AWCD值增长到168 h的近于1的AWCD值(培养168 h,民和的AWCD值最大为1.18,尖扎的AWCD值最小为0.95)。AWCD值的快速增加表明微生物进入指数生长期,碳源被大量利用。在整个培养过程中,7种林型的土壤微生物AWCD值存在差异,培养72 h时,乐都、民和大通1#、大通2#、湟中循化、尖扎,说明乐都和民和的土壤微生物代谢活性最高(P<0.05)。
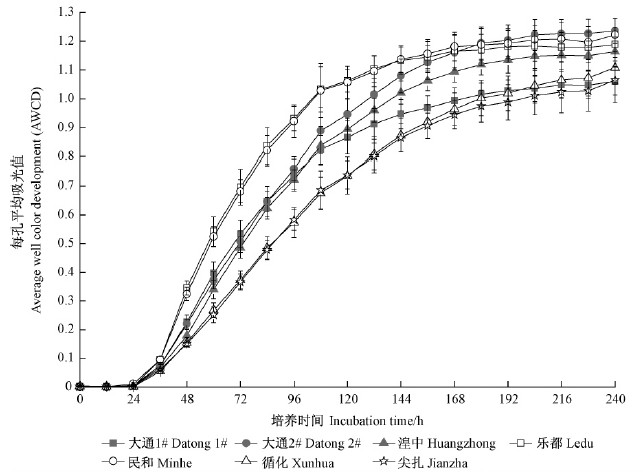 |
图 1 不同林分类型土壤微生物群落AWCD值
Fig. 1 AWCD value of soil microbial communities of different stand types
|
多样性指数可以反映土壤微生物多样性的不同方面。Shannon-Winner指数是反映群落物种及其个体分布均匀程度的综合指标,受群落物种丰富度影响较大;Pielou J指数则是群落物种丰富度均一性的度量。McIntash指数则可反映土壤中微生物群落均匀度(姬艳艳等,2013)。不同林型土壤微生物群落功能多样性指数如图 2所示,与AWCD相似,培养72 h的Shannon-Winner指数、Pielou J指数和McIntash指数总体上均表现出相似规律,即乐都、民和大通1#、大通2#、湟中循化、尖扎;乐都和民和的3类多样性指数值分别为2.93和2.99(Shannon-Winner指数)、0.87和0.89(Pielou指数)、4.51和4.42(McIntash指数)。
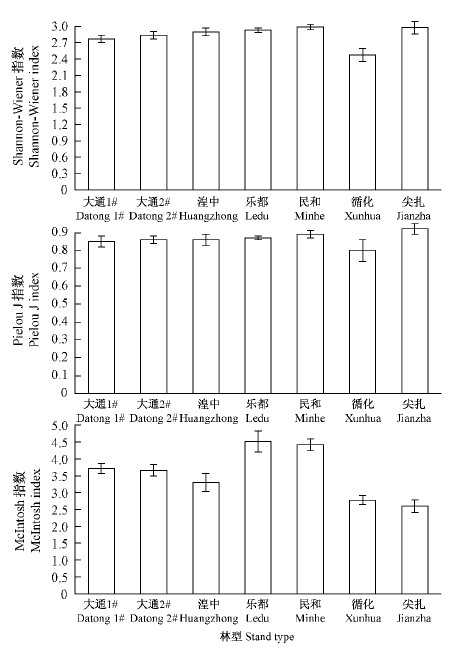 |
图 2 不同林型土壤微生物群落功能多样性
Fig. 2 Soil microbial communities functional diversity of different stand types
|
采用主成分分析方法(principal componentanalysis,PCA),将培养72 h的土壤微生物的每孔相对吸光值转化为几个主成分,以更好地反映微生物功能特征的变化,结果如图 3所示。提取的前2个主成分的方差累积贡献率为76.9 %,其中第1主成分和第2主成分分别解释变量方差的59.8 %和17.1 %,说明前2个主成分(PC1和PC2)是解释微生物碳源利用变异的主要贡献者。主成分因子的载荷分析(表 3)表明,与PC1显著相关的碳源有18种,其中碳水化合物有β-甲基-D-葡萄糖苷(P<0.01)、D-木糖(P<0.01)、D-半乳糖醛酸(P<0.01)、D-甘露醇(P<0.05)、N-乙酰-D-葡萄糖胺(P<0.05)、D-纤维二糖(P<0.01)、α-D-葡萄糖-1-磷酸(P<0.01)和α-D-乳糖(P<0.01)共8种,氨基酸有L-精氨酸(P<0.05)、L-天门冬酰胺(P<0.01)和L-丝氨酸(P<0.01)共3种,多聚物有吐温40(P<0.01)、吐温80(P<0.01)和肝糖(P<0.05)共3种,羧酸有D-苹果酸(P<0.05)、α-丁酮酸(P<0.01)和γ-羟基丁酸(P<0.01)共3种,胺类有腐胺(P<0.05);与PC2显著相关的碳源有5种,其中碳水化合物有i-赤藓糖醇(P<0.05)和D,L-α-磷酸甘油(P<0.01),多聚物有肝糖(P<0.05),氨基酸有L-苯基丙氨酸(P<0.05),胺类有苯乙胺(P<0.01);主成分分析和土壤微生物群落对6种不同碳源的利用图谱(图 4)表明,碳水化合物和氨基酸是土壤微生物群落利用的主要碳源和主成分。
 |
图 3 不同林型土壤微生物群落对碳源利用的主成分分析
Fig. 3 PCA of carbon source utilization of soil microbial communities of different stand types
|
|
|
 |
图 4 不同林分类型土壤微生物对不同碳源的利用图谱
Fig. 4 Map of soil microbial utilization of different carbon sources of different stand types
|
主成分分析是Biolog数据处理中常用的排序方法,但只能得到不同样品间的群落差异,无法探讨群落差异与环境因子间的关系。因此,为了了解土壤微生物代谢特征与环境因子的关系,本研究采用CANOCO软件对Biolog数据进行分析(Bossio et al.,1995)。首先对培养72 h的Biolog数据进行降趋对应分析(DCA),得到第1轴最大梯度长度为0.483,因此选择线性模型冗余分析(RDA)做环境梯度的直接排序分析,探讨环境因子对微生物代谢特征的影响。RDA排序结果表明环境因子变量很好地解释了土壤微生物碳源代谢的变异,RDA前2轴的解释量达到了74.9 %(表 4、图 5),说明环境因子对微生物碳源代谢有重要的影响。RDA第1排序轴的主要影响因子为速效磷含量(P<0.01),第2排序轴的主要影响因子为有机质(P<0.01)、全氮(P<0.05)和碱解氮含量(P<0.05)。
|
|
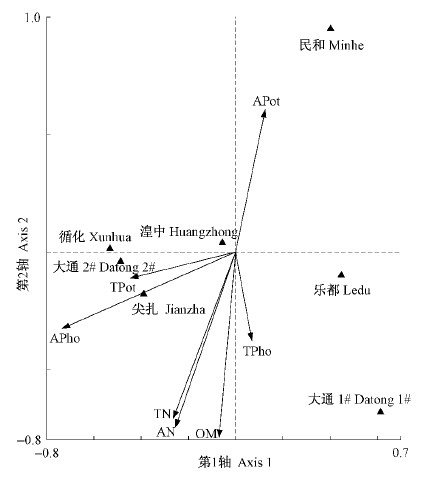 |
图 5 RDA排序图
Fig. 5 RDA ordination diagram
|
本研究中,7种林分类型土壤养分的组成和空间分布特征呈现显著差异。其中,土壤有机质和全氮含量表现为大通1 #、尖扎湟中循化大通2#乐都民和,表明不同林木生长对有机质和全氮含量的影响表现为云杉白桦山杨落叶松。不同林分类型的土壤有机碳的积累和存储是不同的(丁访军等,2012a;2012b),Osbert等(2004)的研究也发现不同林分类型间土壤碳含量各异,其中北美云杉(Picea sitchensis)林和西部铁杉(Tsugaheterophylla)林的土壤碳含量最高,而美国黄松(Pinus ponderosa)林土壤碳含量最低。本研究中不同林型对土壤碱解氮含量的影响也表现为云杉白桦山杨落叶松。Longpré等(1994)和Paré等(1996)的研究表明,不同林分类型土壤的氮素(硝态氮)水平不同,北美短叶松(Pinus banksiana)纯林的硝态氮水平低于其与纸皮桦(Betula papyrifera)或与美洲山杨(Populus tremuloides)的混交林;且不同植被和土壤类型的土壤硝化作用的速率不同,有研究发现纸皮桦和美洲山杨的土壤硝酸盐含量较高,白云杉(Picea glauca)和北美香柏(Thujaoccidentalis)的土壤硝酸盐含较低,而北美短叶松土壤中未发现硝酸盐,因此,不同林分类型影响森林地表氮素的转化。7种林型中民和土壤全磷含量最低,其他6种林型差异不显著;7种林型的土壤全钾含量差异不显著。土壤速效磷含量表现为循化尖扎湟中乐都大通1#、大通2#民和。土壤速效钾含量表现为大通2 #和民和最高,乐都其次,而大通1#、湟中、循化和尖扎较低且相互之间差异不显著。综上可知,不同林分类型条件对土壤养分的影响除速效钾以外,总体上均表现为大通1 #、尖扎湟中循化大通2#乐都民和,即4种不同林木生长对土壤养分积累与分布的影响表现为云杉白桦山杨落叶松,这也充分说明云杉作为青海特有的优势树种对土壤养分的改良及土壤生态的维持具有重要意义(刘晓敏,2012)。
土壤微生物活性和群落结构的变化可以反映土壤生态系统的质量和健康水平(王丽娟等,2013)。植物对土壤环境的重要影响之一是改变土壤微生物群落特征。研究表明不同作物对土壤微生物群落的影响不同(Bronwyn et al.,1997),植物根系对土壤微生物有显著影响(赵兰凤等,2013),植物根系分泌物对土壤微生物的分布有重要作用(Nayyar et al.,2009)。在森林生态系统中,森林树种的改变对地下生态系统功能微生物多样性有明显影响(Augusto et al.,2002),因此微生物、植被和环境之间关系的研究,能更好地了解森林生态系统过程,预测由林型变化等造成的生态系统过程的转化。研究表明,7种林型的微生物群落AWCD曲线相比较,乐都和民和的土壤微生物代谢活性较高,而循化和尖扎的微生物代谢活性较低,大通1 #、大通2 #和湟中的微生物代谢活性则居中。微生物群落代谢多样性指数与AWCD表现出相似规律,这与华建峰等(2013)对砷矿区农田土壤微生物研究结果一致。7种不同林型土壤微生物主成分分析表明,提取的前2个主成分能很好地解释土壤微生物群落的差异性;83.3%的碳水化合物和66.7%的氨基酸与PC1和PC2有较高的相关性(P<0.05),Hackl等(2000)和Peter等(2001)的相关研究也发现,葡萄糖等单糖、寡糖和氨基酸等一些小分子化合物是细菌和真菌等土壤微生物代谢利用的主要碳源。
本研究中不同林分类型土壤微生物功能多样性RDA分析(表 4)表明:土壤养分因子变量共解释了土壤微生物碳源代谢变异的93.1%;其中,速效磷与第1排序轴显著相关(-0.732 8,P<0.01),说明RDA第1轴代表了土壤养分中速效磷;而有机质、全氮、和碱解氮与第2排序轴显著相关,相关系数分别为-0.788 1(P<0.01),-0.7070(P<0.05)和-0.7436(P<0.05),说明RDA第2轴主要反映了土壤有机质和氮素均衡状况对微生物代谢的影响。可见,土壤养分中有机质、氮素和速效磷是影响土壤微生物代谢的主要因素。
| [1] |
丁访军, 潘忠松, 周凤娇, 等. 2012a. 黔中喀斯特地区3种林型土壤有机碳含量及垂直分布特征. 水土保持学报, 26(1): 161-164.( 1) 1)
|
| [2] |
丁访军, 高艳平, 周凤娇, 等. 2012b. 贵州西部4种林型土壤有机碳及其剖面分布特征. 生态环境学报, 21(1): 38-43.( 1) 1)
|
| [3] |
韩磊, 郑佳丽, 贺康宁, 等. 2009. 青海省大通县退耕还林对土壤理化性质的影响. 水土保持研究, 16(3): 100-104.( 1) 1)
|
| [4] |
何振立. 1997. 土壤微生物量及其在养分循环和环境质量评价中的意义. 土壤, (2): 61-69.( 1) 1)
|
| [5] |
华建峰, 林先贵, 蒋倩, 等. 2013. 砷矿区农田土壤微生物群落碳源代谢多样性. 应用生态学报, 24(2): 473-480.( 1) 1)
|
| [6] |
姬艳艳, 张贵龙, 张瑞, 等. 2013. 耕作方式对农田土壤微生物功能多样性的影响. 中国农学通报, 29(6): 117-123.( 1) 1)
|
| [7] |
姜红梅, 李明治, 王亲, 等. 2011. 祁连山东段不同植被下土壤养分状况研究. 水土保持研究, 18(5): 166-170.( 1) 1)
|
| [8] |
焦如珍, 杨承栋, 屠星南, 等. 1997. 杉木人工林不同发育阶段林下植被、土壤微生物、酶活性及养分的变化. 林业科学研究, 10(4): 373-379.( 1) 1)
|
| [9] |
李立平, 张佳宝, 朱安宁, 等. 2004. 土壤养分有效性测定及其方法. 土壤通报, 35(1): 84-90.( 1) 1)
|
| [10] |
李清顺, 黄建忠. 2011. 湟中县林地质量等级研究. 林业调查规划, 36(6): 32-38.( 1) 1)
|
| [11] |
刘贤德, 赵维俊, 张学龙, 等.2013. 祁连山排露沟流域青海云杉林土壤养分和pH变化特征. 干旱区研究, 30(6): 1013-1020.( 1) 1)
|
| [12] |
刘晓敏. 2012. 祁连山青海云杉林土壤理化性质的空间变异性研究.兰州: 甘肃农业大学硕士学位论文.( 1) 1)
|
| [13] |
刘晓敏, 车克钧, 车宗玺, 等. 2011. 祁连山青海云杉分布带土壤的空间变异性研究. 甘肃农业大学学报, 46(6): 86-92.( 1) 1)
|
| [14] |
马建华, 周毛吉. 2009. 循化县畜牧业发展现状及对策. 草业与畜牧, (11): 56-57.( 1) 1)
|
| [15] |
强泰, 毛伟, 赵青林, 等. 2008. 民和县退耕还林(草)的效应及后续发展分析. 安徽农业科学, 36(35): 15601-15603.( 1) 1)
|
| [16] |
王宏志, 林祥钦, 许绍远, 等. 1993. 中国南方混交林研究. 北京: 中国林业出版社, 235-241.( 1) 1)
|
| [17] |
王长庭, 龙瑞军, 王根绪, 等. 2010. 高寒草甸群落地表植被特征与土壤理化性状、土壤微生物之间的相关性研究. 草业学报, 19(6): 25-34.( 1) 1)
|
| [18] |
王丽娟, 李刚, 赵建宁, 等. 2013. 转基因大豆对根际土壤微生物群落功能多样性的影响. 农业环境科学学报, 32(2): 290-298.( 1) 1)
|
| [19] |
严虎, 罗斗拉太. 2006. 尖扎县草地畜牧业生产现状及可持续发展对策. 草业与畜牧, 10, 56-58.( 1) 1)
|
| [20] |
张永利, 杨峰伟, 鲁绍伟. 2007. 青海省森林生态系统服务功能价值评估. 东北林业大学学报, 35(11): 74-76.( 1) 1)
|
| [21] |
张向辉, 王清春, 李瀚, 等. 2002. 青海东峡林区森林生态系统服务功能及经济价值评估. 北京林业大学学报, 24(4): 85-87.( 1) 1)
|
| [22] |
张学龙, 赵维俊, 车宗玺. 2013. 祁连山青海云杉林土壤氮的含量特征. 土壤, 45(4): 616-622.( 1) 1)
|
| [23] |
赵兰凤, 胡伟, 刘小锋, 等. 2013. 生物有机肥对香蕉根际土壤生物多样性的影响. 华南农业大学学报, 34(2): 144-148.( 1) 1)
|
| [24] |
赵串串, 王湜, 孙根行, 等. 2009. 基于GIS和RS的土壤侵蚀监测研究———以青海省乐都县为例. 中国水土保持, (11): 27-28. ( 1) 1)
|
| [25] |
赵维俊, 雷蕾, 刘贤德, 等. 2011a. 祁连山东段青海云杉林土壤理化特性研究. 水土保持通报, 31(6): 72-75.( 1) 1)
|
| [26] |
赵维俊, 刘贤德, 金铭, 等. 2011b. 祁连山西段青海云杉林土壤养分特征研究. 水土保持研究, 18(4): 166-169.( 1) 1)
|
| [27] |
邹扬, 贺康宁, 赵畅, 等. 2013. 高寒区青海云杉人工林密度与林下植物多样性的关系. 西北植物学报, 33(12): 2543-2549.( 1) 1)
|
| [28] |
Augusto L, Ranger J, Binkley D, et al. 2002. Impact of several common tree species of European temperate forest on soil fertility. Annals of Forest Science, 59(3): 233-253. ( 1) 1)
|
| [29] |
Bossio D A, Scow K M.1995. Impact of carbon and flooding on the metabolic diversity of microbial communities in soils. Applied and Environmental Microbiology, 61(11): 4043-4050.( 1) 1)
|
| [30] |
Bronwyn D H, Raymond L C.1997. Using the Gini coefficient with biolog substrate utilization data to provide an alternative quantitative measure for comparing bacterial soil communities. Journal of Microbiological Methods, 30(1): 91-101.( 1) 1)
|
| [31] |
Chaerun S K, Pangesti N P D, Toyota K, et al. 2011. Changes microbial functional diversity and activity in paddy soils irrigated with industrial wastewaters in Bandung, West Java Province, Indonesia. Water Air Soil Pollution, 217(1-4): 491-502.( 1) 1)
|
| [32] |
Classen A T, Boyle S I, Haskins K E, et al. 2003. Community-level physiological profiles of bacteria and fungi: plate type and incubation temperature influences on contrasting soils. FEMS Microbiology Ecology, 44(3): 319-328.( 2) 2)
|
| [33] |
Dobranic J K, Zak J C. 1999. A microtiter plate procedure for evaluating fungal functional diversity. Mycologia, 91(5): 756-765.( 1) 1)
|
| [34] |
Fang H, Yu Y, Chu X, et al. 2009. Degradation of chlorpyrifos in laboratory soil and its impact on soil microbial functional diversity. Journal of Environmental Science, 21(3): 380-386.( 1) 1)
|
| [35] |
Garland J L, Mills A L. 1991. Classification and characterization of heterotrophic microbial communities on basis of patterns of community level sole-carbon-source utilization. Applied Environmental Microbiology, 57(8): 2351-2359.( 1) 1)
|
| [36] |
Hackl E, Bachmann G, Zechmeister-Boltenstern S. 2000. Soil microbial biomass and rhizosphere effects in natural forest stands. Phyton, 40(4): 83-90.( 1) 1)
|
| [37] |
Longpré M H, Bergeron Y, Paré D, et al. 1994. Effect of companion species on the growth of jack pine (Pinus banksiana). Canadian Journal of Forest Research, 24(9): 1846-1853.( 1) 1)
|
| [38] |
Nayyar A, Hamel C, Lafond G, et al. 2009. Soil microbial quality associated with yield reduction in continuous-pea. Applied Soil Ecology, 43(1): 115-121.( 1) 1)
|
| [39] |
Osbert J S, John C, Beverly E L, et al. 2004. Dynamics of carbon stocks in soils and detritus across chronosequences of different forest types in the Pacific Northwest, USA. Global Change Biology, 10(9): 1470-1481.( 1) 1)
|
| [40] |
Paré D, Bergeron Y. 1996. Effect of colonizing tree species on soil nutrient availability in a clay soil of the boreal mixedwood. Canadian Journal of Forest Research, 26(6): 1022-1031.( 1) 1)
|
| [41] |
Peter C, Simon P W, Jonathan M A, 2001. Effects of fungal inocula on the decomposition of lignin and structural polysaccharides in Pinus sylvestris litter. Biology and Fertility of Soils, 33(3): 246-251.( 1) 1)
|
| [42] |
Porazinska D L, Bardgett R D, Blaauw M B, et al. 2003. Relationship at the aboveground-belowground interface: plants, soil biota, and soil processes. Ecological Monographs, 73(3): 377-395.( 1) 1)
|
| [43] |
Spehn E M, Joshi J, Schmid B, et al. 2000. Plant diversity effects on soil heterotrophic activity in experimental grassland ecosystems. Plant and Soil, 224(2): 217-230.( 1) 1)
|
| [44] |
Zak J C, Willig M R, Moorhead D L, et al. 1994. Functional diversity of microbial communities: a quantitative approach. Soil Biology and Biochemistry, 26(9): 1101-1108.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

