文章信息
- 章建红, 陈志颖, 阮晓, 张玉竹, 潘存德, 王强
- Zhang Jianhong, Chen Zhiying, Ruan Xiao, Zhang Yuzhu, Pan Cunde, Wang Qiang
- DHAP胁迫对天山云杉幼苗内源激素含量变化的影响
- Change of Endogenous Plant Hormones Contents during Seedling Growth of Picea schrenkiana Treated with DHAP
- 林业科学, 2014, 50(4): 121-128
- Scientia Silvae Sinicae, 2014, 50(4): 121-128.
- DOI: 10.11707/j.1001-7488.20140418
-
文章历史
- 收稿日期:2013-10-12
- 修回日期:2014-02-17
-
作者相关文章
2. 浙江大学宁波理工学院宁波 315100;
3. 新疆农业大学林学与园艺学院乌鲁木齐 830052
2. Ningbo Institute of Technology, Zhejiang University Ningbo 315100;
3. College of Forestry and Horticulture, Xinjiang Agricultural University Urumqi 830052
植物化感作用是指植物通过向环境释放化学物质,对周围植物(包括微生物)产生直接或间接的有害或有利的作用(Rice,1984)。同种植物间的化感作用被称为自毒作用(Hegde et al.,1990),自毒作用广泛存在于植物森林生态系统中(Zeng et al.,2008),通过自毒物质释放来实现(Chon et al.,2010),植物通过根分泌、茎叶挥发和残体分解作用将自毒物质释放到环境中(Singh et al.,1999;Inderjit et al.,2005)。研究发现Pinus halepensis、赤松(P. densiflora)、P. laricio等自体物质干扰自身种子发芽、生长及幼苗建成的现象(Fernandez et al.,2008;Kato-Noguchi et al.,2010;Muscolo et al.,2006)。人工抚育森林系统中,一些树种如巨桉(Eucalyptus grandis)、银桦(Grevillea robusta)、木麻黄(Casuarina equisetifolia)等自毒物质导致种群更新障碍(Zhang et al.,2010;Singh et al.,1999)。
天山云杉(Picea schrenkiana)属云杉属(Picea),为中亚和亚洲中部山地特有种,主要分布在天山及昆仑山西部北坡。天山云杉林面积约52.84万hm2,占新疆天然林有林地总面积的44.9%,蓄积量约1.231亿m3,为天然林有林地总蓄积量的61.3%,是构成天山乃至新疆森林生态系统的物质主体,对水源涵养、水土保持和维持生态系统健康起着至关重要的作用(Wang et al.,2006)。森林经营者在长期管理实践中发现,云杉天然林存在生产力下降、地力衰退、自然更新困难等问题(张新时等,1963)。在无火干扰的有限时间的森林自然恢复中,自毒作用可能是导致天山云杉天然更新不良或更新障碍的主要因素(Li et al.,2010)。Ruan等(2011)从天山云杉凋落物和针叶水浸提液中分离纯化出的3,4-二羟基苯乙酮(DHAP),被认为是引起天山云杉自毒作用的主要化学物质之一。那么,对DHAP影响天山云杉更新过程生理途径的深入探讨,会对揭示天山云杉自毒作用发生的内在规律有所帮助。
内源植物激素对植物生长发育与形态建成具有调控作用,与植物的环境适应性、抗逆性、胁迫信号传导等有关联(Lopez et al.,2008)。化感物质作为一种胁迫因子,可以通过诱导受体植物体内源激素水平变化,影响细胞正常的生长与发育过程,进而干扰植物间的竞争关系(Broz et al.,2010;Maqbool et al.,2013)。Kaya等(2013)研究发现Lepidiumdraba甲醇提取物处理玉米(Zea mays),导致种子和幼苗内源赤霉素(GA)、玉米素(ZT)、吲哚乙酸(IAA)浓度降低,脱落酸(ABA)浓度升高;此外,提取物处理反枝苋(Amaranthus retroflexus)时,其种子和幼苗内源GA,ZT浓度降低,ABA升高,IAA浓度水平在低处理强度时高于对照,高处理强度时降低。Lara-Nunez等(2009)报道Sicyos deppei提取物能延迟番茄(Lycopersicon esculentum)种子萌发、抑制胚根生长,番茄种子萌发过程内源植物激素ABA含量水平显著升高。Yang等(2008)研究发现紫茎泽兰(Ageratina adenophora)所含化感物质4,7-二甲基-1-(丙烷-2-亚甲基)-1,4,4a,8a-四氢萘-2,6(1H,7H)-二酮(DTD)和6-羟基-5-异丙基-3,8-二甲基-4a,5,6,7,8,8a-六氢萘-2(1H)-酮(HHO)能使陆稻(Oryza sativa)根玉米素核苷酸ZR,IAA,ABA浓度水平发生改变,随着化感物质处理浓度升高,处理时间延长,IAA/ABA,ZR/ABA比值降低。上述研究表明内源植物激素能够响应化感自毒物质对植物幼苗的胁迫作用。DHAP对天山云杉幼苗生长过程内源激素调控作用的研究尚未见报道。本文以胚芽长、胚根长和鲜质量变化为幼苗生长参数,用3个DHAP浓度水平处理天山云杉幼苗,分时间阶段取样分析测定4种内源植物激素含量变化,探讨天山云杉自毒作用发生的生理过程与途径。
1 材料与方法 1.1 试验材料天山云杉种子于2012年10月采自新疆农业大学实习林场2林班(43°20'37″N,86°49' 01″ E,海拔1 738 m)。3,4-二羟基苯乙酮(DHAP)标准物质购于百灵威(上海)科技有限公司。植物激素标准物质玉米素(ZT)、赤霉素(GA3)、吲哚乙酸(IAA)和脱落酸(ABA)购于Sigma-Aldrich(北京)公司。乙腈、甲醇均为色谱纯,购自美国天地公司(Tedia Companic Inc.,Fairfield,USA);甲酸为分析纯;水为二次蒸馏纯净水。
1.2 方法DHAP处理液的配制浓度分别为0.1,1.0,5.0 mmol·L-1,置于冰箱备用。
1)DHAP对幼苗生长影响试验采用人工气候培养箱,选择光强40 μmol·m-2 s-1,设定温度培养条件:光周期20 ℃16 h,暗周期15 ℃ 8 h。选择天山云杉种子(籽粒饱满),用去离子水培养至胚根突破种皮,取100粒胚根突破种皮的种子均匀摆放在铺有2层滤纸的20 cm×25 cm发芽盒内,并配以不同浓度DHAP处理液10 mL(对照组为去离子水),每个处理设3个重复。处理当天为第1天,每天测定各处理组幼苗胚芽长、胚根长和鲜质量,取样本分析植物激素含量,第12天结束试验。
2)内源植物激素提取方法随机从每个处理组取长势均匀的3株幼苗(所取幼苗样品鲜质量标准偏差SD≤0.003 g),单株幼苗分别放入液氮速冻并研磨成粉末,加80%预冷甲醇(内含1.0 mmol·L-12,6-二叔丁基-4-甲基苯酚,BHT)200 μL,4 ℃低温避光浸提12 h,4 ℃ 12 000 r·min-1离心15 min,取上清液;残渣再用80%冷却甲醇200 μL浸提2次,每次1 h,4 ℃ 12 000 r·min-1离心15 min,合并3次上清液。样品过C18固相萃取柱,80%甲醇洗脱收集,氮气吹干后用流动相溶解并定容至2 mL。过0.22 μm滤膜超高效液相色谱分析,每个处理取3组单株幼苗分析结果(取平均值)。
3)色谱分析条件采用超高效液相色谱Agilent1290。色谱柱: Eclipse Plus C18柱,2.1 mm×58 mm,1.8 μm;柱温30 ℃,流速0.5 mL·min-1,进样体积0.3 μL,样品外标法定量,激素含量单位μg·g-1 FW;二极管阵列检测器波长254 nm;流动相A:乙腈-甲醇(5: 95,含0.1%甲酸),流动相B:乙腈-水(5 : 95,含0.1%甲酸);梯度洗脱程序:0~1 min,25% A;1~3.5 min,25%~45% A;3.5 ~6 min,45% A;6~8 min,45%~40% A。图 1A为4种植物激素与DHAP标准溶液色谱图,图 1B为样品色谱图。
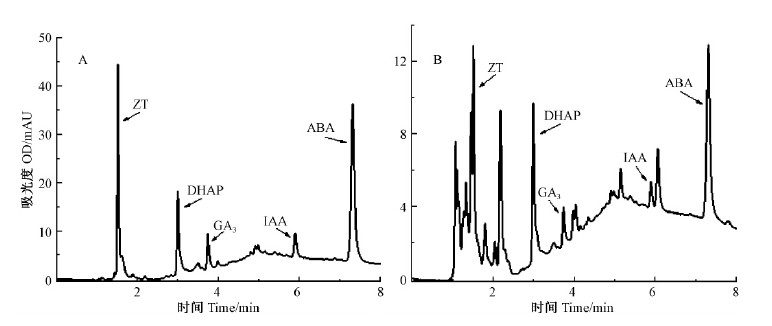 |
图 1 植物激素与DHAP 的UPLC 图谱
Fig. 1 UPLC chromatogram of plant hormones and DHAP
A: 标准品图谱Standard; B: 样品图谱Sample. |
ZT线性方程: Y=674.26X+3.41,R2=0.999 5,线性范围0.03~6.50 μg;GA3线性方程:Y=83.02X-2.42,R2=0.999 6,线性范围0.03 ~89.00 μg;IAA线性方程: Y=43.01X-4.26,R2=0.999 8,线性范围0.04~52.00 μg;ABA线性方程: Y=430.02X-1.38,R2=0.999 7,线性范围0.01~0.50 μg。
1.3 数据处理采用胚根、胚芽和鲜质量3个指标鉴定DHAP对天山云杉幼苗生长的影响。
采用Excel、SPSS和Sigmaplot软件对数据进行处理分析。利用单因素方差分析和最小显著差数法(least significant difference,LSD)多重比较分析幼苗胚根长、胚芽长和鲜质量的差异。
2 结果与分析 2.1 DHAP处理对幼苗生长的影响DHAP处理对实生苗胚芽生长的影响结果见图 2A。与对照相比,DHAP处理对胚芽生长影响作用不显著(P < 0.05)。DHAP对实生苗胚根生长的影响结果见图 2B。与对照相比,0.1 mmol·L-1 DHAP处理第1~8天有抑制但作用不显著,9天后能促进胚根生长;1.0 mmol·L-1 DHAP处理对胚根生长有抑制作用但不显著;5.0 mmol·L-1 DHAP处理对胚根长表现出显著抑制作用(P < 0.05)。DHAP处理对实生苗鲜质量的影响结果见图 2C。与对照相比,0.1 mmol·L-1DHAP处理第5~10天实生苗鲜质量显著降低,10天后实生苗鲜质量增加(P < 0.05);1.0和5.0mmol·L-1 DHAP处理组第2天开始实生苗鲜质量降低,抑制作用显著(P < 0.05)。
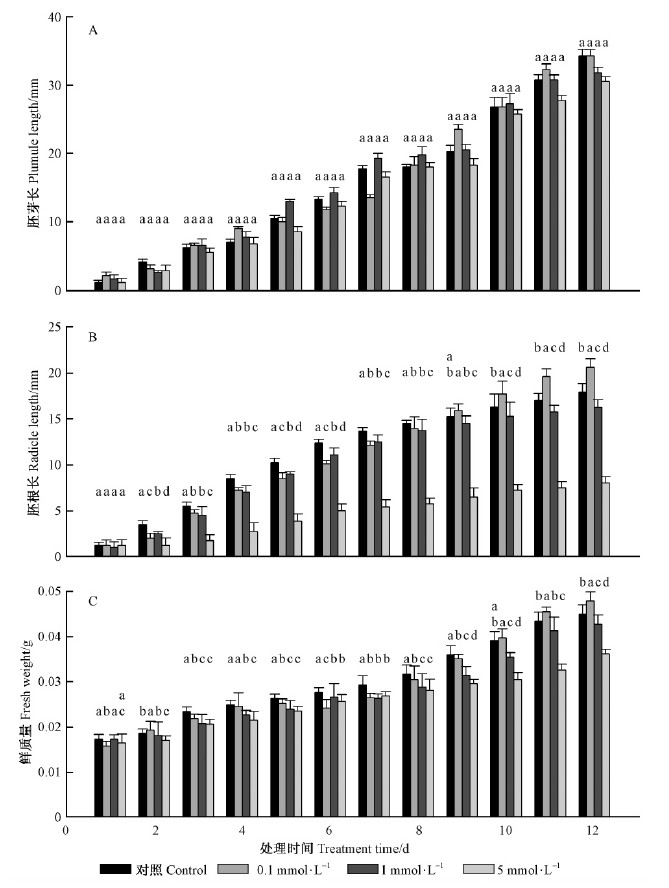 |
图 2 DHAP 处理对天山云杉胚芽、胚根生长及鲜重的影响
Fig. 2 Effect of DHAP on plumule,radicle length and fresh weight of P. schrenkiana(mean ± SD,n = 3)
A:胚芽长Plumule Length;B:胚根长Radicle Length;C:鲜质量(平均值±标准偏差,n=3)Fresh weight(mean±SD,n=3).不同小写字母表示同一观察时间不同浓度DHAP处理之间差异显著(P < 0.05)Different small lettersindicate significant differences among DHAP concentration on each sampling date(P < 0.05). |
DHAP处理对幼苗生长过程内源ZT相对含量变化影响的结果见图 3A。对照与DHAP处理组1~7天未检测到内源ZT存在,第8天内源ZT相对含量上升,最高值分别为对照组[(4.68±0.09)μg·g-1 FW]、0.1mmol·L-1DHAP处理组[(6.10±0.13)μg·g-1 FW]、1.0mmol·L-1 DHAP处理组[(4.14±0.19)μg·g-1FW]、5.0 mmol·L-1 DHAP处理组[(3.38±0.11)μg·g-1 FW]。
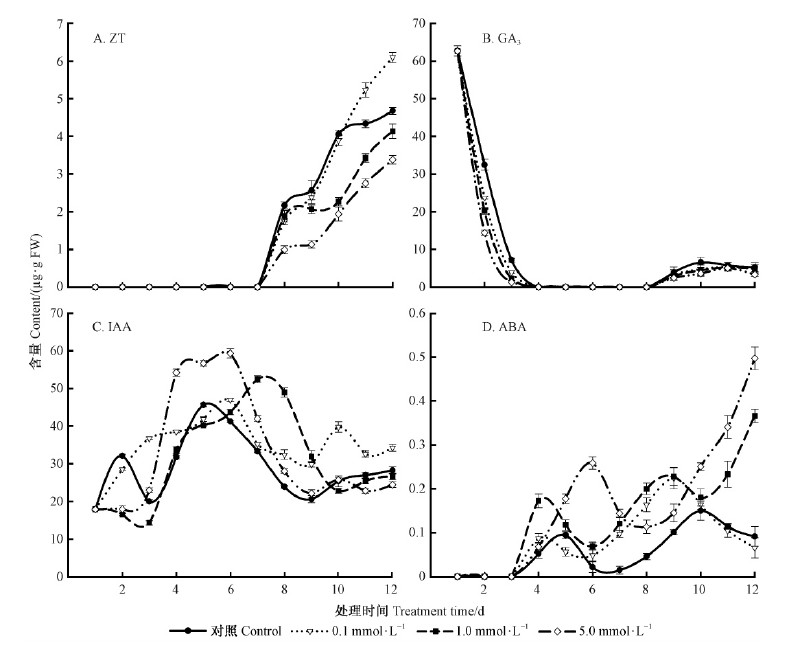 |
图 3 DHAP 处理对天山云杉幼苗生长过程内源激素相对含量变化的影响
Fig. 3 Effect of DHAP on endogenous plant hormone concentration level during the seedling growth of P. schrenkiana (mean ± SD,n = 3)
|
DHAP处理对幼苗生长过程内源GA3相对含量变化影响的结果见图 3B。对照与DHAP处理组内源GA3相对含量变化呈现先降低后小幅回升趋势。处理1天后,对照与DHAP处理组内源GA3相对含量降低幅度最大的是5.0 mmol·L-1 DHAP处理组,其次是1.0 mmol·L-1,再者是0.1 mmol·L-1,降幅最小的是对照组;第4~8天未检出;第9天后有检出,处理间含量变化不显著。
DHAP处理对幼苗生长过程内源IAA相对含量变化影响的结果见图 3C。对照与0.1 mmol·L-1DHAP处理组IAA相对含量呈现双峰,对照组峰值出现在第2天[(32.12±0.43)μg·g-1 FW]、第5天[(45.65±0.42)μg·g-1 FW],0.1 mmol·L-1 DHAP处理组出现在第6天[(46.98±0.45)μg·g-1 FW]、第10天[(39.79±1.39)μg·g-1 FW];1.0 mmol·L-1 DHAP处理IAA含量变化呈双谷单峰,谷出现在第3,10天,峰值出现在第7天[(52.46±0.94)μg·g-1 FW];5.0 mmol·L-1 DHAP处理组IAA相对含量第4~6天出现高峰平台,含量为(54.24±0.94)~(59.34±1.23)μg·g-1 FW,是对照组的1.24~1.70倍。
DHAP处理对幼苗生长过程内源ABA相对含量变化影响的结果见图 3D。对照与0.1 mmol·L-1DHAP处理组ABA相对含量变化呈双峰,对照组峰值出现在第5天[(0.09±8.1e-3)μg·g-1 FW]、10天[(0.15±0.02)μg·g-1 FW],0.1 mmol·L-1DHAP处理组峰出现在第4天[(0.09±0.01)μg·g-1 FW]、第9天[(0.22±0.02)μg·g-1 FW];1.0mmol·L-1 DHAP处理组出现双峰后ABA含量持续上升,峰值出现在第4,9天,后升至最高值(0.37±0.02)μg·g-1 FW;5.0 mmol·L-1 DHAP处理组ABA含量出现峰谷后上升趋势,峰出现第6天,谷在第8天,后升至最高值(0.50±0.03)μg·g-1 FW。
2.3 DHAP处理对幼苗生长过程内源ABA/ZT,ABA/IAA,ABA/(ZT+GA3+IAA)比值的影响DHAP处理对幼苗生长过程内源ABA/ZT比值变化的影响结果见图 4A。第8~12天,对照和0.1 mmol·L-1 DHAP处理组ABA/ZT比值呈先上升后下降趋势;1.0和5.0 mmol·L-1 DHAP处理组ABA/ZT比值呈先上升后下降再上升趋势;DHAP处理对幼苗生长过程内源ABA/IAA比值变化的影响结果见图 4B。对照与0.1 mmol·L-1 DHAP处理组ABA/IAA比值变化呈双峰,峰分别出现在第5,4天和第10,9天;1.0和5.0 mmol·L-1 DHAP处理组ABA/IAA比值出现峰(第4,6天)后呈上升趋势。DHAP处理对幼苗生长过程内源ABA/(ZT+GA3+IAA)比值变化的影响结果见图 4C。对照与DHAP处理组ABA/(ZT+GA3+IAA)比值变化与ABA/IAA比值变化趋势相同。
 |
图 4 DHAP 处理对天山云杉幼苗生长过程内源激素间比值的影响
Fig. 4 Effect of DHAP on the ratios of endogenous plant hormone concentration during the seedling growth of P. schrenkiana
|
研究植物化感作用时,胚根、胚芽长度和鲜质量变化被作为实生苗生长参数(Leather et al.,1986)。有研究表明:胚根生长对化感或自毒作用的敏感性强于胚芽生长(Chon et al.,2000;2002;Haddadchi et al.,2009;Moameri et al.,2011)。DHAP处理对天山云杉幼苗生长影响试验结果表明:处理液对胚芽生长无显著作用,对胚根生长抑制作用强弱为5.0 mmol·L-1 > 1.0 mmol·L-1 > 0.1 mmol·L-1 >对照(0.1 mmol·L-1处理组10天后显著促进胚根生长),对鲜质量抑制作用显著(0.1 mmol·L-1处理组10天后鲜质量显著增加)。DHAP对胚根长的抑制作用强于对胚芽长,与相关研究结论一致(Chon et al.,2000;2002;Haddadchi et al.,2009;Moameri et al.,2011),这可能与胚根最先接触、吸收化感物质有关。
植物可通过自身的生理调节作用产生对胁迫逆境的适应(Peleg et al.,2011)。植物激素(planthormone)是由植物自身代谢产生的一类生长调节物质,能从合成部位快速转运到效应器,在极低浓度下产生生理效应,与植物的生长发育、抗逆性密切相关(Kohli et al.,2013;Davies,2010)。研究表明植物可通过不同激素响应逆境胁迫,ABA被认为是一种最为直接的应激响应激素,可能影响多种生理过程(Sreenivasulu et al.,2012);生长素、赤霉素、细胞分裂素也是植物在胁迫条件下维持生长的关键因子(Peleg et al.,2011);Hutchison等(2002)研究认为玉米素具备与脱落酸类似功能的响应效应;Prasad等(2002)研究发现受体植物经化感物质处理后吲哚乙酸含量显著下降。本研究中随DHAP处理液浓度升高,幼苗内源GA3浓度水平降低,ABA浓度水平升高,此结论与Kamal等(2008)研究向日葵(Helianthus annus)对小麦(Triticum aestivum)的化感作用和Kaya等(2013)研究L. draba提取物对玉米和反枝苋的毒性试验结果一致,这一结果的产生可能是由于天山云杉自毒物质DHAP作为一种抑制剂阻断GA诱导植物细胞生长,抑制GA活性,使能够检测到的活性GA3浓度水平降低;在自毒物质胁迫条件下,激活幼苗ABA合成,从而使幼苗ABA浓度水平升高。经DHAP处理的天山云杉幼苗IAA浓度水平升高,与Rani等(2011)研究儿茶素(catechin)对拟南芥(Arabidopsis thaliana)苗的影响结果一致,这可能是由于DHAP能够减少天山云杉幼苗IAA被氧化。
本研究0.1 mmol·L-1 DHAP处理组10天后IAA浓度水平升高、ABA浓度水平降低、ABA/ZT和ABA/(ZT+GA3+IAA)比值分别降低32.16% ~82.24%和18.81%~39.87%,是诱导胚根长、鲜质量增加的原因,低浓度DHAP处理增加IAA氧化酶活性,促使IAA合成,IAA能够诱导形成次生木质部,次生木质部可促进植物吸收营养物质,从而使植物生长速度加快;低浓度DHAP也可促进ABA降解,抑制型激素降低,促进生长;内源ABA/ZT和ABA/(ZT+GA3+IAA)比值失衡,与Fahad等(2012)研究外源水杨酸(SA)对玉米苗内源激素影响的作用结果相似,DHAP诱导ABA/ZT和ABA/(ZT+GA3+IAA)比值处于低水平平衡有利于植物在胁迫环境生长。1.0 mmol·L-1和5.0 mmol·L-1处理组幼苗生长第4~12天,ABA/(ZT+GA3+IAA)比值分别增大46.12%~331.32%,91.68% ~565.83%,随着DHAP处理液浓度增大,激素间含量比值失衡程度增大,幼苗胚根长和鲜质量抑制作用加强。高处理强度组(5.0 mmol·L-1)IAA浓度水平在幼苗生长4~6天内快速升高,是对照组的1.24~ 1.70倍,这一生长阶段IAA过量积累,使幼苗生长受抑制,为主调控作用。天山云杉自毒物质DHAP诱导天山云杉幼苗内源ABA,IAA,GA3,ZT浓度水平发生的变化,打破原有内源激素平衡,响应和适应自然环境下DHAP胁迫,调控幼苗生长,从而使幼苗表型发生变化,成为调控幼苗生长的“扳机”。
| [1] |
张新时, 张瑛山.1963.乌苏林区天山云杉天然更新的初步研究.新疆农业科学, (1): 8-12.( 1) 1)
|
| [2] |
Broz A K, Broeckling C D, De-la-Pea C. 2010. Plant neighbor identity influences plant biochemistry and physiology related to defense. BMC Plant Biology, 10(1): 115.( 1) 1)
|
| [3] |
Chon S U, Choi S K, Jung S, et al. 2002. Effects of alfalfa leaf extracts and phenolic allelochemicals on early seedling growth and root morphology of alfalfa and barnyard grass. Crop Protection, 21(10): 1077-1082.( 2) 2)
|
| [4] |
Chon S U, Coutts J H, Nelson C J. 2000. Effects of light, growth media, and seedling orientation on bioassays of alfalfa autotoxicity. Agron J, 92(4): 715-720.( 2) 2)
|
| [5] |
Chon S U, Nelson C J.2010. Allelopathy in compositae plants. Agronomy for Sustainable Development, 30(2): 349-358. ( 1) 1)
|
| [6] |
Davies P J. 2010. Plant Hormones: Biosynthesis, Signal Transduction, Action. Kluwer Academic Publishers, Dordrecht, Boston, London, 27-28.( 1) 1)
|
| [7] |
Fahad F, Bano A. 2012. Effect of salicylic acid on physiological and biochemical characterization of maize grown in saline area. Pakistan Journal of Botany, 44(4): 1433-1438.( 1) 1)
|
| [8] |
Fernandez C, Voiriot S, Mévy J P, et al. 2008. Regeneration failure of Pinus halepensis Mill.: The role of autotoxicity and some abiotic environmental parameters. Forest Ecology and Management, 255(7): 2928-2936.( 1) 1)
|
| [9] |
Haddadchi G R, Gerivani Z. 2009. Effects of phenolic extracts of canola (Brassica napuse L.) on germination and physiological responses of soybean (Glycin max L.) seedlings. International Journal of Plant Production, 3(1): 63-74.( 2) 2)
|
| [10] |
Hegde R S, Miller D A. 1990. Allelopathy and autotoxicity in Alfalfa: Characterization and effects of preceding crops and residue incorporation. Crop Science, 30(6): 1255-1259.( 1) 1)
|
| [11] |
Hutchison C E, Kieber J J. 2002. Cytokinin signaling in Arabidpsis. Plant Cell, 14(suppl): S47-S59.( 1) 1)
|
| [12] |
Inderjit, Weston L A, Duke S O. 2005. Challenges, achievements and opportunities in allelopathy research. Journal of Plant Interactions, 1(2): 69-81.( 1) 1)
|
| [13] |
Kamal J, Bano A. 2008. Allelopathic potential of sunflower (Helianthus annus L.) on soil metals and its leaves extracts on physiology of wheat (Triticum aestivum L.) seedlings. African Journal of Biotechnology, 7(18): 3261-3265.( 1) 1)
|
| [14] |
Kato-Noguchi H, Seki T, Shigemori H. 2010. Allelopathy and allelopathic substance in the moss Rhynchostegium pallidifolium. Journal of Plant Physiology, 167(6): 468-471. ( 1) 1)
|
| [15] |
Kaya Y, Aksakal O, Sunar S.2013. Phytotoxical effect of Lepidium draba L. extracts on the germination and growth of monocot (Zea mays L.) and dicot (Amaranthus retroflexus L.) seeds.[2013-03-27]. http://tih.sagepub.com/content/early/2013/01/03/074823371247170.( 2) 2)
|
| [16] |
Kohli A, Sreenivasulu N, Lakshmanan P, et al. 2013. The phytohormone crosstalk paradigm takes center stage in understanding how plants respond to abiotic stresses. Plant Cell Reports, 32(7): 945-957.( 1) 1)
|
| [17] |
Lara-Nunez A, S'anchez-Nieto S, Anaya A L. 2009. Phytotoxic effects of Sicyos deppei(Cucurbitaceae)in germinating tomato seeds. Physiologia Plantarum, 136(2): 180-192.( 1) 1)
|
| [18] |
Leather G R, Einhelling F A. 1986. Bioassays in the study of allelopathy//Putnam A R, Tang C S. The Science of Allelopathy. John Wiley, Sons, New York, 133-145.( 1) 1)
|
| [19] |
Li Z H, Wang Q, Ruan X, et al. 2010. Phenolics and plant Allelopathy. Molecules, 15(12): 8933-8952.( 1) 1)
|
| [20] |
Lopez M A, Bannenberg G, Castresana C. 2008. Controlling hormone signaling is a plant and pathogen challenge for growth and survival. Curr Opin Plant Biol, 11(4): 420-427.( 1) 1)
|
| [21] |
Maqbool N, Wahid A, Farooq M, et al. 2013. Allelopathy and Abiotic Stress Interaction in Crop Plants. Allelopathy. Springer Berlin Heidelbeg, 451-468.( 1) 1)
|
| [22] |
Moameri M, Abbasi-Khalaki M, Tavili A. 2011. Effects of Haloxylon aphyllum(Minkw.) Lljin extract on seeds germination and seedlings growth of Agropyron elongatum (Host.) and Agropyron Desertorum (Fisch.). Res J Seed Sci, 4(1): 40-50.( 2) 2)
|
| [23] |
Muscolo A, Sidari M. 2006. Seasonal fluctuations in soil phenolics of coniferous forest: Effects of seed germination of different coniferous species. Plant Soil, 284(1/2): 305-318.( 1) 1)
|
| [24] |
Peleg Z, Blumwald E. 2011. Hormone balance and abiotic stress tolerance in crop plants. Current Opinion in Plant Biology, 14(3): 290-295.( 2) 2)
|
| [25] |
Prasad M N V, Devi S R. 2002. Physiological basis foralle lochemical action of ferulic acid//Reigosa M J, Pedrol N. Allelopathy: from Molecular to Ecosystems. USA: Science Publishers Inc., 25-43.( 1) 1)
|
| [26] |
Rani A, Vats K S, Sharma M, et al. 2011. Catechin promotes growth of Arabidopsis thaliana with concomitant changes in vascular system, photosynthesis and hormone content. Biologia Plantarum, 55(4): 779-782.( 1) 1)
|
| [27] |
Rice E L. 1984. Allelopathy. 2nd edn. Academic Press: New York, NY, USA.( 1) 1)
|
| [28] |
Ruan X, Li Z H, Wang Q, et al. 2011. Autotoxicity and allelopathy of 3, 4-dihydroxyacetophenone isolated from Picea schrenkiana needles. Molecules, 16(10): 8874-8893.( 1) 1)
|
| [29] |
Singh H P, Batish D R, Kohli R K. 1999. Autotoxicity: concept, organisms, and ecological significance. Critical Reviews in Plant Sciences, 18(6): 757-772.( 2) 2)
|
| [30] |
Sreenivasulu N, Harshavardhan V T, Govind G, et al. 2012. Contrapuntal role of ABA: does it mediate stress tolerance or plant growth retardation under long-term drought stress? Gene, 506(2): 265-273.( 1) 1)
|
| [31] |
Wang Q, Ruan X, Pan C D, et al. 2006. Need for sustainability policy-A case study of the National Forest Conservation Program (NFCP) in the western region of Tianshan Mountain, China. The Forestry Chronicle, 82(1): 31-39.( 1) 1)
|
| [32] |
Yang G Q, Wan F H, Liu W X, et al. 2008. Influence of two allelochemicals from Ageratina adenophora Sprengel on ABA, IAA and ZR contents in roots of upland rice seedlings. Allelopathy Journal, 21(2): 253-262.( 1) 1)
|
| [33] |
Zeng R S, Mallik A U, Luo S M. 2008. Allelopathy in Sustainable Agriculture and Forestry. Springer: New York, 363-386.( 1) 1)
|
| [34] |
Zhang D J, Zhang J, Yang W Q, et al. 2010. Potential allelopathic effect of Eucalyptus grandis across a range of plantation ages. Ecological Research, 25(1): 13-23.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

