文章信息
- 曹喜兵, 赵振利, 范国强, 邓敏捷, 董焱鹏
- Cao Xibing, Zhao Zhenli, Fan Guoqiang, Deng Minjie, Dong Yanpeng
- 甲基磺酸甲酯对毛泡桐丛枝病苗DNA甲基化的影响
- Effect of Methyl Methanesulphonate on DNA Methylation of Witches’Broom Seedlings of Paulownia tomentosa
- 林业科学, 2014, 50(3): 99-108
- Scientia Silvae Sinicae, 2014, 50(3): 99-108.
- DOI: 10.11707/j.1001-7488.20140314
-
文章历史
- 收稿日期:2013-08-14
- 修回日期:2013-11-29
-
作者相关文章
泡桐(Paulownia spp.)是中国重要的速生用材和平原绿化树种之一,在防风固沙、改善生态环境和提高农民生活水平等方面发挥着重要作用。然而,由植原体引起的泡桐丛枝病可引起幼苗和幼树枯死、大树生长量下降(杨庆,2002),减少农民收入,严重影响其种植泡桐的积极性,阻碍中国泡桐产业的发展。过去,虽然科技工作者对泡桐丛枝病进行了大量的研究工作(王蕤等,1981; 金开璇等,1989; 胡勤学等,1991; 1992; 田国忠等,1994a; 1994b; 2010; 范国强等,1997; 巨关升等,1996; 刘飞等,2008; 范国强等,2007b; 宋晓斌等,1997; 赵会杰等,1995),基本阐明了丛枝病病原的传播方式、丛枝病的发生规律以及发病过程中的生理代谢变化,并在分子生物学水平上开展了丛枝病发生机制的研究工作(林木兰等,1993; 牟海青等,2011; 史英姿等,2007; 张春立等,1994; 范国强等,1997; 2003; 2007a; 2007b; 2008; 2011; 2012; 翟晓巧等,2010; 赵改丽等,2011; 曹喜兵等,2012a; Lin et al.,2009; Wang et al.,2010; Li et al.,2011),但目前对于丛枝病病原侵入健康泡桐后,细胞内生理代谢活动发生变化的机制仍不十分清楚。研究表明,泡桐丛枝病发生可导致叶片DNA甲基化水平的降低(黎明等,2008)。DNA甲基化通过DNA构象、DNA与蛋白质相互作用方式和染色质结构等的改变,从而调节基因的表达(Hao et al.,2002; Yoder et al.,1997; Finnegan et al.,2000b)。DNA甲基化水平过高或过低,都可引起生物形态的异常变化(Finnegan et al.,1996; 1998; 2000a; 2000b)。适宜浓度的MMS在SSR水平上不改变泡桐的DNA碱基序列,但可使泡桐丛枝病幼苗转变为健康苗(曹喜兵等,2012a),然而,有关MMS对丛枝病泡桐DNA甲基化的作用至今在国内外未见报道。因此,本文利用AFLP(amplified fragment length polymorphism)和MSAP(methylation sensitive amplification polymorphism)方法研究MMS(methyl methanesulphonate)处理毛泡桐丛枝病幼苗前后DNA碱基序列和DNA甲基化的变化,以期为进一步阐明泡桐丛枝病发生的分子机制奠定基础。
1 材料与方法 1.1 试验材料及处理试验材料为河南农业大学泡桐研究所经体细胞胚胎发生途径获得并培养30天的毛泡桐(P.tomentosa)丛枝病组培苗和对应的健康苗。将上述丛枝病幼苗1.5 cm的顶芽接种于盛有40 mL1/2 MS培养基的100 mL三角瓶中,培养基的MMS浓度分别为0,20,60和100 mg·L-1,对照为接种于不含MMS培养基、经体胚发生途径获得的毛泡桐健康组培苗。每浓度处理20瓶,每瓶接种3个顶芽,试验重复2次。培养方法和条件参见翟晓巧等(2010)方法。培养30 天后,分别剪取适量不同MMS浓度处理幼苗和大小基本相同健康幼苗(CK)长约1.5 cm顶芽,用液氮冷冻后置于-86 ℃冰箱内备用。
1.2 试验方法 1.2.1 DNA提取不同MMS浓度处理和对照幼苗的DNA提取参照张延召等(2009)方法。
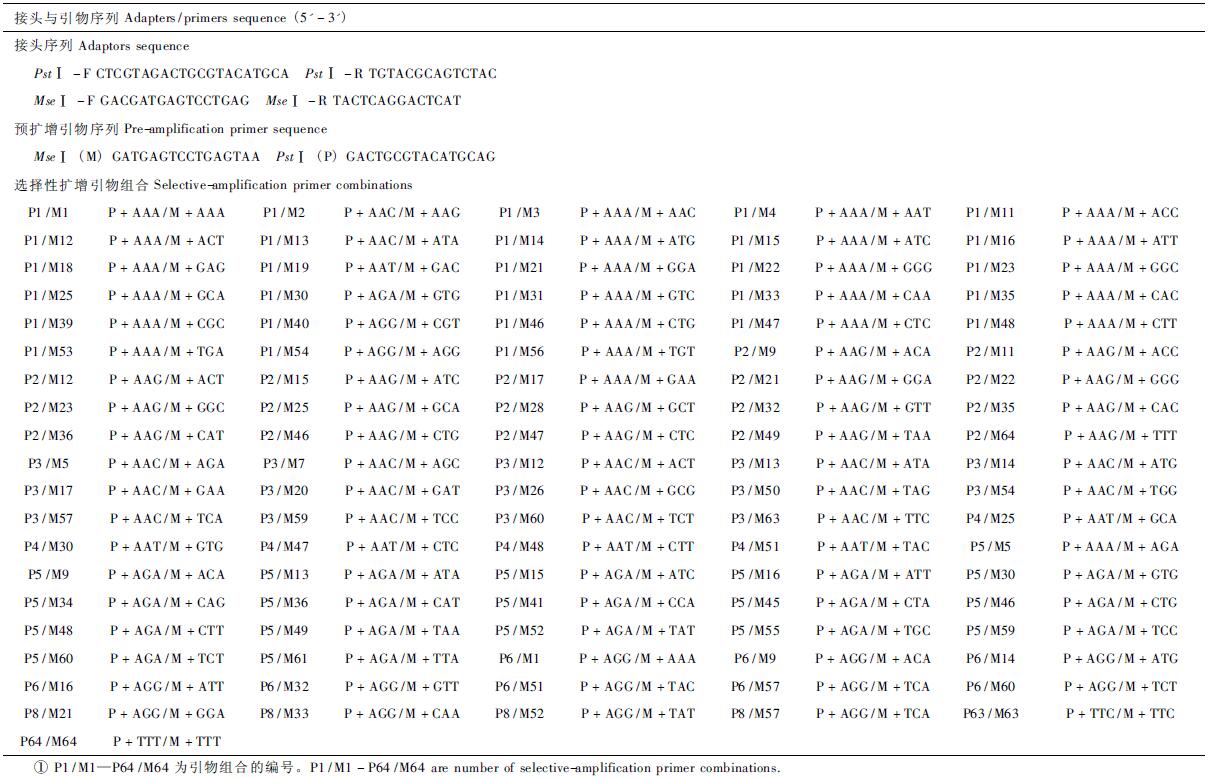
1.2.2 AFLP和MSAP扩增及电泳AFLP技术酶切体系包含500 ng模板DNA,3 U的PstⅠ和MseⅠ; 20 μL连接体系含酶切产物15 μL,0.25 μmol·L-1 PstⅠ接头,2.5 μmol·L-1 MseⅠ接头,2 U T4连接酶; 20 μL 预扩增体系含5 μL稀释10倍的连接产物,100 μmol·L-1 dNTP,2 U Taq酶,PstⅠ和MseⅠ预扩引物各0.25 μmol·L-1; 20 μL选择性扩增反应体系含5 μL稀释20倍预扩增产物,100 μmol·L-1 dNTP,2 U Taq 酶,PstⅠ和MseⅠ选扩引物各0.35 μmol·L-1。AFLP扩增所用接头及引物序列见表 1。AFLP分析所用PCR扩增程序及电泳分别参照曹喜兵等(2010)方法。MSAP技术酶切体系包含300 ng模板DNA,16 U的EcoRⅠ和10 U的HapⅡ(MspⅠ); 25 μL连接体系含酶切产物 20 μL,0.16 μmol·L-1 EcoRⅠ接头,1.6 μmol·L-1 HapⅡ(MspⅠ)接头,2 U T4连接酶; 20 μL预扩增体系含5 μL稀释10倍的连接产物,100 μmol·L-1 dNTP,0.5U Taq 酶,EcoRⅠ和HapⅡ(MspⅠ)预扩引物各 0.25 μmol·L-1; 20 μL选择性扩增反应体系含5 μL稀释30倍预扩增产物100 μmol·L-1 dNTP,0.5U Taq酶,EcoRⅠ和HapⅡ(MspI)选扩引物各0.3 μmol·L-1。MSAP扩增所用接头及引物序列见表 2。MSAP分析所用的PCR扩增程序及电泳分别参照曹喜兵等(2012b)方法。
|
|
|
|
扩增产物电泳结束、凝胶显影后,先在UMAX PowerLook 2100XL型扫描仪扫描成像,再分别统计分析不同MMS浓度处理和健康苗间AFLP和MSAP凝胶谱带的变化。对MSAP凝胶谱带来说,H和M分别为EcoRⅠ/HapⅡ和EcoRⅠ/MspⅠ双酶切产物的电泳谱带,每一条谱带代表一个酶切位点。谱带的"有"或"无"分别记作"1"或"0"。将每个DNA样品的H和M扩增谱带可分为4种: 种类Ⅰ(H,M=1,1),种类Ⅱ(H,M=1,0),种类Ⅲ(H,M=0,1),种类Ⅳ(H,M=0,0)。为了解泡桐丛枝病发生与DNA甲基化模式变化关系,这里以20,60,100 mg·L-1的MMS处理丛枝病幼苗和健康幼苗的DNA甲基化模式与无MMS处理的丛枝病幼苗的模式进行比较。甲基化模式分为多态性和单态性,多态性又包含3种: A型(甲基化)、B型(去甲基化)和C型(不定)。其中,A型中的A1和A2代表DNA重新甲基化(0浓度样品中H和M泳道均有带,而处理样或CK样品中仅H或M泳道有带),A3和A4代表DNA超甲基化(0浓度样品中仅H或M泳道有一条带,而处理样或CK样品中H和M泳道都没带);B型(Bl,B2,B3和B4)代表DNA去甲基化,其中Bl和B2的谱带与对应的A1和A2相反,B3和B4的谱带与对应的A3和A4相反;C型代表DNA甲基化的不确定性(0浓度样品与处理样或CK间DNA甲基化的差异谱带无法确定);D型(D1,D2和D3)代表单态性类型(0浓度样品与处理样或CK间DNA谱带相同)。同时,计算样品的DNA甲基化水平、多态性带数(A +B +C)、DNA甲基化多态性和DNA单态性。
1.2.4 DNA甲基化多态性片段回收、克隆和测序将电泳凝胶上差异条带用干净刀片小心切下后,用聚丙烯酰胺凝胶回收试剂盒(上海生工生物工程股份有限公司)回收目的DNA片段。以5 μL回收产物为模板,用该片段对应的预扩增和选择性扩增引物组合在相同的PCR条件进行二次扩增,扩增产物首先经1%琼脂糖凝胶电泳检测回收后,再与pMD18-T(TaKaRa)载体连接,然后,转化大肠杆菌DH5α感受态细胞,最后挑取阳性单克隆测序(上海生工生物工程股份有限公司)。测序结果与NCBI(http//www.ncbi.nlm.nih.gov)数据库进行比对分析,并进行其对应目的片段的功能预测。
2 结果与分析 2.1 MMS对毛泡桐丛枝病幼苗DNA碱基序列的影响从MMS处理毛泡桐患丛枝病幼苗的AFLP扩增的结果(图 1)可以看出,MMS处理不改变毛泡桐丛枝病幼苗的DNA碱基序列。同一对引物扩增下,MMS处理病苗和健康苗产生了数量相同、大小一致的DNA片段,并且每一引物对可扩增出50~70条谱带。该结果说明,MMS处理没有引起毛泡桐丛枝病幼苗DNA碱基序列在AFLP水平上改变。
 |
图 1 MMS处理毛泡桐丛枝病幼苗的AFLP扩增产物
Fig. 1 AFLP amplification of P. tomentosa witches' broom seedlings treated by MMS
|
MSAP扩增产物的凝胶电泳结果(表 3)表明,MMS处理可以提高毛泡桐丛枝病幼苗的总DNA甲基化水平。随着MMS浓度的增大,处理的毛泡桐丛枝病幼苗的DNA甲基化水平由27.10%逐渐升高到32.93%。但是,MMS处理后幼苗的总DNA甲基化水平仍低于健康幼苗。这意味着MMS处理能提高丛枝病幼苗基因组总DNA甲基化水平,但仍不能达到健康幼苗DNA甲基化水平。
|
|
由MMS处理毛泡桐丛枝病幼苗DNA的MSAP电泳凝胶及其分析结果(图 2)可以看出,幼苗的DNA甲基化模式和状态存在明显的差异(表 4)。与健康幼苗相比,随着MMS浓度的增加,丛枝病幼苗DNA总甲基化多态性由低变高(表 5),并且DNA甲基化多态性谱带由393条增加到400条(DNA甲基化多态性由14.32%上升为15.30%),DNA去甲基化谱带由288条增加到366条(DNA去甲基化多态性由10.49%上升为14.01%),处理丛枝病幼苗DNA去甲基化多态性的丰富性皆低于DNA甲基化多态性的丰富性。此外,毛泡桐健康幼苗DNA甲基化和去甲基化多态性均高于丛枝病幼苗(表 5)。这说明MMS处理能引起丛枝病幼苗DNA甲基化模式发生变化。
 |
图 2 MMS处理毛泡桐丛枝病幼苗的部分DNA甲基化模式变化
Fig. 2 Changes of DNA methylation pattern in seedlings with MMS treatment
|
|
|
|
|
不同浓度MMS处理丛枝病幼苗和健康苗DNA经MSAP扩增共产生60条与丛枝病相关的差异片段,经二次PCR扩增,弃掉扩增失败的片段,最终回收到54条差异片段。测序分析得到34条片段有同源序列,20条没有匹配到同源序列。在有同源序列的片段中,23条为功能已知序列(占总差异片段的42.60%),11条功能未知序列(20.37%)。在23条为功能已知序列中,匹配到的DNA片段对应的蛋白质主要涉及能量代谢(NADH泛醌氧化还原酶亚基E)、物质代谢(内膜转运蛋白yhjE代谢物和41 kDa叶绿体DNA结合蛋白)、转运相关(ABC转运家族蛋白B亚组成员4)、转录调节有关(锌指同源蛋白)、信号转导相关(CHANSE 2传感蛋白和同源亮氨酸拉链蛋白ATHB-7)和致病相关(乙醇脱氢酶)(表 6)。
|
|
丛枝病发生是泡桐与丛枝病植原体相互作用的最终结果。丛枝病植原体(病原)侵入健康泡桐细胞(寄主)后,一方面病原要从寄主内获得其生长发育所需要的营养物质,以便于长期繁衍后代,另一方面病原进入寄主细胞分泌或代谢产生的物质会对寄主的正常生理代谢活动产生一定的影响,这些影响反过来又会左右病原的活动。研究表明,植原体可引起健康植物细胞内植物激素、糖类物质、蛋白质和次生代谢物质等含量的变化,最终使植物形态出现异常(林木兰等,1993; 牟海青等,2011; 史英姿等,2007; 张春立等,1994; 范国强等,1997; 2003; 2007a; 2007b; 2008; 2011; 2012; 翟晓巧等,2010; 赵改丽等,2011; 曹喜兵等,2012a; Lin et al.,2009; Wang et al.,2010; Li et al.,2011)。但是,这些物质含量的变化是泡桐丛枝病发生的结果,而不是其发生的直接原因。众所周知,基因表达水平的变化可引起植物形态的改变。本试验中,低浓度MMS处理可以使毛泡桐丛枝病幼苗的症状减轻,适宜浓度的MMS处理可以消除植原体的存在(翟晓巧等,2010; 曹喜兵等; 2012a),并且MMS处理后的丛枝病幼苗的DNA碱基序列与健康毛泡桐幼苗DNA碱基序列在AFLP水平上相同,这与笔者前期SSR的试验结果(范国强等,2011; 2012; 翟晓巧等,2010; 赵改丽等,2011; 曹喜兵等; 2012a)一致。虽然不同MMS浓度处理患丛枝病毛泡桐幼苗的形态和含植原体的情况存在差异(曹喜兵等,2012a),但毛泡桐丛枝病发生前后寄主DNA碱基序列没有发生变化,因此泡桐丛枝病的发生可能与DNA共价修饰有关。DNA甲基化就是其共价修饰的一种方式。在真核生物中,DNA甲基化可导致基因特异表达、细胞分化和染色体失活等(Lu et al.,2005; Gonzalgo et al.,1997; Meyer et al.,1994; Paterno et al.,1985; Rossi et al.,1997; Ulian et al.,1996)。DNA甲基化既具有表观遗传效应(epigenetic effect)又具有突变效应(mutagenic effect),其在不改变DNA碱基排列顺序的同时,阻断了遗传信息的传递,从而引起形态性状可稳定遗传的变化(Holliday,1987)。本研究表明,毛泡桐丛枝病幼苗DNA的甲基化水平低于形态正常的MMS处理苗,这与笔者过去利用土霉素处理丛枝病苗得到的结果一致(黎明等,2008),类似结果也出现在病毒侵染的西伯利亚百合(Lilium brownii var.viridulum)的研究中(许静静等,2011),也有报道用DNA去甲基剂(5-氮胞苷)处理甘蓝(Brassica oleracea var.acephala)在引起其DNA甲基化水平降低的同时导致植株产生矮化、叶片变小、丛状株等现象(King,1995)。因此,笔者认为总DNA甲基化水平降低是毛泡桐丛枝病发生的主要原因之一。由于EcoRⅠ/HapⅡ和EcoRⅠ/MspⅠ仅识别CCGG序列的甲基化,而CCGG序列的甲基化是基因组甲基化很小的一部分(1/256)(Xiong et al.,1999),甲基化还发生在CNG和CHH序列中(Cokus et al.,2008)。人体基因启动子区异常高甲基化使得抑癌等基因转录沉默引起癌症的发生,但基因组总DNA甲基化水平降低(Muntean et al.,2009)。因此,要阐明泡桐丛枝病发生与DNA甲基化变化的关系,既要研究其总DNA甲基化水平的变化,还要研究DNA甲基化模式或状态的变化。研究表明,在基因中或其临近区域发生DNA甲基化则可以抑制基因的表达,而去甲基化可以激活基因的表达(陆光远等,2005)。本研究中,丛枝病植原体侵染也导致泡桐DNA甲基化模式发生了变化,其原因可能是植原体激活了一些诱导泡桐丛枝病发生的基因表达的结果。随着MMS浓度增大,丛枝病幼苗转化为健康状态,这些诱导发病的基因关闭,同时,新的抑制丛枝病发生相关的基因开始表达,从而植株形态发生从病态转变为健康状态的过程。该过程可能是通过基因组DNA甲基化状态变化调整来实现的。这种现象与TMV诱导的烟草DNA甲基化模式变化趋势一致(Choi et al.,2007)。
DNA甲基化模式变化是DNA甲基化酶和去甲基化酶相互作用的一个过程(Rival et al.,2008)。毛泡桐丛枝病发生过程中,一些基因通过甲基化和去甲基化调节基因表达水平,从而影响其形态特征。例如,41 kDa叶绿体类核DNA结合蛋白参加光合作用1,5-二磷酸核酮糖羧化酶/加氧酶的降解(Kato et al.,2004),可导致植物顶端分生组织过度分化,叶片变小和植株矮化,光合速率减慢(Murakami et al.,2000),从而使植物呈现丛枝症状。CHANSE2传感蛋白(腺苷酸环化酶/膜上的组氨酸激酶)能感受细胞膜上渗透压改变,刺激膜上的腺苷酸环化酶催化ATP形成环腺苷酸,从而引起胞内细胞信号的级联反应(Kimura et al.,2002)。在细胞信号网络传递过程中,ABC转运蛋白B亚组成员4能接受细胞信号,并形成跨膜通道实现底物分子跨膜运输和底物识别,能把大量的多糖、酶、激素、酚类及次生代谢产物通过ATP水解释放的能量跨膜转运(Flanagan et al.,2007; Kaneda et al.,2011)。锌指蛋白在接受病原胁迫信号时可激活钙调蛋白基因表达并激活病程相关蛋白的转录(Park et al.,2007)。由此可得出,毛泡桐丛枝病发生与其DNA甲基化水平降低和甲基化模式变化密切相关,是毛泡桐基因网络中相关基因共同作用的结果。
| [1] |
曹喜兵,范国强,翟晓巧,等. 2012a. 甲基磺酸甲酯处理毛泡桐丛枝病幼苗的形态变化及SSR分析. 植物病理学报,42(2): 214-218.( 5) 5)
|
| [2] |
曹喜兵,赵改丽,范国强. 2012b. 泡桐MSAP体系建立及引物筛选. 河南农业大学学报,46(5): 535-541.( 1) 1)
|
| [3] |
曹喜兵,何 佳,翟晓巧,等. 2010. 泡桐AFLP反应体系的建立及引物筛选. 河南农业大学学报,44(2): 145-150.( 1) 1)
|
| [4] |
范国强,蒋建平. 1997. 泡桐丛枝病发生与叶片蛋白质氨基酸变化关系的研究. 林业科学研究,10(6): 570-573.( 3) 3)
|
| [5] |
范国强,李 有,郑建伟,等. 2003. 泡桐丛枝病发生相关蛋白质的电泳分析. 林业科学,39(2): 121-122.( 2) 2)
|
| [6] |
范国强,曾 辉,翟晓巧. 2008. 泡桐丛枝病发生特异相关蛋白质亚细胞定位及质谱鉴定. 林业科学,44(4): 83-86.( 2) 2)
|
| [7] |
范国强,张 胜,翟晓巧,等. 2007a. 抗生素对泡桐丛枝病植原体和发病相关蛋白质的影响. 林业科学,43(3): 138-142.( 2) 2)
|
| [8] |
范国强,张变莉,翟晓巧,等. 2007b. 利福平对泡桐丛枝病幼苗形态和内源植物激素变化的影响. 河南农业大学学报,41(4): 387-395.( 2) 2)
|
| [9] |
范国强,赵改丽,翟晓巧,等. 2011. 硫酸二甲酯处理豫杂一号泡桐丛枝病幼苗的形态变化及其SSR分析. 东北林业大学学报,39 (5): 30-33.( 3) 3)
|
| [10] |
范国强,赵改丽,翟晓巧,等. 2012. 硫酸二甲酯对毛泡桐丛枝病幼苗植原体SSR 扩增位点的影响. 南京林业大学学报,36(3): 5-8.( 3) 3)
|
| [11] |
胡勤学,周咏芝,丁达明.1991. 泡桐丛枝病寄主酚及酚相关酶的变化. 森林病虫通讯,2: 9-11.( 1) 1)
|
| [12] |
胡勤学,周咏芝. 1992. 泡桐丛枝病感病指示植物的病理变化. 中南林学院学报,12(1): 57-63..( 1) 1)
|
| [13] |
金开璇,田国忠. 1989. 组织化学技术快速检测泡桐丛枝病研究. 植物学报,19(30): 185-189.( 1) 1)
|
| [14] |
巨关升,王 蕤,周银莲,等. 1996. 泡桐丛枝病的抗性与维生素C关系的研究. 林业科学研究,4(9): 431-434.( 1) 1)
|
| [15] |
黎 明,翟晓巧,范国强,等. 2008. 土霉素对豫杂一号泡桐丛枝病幼苗形态和DNA甲基化水平的影响. 林业科学,44(9): 152-156.( 2) 2)
|
| [16] |
林木兰,杨继红,陈 捷,等. 1993. 泡桐丛枝病类菌原体单克隆抗体的研制及初步应用. 植物学报,35(9): 710-715.( 2) 2)
|
| [17] |
刘 飞,翟晓巧,董占强,等. 2008. 抗生素对豫杂一号泡桐丛枝病苗体外植株再生的影响. 河南农业大学学报,42(1): 27-31.( 1) 1)
|
| [18] |
陆光远,伍晓明,陈碧云,等. 2005. 油菜种子萌发过程中DNA甲基化的MSAP分析. 科学通报, 50(24): 2750-2756.( 1) 1)
|
| [19] |
牟海青,周 涛,赵文军,等. 2011. 泡桐丛枝植原体抗原膜蛋白抗血清的制备及应用. 植物病理学报,41 (2): 161-170.( 2) 2)
|
| [20] |
史英姿,吴云锋,顾沛雯,等. 2007. 泡桐丛枝植原体16SrDNA和延伸因子基因序列分析. 微生物学通报,34 (2): 291-295.( 2) 2)
|
| [21] |
宋晓斌,张学武,郑文锋. 1997. 丛枝病对泡桐不同部位细胞差别透性的影响. 西北林学院学报,12(2): 77-79.( 1) 1)
|
| [22] |
田国忠,张锡津,熊耀国,等. 1994a. 泡桐筛管内胼胝质与抗丛枝病关系的研究. 植物病理学报,24(4): 352.( 1) 1)
|
| [23] |
田国忠,金开璇,袁巧平,等. 1994b. 感染MLO泡桐组培苗代谢变化与致病机理的关系. 中国科学(B),24(5): 484-490.( 1) 1)
|
| [24] |
田国忠,李 永,梁文星. 2010. 丛枝病植原体侵染对泡桐组培苗组织内H202产生的影响. 林业科学,46(9): 96-104.( 1) 1)
|
| [25] |
王 蕤,王守宗,孙秀琴. 1981. 激素对泡桐丛枝病发生的影响. 林业科学,17(3): 280-286.( 1) 1)
|
| [26] |
许静静,杨 凯,王文和,等. 2011. 病毒侵染对西伯利亚百合DNA甲基化的影响. 西北植物学报,31(5): 0861-0867.( 1) 1)
|
| [27] |
杨 庆. 2002. 丛枝病对泡桐木材材性的影响. 西北农林科技大学学报,30(4): 62-64.( 1) 1)
|
| [28] |
翟晓巧,曹喜兵,范国强,等. 2010. 甲基磺酸甲酯处理的豫杂一号泡桐丛枝病幼苗的生长及SSR分析. 林业科学,46(12): 176-181.( 5) 5)
|
| [29] |
张春立,林木兰,胡勤学,等. 1994. 泡桐丛枝病类菌原体DNA的分子克隆与序列分析. 植物学报,36(4): 278-282.( 2) 2)
|
| [30] |
张延召,曹喜兵,翟晓巧,等. 2009. 适用于AFLP分析的泡桐DNA提取方法研究. 河南农业大学学报,43(6): 610-614.( 1) 1)
|
| [31] |
赵改丽,赵振利,范国强,等. 2011. 硫酸二甲酯对白花泡桐丛枝病幼苗形态变化及DNA碱基序列的影响. 河南农业大学学报,45(3): 287-291.( 3) 3)
|
| [32] |
赵会杰,吴光英,林学焐,等. 1995. 泡桐丛枝病与超氧物歧酶的关系. 植物生理学通讯,31 (4): 266-267.( 1) 1)
|
| [33] |
Choi C S,Sano H.2007. Abiotic-stress induces demethylation and transcriptional activation of a gene encoding a glycerophosphodiesterase-like protein in tobacco plants. Molecular Genetics and Genomics, 277(5): 589-600.( 1) 1)
|
| [34] |
Cokus S J,Feng S,Zhang X,et al. 2008. Shotgun bisulphite sequencing of the Arabidopsis genome reveals DNA methylation patterning. Nature,452(7184): 215-219.( 1) 1)
|
| [35] |
Finnegan E J,Genger R K,Kovac K, et al. 1998. DNA methylation and the promotion of flowering by vernalization. Proc Natl Acad Sci USA,95: 5824-5829.( 1) 1)
|
| [36] |
Finnegan E J,Kovac K A. 2000a. Plant DNA methylationforases. Plant Mol Biol,43: 189-201.( 1) 1)
|
| [37] |
Finnegan E J,Peacock W J,Dennis E S. 2000b. DNA methylation, a key regulation of plant development and other processes. Curr Opin Genet Dev,10(2): 217-223.( 2) 2)
|
| [38] |
Finnegan E J,Peacock W J,Dennis E S. 1996. Reduced DNA methylation in Arabidopsis thaliana results in abnormal plant development. Proc Natl Acad Sci USA,93: 8449-8454.( 1) 1)
|
| [39] |
Flanagan J U,Huber T. 2007. Structural evolution of the ABC transporter subfamily B. Evolutionary Bioinformatics,8(3): 309-316.( 1) 1)
|
| [40] |
Gonzalgo M L,Jones P A.1997. Mutagenic and epigenetie effects of DNA methylation. Mutation Research,386(2): 107-118.( 1) 1)
|
| [41] |
Hao Y J,Deng X X. 2002. Stress treatments and DNA methylation afected the somatic embryogenesis of citrus callus. Acta Botanica Sinica,44(6): 673-677.( 1) 1)
|
| [42] |
Holliday R.1987.The inheritance of epigenetic defects. Science,238(4824): 163-170.( 1) 1)
|
| [43] |
Kaneda M,Schuetz M,Lin B S,et al. 2011. ABC transporters coordinately expressed during lignification of Arabidopsis stems include a set of ABCBs associated with auxin transport. J Exp Bot,62(6): 2063-2077.( 1) 1)
|
| [44] |
Kato Y,Murakami S,Yamamoto Y,et al. 2004. The DNA-binding protease, CND41 and the degradation of ribulose -1,5- bisphosphate carboxylase/oxygenase in senescent mleaves of tobacco. Planta,220(1): 97-104.( 1) 1)
|
| [45] |
Kimura Y,Mishima Y,Nakano H,et al. 2002. An adenylyl cyclase, CyaA, of Myxococcus xanthus functions in signal transduction during osmotic stress. J Bacterionl,184(13): 3578-3585.( 1) 1)
|
| [46] |
King G J. 1995. Morphological development in brassica-oleracea is modulated by in-vivo treatment with 5-azacytidine.Journal of Horticultural Science,70(2): 333.( 1) 1)
|
| [47] |
Li Y,Tian G Z,Piao C G,et al. 2011. The molecular identification and phylogeny of tephrosia witches'-broom phytoplasma. Forest Research,24(5): 549-553.( 2) 2)
|
| [48] |
Lin C L,Zhou T,Li H F,et al. 2009. Molecular characterisation of two plasmids from paulownia witches'-broom phytoplasma and detection of a plasmid-encoded protein in infected plants. Eur J Plant Pathol,123(3): 321-330.( 2) 2)
|
| [49] |
Lu G Y,Wu X M,Chen B Y,et al. 2005. MSAP analysis of DNA methylation during rapeseed germination. Chinese Science Bulletin,24: 2750-2756.( 1) 1)
|
| [50] |
Meyer P,Niedenhof I,Ten L M. 1994. Evidence for cytosine methylation of nonsymmetrical sequence in transgenic Petunia hybrida. The EMBO Journal,13: 2084-2088.( 1) 1)
|
| [51] |
Muntean A G,Hess J L. 2009. Epigenetic dysregulation in cancer. The American Journal of Pathology,175: 1353-1361.( 1) 1)
|
| [52] |
Murakami S,Kondo Y,Nakano T,et al. 2000. Protease activity of CND41,a chloroplast nucleoid DNA-binding protein,isolated from cultured tobacco cells. Febs Lett,468(1): 15-18.( 1) 1)
|
| [53] |
Park H C,Kim M L,Lee S M,et al. 2007. Pathogen-induced binding of the soybean zinc finger homeodomain proteins GmZF-HD1 and GmZF-HD2 to two repeats of ATTA homeodomain binding site in the calmodulin isoform 4 (GmCaM4) promoter. Nucleic Acids Res,35: 3612-3623.( 1) 1)
|
| [54] |
Paterno G D,Adra C N. 1985. X-chromosome reactivation in mouse emhryonal carcinoma cells. Mol Cell Biol,5: 2705-2712..( 1) 1)
|
| [55] |
Rival A,Jaligot E,Beule T,et al. 2008. Isolation and expression analysis of genes encoding MET, CMT, and DRM methyltransferases in oil palm (Elaeis guineensis Jacq.) in relation to the 'mantled' somaclonal variation. J Exp Bot, 59(12): 3271-3281.( 1) 1)
|
| [56] |
Rossi V,Motto M,Pellegrini L. 1997. Analysis of the methylation pattern of the maize opque-z(o2)promoter and in vitro binding studies indicate that the o2 B-Zip protein and other endosperm factors can bind to methylated target sequences. Journal of Biological Chemistry,272(21): 13758-13765.( 1) 1)
|
| [57] |
Ulian E C,Magill J M,Magill C W,et al. 1996. DNA methylation and expression of NPTII in transgenic petunias and progeny. Theoretical and Applied Genetics, 92: 976-981.( 1) 1)
|
| [58] |
Wang J,Zhu X P,Gao R,et al. 2010. Genetic and serological analyses of elongation factor EF-Tu of paulownia witches'-broom phytoplasma (16SrI-D). Plant Pathology,59(5): 972-981.( 2) 2)
|
| [59] |
Xiong L Z,Xu C G,Maroof M S,et al. 1999. Patterns of cytosine methylation in an elite rice hybrid and its parental lines, detected by a methylation-sensitive amplification polymorphism technique. Molecular and General Genetics MGG,261(3): 439-446.( 1) 1)
|
| [60] |
Yoder J A,Soman N S,Verdine G L,et al. 1997. DNA (cytosine-5)-methyltransferases in mouse cells and tissues.Studies with a mechanism-based probe. J Mol Biol,270: 385-395( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50