文章信息
- 王贵章, 李杨昕, 王贵禧, 梁丽松, 马庆华
- Wang Guizhang, Li Yangxin, Wang Guixi, Liang Lisong, Ma Qinghua
- 外源乙烯对冷藏桃果实香气物质合成的调控
- Aroma Volatiles Biosynthesis and Relative Enzyme Activities Regulated by Exogenous Ethylene in Peach Fruits Stored at Low Temperature
- 林业科学, 2014, 50(3): 55-62
- Scientia Silvae Sinicae, 2014, 50(3): 55-62.
- DOI: 10.11707/j.1001-7488.20140308
-
文章历史
- 收稿日期:2013-02-28
- 修回日期:2013-12-23
-
作者相关文章
2. 北京市建华实验学校 北京 100039
2. Beijing Jianhua Experimental School Beijing 100039
香味同质地、外观一样,是桃(Prunus persica)果实品质的重要组成部分,直接影响人们的喜好程度。不同品种的果实其香气成分的物质组成和质量均不相同(Horvat et al.,1990),芳香物质组合及其比例决定了水果的特有香味(Riu-Aumatell et al.,2004)。近些年来,随着消费者对品质要求的提升,桃果实香味品质引起研究者的广泛兴趣,已经从桃中鉴定出100多种挥发性芳香成分,主要包括酯类、醛类、醇类、酮类、内酯类和烷烃类等(Wang et al.,2009; Eduardo et al.,2010)。桃属于呼吸跃变型果实,采后在常温条件下2~3天内即可完成后熟,香气充分释放,食用品质达到最佳,但随之发生软烂,丧失商业价值和食用价值。低温可以明显延长桃果实的贮藏期,但在低温下桃果肉易发生冷害,除了果肉质地、颜色和口感发生明显劣变外(Cantín et al.,2010),还伴随香气的变淡或消失(Lurie et al.,2005)。针对桃果实冷害导致的品质下降,对其调控措施进行研究,如在转入0 ℃前先在一定的低温条件下预冷处理可以显著降低冷害; 通过调节贮藏温度和贮藏库内气体及在采前或采后采用各种措施,均在一定程度上改善了果实贮藏期品质(Woolf et al.,2003; Cai et al.,2006; Zhou et al.,2001; 王友升等,2006)。然而,果实香味丧失问题仍没有得到有效解决。
研究表明:乙烯对果实风味物质的合成具有重要调控作用,常温下水蜜桃果实中乙烯的释放伴随着主要香气成分内酯类物质合成的明显增加,二者存在明显正相关性(Zhang et al.,2005),说明乙烯是香气成分合成的促进因子。但低温下桃果实的乙烯合成减少或受阻(茅春林等,1999; 谢永红等,2006),影响了风味物质的代谢。对桃果实施加较低浓度的外源乙烯,可以提高贮藏中后期桃果实内丙二醛(MDA)、脂氧合酶(LOX)的活性,减轻低温贮藏条件下的冷害症状,从而使桃果实在贮藏期间能保持较好的果实品质(胡花丽等,2007)。李杨昕等(2011)经过研究发现,0 ℃下贮藏30天后的桃果实品质开始下降,通过施加外源乙烯处理,可在一定程度上缓解冷害症状。基于以上研究,推测低温贮藏期间挥发性芳香成分的代谢失调很可能与缺乏内源乙烯有关,通过施加外源乙烯可能会对芳香成分的合成起到促进作用。对于冷藏过程中乙烯如何影响桃果实内的芳香成分和特征香气物质,乙烯对香气合成途径中相关的酶活性与香气合成之间的关系调节目前尚不清楚。本研究试图通过低温抑制和外源乙烯恢复条件下桃果实的挥发代谢谱和相关酶的活性变化,揭示乙烯对桃果实风味物质发生低温合成障碍的恢复作用。
1 材料与方法 1.1 植物材料以北京地区栽培品种'大久保’(Prunus persica 'Okubo’)桃果实为材料,2010年8月13日和2011年8月12日采摘自北京市平谷区桃园,选取八成熟、大小均匀、着色基本一致、没有损伤和病虫害的果实进行处理,果实成熟度的判断标准参考NY/T242—2002 (中华人民共和国农业部,2002)。
1.2 试验处理和取样试验将常温贮藏桃设为对照1,0 ℃冷库贮藏桃作为低温对照2,在0 ℃冷库中贮藏至15天后,每天向贮藏袋内注入外源乙烯,使袋内乙烯浓度保持在50~80 μL·L-1(胡花丽等,2007),直至贮藏结束(T)。
每处理重复6袋,每袋45个果。取样时从袋中随机取30个果,15个用于挥发物的测定,15个用于酶活性测定。采用四分法取样,去皮后从果实四面的胴部各取1 cm厚的果肉切片混合,用于测定芳香挥发物成分及相关酶活性。每个指标重复3次。
1.3 挥发性物质的测定挥发物的测定参考Zhang等(2009)的方法。将去核、去皮果肉鲜样5 g放入低温榨汁机榨汁备用; 将固相微萃取装置的萃取头(美国SUPELCO公司生产,PDMS100 μm)在气相色谱的进样口老化,老化温度为250 ℃,载气体积流量为1 mL·min-1,老化萃取头2 h; 取5 mL桃汁放入15 mL的样品萃取瓶中,加入5 mL饱和NaCl溶液充分摇匀,加入磁力转子后置于固相微萃取工作台上,将固相微萃取器的萃取头通过瓶盖的聚四氟乙烯隔垫插入样品萃取瓶的顶空,推出纤维头使其暴露于萃取瓶顶空中。40 ℃下顶空吸附30 min后,缩回纤维头,迅速将针管插入气相色谱仪的进样口,推出纤维头热解析,进行测定数据的采集。气相色谱和质谱试验采用美国Thermo气质联用仪(型号为TRACE GC100)。气相色谱(GC)条件: HP-5(30 m×0.1 mm×0.33 μm)弹性石英纤维毛细管柱; 程序升温模式,起始温度50 ℃,保持2 min,以每min 4 ℃的速度升温至250 ℃,保持10 min; 配置FID检测器,温度280 ℃,进样口温度220 ℃,载气为氮气。质谱(MS)条件: Finnigan Trace GC ultra/ Finnigan Trace DSQ,质谱接口温度为250 ℃,离子源温度200 ℃,电离方式EI,离子能量70 eV,全扫描模式,扫描质量范围为29~540 amu; 通过计算机检索与NIST2000质谱库提供的标准质谱图对照解谱,选择匹配度大于900的鉴定结果。
1.4 香气合成相关酶活性测定 1.4.1 脂氧合酶(lipoxygenase,LOX)活性测定参照Wang等(2005)的方法,稍加改进。提取液的制备: 取上述2 g果肉组织,加入 0.5 g PVP和10 mL预冷的磷酸缓冲液(50 mmol·L-1,pH7.0),冰浴研磨,4 ℃下15 000 g离心15 min,取上清液备用。
酶活性测定: 取2.7 mL 30 ℃保温30 min的磷酸缓冲液,同时取40 μL 0.1 mol·L-1 的亚油酸钠制成反应混合液; 取0.1 mL提取液加入反应混合液,反应15 s后计时并记录1 min内OD234的变化为1 U。活性以U ·g-1FW表示。
1.4.2 乙醇脱氢酶(alcohol dehydrogenase,ADH)活性的测定参照Longhurst等(1994)的方法。粗酶液的制备: 取上述10 g果肉,加入15 mL预冷的磷酸缓冲液(0.1 mol·L-1,pH7.0)研磨样品。12 000 g 4 ℃下离心20 min,留上清。
酶活性测定:取反应底液2.4 mL MES-Tris缓冲液(pH6.5),0.15 mL NADH(1.6 mmol·L-1),0.15 mL乙醛(80 mmol·L-1),加入0.3 mL粗酶液,30 ℃下反应15 s后开始计时,记录1 min内OD340的变化。活性单位为△OD340·mg-1min-1。
1.4.3 乙醇酰基转移酶(alcohl acyltransferaes,AAT)活性的测定参考Pérez等(1996)的方法,稍加改进。粗酶液的提取: 上述10 g果肉,称取0.1 g PVP和15 mL磷酸缓冲液(0.1 mol·L-1,pH7.0)在冰浴下充分研磨。12 000 g低温离心20 min,留上清。
酶活性测定反应底液:0.5 mol·L-1 Tris-HCl缓冲液(pH7.0),11.6 mmol·L-1 MgCl2,0.3 mmol·L-1 乙酰CoA,10 mmol·L-1丁醇和0.6 mL酶液。35 ℃下反应15 min后加入20 mmol·L-1 的5,5-二硫代双硝基苯甲酸(DTNB)150 μL,室温放置10 min,测定412 nm下的吸光值。活性单位以△OD412·mg-1min-1表示。
1.5 数据处理及统计分析本文中数据的作图采用Microsoft Office Excel 2003,数据统计分析用SPASS软件。
2 结果与分析 2.1 低温下受外源乙烯调控的'大久保’桃果实香气成分分析 2.1.1 低温下受外源乙烯调控的香气成分种类常温存放3天的'大久保’桃果实中共检测到29种香气成分(表 1)。0 ℃贮藏30天有19种果实香气合成受到抑制,但在0 ℃条件下施加外源乙烯后诱导上调的有21种。在所有受到乙烯正向调控的香气中,柠檬醛、γ-癸内酯、乙酸和十九(碳)烷同时受到0 ℃低温的诱导,即在0 ℃条件下其质量百分含量明显高于常温贮藏;而7种由乙烯负向调控的香气成分中除了2,6-二异丁基苯醌外,其他6种成分也均受到低温的作用而导致质量百分含量增高。除了醇类物质,乙烯还促进了酸酮类和烷烃类物质的释放,烷烃类物质是除醛类成分外的第2类高含量挥发物,在3个处理中质量百分含量均高于20%(图 1)。有报道称,库尔勒香梨(Pyrus sinkiangensis)香气成分中的烷烃类物质主要来自果皮中的蜡质,对果实香气贡献不大(于建娜等,2006),而其对桃果实风味形成的作用目前尚不明确。以上结果表明0 ℃条件下外源乙烯对'大久保’桃果实的香气物质合成有明显的调节作用。
|
|
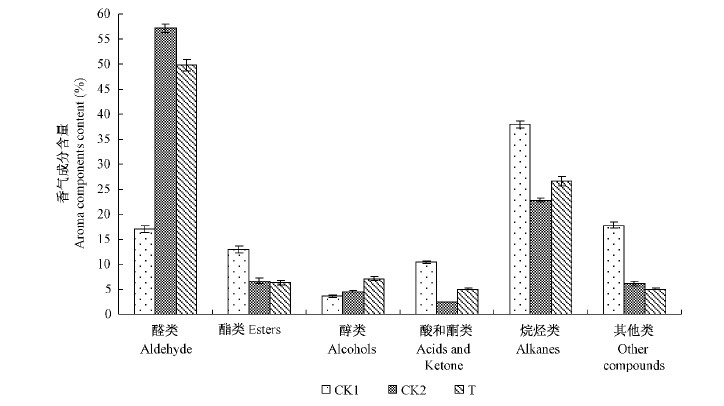 |
图 1 外源乙烯处理桃果实中不同类别香气成分含量的变化
Fig. 1 Changes of contents of different types of volatiles in peaches treated by exogenous ethylene
|
桃果实主要有5种特征香气成分,分别为己醛、反-2-己烯醛、苯甲醛、芳樟醇、γ-癸内酯。其中己醛、反-2-己烯醛、苯甲醛属于青草型香气物质,而芳樟醇和γ-癸内酯则属于花香型香气物质(贾惠娟,2007)。对5种特征香气成分进行分析(图 2)发现,0 ℃贮藏30天的果实中青草型香气己醛、苯甲醛和反-2-己烯醛的含量都高于常温对照,但用外源乙烯处理后导致以上3种青草型香气成分的降低,花香型香气芳樟醇和γ-癸内酯含量均高于常温对照和低温对照。李杨昕等(2011)对常温贮藏桃品质的调查发现,青草型香气与花香型香气的比率与果实的风味密切相关,比率越低桃果实的特征风味越浓。本研究中也发现相似的规律: 常温(24 ℃)贮藏3天的桃果实中二者的比率最低为4.0,此时食用品质最佳,而在0 ℃贮藏15天后施加外源乙烯贮藏至30天的桃果实中,二者比率略高于常温3天的果实,为6.7,而明显低于简单在0 ℃贮藏30天的21.8(图 3)。
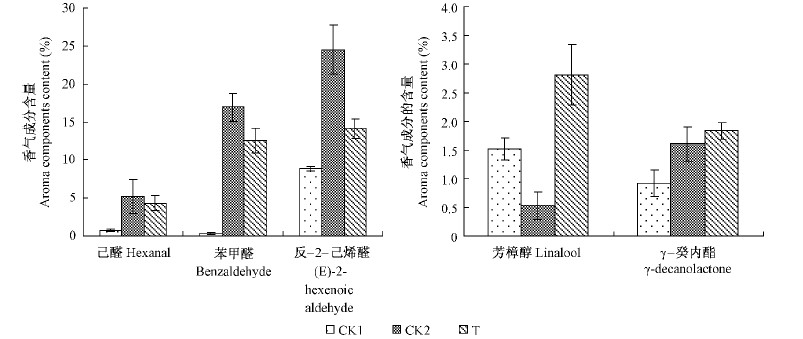 |
图 2 0 ℃条件下外源乙烯处理桃果实中5种特征香气成分含量的变化
Fig. 2 Changes of content of characteristic volatiles of 'Okubo’ peach treated by exogenous ethylene during postharvest storage at 0 ℃
|
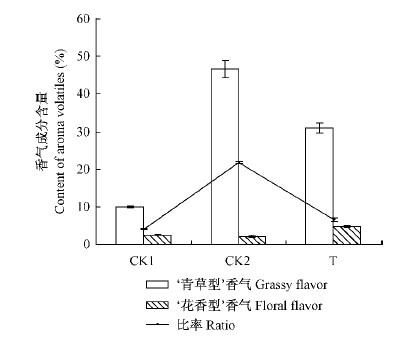 |
图 3 外源乙烯处理桃果实青草型香气与花香型香气质量百分含量及其比例的变化
Fig. 3 Changes of content and ratio of grassy flavor and floral flavor volatiles in peach fruits treated by exogenous ethylene
|
在测得的7种醛类物质中(图 4A),除了己醛、苯甲醛和反-2-己烯醛外,其他4种醛类物质的含量受到乙烯正向调控均有不同程度的上升,但由于这4种成分的上升幅度比其他3种的下降幅度小,因此在醛类物质总量上体现为外源乙烯处理的桃果实较0 ℃对照低。醇类物质中,除了顺-2-己烯醇有小幅降低外,其他成分均受到乙烯的正向调控,含量升高,尤其是桃果实的特征香气成分芳樟醇的含量明显高于2个对照(图 4B)。酯类香气物质中(图 4C),只有乙酸乙酯的含量用外源乙烯处理后较低温对照低,其他4种酯类物质含量均受到外源乙烯的诱导而小幅增加或持平,特征香气成分γ-癸内酯的含量高于2个对照。
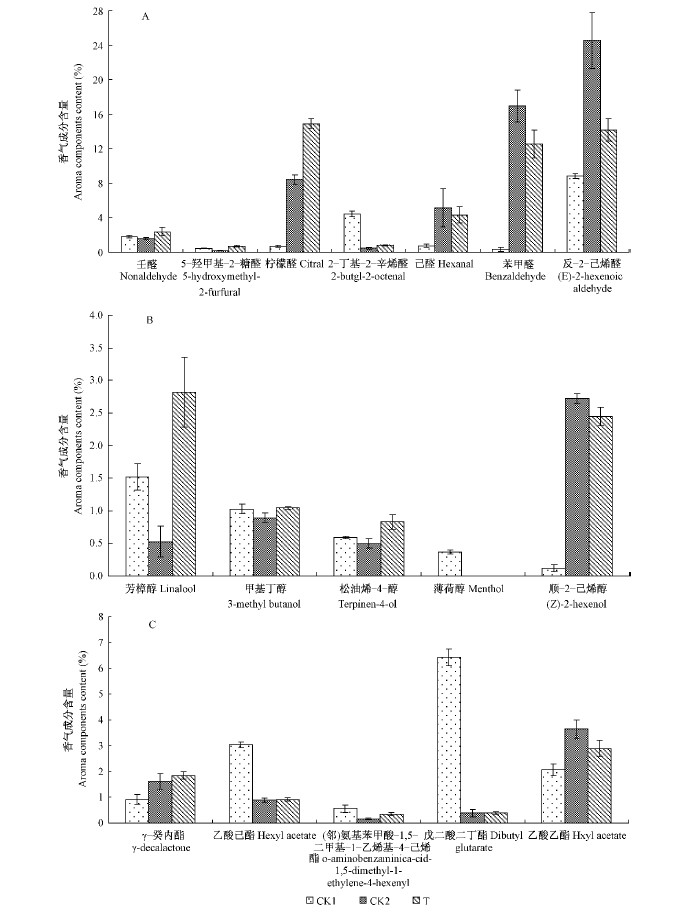 |
图 4 不同贮藏条件下醛类(A)、醇类(B)和酯类(C)物质各成分的含量变化
Fig. 4 Changes of contents of aldehydes(A), alcohols(B) and esters(C) volatiles in peaches treated by exogenous ethylene
|
与常温对照相比,LOX受到低温诱导而增强,0 ℃贮藏15天施加外源乙烯至30天时其活性略微降低(图 5A)。ADH则受低温和乙烯双向调控,低温降低了其活性,但是外源乙烯处理后ADH活性又升高(图 5B)。AAT酶活性也因低温的抑制而降低,外源乙烯作用下活性略有升高。将LOX,ADH和AAT活性与6种不同类别香气成分进行相关性分析,发现LOX活性与醛类呈显著正相关。 ADH活性与醛类呈显著负相关,与醇类物质的释放呈显著正相关,AAT活性与酯类物质的释放呈显著正相关,表明LOX,ADH和AAT分别与醛类、醇类和酯类物质的合成关系密切,而这3类物质是影响桃果实风味的主要成分。
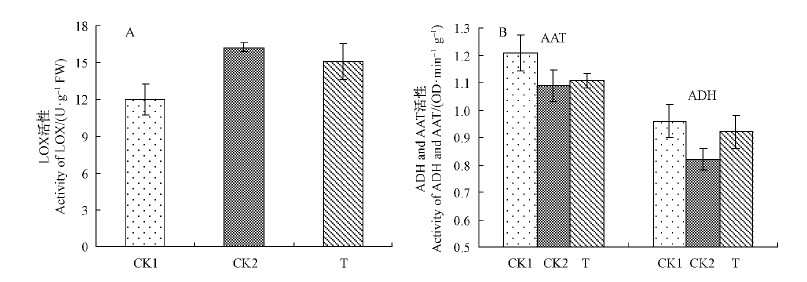 |
图 5 不同贮藏条件下'大久保’桃果实LOX,ADH和AAT活性变化
Fig. 5 Changes of LOX,ADH and AAT activities of 'Okubo’ peach stored at different conditions
|
桃果实的香味特征不单由香气物质的含量决定,还要结合该香气物质的芳香强度,也就是阈值浓度(Baldwin et al.,2000),即能被人们的嗅觉器官所能感知到的最低浓度,又称为可嗅浓度,阈值浓度越低香气越强,反之则越弱。本研究通过对常温和0 ℃低温条件下'大久保’桃果实中的挥发性芳香物质的含量进行分析,发现0 ℃低温贮藏桃果实中壬醛、芳樟醇、乙酸己酯等19种物质的释放量较常温贮藏桃均有不同程度的降低,0 ℃低温抑制了这些香气物质的释放。尽管这些成分的变化幅度不大在16%~0.1%范围内,0 ℃低温贮藏桃CK2较常温贮藏桃CK1中壬醛的相对质量百分含量仅降低0.24%,但由于一些香气成分的阈值浓度也很低,壬醛的风味阈值浓度为1 μg·kg-1,紫罗兰酮仅为0.4 μg·kg-1(Leffingwell et al.,1991),判断一种挥发性成分对风味的贡献,在某种程度上取决于该物质的含量超过其阈值浓度的程度,因此即使含量有轻微的变化也可能引起桃风味的改变。
3.2 外源乙烯对低温贮藏桃果实风味物质合成的调节机制乙烯一直被认为是促进呼吸跃变型果实成熟软化的重要因子,在促进果实软化成熟的同时又影响果实中芳香物质的合成。在苹果(Malus pumila)成熟过程中乙烯产生前伴随着LOX活性的升高,认为乙烯的存在促进了果实内脂肪酸的合成和香气物质释放(Yahia,1994)。本研究以常温保存完成正常后熟的桃果实及0 ℃贮藏桃为对照,对挥发性香气物质进行检测。通过对醛类、醇类以及酯类物质各组分的分析发现,3种类型香气中各个组分在0 ℃贮藏30天和0 ℃贮藏15天施加外源乙烯至30天条件下,其含量的变化均受到乙烯正向或负向调控的影响,施加外源乙烯对萜烯类香气芳樟醇及多种醛类物质有明显的恢复作用,18种受到低温抑制的成分均在乙烯处理后含量有不同程度的升高。用外源乙烯处理的果实中6-C醛类的合成降低,推测可能是乙烯促进醛类物质向醇类物质的转变而引起的。
此外乙烯对青草型香气与花香型香气及其比率的影响表明:外源乙烯处理可以改善冷藏桃果实风味,青草型香气和花香型香气含量及其比率的变化,或可成为桃果实采后贮藏过程中风味品质的一个衡量指标。0 ℃低温下施加一定浓度的外源乙烯处理,可以缓解冷害的发生,使'大久保’桃保持较高的果实品质。
3.3 外源乙烯对香气合成相关酶的调节果实的风味特征受多种因素控制,代谢途径比较复杂,其合成过程也有大量的酶参与。脂肪酸代谢途径是果实中6-碳醛和醇的主要来源(Dixon et al.,2000; Beekwilder et al.,2004; Knee et al.,2002),此代谢途径中脂肪酸在脂氧合酶(LOX)作用下形成亚麻酸和亚油酸同分异构体,随后在酶的催化下生成相应的醛类,乙醇脱氢酶(ADH)则催化醛生成相应的醇,而乙醇酰基转移酶(AAT)催化酰基,将相应的醇类转化成酯(Zhang et al.,2010),因此,LOX,ADH和AAT是影响果实中醇醛类和酯类芳香挥发物产生的关键酶。研究发现,乙烯能调节苹果中脂肪酸途径最后一步的关键酶AAT活性,从而促进酯类物质的合成(Defilippi et al.,2005)。本研究通过对LOX途径中公认的几种关键酶LOX,ADH和AAT活性测定发现,'大久保’桃果实在常温正常后熟过程中,ADH和AAT活性分别与醇类和酯类物质的释放呈显著正相关。乙烯对低温下醛类向醇类物质合成转化的促进作用伴随着ADH酶活性的增高。低温诱导LOX活性增强,这与低温对番木瓜(Carica papaya)果实LOX活性的作用研究结果一致(González-Aguilar et al.,2004),但是外源乙烯对LOX的活性影响不大。抑制了ADH酶的活性,导致醛类物质向醇类物质的转化发生障碍,而人为施加乙烯则促进ADH行使其正常的催化作用,从而在一定程度上保持了果实的品质。外源乙烯对AAT活性有一定的恢复作用,除乙酸乙酯外酯类物质的合成受到乙烯的诱导含量均升高,推测乙酸乙酯可能通过其他途径合成而不受AAT催化,此前有研究证明,草莓(Fragaria×ananassa)中酯类物质是通过氨基酸途径合成(Pérezrez et al.,2002)。
本研究从生理角度探讨了低温下乙烯对挥发性产物及蛋白酶活性的影响,对于蛋白酶与低温和乙烯的作用关系中是否有基因家族成员的参与,以及家族成员对二者的响应机制是否相同,尚有待于进一步研究。本结果可为冷藏过程中乙烯对桃果实香气合成的分子水平调控提供数据与支持。
| [1] |
胡花丽, 梁丽松, 王贵禧, 等. 2007. 外源乙烯对CA贮藏桃果实MDA含量、PPO和LOX活性变化的影响. 西北林学院学报, 22 (3) : 38- 42.( 2) 2)
|
| [2] |
贾惠娟. 2007. 水果香气物质研究进展. 福建果树, (2): 31- 34.( 1) 1)
|
| [3] |
李杨昕, 王贵禧, 梁丽松. 2011. ‘大久保’桃常温贮藏过程中香气成分变化及其与乙烯释放的关系. 园艺学报, 38 (1): 35- 42.( 2) 2)
|
| [4] |
茅春林,张上隆. 1999. 采后桃果实中多胺和乙烯对低温胁迫的反应.园艺学报, 26(6) : 360-363.( 1) 1)
|
| [5] |
王友升, 王贵禧, 梁丽松. 2006. 不同气体成分贮藏对'大久保'桃果实品质的影响. 农业工程学报, 22(8): 214 -218.( 1) 1)
|
| [6] |
谢永红, 刘国杰, 欧 毅, 等. 2006. 温度和GA3对桃果实采后乙烯合成及桃ETR1同源基因表达的影响. 果树学报, 23 (4): 523-526.( 1) 1)
|
| [7] |
于建娜, 刘文杰. 2006. 库尔勒香梨果实香气成分的气象色谱-质谱分析. 塔里木大学学报, 18(4): 10-12.( 1) 1)
|
| [8] |
中华人民共和国农业部.2002.NY/T 586—2002, 鲜桃. 北京:中国标准出版社.( 1) 1)
|
| [9] |
Baldwin E A, Scott J W, Shewmaker C K. 2000. Flavor trivia and tomato aroma: Biochemistry and possible mechanisms for important aroma components. Hortscience, 35 (6): 1021-1031.( 1) 1)
|
| [10] |
Beekwilder J, Alvarez-Huerta M, Neef E, et al. 2004. Functional characterization of enzymes forming volatile esters from straw-berry and banana. Plant Physiology, 135(4): 1865-1878.( 1) 1)
|
| [11] |
Cai C, Xu C J, Shan L L, et al. 2006. Low temperature conditioning reduces postharvest chilling injury in loquat fruit. Postharvest Biology and Technology, 41(3): 252-259.( 1) 1)
|
| [12] |
Cantín C M, Crisosto C H, Ogundiwin E A, et al. 2010. Chilling injury susceptibility in an intra-specific peach \ progeny. Postharvest Biology and Technology, 58(2): 79-87.( 1) 1)
|
| [13] |
Defilippi B G, Kader A A, Dandekar A M. 2005. Apple aroma: alcohol acyltransferase, a rate limiting step for ester biosynthesis, is regulated by ethylene. Plant Science, 168 (5): 1199- 1210.( 1) 1)
|
| [14] |
Dixon J, Hewett E W. 2000. Factors affecting apple Aroma/flavor volatile concentration:review. Journal of Crop and Horticultural Science, 28(3):155-173.( 1) 1)
|
| [15] |
Eduardo I, Chietera G, Bassi D, et al. 2010. Identification of key odor volatile compounds in the essential oil of nine peach accessions. Journal of the Science of Food and Agriculture, 90(7): 1146- 1154.( 1) 1)
|
| [16] |
González-Aguilar G A, Tiznado-Hernández M E, Zavaleta-Gatica R, et al. 2004. Methyl jasmonate treatments reduce chilling injury and activate the defense response of guava fruits. Biochemical and Biophysical Research Communications, 313(3): 694-701.( 1) 1)
|
| [17] | Hayama H, Shimada T, Fujii H, et al. 2006. Ethylene-regulation of fruit softening and softening-related genes in peach. Journal of Experimental Botany, 57(15): 4071-4077. |
| [18] |
Horvat R J, Chapman G W, Robertson J A. 1990. Comparison of the volatile compounds from several commercial peach cultivars. Journal of Agriculture and Food Chemistry, 38(1): 234 -237.( 1) 1)
|
| [19] |
Knee M. 2002. Fruit quality and its biological basis. Sheffield: Sheffield Academic Press.( 1) 1)
|
| [20] |
Leffingwell J C, Leffingwell D. 1991. GRAS flavor chemicals-detection thresholds. Perfumer & Flavorist, 16(1): 2-19.( 1) 1)
|
| [21] |
Longhurst T J, Tung J F, Brady C J. 1994. Development regulation of the expression of alcohol dehydrogenase in ripening tomato fruit. Journal of Food Biochemistry, 14(6): 421- 433.( 1) 1)
|
| [22] |
Lurie S, Crisosto C H. 2005. Chilling injury in peach and nectarine. Postharvest Biology and Technology, 37(3): 195-208.( 1) 1)
|
| [23] |
Pérez A G, Olías R, Luaces P, et al. 2002. Biosynthesis of strawberry aroma compounds through amino acid metabolism. Journal of Agriculture and Food Chemistry, 50(14): 4037- 4042.( 1) 1)
|
| [24] |
Pérez A G, Sanz C, Olias R. 1996. Evolution of strawberry alcohol acyltransferase activity during fruit development and storage. Journal of Agriculture and Food Chemistry, 44(10): 3286- 3290.( 1) 1)
|
| [25] |
Riu-Aumatell M, Castellari M, López-Tamames E, et al. 2004. Characterization of volatile compounds of fruit juices and nectars by HS/SPME and GC/MS. Food Chemistry, 87(4): 627-637.( 1) 1)
|
| [26] |
Wang Y, Yang C, Li S, et al. 2009. Volatile characteristics of 50 peaches and nectarines evaluated by HP-SPME with GC-MS. Food Chemistry, 116 (1): 356-364.( 1) 1)
|
| [27] |
Wang Y S, Tian S P, Xu Y. 2005. Effects of high oxygen concentration on pro- and anti-oxidant enzymes in peach fruits during postharvest periods. Food Chemistry, 91(1): 99-104.( 1) 1)
|
| [28] |
Woolf A B, Cox K A, White A. 2003. Low temperature conditioning treatments reduce external chilling injury of 'Hass' avocados. Postharvest Biology and Technology, 28(1): 113-122.( 1) 1)
|
| [29] |
Yahia E M. 1994. Apple flavor. Horticultural Reviews,16:197-234.( 1) 1)
|
| [30] |
Zhang B, Shen J Y, Wei W W, et al. 2010. Expression of genes associated with aroma formation derived from the fatty acid pathway during peach fruit ripening. Journal of Agriculture and Food Chemistry, 58(10): 6157- 6165.( 1) 1)
|
| [31] |
Zhang B, Yin X R, Li X, et al. 2009. Lipoxygenase gene expression in ripening kiwifruit in relation to ethylene and aroma production. Journal of Agriculture and Food Chemistry, 57(7): 2875-2881.( 1) 1)
|
| [32] |
Zhang X M, Jia H J. 2005. Changes in aroma volatile compounds and ethylene production during "Hujingmilu" peach (Prunus persica L.) fruit development. Journal of Plant Physiology and Molecular Biology, 31 (1): 41- 46.( 1) 1)
|
| [33] |
Zhou H W, Dong L, Ben-Arie R, et al. 2001. The role of ethylene in the prevention of chilling injury in nectarines. Journal of Plant Physiology, 158(1): 55- 61.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

