文章信息
- 张乐华, 王书胜, 单文, 李晓花, 王凯红, 王兆宏
- Zhang Lehua, Wang Shusheng, Shan Wen, Li Xiaohua, Wang Kaihong, Wang Zhaohong
- 基质、激素种类及其浓度对鹿角杜鹃扦插育苗的影响
- Influences of Growth Media, and Hormone Types and Concentrations on Cutting Propagation of Rhododendron latoucheae
- 林业科学, 2014, 50(3): 45-54
- Scientia Silvae Sinicae, 2014, 50(3): 45-54.
- DOI: 10.11707/j.1001-7488.20140307
-
文章历史
- 收稿日期:2013-07-25
- 修回日期:2013-12-22
-
作者相关文章
鹿角杜鹃(Rhododendron latoucheae)隶属杜鹃花属马银花亚属(Subg. Azaleastrum),为常绿灌木至小乔木,产浙江、江西、福建、湖北、湖南、广东、广西及贵州等省区,并呈集群格局分布于海拔较高的山脊陡坡,对维护林地环境、涵养水源、保护生态平衡等起着重要作用(高俊香等,2009)。该物种株型好、耐修剪、花期长,且生长快、适应性强,具有广阔的开发应用前景。
扦插是小叶落叶及半常绿类杜鹃(Azalea)的主要繁殖方法并广为应用,但原产中高山的大叶常绿类杜鹃扦插生根困难(Strzelecka,2007; 张长芹等,2004),目前大多采用播种繁殖(Singh et al.,2010; 张乐华等,2006)。播种育苗虽然繁殖系数大,但幼苗生长慢、开花周期长,且杜鹃自然杂交机率大,难于确保基因纯度。针对大叶常绿类杜鹃苗木需求量大而扦插生根难等问题,近年国内外学者分别采用不同激素与浓度开展了常绿杜鹃亚属(Subg. Hymenanthes)(Strzelecka,2007; Ferriani et al.,2006; Nawrocka-Grześkowiak,2004)及杜鹃亚属(Subg. Rhododendron)(Gensel et al.,1985; 耿芳等,2008)部分种的扦插试验,发现常绿类杜鹃以秋季扦插为佳,生根能力主要取决于物种及激素应用,IBA能有效促进插穗生根,但最佳浓度因种间生根难易而异。已有报道仅限于激素种类或浓度的单因素或双因素的结果比较,缺乏对多因素交互影响的系统认识,而产业化前景广阔的马银花亚属杜鹃扦插育苗鲜见报道(李朝婵等,2012)。为挖掘利用鹿角杜鹃资源,本研究采用2种基质、5种激素及5个浓度水平系统开展了其扦插育苗试验,探讨了不同因素及其交互效应对12个育苗指标的影响,并运用隶属函数法对各处理组合的育苗效果进行了评价,以期筛选出最佳处理组合,为鹿角杜鹃规模化育苗提供科技支撑。
1 材料与方法本试验在江西省、中国科学院庐山植物园杜鹃繁殖温室中进行。
1.1 试验材料鹿角杜鹃插穗取自庐山植物园杜鹃园,为树龄25年左右的成年株; 基质材料为庐山林下腐殖土和经冲洗过筛的河沙。
1.2 方法 1.2.1 苗床铺设苗床为砖混结构,高42 cm,为增加滤水性,底层设20 cm左右的石块层,其上铺粗河沙5 cm,粗河沙上铺地热线,地热线上层再覆盖2 cm粗河沙,最后铺设厚8 cm的扦插基质并耙平轻压。为控制环境温湿度与光照,苗床上层搭建塑料棚,棚内配备自动喷雾设施,棚外设置可移动的遮阳网。苗床制作完成后,用500倍多菌灵溶液对基质及周边环境进行全面消毒。
1.2.2 插穗制作2010-10-25上午室外采集母株冠层当年生健壮的木质化枝条并及时运回室内喷水保湿,下午选取大小一致、无病虫害、无花苞小枝,剪成长12~15 cm插穗。去除基部叶片,保留顶芽和顶部3~4叶,再依据叶片大小剪去1/3~2/3。插穗基部一侧用嫁接刀去除长约1.5 cm的"U"形皮层,以利于插穗吸收激素与水分,促进生根。
1.2.3 试验设计采用不同基质(A)、激素种类(B)及其浓度(C)3个因素处理。A因素设置2个水平[A1: 河沙+腐殖土(3:1)、A2: 腐殖土+河沙(3:1),V/V];B因素设5个水平[B1: 吲哚丁酸(IBA)、B2: 吲哚乙酸(IAA)、B3: 萘乙酸(NAA)、B4: 赤霉素(GA3)、B5: 6-苄(氨)基嘌呤(6-BA),所有激素购自北京索莱宝科技有限公司]; C因素也设5个水平(前4种激素为C1: 0 mg·L-1(自来水)对照、C2: 50 mg·L-1、C3: 100 mg·L-1、C4: 200 mg·L-1、C5: 400 mg·L-1; 6-BA分别为0,10,20,50,100 mg·L-1); 处理时间为插穗基部(1.5~2 cm)浸泡16 h。按2×5×5三因素析因设计,共50个试验处理,每处理3次重复,每重复20(对照30)个插穗。
1.2.4 扦插与管理插穗处理后立即扦插,株行距8 cm×8 cm,扦插深度6~7 cm,插后喷透水1次。试验期间采用全自动间歇喷雾系统补水增湿: 白天每隔2 h喷水2 min,晚上每隔4 h喷水2 min,1个月后逐渐减少喷水次数; 为减少污染,及时清除苗床落叶并每14天喷500倍多菌灵1次; 苗床地温设定为20 ℃,棚内温度、光照强度分别通过塑料棚两侧通风及遮阳网调节; 每天观察记录苗床地温及棚内温湿度2次(9:30和16:30)。受天气影响,试验前3个月苗床实测日平均地温为18.7~22.0 ℃,棚内日平均气温12.3~20.2 ℃、空气湿度82.8%~98.6%。
1.3 指标观测及数据分析
生根过程中,第15天开始每隔15天取样1次(每处理选取生长表现较好的插穗3个),观察插穗生根部位、根数和根长等信息并及时回栽。2011年4月上旬结合苗木移栽,统计愈伤率、腐烂率、生根率、不定根数、最长不定根长、总根数、根系直径(将生根插穗垂直放置于测量台,东西、南北"十字形"测量2个方向的根系长度,求平均值)等7个插穗生根指标及老叶留存率、老叶留存数、新梢率、新梢数、新梢长等5个扦插苗地上部分生长指标,并运用SPSS 16.0软件对所有指标进行方差分析和LSD多重比较。方差分析前参照Swamy等(2002)的方法对所有百分率指标进行反正弦转换(sin-1),数量指标作平方根转换
。
隶属函数计算公式为: U(Xj)=(Xj- Xmin)/(Xmax-Xmin),式中:Xj为指标测定值,Xmin,Xmax为所有处理某一指标的最小值和最大值; 腐烂率与育苗效果呈负相关,其公式为: U(Xj)=1-(Xj- Xmin)/(Xmax-Xmin)。将各处理不同指标的隶属值进行累加求其平均值,平均值越大育苗效果越好(王凯红等,2011)。
2 结果与分析 2.1 鹿角杜鹃插穗生根过程观察发现,鹿角杜鹃于扦插后20天左右形成愈伤组织,愈伤组织较薄、不呈痂状; 30天后形成根原基,45天后产生白色透明的不定根,60天时最长不定根长约1 cm(图 1A),90天最长不定根长达3 cm(图 1B),160天时最大根系直径达9~10 cm(图 1C)。不定根原基主要发端于皮部,愈伤组织生根极少,属皮部生根类型。
 |
图 1 鹿角杜鹃扦插繁殖不定根形成及育苗效果
Fig. 1 The formation of adventitious roots and effect of cutting propagation of R.latoucheae
A: 扦插60 天时不定根; B: 扦插90天时根系; C: 腐殖土+河沙(3:1)基质与50 mg·L-1GA3组合的育苗效果。 A: Adventitious roots at cutting 60 d; B: Roots system at cutting 90 d; C: Effect of cutting propagation with the combination of soil + sand (3:1) medium and GA3(50 mg·L-1). |
三因素方差分析结果(表 1)表明:在3个主效应因素中,激素种类对插穗生根影响最大,除不定根数为显著水平(P < 0.05)外,其他6个生根指标均达极显著水平(P < 0.01); 激素浓度影响其次,除不定根数、最长不定根长及根系直径为显著水平外,其他4个指标均达极显著水平; 扦插基质对生根指标影响较小,仅对愈伤率、生根率分别有极显著和显著影响。双因素交互效应中,激素种类×浓度互作对插穗生根影响最大,在所有生根指标上均达极显著水平; 基质×激素浓度的影响其次,对腐烂率、生根率有极显著影响,对不定根数、最长不定根长和根系直径有显著影响; 基质×激素种类效应较小,除极显著影响愈伤率外,其他指标均未达显著水平(P > 0.05)。三因素交互效应对愈伤率有极显著影响,对不定根数、总根数有显著影响。F值分析显示,双因素及三因素互作效应主要来源于激素种类及浓度水平,表明激素种类与浓度是影响鹿角杜鹃扦插生根的主要因素。
|
|
河沙+腐殖土(3:1)基质的插穗愈伤率极显著高于腐殖土+河沙(3:1),而腐殖土+河沙(3:1)基质生根率显著高于河沙+腐殖土(3:1),其他指标未达显著水平(表 2)。2种基质的组成材料相同,腐殖土+河沙(3:1)基质的腐殖土配比较高、保水性强、透气性相对较差,不利于愈伤组织形成,故愈伤率低于河沙+腐殖土(3:1)。数据分析发现,愈伤率与生根率在2种基质间表现不一致性,可能与鹿角杜鹃为皮部生根有关: 愈伤组织形成状况对插穗生根影响较小,基部轻微腐烂的插穗可正常生根。
|
|
由表 2可见,愈伤率、生根率在5种激素间表现一致,腐烂率则相反,3个指标由好至差依次为GA3,IBA,IAA,6-BA,NAA。GA3处理极显著或显著优于其他激素,IBA,IAA又极显著优于6-BA,NAA处理最差。不定根数、最长不定根长、总根数及根系直径4个根系生长指标均以IBA处理最佳,IAA,GA3其次,NAA,6-BA较差。可见,GA3处理有利于愈伤组织诱导和生根,并降低腐烂率,可能原因为外源GA3处理增加了插穗内源GA3含量,而较高的内源GA3水平有利于杜鹃花插穗愈伤组织诱导和不定根形成(赵云龙等,2013; 李朝婵等,2012); IBA处理则有利于促进根系生长。
2.2.4 激素浓度对插穗生根指标的影响5个激素浓度对插穗生根的影响因指标而异(表 2)。愈伤率随着浓度升高而降低,除对照与100 mg·L-1处理间无显著差异外,其他浓度间均达极显著水平。腐烂率随着激素浓度升高而升高,50,100 mg·L-1处理最低,200 mg·L-1其次,对照极显著高于IBA处理。生根率是扦插育苗的重要指标,50~200 mg·L-1浓度间差异不显著,均极显著高于400 mg·L-1处理,对照极显著低于IBA处理。不定根数、最长不定根长、总根数及根系直径等4个根系生长指标均以200 mg·L-1处理最佳,100 mg·L-1其次,而对照除不定根长外其他指标表现较差。7个生根指标综合比较表明,200和100 mg·L-1为较理想的生根浓度。
2.3 基质、激素种类及浓度对鹿角杜鹃扦插苗地上部分生长指标的影响 2.3.1 各因素及其交互效应对扦插苗地上部分生长指标的影响3个主因素中,基质对扦插苗地上部分生长指标的影响最大,除老叶留存数为显著水平外,其他均达极显著水平; 激素种类及浓度对地上部分生长指标也有较大的影响,除激素种类、浓度分别对新稍长、新梢数的影响不显著外,其他均达极显著水平。两因素交互效应中,激素种类×浓度互作对地上部分生长指标影响较大,除新梢数、新梢率未达显著水平外,其他3个指标均达极显著水平; 基质×激素种类、基质×激素浓度的交互效应较小,仅分别对新梢率、老叶留存数有显著和极显著影响。三因素互作对所有指标无显著影响(表 3)。可见,鹿角杜鹃扦插苗地上生长指标主要受3个主效应及激素种类×浓度交互效应的影响。
|
|
腐殖土+河沙(3:1)基质与河沙+腐殖土(3:1)除对老叶留存数影响显著外,对其他指标影响均极显著基质(表 4),表明腐殖土+河沙(3:1)基质更有利于扦插苗地上部分生长。
|
|
老叶留存率、老叶留存数、新梢率及新梢数在5种激素间表现相似,均以GA3处理最佳,IBA,IAA处理其次,NAA处理最差。新梢长以IBA处理最长,GA3其次,6-BA显著低于IBA处理(表 4)。可见,GA3处理最有利于扦插苗地上部分生长,IBA其次,NAA处理最差。
2.3.4 激素浓度对扦插苗地上部分生长指标的影响5个地上部分生长指标中(表 4),老叶留存率受激素浓度影响最大并随着激素浓度升高而下降,除50 mg·L-1与100 mg·L-1处理间无显著差异外,其他浓度间均达极显著水平,对照极显著低于IBA处理。其他4个指标均随着激素浓度升高呈先增大后减小的变化趋势,且总体表现200 mg·L-1最好,100 mg·L-1其次,400 mg·L-1处理各项指标显著下降。
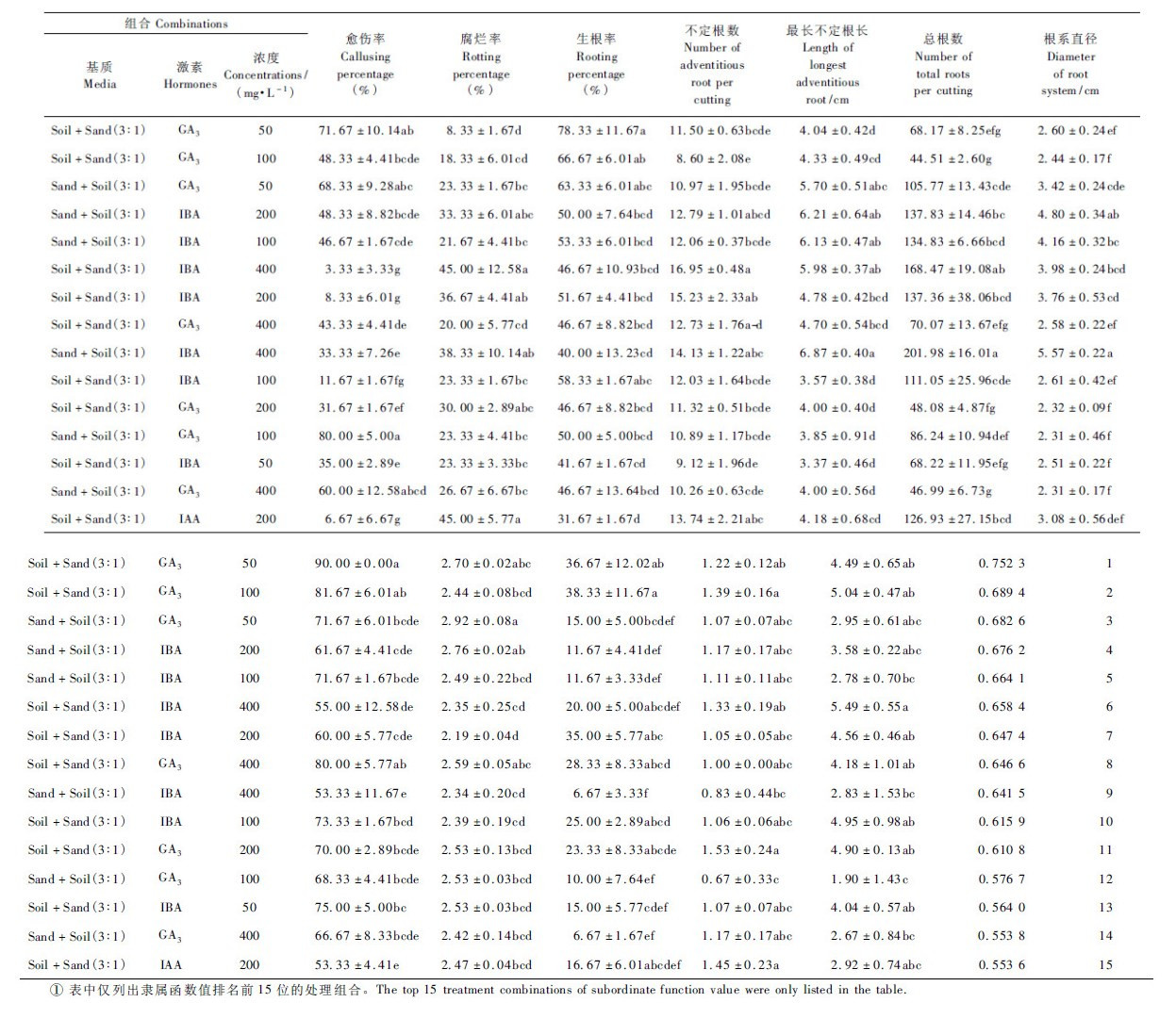
2.4 鹿角杜鹃扦插育苗最佳基质、激素种类与浓度组合的筛选研究发现,不同育苗指标在各处理组合中的表现存在差异,单一或少数指标难以全面、客观地反映各组合的育苗效果,采用隶属函数法对各组合的育苗效果进行综合评价。50个处理中隶属函数值U(Xj)排名前15位的组合育苗效果及排序见表 5。表 5可见,U(Xj)排名前15位的组合中,腐殖土+河沙(3:1)基质占9个,育苗效果优于河沙+腐殖土(3:1); 5种激素中,除200 mg·L-1IAA在腐殖土+河沙(3:1)基质中的U(Xj)排名前15位外,其他均为GA3,IBA处理,进一步表明GA3,IBA为鹿角杜鹃扦插育苗的理想激素; 5个浓度的育苗表现因激素种类而异。各因素组合中,腐殖土+河沙(3:1)基质与50 mg·L-1 GA3 组合的U(Xj)最大(0.752 3),其生根率(78.33%)与老叶留存率(90.00%)在所有组合中最高,腐烂率(8.33%)最低,愈伤率、新梢率及老叶留存数也位列前3位,为本试验中育苗效果最好的组合; 腐殖土+河沙(3:1)与100 mg·L-1 GA3组合及河沙+腐殖土(3:1)与50 mg·L-1GA3 组合效果其次; 河沙+腐殖土(3:1)基质与400 mg·L-1IBA组合虽然生根率(40.00%)表现一般,但不定根数、最长不定根长、总根数及根系直径等根系生长指标表现极佳,适用于插穗材料丰富的地区培育根系发达的优质苗木。
|
|
杜鹃花种类繁多,生态类型多样,生根时间各异。常绿类杜鹃中较易生根的彭土杜鹃(Rhododendron ponticum)扦插3周时形成根原基和幼小的不定根(Strzelecka,2007),较难生根的大白杜鹃(Rhododendron decorum)最快于44天生根(Chen et al.,2009),而难生根的半圆叶杜鹃(Rhododendron thomsonii)扦插70天时愈伤率仅为3.82%,未见不定根发生(Ferriani et al.,2006)。本试验发现,鹿角杜鹃扦插30天后形成根原基,45天时产生不定根,属皮部生根类型,为杜鹃花属中较难生根的种类。
3.1 基质对鹿角杜鹃扦插育苗的影响基质的组成与理化性状决定着生根环境,理想的基质应具有良好的透气、保水性和丰富的营养成份(Dolor et al.,2009)。Shah等(2006)研究发现,腐殖土基质的插穗生根数及叶片数、叶面积与株高显著优于泥沙,而泥沙基质的根系较长,认为腐殖土基质生根数多、地上部分生长快与其有机质含量高、保水性强有关,而泥沙基质根系较长是因为泥沙保水性差,水分、养分向下沉积,从而促使根的伸长; Ammarellou等(2012)也发现腐殖土基质的生根率、生根数及根质量优于河沙。本研究发现,基质对鹿角杜鹃插穗生根指标的影响较小,但显著影响扦插苗地上部分生长; 2种基质中,腐殖土+河沙(3:1)基质的生根率、老叶保留率及所有新梢指标均显著优于河沙+腐殖土(3:1),可能与其腐殖土配比高、有机质丰富、保水性强有关,但最佳基质配比尚有待进一步筛选。
3.2 激素种类对鹿角杜鹃扦插育苗的影响生长素IBA,IAA,NAA是植物扦插育苗常用的生根剂。大量研究表明:IBA诱导杜鹃花(Singh et al.,2009; Chen et al.,2009)及其他木本植物(Bashir et al.,2009; Rana et al.,2012)的生根效果优于IAA,NAA,并认为与IBA降解代谢慢、稳定性强、转运慢、作用时间长及毒性小、活性强等特性有关(Bartel et al.,2001; Nordström et al.,1991)。外源生长素可提高插穗生根区的内源生长素水平和IAA氧化酶、过氧化酶活性,加速淀粉、蛋白质水解和糖代谢,从而促进根原基形成与生长,而IBA处理插穗的生理活性及生根、萌芽能力大于NAA(Kochhar et al.,2008; Husen,2012)。GA3被认为是不定根形成的抑制剂,通过降低早期的细胞分裂抑制杨树(Populus)侧根原基形成,减少侧根数及长度(Gou et al.,2010),减少海枣(Phoenix dactylifera)及Lycium shawii生根率、生根数与根长(Afzal et al.,2011; Suleiman et al.,2011); GA3处理导致插穗低分子碳水化合物的大量消耗,延迟欧洲赤松(Pinus sylvestris)生根时间,降低生根率和生根数(Ernstsen et al.,1986); Abd El-Aal等(2011)发现内源GA3水平与葡萄(Vitis)品种的生根难易密切相关,高水平GA3是抑制生根的重要因子。但早期也偶见GA3促进插穗生根的报道: Nanda等(1972)通过156种植物的扦插试验,首次报道GA3处理可增加南美旋花(Ipomoea fistulosa)的生根数、根长及萌芽数、芽长,认为可能与增加腋生分生组织生长素或促进营养运输有关,Felippe等(1980)简报了GA3对大黍(Panicum maximum)生根有直接的促进作用。鉴于GA3对插穗生根与生长作用的报道极少,且不同种间存在不确定性,最近Niu等(2013)从分子、生理及解剖学上探讨了其作用机制,发现GA3可抑制烟草(Nicotiana tabacum)侧根原基的早期启动并显著减少不定根数,但对根系发育有重要的调节作用并显著增加主根长。本研究结果表明:激素种类对除新梢长外的所有指标有极显著或显著影响,其中GA3,IBA处理育苗效果最佳,IAA其次,6-BA与NAA较差,3种生长素间的育苗效果与前人报道一致,6-BA处理在不同激素间的表现也与Lü等(2012)结果相似,但GA3显著提高鹿角杜鹃愈伤率、生根率,降低腐烂率,并显著促进扦插苗地上部分生长不同于以往报道。近年,赵云龙等(2013)、李朝婵等(2012)发现外源激素可提高糙叶杜鹃(Rhododendron scabrifolium)及同亚属的长蕊杜鹃(Rhododendron stamineum)内源GA3水平,且其含量上升与愈伤组织诱导和不定根形成呈正相关,并推论GA3对根原基分化起着重要作用,为本研究结果提供了间接的支持,但其作用机制还有待从解剖、生理及其与生长素间协同作用等方面深入研究。
3.3 激素浓度对鹿角杜鹃扦插育苗的影响本研究发现,激素浓度对除新梢数外的所有指标有显著影响,且不同指标对浓度水平的响应差异较大。愈伤率、腐烂率及老叶留存率以低浓度(50 mg·L-1)处理最佳,随着浓度升高效应下降; 生根率、老叶留存数在0~100 mg·L-1时随着浓度升高而增大,后逐渐下降; 其他7个指标在0~200 mg·L-1时随着浓度升高而增大,400 mg·L-1处理显著下降。Laubscher等(2008)也发现,低浓度处理有益于愈伤组织诱导,中高浓度促进插穗生根及根系生长,但过高的浓度对插穗组织造成伤害,影响生根和扦插苗生长(Singh et al.,2009; Swamy et al.,2002; Rana et al.,2012)。
3.4 各因素交互作用对鹿角杜鹃扦插育苗的影响大量研究表明:基质、激素种类及其浓度不仅单独影响插穗生根与萌芽,且相互间有显著的交互影响(Mohammadi et al.,2012; Swamy et al.,2002)。本研究发现,激素种类×浓度交互效应对除新梢数、新梢长外的所有指标有极显著影响,基质×激素浓度互作主要影响插穗生根指标及老叶留存率,而基质×激素种类及三因素交互效应仅对少数指标有显著影响; 同时发现,所有交互效应对新梢数、新梢长无显著影响。Bashir等(2009)也发现激素种类×浓度交互作用显著影响生根指标,但对萌芽指标影响不显著,认为萌芽能力主要取决于插穗自身的营养储备及生理状况。
大叶常绿类杜鹃扦插难以生根是制约其产业化的关键问题。本研究以经济环保的腐殖土、河沙为基质材料,采用5种激素5个浓度的扦插试验发现,腐殖土+河沙(3:1)基质与50 mg·L-1 GA3组合不仅生根率高,且扦插苗后期生长好,为鹿角杜鹃木质化枝条扦插育苗的最佳组合,可用于规模化育苗。GA3被普遍认为是扦插生根的抑制剂,本研究首次发现GA3可显著提高鹿角杜鹃扦插育苗效果,为拓展GA3应用领域及杜鹃花产业化发展提供了科学依据。
| [1] |
高俊香, 梅盛龙, 鲁小珍, 等. 2009. 凤阳山自然保护区麂角杜鹃种群结构与分布. 南京林业大学学报: 自然科学版, 33(2): 35-38.( 1) 1)
|
| [2] |
耿芳, 张冬林, 李志辉, 等. 2008. IBA生根剂对卡罗来纳杜鹃插条生根的影响. 华中农业大学学报, 27(1): 127-130.( 1) 1)
|
| [3] |
李朝婵, 赵云龙, 张冬林, 等. 2012. 长蕊杜鹃扦插内源激素变化及解剖结构观察. 林业科学研究, 25(3): 360-365.( 3) 3)
|
| [4] |
王凯红, 凌家慧, 张乐华, 等. 2011. 两种常绿杜鹃亚属幼苗耐热性的主成分及隶属函数分析. 热带亚热带植物学报, 19(5): 412-418.( 1) 1)
|
| [5] |
张长芹, 高连明, 薛润光, 等. 2004. 中国杜鹃花的保育现状和展望. 广西科学, 11(4): 354-359, 362.( 1) 1)
|
| [6] |
张乐华, 刘向平, 王凯红, 等. 2006. 杜鹃属植物种子育苗研究. 园艺学报, 33(6): 1361-1364.( 1) 1)
|
| [7] |
赵云龙, 陈 训, 李朝婵. 2013. 糙叶杜鹃扦插生根过程中生理生化分析. 林业科学, 49(6): 45-51.( 2) 2)
|
| [8] |
Abd El-Aal A M K, Shaaban M M. 2011. Why some grapevine cultivars are hard to root?. Australian Journal of Basic and Applied Sciences, 5(2): 110-116.( 1) 1)
|
| [9] |
Afzal M, Khan M A, Pervez M A, et al. 2011. Root induction in the aerial offshoots of date palm (Phoenix dactylifera L.) cultivar, Hillawi. Pakistan Journal of Agricultural Sciences, 48(1): 11-17.( 1) 1)
|
| [10] |
Ammarellou A, Kazemeitabar K, Najafei H Z, et al. 2012. Effects of different culture media on rooting of Urtica dioica L. stem cuttings. Journal of Soil Science and Environmental Managemen, 3(7): 172-175.( 1) 1)
|
| [11] |
Bartel B, LeClere S, Magidin M, et al. 2001. Inputs to the active indole-3-acetic acid pool: de novo synthesis, conjugate hydrolysis, and indole-3-butyric acid β-oxidation. Journal of Plant Growth Regulation, 20(3): 198-216.( 1) 1)
|
| [12] |
Bashir M A, Anjum M A, Chaudhry Z, et al. 2009. Response of jojoba (Simmondsia chinensis) cuttings to various concentrations of auxins. Pakistan Journal of Botany, 41(6): 2831-2840.( 2) 2)
|
| [13] |
Chen X J, Zhou Y, Zhang Q X, et al. 2009. Cutting propagation of wild Rhododendron decorum Franch. HortScience, 44(4): 1104.( 2) 2)
|
| [14] |
Dolor D E, Ikie F O, Nnaji G U. 2009. Effect of propagation media on the rooting of leafy stem cuttings of Irvingia wombolu (Vermoesen). Research Journal of Agriculture and Biological Sciences, 5(6): 1146-1152.( 1) 1)
|
| [15] |
Ernstsen A, Hansen J. 1986. Influence of gibberellic acid and stock plant irradiance on carbohydrate content and rooting in cuttings of Scots pine seedlings (Pinus sylvestris L.). Tree Physiology, 1(1): 115-125.( 1) 1)
|
| [16] |
Felippe G M. 1980. Bud breaking and adventitious root formation in Panicum maximum Jacq. Biologia plantarum, 22(5): 392-395.( 1) 1)
|
| [17] |
Ferriani A P, Bortolini M F, Zuffellato-Ribas K C, et al. 2006. Vegetative propagation by cuttings of azaléia tree (Rhododendron thomsonii HOOK. f.). Semina: Ciências Agrárias, 27(1): 35-42. ( 2) 2)
|
| [18] |
Gensel W H, Blazich F A. 1985. Propagation of Rhododendron chapmanii by stem cuttings. Journal of Environmental Horticulture, 3(2): 65-68.( 1) 1)
|
| [19] |
Gou J Q, Strauss S H, Tsai C J, et al. 2010. Gibberellins regulate lateral root formation in Populus through interactions with auxin and other hormones. Plant Cell, 22(3): 623-639.( 1) 1)
|
| [20] |
Husen A. 2012. Changes of soluble sugars and enzymatic activities during adventitious rooting in cuttings of Grewia optiva as affected by age of donor plants and auxin treatments. American Journal of Plant Physiology, 7(1): 1-16.( 1) 1)
|
| [21] |
Kochhar S, Singh S P, Kochhar V K. 2008. Effect of auxins and associated biochemical changes during clonal propagation of the biofuel plant—Jatropha curcas. Biomass Bioenergy, 32(12): 1136-1143.( 1) 1)
|
| [22] |
Laubscher C P, Ndakidemi P A. 2008. Rooting success using IBA auxin on endangered Leucadendron laxum (PROTEACEAE) in different rooting mediums. African Journal of Biotechnology, 7(19): 3437-3442.( 1) 1)
|
| [23] |
Lü J F, Silva J A T, Ma G H. 2012. Vegetative propagation of Primulina tabucum Hance by petiole cuttings. Scientia Horticulturae, 134(1): 163-166.( 1) 1)
|
| [24] |
Mohammadi A T, Vahid S. 2012. Rooting in hibiscus rosa-sinensis (yellow double hybrid') by indole butyric acid and rooting substrates. International Journal of Plant, Animal and Environmental Sciences, 2(2): 194-197.( 1) 1)
|
| [25] |
Nanda K K, Anand V K, Chibbar R N. 1972. The promotive effect of gibberellic acid on the production of adventitious roots on stem cuttings of Ipomoea fistulosa. Planta, 105(4): 360-363.( 1) 1)
|
| [26] |
Nawrocka-Grześkowiak U. 2004. Effect of growth substances on the rooting of cuttings of Rhododendron species. Folia Horticulturae, 16(1): 115-123.( 1) 1)
|
| [27] |
Niu S H, Li Z X, Yuan H W, et al. 2013. Proper gibberellin localization in vascular tissue is required to regulate adventitious root development in tobacco. Journal of Experimental Botany, 64(11): 3411-3424.( 1) 1)
|
| [28] |
Nordström A C, Jacobs F A, Eliasson L. 1991. Effect of exogenous indole-3-acetic acid and indole-3-butyric acid on internal levels of the respective auxins and their conjugation with aspartic acid during adventitious root formation in pea cuttings. Plant Physiology, 96(3): 856-861.( 1) 1)
|
| [29] |
Rana R S, Sood K K. 2012. Effect of cutting diameter and hormonal application on the propagation of Ficus roxburghii Wall. through branch cuttings. Annals of Forest Research, 55(1): 69-84.( 2) 2)
|
| [30] |
Shah M, Khattak A M, Amin N. 2006. Effect of different growing media on the rooting of Ficus binnendijkii 'Amstel Queen' cuttings. Journal of Agricultural and Biological Science, 1(3): 15-17.( 1) 1)
|
| [31] |
Singh, K K, Gurung B. 2009. In vitro propagation of R. maddeni Hook. F. an endangered rhododendron species of Sikkim Himalaya. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 37(1): 79-83.( 2) 2)
|
| [32] |
Singh K K, Gurung B, Rai L K, et al. 2010. The influence of temperature, light and pre-treatment on the seed germination of critically endangered Sikkim Himalayan Rhododendron (R. niveum Hook f.). Journal of American Science, 6(8): 172-177.( 1) 1)
|
| [33] |
Strzelecka K. 2007. Anatomical structure and adventitious root formation in Rhododendron ponticum L. cuttings. Acta Scientiarum Polonorum, 6 (2): 15-22.( 3) 3)
|
| [34] |
Suleiman M K,Bhat N R, Jacob S, et al. 2011. Effect of growth regulators on rooting of hardwood cuttings of Lycium shawii, Nitraria retusa and Farsetia aegyptia. Journal of Agricultural Science and Technology B, 1(3): 414-419.( 1) 1)
|
| [35] |
Swamy S L, Puri S, Singh A K. 2002. Effect of auxins (IBA and NAA) and season on rooting of juvenile and mature hardwood cuttings of Robinia pseudoacacia and Grewia optiva. New Forests, 23(2): 143-157.( 3) 3)
|
 2014, Vol. 50
2014, Vol. 50