文章信息
- 唐欣, 王瑞辉, 杨秀艳, 朱建峰, 刘正祥, 倪建伟, 张华新
- Tang Xin, Wang Ruihui, Yang Xiuyan, Zhu Jianfeng, Liu Zhengxiang, Ni Jianwei, Zhang Huaxing
- 唐古特白刺液泡膜Na+/H+逆向运输蛋白基因NtNHX1的克隆与表达分析
- Isolation and Expression Analysis of a Vacuolar Membrane Na+/H+ Antiporter Gene NtNHX1 from Nitraria tangutorum
- 林业科学, 2014, 50(3): 38-44
- Scientia Silvae Sinicae, 2014, 50(3): 38-44.
- DOI: 10.11707/j.1001-7488.20140306
-
文章历史
- 收稿日期:2013-11-14
- 修回日期:2013-12-31
-
作者相关文章
2. 国家林业局盐碱地研究中心 北京 100091;
3. 林木遗传育种国家重点实验室 北京 100091
2. Research Center of Saline and Alkali Land of State Forestry Administration Beijing 100091;
3. State Key Labortory of Tree Genetics and Breeding Beijing 100091
盐胁迫是限制植物生长的重要环境因素之一。在大多数盐环境中,NaCl是盐的主要种类(Wu et al.,2009)。盐胁迫下Na+在植物细胞中大量累积,导致细胞内代谢活动减弱及扰乱胞内的离子平衡是其对植物生长发育的主要危害表现(张智俊等,2011)。为了避免盐碱条件下细胞出现离子平衡紊乱情况,植物体必须在胞质内维持一个低Na+高K+的环境,从而保证各种代谢活动的正常运行(Zörb et al.,2005)。盐胁迫下,植物采用不同的方式保持胞质内低Na+浓度,包括限制Na+涌入、保持积极的Na+外排和将Na+区隔化至液泡等(Rubio et al.,1995)。众多研究表明,Na+在液泡内区隔化是植物在高盐浓度下耐盐机制的重要环节(Barkla et al.,1996; Rausch et al.,1996)。在植物将Na+区隔化至液泡的过程中,液泡膜上Na+/H+逆向转运蛋白(Na+/H+antiporter,NHX)控制Na+的跨液泡膜转运和它在液泡中的积累(Rausch et al.,1996; Barkla et al.,1996),其运输活性的强弱直接关系到此机制在耐盐过程中的作用大小(严一诺等,2007)。液泡膜Na+/H+逆向转运蛋白不仅在离子区隔化和离子稳态平衡中发挥着非常重要的作用,还可以调节液泡pH变化(Yoshida et al.,2005)和影响植物的发育(Apse et al.,2003)。Apse等(1999)在拟南芥(Arabidopsis thaliana)中鉴定了第1个高等植物的液泡膜Na+/H+逆向转运蛋白基因AtNHX1,并将其转入拟南芥且成功获得了能在200 mmol·L-1 NaCl中正常生长发育的转基因植株; 进一步研究发现转基因植株叶中Na+的含量比野生型植物高,其耐盐性提高的原因是Na+/H+逆向转运蛋白将大量Na+区隔化在液泡中(Apse et al.,1999; Zhang et al.,2001)。过表达AtNHX1可引起耐盐性的改善,相继在油菜(Brassica campestris)、番茄(Solanum lycopersicum)、陆地棉(Gossypium hirsutum)、小麦(Triticum aestivum)、烟草(Nicotiana tabacum)、甜菜(Beta vulgaris)、水稻(Oryza sativa)等单、双子叶植物中都同样得到了验证(Kronzucker et al.,2011)。
唐古特白刺(Nitraria tangutorum)隶属于蒺藜科(Zygophyllaceae)白刺属(Nitraria),是中国特有的盐生植物,主要分布于西北盐渍化荒漠(刘瑛心,1987)。唐古特白刺根系发达,叶小且肉质化,具有抗风沙、抗干旱和耐盐碱等抗逆能力(王镜泉,1989),是典型的聚盐型(将盐离子聚于液泡中)盐生植物,可在土壤含盐量达2%的地域正常生长(闫永庆等,2010),是我国西北荒漠植被的重要建群种之一。目前对白刺属植物的研究主要集中在生理耐盐机制方面(王秀娟等,2010; 高暝等,2011; 倪建伟等,2012; 杨秀艳等,2013),但对其耐盐性分子机制的研究鲜见报道。本研究组前期研究发现,盐胁迫下,唐古特白刺在累积Na+同时,通过增加对K+、Ca2+等植物必需营养离子的选择性吸收及运输来维持地上部较稳定的离子含量及Ca2+/Na+、K+/Na+比值,从而维持盐胁迫下体内正常的生理代谢(杨秀艳等,2013)。为了探究盐胁迫下白刺维持体内离子平衡的分子机制,挖掘其耐盐基因资源,本研究依据NHX1 基因家族保守序列设计引物,采用RT-PCR和RACE 2种方法进行唐古特白刺液泡膜Na+/H+逆向转运蛋白基因的克隆,并通过相对荧光定量分析NaCl胁迫条件下NtNHX1在唐古特白刺组织中的表达情况,以期为探讨唐古特白刺耐盐分子机制和合理利用白刺属耐盐基因资源提供参考资料。
1 材料与方法 1.1 试验材料与处理方法唐古特白刺种子采自内蒙古磴口县。种子播种在蛭石:草炭为3:1(V/V)的混合介质中,置于中国林业科学研究院温室培养。选择生长正常且大小一致的3月龄苗用自来水培养,培养期间每隔4天换水1次。水培1周左右,采用0(CK)和200 mmol·L-1 NaCl处理幼苗1,3,6,12,24,48 h,每个处理3个重复,每个重复3株,共计72株。2013年9月22日上午10: 00—11: 00统一采取嫩根、嫩茎及嫩叶并用锡箔纸包好后速冻,保存于-80 ℃冰箱以备RNA提取。
1.2 总RNA的提取用北京天恩泽基因有限公司的柱式植物RNAout试剂盒提取唐古特白刺生长期嫩叶总RNA。按照SuperScript III Reverse Transcriptase 说明书进行反转录合成cDNA,置于-20 ℃冰箱保存备用。
1.3 NtNHX1全长cDNA序列的克隆基于已克隆(http://www.ncbi.nlm.nih.gov/genbank)的霸王(Sarcozygium xanthoxylon)ZxNHX(ABU92562.1)、拟南芥AtNHX1(NP_198067.1)、盐地碱蓬(Suaeda salsa)SsNHX1(AAP15178.1)、盐角草(Salicornia europaea)SeNHX1(AAN08157.1)、盐爪爪(Kalidium foliatum)KfNHX1(AAV73803.1)、小盐芥(Thellungiella halophila)ThNHX1(BAJ33874.1)、水稻(Oryza sativa)OsNHX1(BAA83337.1)等进行多序列比对,然后在氨基酸保守区,利用Primer Premier 5.0软件设计简并引物(表 1)。以唐古特白刺叶片总RNA,反转录后得到第1条链cDNA并以此为模板进行PCR 扩增,获得中间片段序列。在中间片段序列基础上利用Primer Premier 5.0软件设计3’RACE和5’RACE引物,通过巢式扩增得到全长序列。
|
|
以唐古特白刺嫩叶片的cDNA为模板进行PCR扩增。中间片段扩增程序为: 94 ℃ 5 min; 94 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,30个循环; 72℃ 7 min。3’5’末端扩增: 94 ℃预变性5 min; 94 ℃ 30 s,72 ℃ 3 min,5个循环; 94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,5个循环; 94 ℃ 30 s,62 ℃ 30 s,72 ℃ 3 min,30个循环。扩增全长cDNA程序为: 94 ℃ 5 min; 94 ℃ 30 s,58 ℃ 1 min,72 ℃ 2 min,30个循环; 72 ℃ 7 min。所有扩增反应体系均为25 μL。
1.4 NtNHX1基因生物信息学分析利用NCBI将NtNHX1基因序列翻译成氨基酸,在线分析蛋白质和DNA同源性(http://www.ncbi.nlm.nih.gov/BLAST/); 运用DNAMan软件进行NtNHX1基因序列的整理和蛋白氨基酸多重序列比对; 运用Compute pI /Mw软件预测NtNHX1基因编码蛋白分子质量和等电点; 采用Mega 5软件对系统进化树进行构建,进化距离的计算用Neighbor-Joining方法。利用在线SOPMA软件(Geourjon et al.,1995)进行唐古特白刺NtNHX1蛋白二级结构的预测; 运用 Scanprosite寻找编码蛋白的Motif(http://us.expasy.org/prosite); 运用TMHMM软件对编码蛋白跨膜结构域进行预测(http://genome.cbs.dtu.dk/services/TMHMM/); 利用ProtFun进行NtNHX1蛋白的功能预测(http://www.cbs.dtu.dk/services/ProtFun); 利用Signal P软件进行N-末端的信号肽序列的分析(http://genome.cbs.dtu.dk/services/Signalp/); 利用Protscal程序对NtNHX1基因序列疏水性预测分析。
1.5 相对荧光定量PCR表达特征为了研究NtNHX1在唐古特白刺不同组织中的表达情况,分别从幼叶、幼茎和幼根中提取总RNA,分别取500 ng为模板并反转录合成cDNA第1链。基于NtNHX1 cDNA全长序列,设计1对特异引物M7和M8(表 1)成功获得扩增长度为155 bp的片段。参考小果白刺(Nitraria sibirica)Actin基因(AB617805.1)序列,设计其特异引物Act-F和Act-R(表 1)作为内参,用于相对荧光定量分析。
2 结果与分析 2.1 cDNA编码区全长的克隆及序列分析采用引物M5和M6 扩增目的基因开放阅读框(ORF),测序结果表明该序列长度为1 635 bp。拼接RT-PCR及RACE-PCR扩增片段,最终获得长度为2 134 bp的唐古特白刺NHX cDNA全长序列,命名为NtNHX1(GenBank登录号: KF751928; 2014年5月28日公布)。将NtNHX1 cDNA全长序列提交至NCBI提供的ORF Finder程序进行分析发现,该cDNA全长的开放阅读框为1 635 bp,共编码544个氨基酸,3'非翻译区长218 bp,5'非翻译区长281 bp。
为了比较NtNHX1蛋白与其他Na+/H+转运蛋白的亲缘关系,将唐古特白刺NtNHX1氨基酸序列提交NCBI进行在线比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi),从GenBank中选取7个来源于不同植物中的Na+/H+逆向运输蛋白的氨基酸序列,分别为柑橘(Citrus reticulata AAT36679.1)、霸王(ABU92562.1)、盐角草(AAN08157.1)、北滨藜(Atriplex gmelini BAB11940.1)、犁苞滨藜(Atriplex dimorphostegia AAO48271.1)、拟南芥(NP_198067. 1)、水稻(BAA83337.1)。利用DNAMAN软件进行了多重比较,结果显示,NtNHX1氨基酸序列与已克隆的柑橘Na+/H+逆向转运蛋白CrNHX1同源性达81%,和其他植物的Na+/H+逆向转运蛋白也有较高的同源性(图 1)。从图 1可以看出,NtNHX1中红色方框处序列LFFIYLLPPI与其他植物的此序列都是高度保守的,该序列在哺乳动物中被鉴定为真核生物Na+/H+逆向转运蛋白竞争抑制剂氨氯吡嗪脒的结合位点(Gaxiola et al.,2001)。
 |
图 1 唐古特白刺NtNHX1与其他植物NHX1同源序列的比较
Fig. 1 Comparison of NtNHX1 with other plant NHX1 antiporter
红色方框表示氨氯吡嗪脒结合位点 Antiporter inhibitor’s amiloride-binding motif is marked with red box.Nt: 唐古特白刺Nitraria tangutorum; Cr: 柑橘Citrus reticulata; Se: 盐角草Salicornia europaea; Zx: 霸王Sarcozygium xanthoxylon; Ag: 北滨藜Atriplex gmelini; Ad: 犁苞滨藜Atriplex dimorphostegia; At: 拟南芥Arabidopsis thaliana; Os: 水稻Oryza sativa. 下同。The same below. |
在多重比较的基础上,为进一步了解NtNHX1与其他植物NHX1之间的进化关系,运用Mega5软件构建系统进化树,采用Neighbor-Joining方法进行进化距离的计算。结果表明: NtNHX1与液泡型的Na+/H+逆向转运蛋白的亲缘关系近,其中与柑橘CrNHX1的亲缘关系最近,其次是与拟南芥AtNHX1和同为蒺藜科的霸王ZxNHX亲缘关系较近; 而与同样来源于植物的质膜型Na+/H+逆向转运蛋白SOS1的亲缘关系较远(图 2)。这表明唐古特白刺NtNHX1为液泡型Na+/H+逆向转运蛋白。
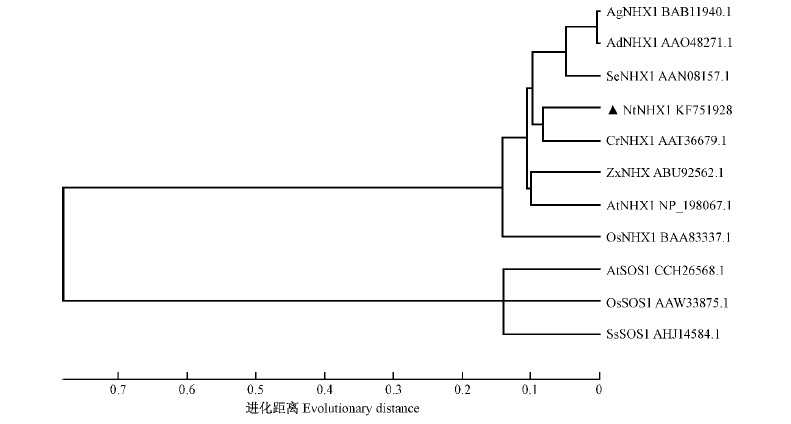 |
图 2 几种植物Na+/H+逆向转运蛋白的系统进化关系分析
Fig. 2 Phylogenetic tree analysis of Na+/H+ antiporters from various plant species
Ss: 盐地碱蓬Suaeda salsa. |
预测NtNHX1逆向运输蛋白相对分子质量为59.9 kDa,等电点为8.14; 二级结构预测表明,NtNHX蛋白含有269个α螺旋、187个随意卷曲和88个延伸链且分别占到49.45%,34.38%,16.18%(图 3A),α螺旋和随意卷曲结构交错构成了二级结构的主要部分。疏水性分析(http://web.expasy.org/cgi-bin/protscale/protscale.pl)发现,N末端部分具有很强的疏水性,而C末端的亲水性较强。从图中可以看出整个肽链中均匀地分布着疏水性氨基酸,且多于亲水性氨基酸,因此,整个多肽链表现为疏水性,说明NtNHX1蛋白符合膜蛋白的特征,属于疏水性蛋白(图 3B)。利用TMHMM软件进行跨膜性预测,表明NtNHX1含有12个跨膜区(图 3C),并且其中包含并没有完全跨过液泡膜的TM5和TM6两个跨膜结构域,相关研究证明这2个跨膜结构域是液泡型Na+/H+逆向运输蛋白活性的重要结构域,可与Na+结合(张雨良等,2009)。另外,NtNHX蛋白的C末端氨基酸序列差别较大且有一个长的亲水性"尾巴"(图 1),而长的"尾巴"在Na+运输中起着重要的作用(伍国强,2008)。因此,可以进一步推断唐古特白刺NtNHX1逆向转运蛋白为一个跨膜转运蛋白。
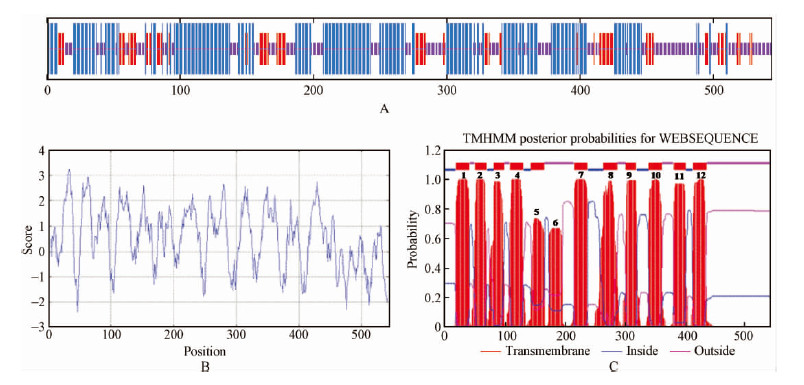 |
图 3 唐古特白刺NtNHX1蛋白的生物信息学分析
Fig. 3 Bioinformatics analysis of NtNHX1 protein in Nitraria tangutorum
A. 二级结构预测; B. 疏水性分析; C. 跨膜结构分析。A. Secondary structure prediction; B. Hydrophobicity analysis; C. Transmembrane structure prediction of the antiporter protein NtNHX1. |
以小果白刺Actin基因为内参照,采用荧光定量PCR检测正常生长条件下唐古特白刺不同器官中NtNHX1的表达,结果(图 4A)表明,NtNHX1在不同器官中均有表达,且在叶片中的表达量显著高于茎和根。为探究唐古特白刺NHX1基因是否受盐诱导和调节,检测了200 mmol·L-1 NaCl胁迫1,3,6,12,24,48 h时叶片中NtNHX1的表达水平。结果显示随着盐胁迫时间的延长,唐古特白刺NHX1基因在叶片中表达量持续增加,胁迫12 h时表达量与对照相比增加了3倍,而后逐渐减弱,从图中还可以看出盐分处理3 h时NtNHX1基因的表达量也迅速升高(图 4B)。这些结果说明NtNHX1可能在唐古特白刺的耐盐机制中发挥重要作用。
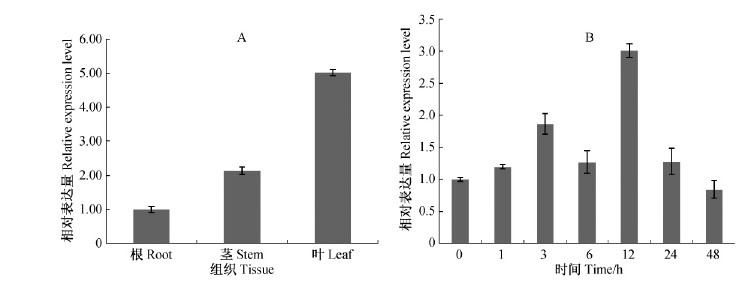 |
图 4 唐古特白刺NtNHX1基因的相对表达量分析
Fig. 4 Analysis of relative expression level of NtNHX1 in Nitraria tangutorum
A. 不同组织中NtNHX1基因的相对表达量; B. NaCl胁迫下唐古特白刺叶片中NtNHX1基因的相对表达量。 A. Relative expression level of NtNHX1 in different tissues; B. Expression of NtNHX1 in the leaf under NaCl stress. |
本研究首次从唐古特白刺中克隆到Na+/H+逆向转运蛋白基因NtNHX1,对其核酸序列所翻译的蛋白序列预测发现含有12个跨膜区域,这与已报道的动植物Na+/H+逆向转运蛋白的跨膜区域数目(10~12)一致且与其他逆向转运蛋白的跨膜区高度同源。NtNHX1蛋白的高度保守区包括1个特殊的序列LFFIYLLPPI,该序列在哺乳动物中被鉴定是真核生物Na+/H+逆向转运蛋白抑制剂氨氯吡嗪脒的结合位点(Hamada et al.,2001)。另外,NtNHX1与来源于植物的质膜型Na+/H+逆向转运蛋白SOS1的亲缘关系较远,表明研究中所克隆到基因是液泡型的Na+/H+逆向转运蛋白基因,其功能可能是跨液泡膜运输Na+,并在液泡内积累。NtNHX1系统发育分析表明NtNHX1与柑橘CrNHX1亲缘关系最近,而与水稻OsNHX1亲缘关系较远,表明植物Na+/H+逆向转运蛋白在进化上具有多样性,这种差异在单子叶与双子叶植物之间更为明显(马清等,2011)。
大量研究表明,液泡膜Na+/H+逆向转运蛋白具有将胞质中过多的Na+区域化到液泡的功能,并且NaCl能调控其基因的表达(Apse et al.,1999; Hamada et al.,2001; Fukuda et al.,2004)。本研究结果表明唐古特白刺NtNHX1表达具有组织的差异性并受盐胁迫的诱导和调控。与拟南芥AtNHX1(Apse et al.,1999)、盐地碱蓬SsNHX1(Ma et al.,2004)、陆地棉GhNHX1(Wu et al.,2004)的表达模式相似,正常生长条件下的NtNHX1基因在唐古特白刺的根、茎、叶中都有表达,且在叶中的表达量最高(是根中的5倍),表明Na+/H+逆向转运蛋白在植物生长和发育方面发挥着重要作用。基于NtNHX1在唐古特白刺中的组织表达情况,本试验开展了高浓度盐(200 mmol·L-1)处理下叶片NtNHX1的表达分析,在短期盐分处理(3 h)后,NtNHX1基因的表达量明显上升,与同为蒺藜科植物的霸王ZxNHX的表达相似(伍国强,2008),说明唐古特白刺可能存在与霸王相似的信号传递机制,在受到盐分胁迫时能快速感受盐分胁迫信号并向地上器官快速传递,进而启动NtNHX1特异性表达的信号转导系统。在盐处理12 h时NtNHX1的表达量最大,而后呈逐渐下降趋势,24 h时接近NaCl处理前水平,48 h时明显低于处理前水平。这一研究结果与碱地肤(Kochia sieversiana)KsNHX1(付寅生等,2012)、霸王ZxNHX(伍国强,2008)、番杏(Tetragonia tetragonioides)TtNHX1(吕慧颖等,2004)的报道相一致。
植物将Na+区隔化至液泡以适应盐胁迫的过程中,液泡膜上Na+/H+逆向转运蛋白(NHX)起着重要作用。之前的研究已经表明AtNHX1敲除的拟南芥突变体和LeNHX2基因沉默的番茄都变得对盐胁迫更加敏感(Rodríguez-Rosales et al.,2008)。众多研究表明在多种植物中超表达AtNHX1或其他植物NHX亚型都能明显增加植物的耐盐性(Apse et al.,1999; Zhang et al.,2001; Pardo et al.,2006; Chen et al.,2008)。唐古特白刺为盐生植物,耐盐能力极强,NtNHX1基因与非盐生植物中的同源基因(如AtNHX1)在功能上是否存在差异还有待研究。在后续研究中,本研究组将构建NtNHX1的植物表达载体,并对模式植物和唐古特白刺进行遗传转化,从而对NtNHX1的功能进行深入研究。
| [1] |
付寅生,崔继哲,陈广东,等.2012. 盐碱胁迫下碱地肤Na+/H+逆向转运蛋白基因KsNHX 1 表达分析.应用生态学报,23(6): 1629-1634.( 1) 1)
|
| [2] |
高暝,李 毅,种培芳,等.2011.渗透胁迫下不同地理种源白刺的生理响应.草业学报, 20(3): 99-107.( 1) 1)
|
| [3] |
吕慧颖,李银心,陈 华,等.2004.番杏 Na+/H+逆向转运蛋白基因的克隆与特性分析.高技术通讯,14(11):26-31.( 1) 1)
|
| [4] |
刘瑛心. 1987.中国沙漠植物志.北京:科学出版社, 303-306.( 1) 1)
|
| [5] |
马清,包爱科,伍国强,等. 2011.质膜Na+/H+逆向转运蛋白与植物耐盐性. 植物学报,46(2): 206-215.( 1) 1)
|
| [6] |
倪建伟, 武 香, 张华新, 等. 2012. 3 种白刺耐盐性的对比分析. 林业科学研究,25(1): 48-53.( 1) 1)
|
| [7] |
王镜泉.1989.白刺属植物的分类分布及其生物生态学特性研究.干旱造林研究,(2): 47-63.( 1) 1)
|
| [8] |
王秀娟,杨会青.2010.盐碱胁迫下西伯利亚白刺的渗透调节物质的变化.热带农业科学,30(2): 34-36.( 1) 1)
|
| [9] |
伍国强.2008.多浆旱生植物霸王液泡膜Na+/H+逆向转运蛋白基因的克隆与表达. 兰州: 兰州大学硕士学位论文.( 3) 3)
|
| [10] |
严一诺,孙淑斌,徐国华,等.2007.菊芋Na+/H+逆向转运蛋白基因的克隆与表达分析.西北植物学报,27(7): 1291-1298. ( 1) 1)
|
| [11] |
闫永庆,刘兴亮,王 崑,等. 2010.白刺对不同浓度混合盐碱胁迫的生理响应. 植物生态学报,34(10): 1213-1219.( 1) 1)
|
| [12] |
杨秀艳,张华新,张 丽,等. 2013. NaCl胁迫对唐古特白刺幼苗生长及离子吸收、运输与分配的影响. 林业科学,49(9): 165-171.( 2) 2)
|
| [13] |
张雨良,张智俊,杨峰山,等. 2009. 新疆盐生植物车前PmNHX 1 基因的克隆及生物信息学分析. 中国生物工程杂志,29(1): 27-33.( 1) 1)
|
| [14] |
张智俊,杨 洋. 2011. 毛竹液泡膜Na+/H+逆向运输蛋白基因克隆及表达分析.农业生物技术学报, 19(1):69-76.( 1) 1)
|
| [15] |
Apse M P, Aharon G S, Snedden W A, et al. 1999. Salt tolerance conferred by over expression of a vacuolar Na+/H+ antiporter in Arabidopsis. Science, 285(4): 1256-1258.( 5) 5)
|
| [16] |
Apse M P, Sottosanto J B, Blumwald E. 2003.Vacuolar cation/H+ exchange, ion homeostasis, and leaf development are altered in a T-DNA insertional mutant of AtNHX1, the Arabidopsis vacuolar Na+/H+ antiporter. Plant Journal, 36(2): 229-239.( 1) 1)
|
| [17] |
Barkla B J, Pantoja O. 1996. Physiology of ion transport across the tonoplast of higher plants. Annual Review of Plant Physiology and Plant Molecular Biology, 47(1):159-184.( 2) 2)
|
| [18] |
Chen L H, Zhang B, Xu Z Q. 2008. Salt tolerance conferred by overexpression of Arabidopsis vacuolar Na+/H+ antiporter gene AtNHX 1 in common buckwheat (Fagopyrum esculentum). Transgenic Research, 17(1): 121-132.( 1) 1)
|
| [19] |
Fukuda A, Nakamura A, Tagiri A, et al. 2004. Function, intracellular localization and the importance in salt-tolerance of a vacuolar Na+/H+ antiporter from rice. Plant and Cell Physiology, 45(2): 146-159.( 1) 1)
|
| [20] |
Gaxiola R A, Li J, Undurraga S, et al. 2001. Drought- and salt-tolerant plants result from overexpression of the AVP1 H+-pump. Proceedings of the National Academy of Sciences, 98(20): 11444-11449.( 1) 1)
|
| [21] |
Geourjon C, Deleage G. 1995. SOPMA: significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments. Computer Applications in the Biosciences: CABIOS, 11(6): 681-684.( 1) 1)
|
| [22] |
Hamada A, Shono M,Xia T, et al. 2001. Isolation and characterization of a Na+/H+ antiporter gene from the halophyte Atriplex gmelini. Plant Molecular Biology, 46(1):35-42.( 2) 2)
|
| [23] |
Kronzucker H J, Britto D T. 2011. Sodium transport in plants: a critical review. New Phytologist, 189(1): 54-81.( 1) 1)
|
| [24] |
Ma X L, Zhang Q, Shi H Z, et al. 2004. Molecular cloning and different expression of a vacuolar Na+/H+ antiporter gene in Suaeda salsa under salt stress. Biologia Plantarum, 48(2): 219 -225.( 1) 1)
|
| [25] |
Pardo J M, Cubero B, Leidi E O, et al. 2006. Alkali cation exchangers: roles in cellular homeostasis and stress tolerance. Journal of Experimental Botany, 57(5): 1181-1199.( 1) 1)
|
| [26] |
Rausch T, Kirsch M, Low R, et al.1996. Salt stress responses of higher plants: The role of proton pumps and Na+/H+ antiporters. Journal of Plant Physiology, 148(3): 425-433.( 2) 2)
|
| [27] |
Rubio F, Gassmann W, Schroeder J I.1995. Sodium-driven potassium uptake by the plant potassium transporter HKT1 and mutations conferring salt tolerance. Science, 270(5242):1660-1662.( 1) 1)
|
| [28] |
Rodríguez-Rosales M P, Jiang X, Gálvez F J, et al. 2008. Overexpression of the tomato K+/H+ antiporter LeNHX2 confers salt tolerance by improving potassium compartmentalization. New Phytologist, 179(2): 366-377.( 1) 1)
|
| [29] |
Wu C X, Gao X H, Kong X Q, et al. 2009. Molecular cloning and functional analysis of a Na+/H+antiporter gene ThNHX 1 from a halophytic plant Thellungiella halophila. Plant Molecular Biology, 27(1):1-12.( 1) 1)
|
| [30] |
Wu C A, Yang G D, Meng Q W, et al. 2004. The cotton GhNHX 1 gene encoding a novel putative tonoplast Na+/H+ antiporter plays an important role in salt stress. Plant and Cell Physiology, 45(5): 600-607. ( 1) 1)
|
| [31] |
Yoshida K, Kawachi M, Mori M, et al. 2005. The involvement of tonoplast proton pumps and Na+ (K+)/H+ exchangers in the change of petal color during flower opening of morning glory, Ipomoea tricolor cv. Heavenly Blue. Plant and Cell Physiology, 46(3): 407-415. ( 1) 1)
|
| [32] |
Zhang H X, Blumwald E. 2001. Transgenic salt-tolerant tomato plants accumulate salt in foliage but not in fruit. Nature. Biotechnology, 19(8): 765-768.( 2) 2)
|
| [33] |
Zörb C, Noll A, Karl S, et al. 2005. Molecular characterization of Na+/H+ antiporters ( ZmNHX) of maize (Zea maysL.) and their expression under salt stress. Journal of Plant Physiology, 162(1): 55-66.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

