文章信息
- 张伟溪, 刘浡洋, 丁昌俊, 张冰玉, 黄秦军, 褚延广, 苏晓华
- Zhang Weixi, Liu Boyang, Ding Changjun, Zhang Bingyu, Huang Qinjun, Chu Yanguang, Su Xiaohua
- 欧美杨锌指蛋白转录因子基因(ZxZF)的遗传转化及抗旱性初步分析
- Transformation of Zinc Finger Protein Transcription Factor Gene (ZxZF) and Preliminary Evaluation of Drought Tolerance in Populus × euramericana
- 林业科学, 2014, 50(3): 31-37
- Scientia Silvae Sinicae, 2014, 50(3): 31-37.
- DOI: 10.11707/j.1001-7488.20140305
-
文章历史
- 收稿日期:2013-11-12
- 修回日期:2013-11-22
-
作者相关文章
2. 北京林业大学 北京 100083
2. Beijing Forestry University Beijing 100083
我国干旱、半干旱地区约占国土总面积的1/2,再加上林木基因资源和木本植物自身生物学特性的限制,能够用于困难地造林的林木品种十分缺乏,严重限制了当地的生态建设及经济建设的发展。因此,培育林木抗逆新品种已成林木良种选育的重要趋势。杨树(Populus)生长快、适应性强、木材用途广,在水土保持和维护生态环境方面发挥着重要作用,是我国绿化、造林和工业用材的重要树种,但现有大多数杨树品种抗旱性较差,难以在干旱地区发挥其高产潜力。相对于常规育种途径,基因工程育种不仅可以缩短育种周期,又可在基因水平上改造林木抗性遗传物质,提高了育种的目的性和可操作性,是加速林木改良的一个重要途径(苏晓华等,2003)。有关转抗逆基因杨树方面的研究已有一些报道,例如,转抗旱基因(SacB)杨树(张冰玉等,2005; 李义良等,2007)、转耐盐基因(JERF基因等)杨树(Li et al.,2009)及转耐寒基因(PtFAD3)杨树(Zhu et al.,2013; Zou et al.,2008)等,并在一定程度上提高了杨树的抗旱、耐盐及耐寒性。
转录因子(transcription factor,TF)在抗逆基因表达调控中起着重要的作用。锌指蛋白(zinc finger protein)是真核生物基因组中最丰富的一类转录因子,参与调控一些重要的生理过程,如花的发育、光形态建成以及对胁迫的响应等方面(Takatsuji,1998)。在农作物及拟南芥上众多研究表明,一些锌指蛋白的过表达可以提高植物的耐非生物胁迫能力,如对拟南芥(Arabidopsis thaliana)锌指蛋白基因STZ(Sakamoto et al.,2000; 2004)、ZAT7(Mittler et al.,2006)、ZAT12(Davletova et al.,2005; Vogel et al.,2005)及ThZF1(Xu et al.,2007)等研究表明,这些基因的过表达可明显提高转基因植株对干旱、高盐或低温等非生物胁迫抗性。Kim等(2001)把大豆(Glycine max)锌指蛋白基因SCOF-1 转入拟南芥和烟草(Nicotiana tabacum),使转基因植株的抗寒能力显著增强; 转锌指蛋白基因ZPT2-3矮牵牛(Petunia hybrida)的抗旱能力得到增强(Sugano et al.,2003); 水稻(Oryza sativa)锌指蛋白OSISAP1的过表达可以增强转基因烟草对高盐、干旱及低温的抵抗能力(Mukhopadhyay et al.,2004)。在木本植物研究中目前虽有锌指蛋白转录因子相关报道,但多数集中在基因克隆和表达阶段,如胡杨(Populus euphratica)(王俊英等,2005)、刚毛柽柳(Tamarix hispida)(An et al.,2011)、橡胶树(Hevea brasiliensis)(朱家红等,2006)及麻疯树(Jatropha curcas)(严安心等,2012)。对抗逆木本植物新品系培育而言,利用木本植物自身的基因进行遗传转化,比外源基因具有更高的安全性和遗传稳定性。因此,抗逆木本植物的优良抗逆基因资源还有待于进一步开发与利用。霸王(Sarcozygium xanthoxylon),蒺藜科(Zygophyllaceae),是一种强旱生小灌木,是我国西北和蒙古荒漠草原上的主要植被之一(中国科学院中国植物志编辑委员会,1998)。本研究利用农杆菌(Agrobacterium tumefacien)介导法将受诱导型启动子驱动的源于霸王转录因子基因——锌指蛋白基因(ZxZF)转入欧美杨'渤丰1号’(Populus × euramericana cl. 'Bofeng1’)中,获得转基因欧美杨植株,并对其进行抗旱性研究,以期筛选出抗旱转基因欧美杨株系,为我国干旱、半干旱地区培育杨树优良新品种奠定基础。
1 材料与方法 1.1 试验材料'渤丰1号’属聚合型杂种欧美杨,母本为美洲黑杨种内聚合杂种65号杨(Populus deltoides cl. '55/65’× P. deltoides cl. '2KEN8’),父本为欧洲黑杨种内聚合杂种(P. nigra 'Brummen’× P. nigra 'Piccarolo’)。它由中国林业科学研究院林业研究所培育,并于2008年获得国家林业局植物新品种保护权,于2011年被国家林业局林木品种审定委员会审定为林木良种。将'渤丰1号’在中国林业科学研究院科研温室进行扦插繁殖,取其健康幼嫩叶片进行农杆菌侵染。
1.2 外源基因植物表达载体质粒及农杆菌锌指蛋白转录因子基因ZxZF是从我国西部极端抗旱木本植物霸王中克隆分离出的具有自主知识产权转录因子(专利号: ZL 200610090934.4),属于锌指蛋白C2H2亚类。植物表达载体质粒pBZxZF(由本实验室构建并保存,见图 1)应用液氮冻融法转化农杆菌GV3101,获得转基因供体农杆菌。
 |
图 1 植物表达载体pBZxZF的结构示意
Fig. 1 The structural drawing of ZxZF in expression vector
|
用本实验室前期建立的高效再生体系及卡那霉素选择压(崔旭东等,2012)。叶片再生培养基: MS+6-BA 0.4 mg·L-1+NAA0.04 mg·L-1; 不定芽生根培养基: 1/2MS+IBA0.05 mg·L-1+NAA0.02 mg·L-1。叶片分化卡那霉素(Km)选择压为30 mg·L-1; 不定芽生根Km选择压为20 mg·L-1。
1.4 遗传转化与转基因植株获得将消毒好的无菌叶片切成1 cm×1 cm的叶盘,放入叶片诱导培养基中,预培养3~6天; 同时制备农杆菌侵染液,使其OD600=1.0~1.5,取出预培养叶盘浸入转化菌液中,轻微震荡,侵染5~15 min; 取出叶盘,在无菌滤纸上吸干,接种到叶片再生培养基上,27 ℃、黑暗条件下共培养2~3天。将共培养后的叶盘用含有300 mg·L-1头孢霉素(Cef)的无菌水冲洗后,在无菌滤纸上吸干,转移到附加Cef 300 mg·L-1的筛选分化培养基上筛选,每20天左右更换1次培养基,直至长出不定芽。切取再生的Km抗性芽(1.0~1.5 cm),转入附加Cef 400 mg·L-1的筛选生根培养基上培养诱导生根,进一步培养成为完整的植株。
1.5 转基因植株的分子检测 1.5.1 PCR 检测采用CTAB法提取转基因植株及对照植株叶片DNA(Lodhi et al.,1994),根据已知ZxZF基因特异序列设计引物,上海英俊生物公司合成。上游引物序列: 5’-CCTCATCAAGGTTCT GGGAGT-3’; 下游引物序列: 5’-AAACATCAAT TTTGGGTCGG-3’; 其产物大小: 726 bp。扩增反应体系25 μL: DNA模板 1 μL,上游引物(10 μmol·L-1)0.5 μL,下游引物(10 μmol·L-1)0.5 μL,10 × Taq Buffer 2.5 μL,dNTP Mixture(2.5 mol·L-1)1 μL,Taq酶(5 U·μL-1)0.13 μL,超纯水补足25 μL。扩增反应条件: 94 ℃预变性5 min; 94 ℃变性1 min,57 ℃退火30 s,72 ℃复性1 min,40个循环; 72 ℃延伸7 min,4 ℃保存。
1.5.2 Southern印记杂交检测采用放射性同位素法进行Southern杂交试验。使用经过RNaseA处理并抽提再沉淀后的DNA进行酶切,体系如下: DNA 30~40 μg,限制性内切酶SacⅠ10 μL,10×Buffer 10 μL,超纯水补足25 μL,37 ℃酶切过夜。酶切完毕的DNA用0.8%凝胶电泳,随后进行真空转膜(Olszewska et al.,1988)。根据R and om Primer DNA Labeling Kit Ver.2.0(Takara公司)说明书,使用32P同位素进行探针标记。参考《分子克隆试验指南》(萨姆布鲁克等,2002)进行杂交和检测。
1.5.3 qRT-PCR检测使用RNeasy Plant Mini Kit(Qiagen)试剂盒提取转基因欧美杨叶片总RNA,2 μg总RNA 用于cDNA合成。首先去除残留DNA,反应体系如下: 10×RQ1 RNase-free DNase Reaction Buffer 1.5 μL,RQ1 RNase-free DNase(1 U·μg-1)2 μL,RNA 2 μg,超纯水补足15 μL,37 ℃下反应30 min; 反应结束后立即加入1 μL RQ1 DNase Stop Solution,65 ℃ 10 min,终止反应; 向上述离心管中加Oligo(dT)15 Primer 1 μL,70 ℃变性5 min,迅速置于冰上; 向管内加入M-MLV 5×Reaction Buffer 5 μL,dNTP Mixture(2.5 mmol·L-1)1.25 μL,Recombinant RNasin Ribonuclease Inhibitor 0.625 μL,M-MLV 1.0 μL,超纯水补足25 μL,混匀后37 ℃下反应1 h; 65 ℃ 10 min终止反应,4 ℃∞,-20 ℃保存。
ZxZF基因特异序列,上游引物: 5’-CTCCAAA CTCCTCTGCAAGCTT-3’; 下游: 5’-GATTGCCGCC AGTTAATTGTG-3’; 产物大小150 bp。以UBQ为内对照基因(ubiquitin,BU879229),上游引物: 5’-GTTGATTTTTGCTGGGAAGC-3’; 下游: 5’- GATC TTGGCCTTCACGTTGT -3’; 产物大小193 bp。以稀释20倍的反转录产物为模板,参照SYBR Premix Ex Taq试剂盒(Takara公司)说明配制qRT-PCR反应体系: cDNA模板2 μL,2×SYBR Premix Ex TaqⅡ10 μL,50×ROX Reference DyeⅡ 0.4 μL,上游引物(10 μmol·L-1)0.6 μL,下游引物(10 μmol·L-1)0.6 μL,Nulease free water 6.4 μL。使用ABI 7500型荧光定量PCR仪,选用两步法扩增,单独运行溶解曲线。
1.6 转基因植株的抗旱性检测首先选取ZxZF基因成功表达的4个转基因欧美杨植株的健康叶片进行组培再生,将所得再生芽转入生根培养基中生根,至生根5~8条时,选择苗高7~8 cm、5~7片叶子的幼苗,移至温室内水培培养(环境温度为22~24 ℃)。培养液为Hoagl and 溶液(pH6.0),培养液每隔3天更换1次,待幼苗长至15 cm以上时,选择生长一致的植株进行PEG模拟干旱处理。处理浓度为0%,5%,10%和15%(W/V)4个梯度,处理时间为8 h,每个处理每个株系8次重复。处理结束后,参照《植物生理生化实验原理和技术》(李合生,2007)取各株系叶片,测定叶片相对含水量(RWC)、脯氨酸含量,各指标均设置3次重复。
2 结果与分析 2.1 转基因欧美杨植株获得欧美杨'渤丰1号’无菌叶片经农杆菌侵染后,在附加Cef 300 mg·L-1的分化筛选培养基中培养30天左右后,抗性芽长至0.2~0.5 cm,60天左右抗性芽伸长的长度可达1.0~2.0 cm。同时会淘汰出一些假阳性植株。当抗性芽长至1.0~1.5 cm时,转入附加Cef 400 mg·L-1的生根筛选培养基中,30天以后可长出3~4条根,根长可达4.0~8.0 cm,苗高可达3.0~6.0 cm,而假阳性植株却未能生根,苗黄化死去。当转基因抗性植株的苗高为3.0~6.0 cm时,移栽至温室进行脱菌生长,共获得80株具有卡那霉素抗性的转基因植株。
2.2 转基因欧美杨植株分子检测 2.2.1 转基因植株PCR分析选择在温室生长较好的转基因卡那霉素抗性植株,提取DNA,并用目的基因ZxZF引物扩增,以含有锌指蛋白基因的pBI121质粒作为阳性对照,以非转基因植株作为阴性对照,进行PCR扩增,部分扩增结果见图 2。转ZxZF基因的植株在约726 bp处出现1条特征条带,与预期扩增结果一致,而在阴性对照的泳道上未发现该特征带,这初步证明ZxZF基因已成功整合到'渤丰1号’基因组中,并获得转ZxZF基因欧美杨17株。
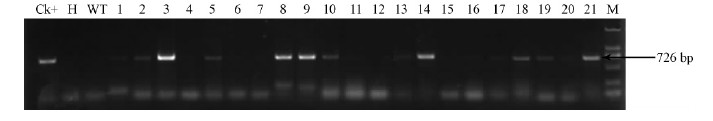 |
图 2 转基因欧美杨扩增ZxZF基因的PCR检测
Fig. 2 Detection of ZxZF from Km-resistant transgenic plants of P.× euramericana by PCR
Ck+: 阳性对照 Positive control; H: ddH2O; WT: 非转基因植株 Non-transgenic plant; 1-21: 转基因卡那霉素抗性植株 Kan-resistance transgenic plant; M: D2000. |
经过SacⅠ单酶切后的基因组DNA被用来进行Southern杂交试验,使用标记有P32-dCTP放射性同位素的NPTⅡ片段(产物大小: 505 bp)作为探针,杂交结果(图 3)显示阳性对照及部分阳性转基因株系出现了明显的杂交条带(2,3,4,5,6),非转基因植株没有杂交条带。证明外源基因ZxZF已经成功整合至植物基因组中,且为单个拷贝。
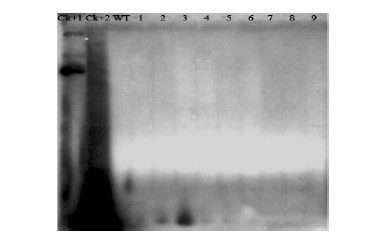 |
图 3 Southern杂交印记杂交检测结果
Fig. 3 The result of Southern blotting
Ck+1: 质粒阳性对照 Plasmid,positive control; Ck+2: PCR阳性对照 PCR positive control; WT: 非转基因植株 Non-transgenic plant; 1-9: PCR阳性转基因株系PCR positive transgenic plants. |
为了检测ZxZF基因在转基因欧美杨中的转录表达情况,使用转基因植株(L1,L2,L3,L4,L5)和非转基因植株(WT)总RNA为模板反转录获得的cDNA进行RT-PCR及qRT-PCR检测。经UBQ基因特异引物扩增确定RNA 浓度后,进行ZxZF基因的RT-PCR检测,对照植株没有扩增出相应条带,转基因株系L1-L4均扩增出1条清晰的特征条带(150 bp),而转基因株系L5条带不清晰(图 4A)。随后对转基因株系L1-L4进行qRT-PCR检测,定量结果(图 4B)显示: 转基因株系L1-L4中ZxZF基因均正常转录表达,其中,ZxZF基因在转基因无性系L1,L2体内表达量显著高于转基因株系L3,L4。该结果与RT-PCR结果一致,说明外源基因ZxZF已经成功整合进入了植物基因组中,并且能够正常表达。
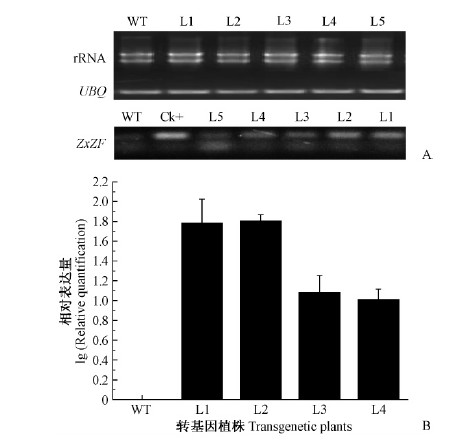 |
图 4 转基因欧美杨株系RT-PCR及qRT-PCR检测
Fig. 4 RT-PCR and qRT-PCR analysis of transgenic P.× euramericana lines
A. 转基因植株RT-PCR检测 RT-PCR analysis of transgenic plants; B. 转基因植株qRT-PCR检测 qRT-PCR analysis of transgenic plants. Ck+: 阳性对照 Positive control; WT: 非转基因植株 Non-transgenic plants; L1-L5: 转基因植株 Transgenic plants.下同。The same below. |
向培养液中加入不同浓度PEG处理8 h后,转基因株系与非转基因株系发生明显变化(图 5)。在5% PEG处理组中,转基因株系与非转基因株系少量叶片开始变黄,但二者差异不明显(图 5A,B); 在10%PEG处理组中,转基因株系和非转基因株系开始发生萎蔫现象,非转基因株系叶片变黄面积明显大于转基因无性系,茎顶端开始弯曲(图 5A,B); 在15% PEG处理组中,非转基因株系叶片失水严重,开始下垂,转基因株系部分植株叶片失水,少量变黄,生长情况要明显好于非转基因植株(图 5C)。
 |
图 5 不同PEG处理间欧美杨植株生长表型变化
Fig. 5 P.× euramericana in varied concentration of PEG
A.不同PEG浓度非转基因株系生长情况Effect of PEG concentration on non-transgenic plants;B.不同PEG浓度转基因L3株系生长情况Effect of PEG concentration on L3;C. 15%PEG处理组各植株生长情况P.× euramericana in 15% PEG . |
叶片相对含水量(RWC)是显示植物水分状态的一个有效指标(Sinclair et al.,1986)。由图 6可以看出: 随着PEG浓度加大,各株系叶片相对含水率均呈下降趋势,其中非转基因植株降幅较大,各浓度梯度之间差异极显著; 转基因株系相对含水量在5%PEG处理组中降幅较小,与对照组差异不显著; 在10%和15% PEG处理组中各转基因株系相对含水量显著低于对照组,均高于非转基因株系,其中转基因株系L1和L2叶片相对含水量分别显著高于非转基因株系10.34%和18.93%(10%处理组)及20.27%和17.24%(15%处理组),L3叶片相对含水量在10%PEG处理组中显著高于非转基因株系9.59%。说明转基因株系在干旱模拟胁迫条件下,叶片保水能力高于非转基因株系,这可能有助于提高转基因株系的抗旱能力。
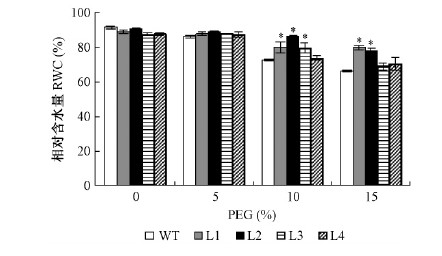 |
图 6 不同PEG处理下欧美杨转基因株系叶片相对含水率变化
Fig. 6 Effect of varied concentration of PEG on relative water content(RWC) of transgenic P.× euramericana lines
*: 与WT存在显著差异(P<0.05) Significant differences from the WT at P<0.05. |
脯氨酸(proline,Pro)在植物组织内是作为一种理想的渗调物质和防脱水剂,能通过调节降低细胞水势并保持膨压(Nanjo et al.,1999)。如图 7所示,各转基因株系在不同浓度PEG处理后,脯氨酸含量呈现不同程度积累,转基因株系L1,L2呈现先升高后降低趋势,L3,L4持续增高; 非转基因株系呈现先降低后升高趋势; 在各处理组中(对照组除外)各转基因株系脯氨酸含量均高于非转基因株系,L2分别显著高于非转基因株系12.91%(5%PEG)及41.82%(10%PEG),L3显著高于非转基因株系53.34%(15%PEG),L4显著高于非转基因株系53.08%(5%PEG)。说明转基因株系在模拟干旱条件下,各株系脯氨酸积累能力不同,但转基因株系脯氨酸积累能力要高于非转基因株系,从而推断转基因株系抗脱水能力强于非转基因株系。
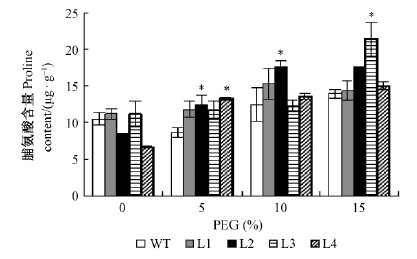 |
图 7 不同PEG处理对欧美杨转基因株系脯氨酸含量的影响
Fig. 7 Effect of concentration of PEG on proline content of transgenic P.× euramericana lines
*: 与WT存在显著性差异(P<0.05) Significant differences from the WT at P<0.05. |
锌指蛋白是植物体内重要的转录因子,具有调控植物生长发育、耐逆性等多种功能(Englbrecht et al.,2004)。在农作物上已有研究报道锌指蛋白基因的过量表达或导入可以显著增加植株(水稻、烟草)抗旱能力(Huang et al.,2009; Yang et al.,2008; Jain et al.,2008)。本研究将从极端抗旱木本植物霸王中获得的锌指蛋白转录因子导入欧美杨'渤丰1号’中,通过PCR、Southern印记杂交、RT-PCR及qRT-PCR分子检测,证实ZxZF基因已经成功以单拷贝形式整合到转基因欧美杨体内,且在部分转基因欧美杨中已经成功表达。本研究中使用的是干旱诱导型启动子RD29A,这个启动子没有器官专一性,在逆境(如干旱、高盐和低温)时可驱动靶基因大量表达,从而提高转基因植物的抗逆性(Yamaguchi-Shinozaki et al.,1994),可以避免35S强启动子对转基因植株带来的不良影响,如矮化现象(Hsieh et al.,2002a; 2002b)。
利用聚乙二醇(PEG)、甘露醇和蔗糖等高渗溶液模拟干旱胁迫处理是作物抗旱性室内鉴定的常用方法,其中高渗溶液中以PEG-6000较为理想,能使植物组织和细胞处于类似于干旱的水分胁迫之中,而不会引起质壁分离伤害植物(Ravikumar et al.,2003)。本研究通过对转基因欧美杨植株的PEG干旱模拟胁迫试验显示,转基因株系与非转基因株系在经PEG胁迫处理后,转基因株系从生长形态上到生理指标(相对含水量、脯氨酸含量)上均表现出一定的优势。在干旱胁迫下,相对含水量的高低与其抗脱水能力一致(Castonguay et al.,1992),脯氨酸的积累可以通过渗透调节保护亚细胞结构免受损害(Nanjo et al.,1999),因此,转基因杨树抗脱水能力和渗透调节能力提高,进而抗旱性增强。此外,C2H2类转录因子(ZFP245)可通过调节脯氨酸合成相关基因表达,促进转基因植物脯氨酸的积累,增强转基因植物抗旱、耐盐能力(Huang et al.,2009)。推测本研究中,ZxZF转录因子的导入可能是通过间接调节脯氨酸合成及代谢相关基因的表达,来增强转基因株系的渗透调节能力。而各转基因株系间某些生理指标变化存在差异,可能与转基因株系中外源基因插入位点和转录后调控等因素有关(杨金水等,1995)。
杨树,作为我国第一大造林树种和林木基因工程的模式树种,在林木遗传改良、培育林木优良品种中具有重要作用。本研究将来自极端抗旱木本植物霸王ZxZF转录因子基因成功导入欧美杨中,通过胁迫试验验证,转基因欧美杨的抗旱能力得到提高,表明ZxZF转录因子基因对提高杨树抗旱能力具有重要作用,在培育抗旱林木优良品种中具有重要育种价值。
| [1] |
崔旭东, 苏晓华, 张冰玉, 等. 2012. 欧美杨渤丰1号高效组培再生体系建立. 林业科学研究, 25(2): 157-162.( 1) 1)
|
| [2] |
李合生. 2007. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 164, 137-137, 258-260.( 1) 1)
|
| [3] |
李义良, 苏晓华, 张冰玉, 等. 2007. 外源SacB基因在银腺杂种杨基因组中的表达及抗旱性分析. 北京林业大学学报, 29(2): 1-6.( 1) 1)
|
| [4] |
苏晓华, 张冰玉,黄烈健, 等. 2003.转基因林木研究进展. 林业科学研究, 16(1): 95-103.( 1) 1)
|
| [5] |
萨姆布鲁克 J, 拉塞尔 D W. 2002. 分子克隆实验指南.3版. 北京:科学出版社.( 1) 1)
|
| [6] |
王俊英, 尹伟伦, 夏新莉. 2005. 胡杨锌指蛋白基因克隆及其结构分析. 遗传, 27(2): 245-248.( 1) 1)
|
| [7] |
严安心, 谢 瑜, 吉柔风, 等. 2012. 一个麻疯树RING型锌指蛋白基因JcRFP 1 的克隆及表达. 植物生理学报, 48(5): 456-464.( 1) 1)
|
| [8] |
杨金水, 王光清. 1995. 转基因的失活与沉默. 生物工程进展, 15 (3) :41-45.( 1) 1)
|
| [9] |
张冰玉, 苏晓华, 黄秦军, 等. 2005. 转果聚糖蔗糖转移酶基因银腺杨的获得(英文). 林业科学, 41(3): 48-53.( 1) 1)
|
| [10] |
中国科学院中国植物志编辑委员会. 1998. 中国植物志(第43卷, 第一分册). 北京: 科学出版社, 140-142.( 1) 1)
|
| [11] |
朱家红, 李辉亮, 屠发志, 等. 2006. 巴西橡胶树环锌指蛋白基因克隆及其分子特性(英文). 植物生理与分子生物学学报, 32(6): 627-633.( 1) 1)
|
| [12] |
An Y, Wang Y, Lou L, et al. 2011. A novel zinc-finger-like gene from Tamarix hispida is involved in salt and osmotic tolerance. J Plant Res, 124(6):689-97.( 1) 1)
|
| [13] |
Castonguay Y, Markhart A H. 1992. Leaf gas exchange in water-stressed common bean and tepary bean. Crop Sci, 32(4): 980-986.( 1) 1)
|
| [14] |
Davletova S, Schlauch K, Coutu J, et al. 2005. The zinc-finger protein Zat12 plays a central role in reactive oxygen and abiotic stress signaling in Arabidopsis. Plant Physiology, 139(2): 847-856.( 1) 1)
|
| [15] |
Englbrecht C C, Schoof H, Böhm S. 2004. Conservation, diversification and expansion of C2H2 zinc finger proteins in the Arabidopsis thaliana genome. BMC Genomics, 5(1):39.( 1) 1)
|
| [16] |
Hsieh T, Lee J, Charng Y, et al. 2002a. Tomato plants ectopically expressing Arabidopsis CBF 1 show enhanced resistance to water deficit stress. Plant Physiology, 130(2): 618-626.( 1) 1)
|
| [17] |
Hsieh T, Lee J, Yang P, et al. 2002b. Heterology expression of the Arabidopsis C-Repeat/Dehydration Response Element Binding Factor 1 gene confers elevated tolerance to chilling and oxidative stresses in transgenic tomato. Plant Physiology, 129(3): 1086-1094.( 1) 1)
|
| [18] |
Huang J, Sun S, Xu D, et al. 2009. Increased tolerance of rice to cold, drought and oxidative stresses mediated by the overexpression of a gene that encodes the zinc finger protein ZFP245. Biochemical and Biophysical Research Communications, 389(3): 556-561.( 2) 2)
|
| [19] |
Jain M, Tyagi A K, Khurana J P. 2008. Constitutive expression of a meiotic recombination protein gene homolog, OsTOP6A1, from rice confers abiotic stress tolerance in transgenic Arabidopsis plants. Plant Cell Reports, 27(4): 767-778.( 1) 1)
|
| [20] |
Kim J C, Lee S H, Cheong Y H, et al. 2001. A novel cold-inducible zinc finger protein from soybean, SCOF-1, enhances cold tolerance in transgenic plants. The Plant Journal, 25(3): 247-259.( 1) 1)
|
| [21] |
Li Y, Su X, Zhang B, et al. 2009. Expression of jasmonic ethylene responsive factor gene in transgenic poplar tree leads to increased salt tolerance. Tree Physiology, 29(2): 273-279.( 1) 1)
|
| [22] |
Mittler R, Kim Y, Song L, et al. 2006. Gain- and loss-of-function mutations in Zat10 enhance the tolerance of plants to abiotic stress. FEBS Letters, 580(28): 6537-6542.( 1) 1)
|
| [23] |
Mukhopadhyay A, Vij S, Tyagi A K. 2004. Overexpression of a zinc-finger protein gene from rice confers tolerance to cold, dehydration, and salt stress in transgenic tobacco. Proceedings of the National Academy of Sciences of the United States of America, 101(16): 6309-6314.( 1) 1)
|
| [24] |
Nanjo T, Kobayashi M, Yoshiba Y, et al. 1999. Biological functions of proline in morphogenesis and osmotolerance revealed in antisense transgenic Arabidopsis thaliana. Plant J, 18(2): 185-193.( 2) 2)
|
| [25] |
Ravikumar R L, Patil B S, Salimath P M. 2003. Drought tolerance in sorghum by pollen selection using osmotic stress. Euphytica, 133(3): 371-376.( 1) 1)
|
| [26] |
Sakamoto H, Araki T, Meshi T, et al. 2000. Expression of a subset of the Arabidopsis Cys2/His2-type zinc-finger protein gene family under water stress. Gene, 248(1): 23-32.( 1) 1)
|
| [27] |
Sakamoto H, Maruyama K, Sakuma Y, et al. 2004. Arabidopsis Cys2/His2-type zinc-finger proteins function as transcription repressors under drought, cold, and high-salinity stress conditions. Plant Physiology, 136(1): 2734-2746.( 1) 1)
|
| [28] |
Sinclair T R, Ludlow M M. 1986. Influence of soil water supply on the plant water balance of four tropical grain legumes. Australian Journal of Plant Physiology, 13(3): 329-341. ( 1) 1)
|
| [29] |
Sugano S, Kaminaka H, Rybka Z, et al. 2003. Stress-responsive zinc finger gene ZPT 2-3 plays a role in drought tolerance in petunia. The Plant Journal, 36(6): 830-841.( 1) 1)
|
| [30] |
Takatsuji H. 1998. Zinc-finger transcription factors in plants. Cellular and Molecular Life Sciences CMLS, 54(6): 582-596.( 1) 1)
|
| [31] |
Vogel J T, Zarka D G, Van Buskirk H A, et al. 2005. Roles of the CBF2 and ZAT12 transcription factors in configuring the low temperature transcriptome of Arabidopsis. The Plant Journal, 41(2): 195-211.( 1) 1)
|
| [32] |
Xu S, Wang X, Chen J. 2007. Zinc finger protein 1 (ThZF1) from salt cress (Thellungiella halophila) is a Cys-2/His-2-type transcription factor involved in drought and salt stress. Plant Cell Reports, 26(4): 497-506.( 1) 1)
|
| [33] |
Yamaguchi-Shinozaki K, Shinozaki K. 1994. A novel cis-acting element in an Arabidopsis gene is involved in responsiveness to drought, low-temperature, or high-salt stress. The Plant Cell Online, 6(2): 251-264.( 1) 1)
|
| [34] |
Yang X, Sun C, Hu Y, et al. 2008. Molecular cloning and characterization of a gene encoding RING zinc finger ankyrin protein from drought-tolerant Artemisia desertorum. Journal of Biosciences, 33(1): 103-112.( 1) 1)
|
| [35] |
Zhu Z, Shi J, Xu W, et al. 2013. Three ERF transcription factors from Chinese wild grapevine Vitis pseudoreticulata participate in different biotic and abiotic stress-responsive pathways. J Plant Physiol, 170(10): 923-933.( 1) 1)
|
| [36] |
Zou M, Guan Y, Ren H, et al. 2008. A bZIP transcription factor, OsABI5, is involved in rice fertility and stress tolerance. Plant Molecular Biology, 66(6): 675-683.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

