文章信息
- 杜振宇, 刘方春, 马丙尧, 董海凤, 马海林
- Du Zhenyu, Liu Fangchun, Ma Bingyao, Dong Haifeng, Ma Hailin
- 滨海盐碱地人工刺槐绒毛白蜡混交林的根系分布与细根生长
- Root Distribution and Fine Root Growth in Mixed Plantation of Robinia pseudoacacia and Fraxinus velutina in Coastal Saline-Alkali Area
- 林业科学, 2014, 50(3): 10-15
- Scientia Silvae Sinicae, 2014, 50(3): 10-15.
- DOI: 10.11707/j.1001-7488.20140302
-
文章历史
- 收稿日期:2013-01-15
- 修回日期:2014-01-14
-
作者相关文章
2. 山东农业大学资源与环境学院 泰安 271018
2. College of Resources and Environment, Shandong Agricultural University Tai'an 271018
黄河三角洲地处山东省东北部,位于渤海南部的黄河入海口沿岸地区,在环渤海地区发展中具有重要的战略地位。区域内荒漠化和土壤盐渍化严重,分布有大片盐碱化未利用的土地,生态环境极度脆弱,抗干扰能力弱,系统对外界变化的适应能力差,导致生态系统退化严重(邢尚军等,2006)。因此,在该区域开展盐碱地脆弱生态区的植被恢复和重建、森林的保护管理、盐碱地造林技术和生物改良技术研究是目前该区域经济发展和生态环境建设要解决的重点问题。
为此,该地区自20世纪80年代初开始大规模造林,主要造林树种为刺槐(Robinia pseudoacacia),其次为绒毛白蜡(Fraxinus velutina)、白榆(Ulmus pumila)和臭椿(Ailanthus altissima)等。至今刺槐保存面积达5 000 hm2,是我国现存面积最大的刺槐人工林(马凤云等,2010)。这些以刺槐为代表的人工林对于防风固沙、保持水土、涵养水源和改善气候发挥了重要作用,已成为胜利油田和东营市防风固沙的重要屏障。但目前刺槐人工林出现了大面积枯梢,甚至成片死亡,对黄河三角洲地区的防护林建设及盐碱化治理造成了巨大损失。绒毛白蜡具有较强的抗逆性能,其耐盐能力和寿命远高于其他耐盐乔木树种属(刘德玺等,2008)。在黄河三角洲地区,刺槐和绒毛白蜡混交是应用较早和栽培面积较大的造林模式。早在30年前,该地区就营造了大面积的刺槐绒毛白蜡混交林,在滨海盐碱立地环境中经过多年生长,刺槐和绒毛白蜡表现出不同的生长特征。
根系的分布是指根在空间梯度或格点上的存在,主要涉及: 根生物量、长度或表面积随土层深度的变化,距植物茎部的距离,邻体间的位置等(王进鑫等,2004)。根系的形态和分布直接反映林木对立地的利用状况,对树木的生长具有决定性作用。根系,尤其是细根,在发挥植物功能和陆地生态系统能量流动和物质循环中扮演重要角色(程瑞梅等,2012)。细根通常是指直径小于2 mm的根,具有巨大的吸收表面积,是树木吸收水分和养分的主要器官(张小全等,2000)。由于刺槐适应性强、生长快、繁殖容易、耐干旱贫瘠等特点,成为水土保持先锋树种,很多研究者对其在干旱胁迫条件下的根系生长、根系分布、细根特征等开展了较多研究,取得了很大进展(李鹏等,2002; 董三孝,2004)。但目前尚未有针对滨海盐碱立地条件下刺槐林根系分布的研究报道。绒毛白蜡具有较强的抗逆性能,在盐碱地区土壤改良和生态体系构建中发挥了重要作用,而其根系方面的研究目前仍属空白。本研究分析黄河三角洲人工刺槐绒毛白蜡混交林中不同林木的根系空间分布和细根生长特征,探讨刺槐和绒毛白蜡对盐碱立地土壤条件的适应机制,为滨海盐碱地的植被恢复和适宜树种选择提供理论依据。
1 研究区概况试验地点位于山东省东营市河口区(118°49'E,37°55'N),该地处于黄河三角洲的东北部,属于暖温带大陆季风性气候,全年平均气温12.3 ℃,全年无霜期长达206天,0 ℃以上年积温4 783.5 ℃。太阳辐射年总量5 146~5 411 MJ·m-2,平均年日照时数2 682 h,是我国日照较丰沛的地区之一。平均年降水量574.4 mm,约63.9%的降水集中于夏季(6—8月份),年蒸发量1 962.1 mm,是降水量的3.6倍。试区土壤为冲击性黄土母质在海侵母质上沉积而成,机械组成以粉沙为主,沙粘相间,层次变化复杂,地下水位约1.5 m,水质矿化度较高。天然植被以盐生、湿生的芦苇(Phragmites australis)、白茅(Imperata cylindrica)、田旋花(Convolvulus arvensis)和狗尾草(Setaria viridis)为主,人工林分主要有刺槐林、柽柳(Tamarix chinensis)林、竹柳(Salix sp.)林、绒毛白蜡林及不同类型的混交林等(邢尚军等,2006; 吴丽云等,2010)。
试验林为27年生刺槐和绒毛白蜡行状混交林(1:1),1985年春季采用1年苗营造,株行距为2.5 m×3 m,造林当年林地间作豆类。由于土壤盐渍化影响,目前林分生长状况较差,刺槐的枯梢死亡现象严重,绒毛白蜡目测无枯梢,总体长势优于刺槐,但也有很明显的缺株现象。试验林地土壤类型为盐化潮土,基本理化性状如下: pH值 8.8(土水比 1:2.5),有机质含量1.6 g·kg-1,有效氮含量75.4 mg·kg-1,有效磷含量4.0 mg·kg-1,速效钾含量92.6 mg·kg-1,水溶性盐总含量0.08%。
2 研究方法在刺槐绒毛白蜡混交林中设置30 m×20 m的标准地3块。对标准地林木逐株进行胸径、树高测定,记录树木缺失和死亡情况。在各标准地选取刺槐和绒毛白蜡标准木各3株,进行根系和根际土壤的调查取样。
根系取样采用分层分段挖掘法(王进鑫等,2004)。以6株标准木为中心,沿垂直树行方向,水平方向每50 cm为一段,分别取0~50,50~100,100~150,150~200和200~250 cm共5段,向下每20 cm为一层,分别取0~20,20~40和40~60 cm 3个层次。每一层、段土体,经破碎过筛,仔细挑拣活根,清洁根系表面之后,用游标卡尺逐一量测,按照<2,2~5和>5 mm的粗度进行分级。取<2 mm细根,采用根系形态学和结构分析系统(WINRhizo)测定根系长度、表面积、体积和平均直径等生长指标。采用氯化三苯基四氮唑法测定<2 mm细根的根系活力(西北农业大学植物生理生化教研组,1986)。然后,将各级根系分别放入80 ℃烘箱中烘干至恒质量,称质量并记录其生物量。
使用Microsoft Excel 2003计算根系生物量和细根生长指标的平均数、标准差和百分比。采用Statistics 6.0统计软件的方差分析(One-way ANOVA)和多重比较(LSD法,P<0.05)来研究不同树种在不同土层深度、不同水平距离根系生物量的差异显著性以及细根生长指标的差异显著性。利用Excel进行统计作图。
3 结果与分析 3.1 人工混交林中林木的生长情况刺槐和绒毛白蜡的生长情况调查结果见表 1。由表 1可以看出,人工混交林中绒毛白蜡的平均胸径和树高均明显大于刺槐,分别高出25.2%和38.5%。2者的保存率也存在显著差异,绒毛白蜡明显优于刺槐。
|
|
人工刺槐绒毛白蜡混交林中2种林木的根系生物量在0~20 cm土壤表层剖面具有相似的分布特征(图 1): 随着距树干距离的增加,根系生物量都呈下降趋势; 在林地土壤表层,绒毛白蜡的根系生物量显著高于刺槐; 绒毛白蜡根系的水平延伸距离也明显大于刺槐,在200~250 cm距离内仍有一定数量的根系分布。在20~40 cm土层内,绒毛白蜡根系主要分布在距树干50~100 cm距离内,在其他距离范围内均有少量分布; 刺槐根系的分布特征同在其土壤表层中的分布类似。在40~60 cm土层,刺槐和绒毛白蜡根系主要分布在距树干50~100 cm距离内,刺槐根系在0~50 cm和100~150 cm距离内有少量分布,绒毛白蜡根系在100~150 cm内也有少量分布,而在距离树干150 cm以外没有发现这2种林木的根系分布。结果表明,这2种林木的根系主要分布在0~20 cm土层,分别占根系生物量的59.8%和83.6%,其次为20~40 cm土层,而在40~60 cm土层内的根系很少,仅占根系总生物量的4.9%和3.2%。
 |
图 1 刺槐和绒毛白蜡根系生物量的水平分布
Fig. 1 Horizontal distribution of root biomass of Robinia
pseudoacacia and Fraxinus velutina in soil
|
本试验所挖掘土体内绒毛白蜡和刺槐的根系生物量分别为4 146.04 g和1 563.14 g,绒毛白蜡显著高于刺槐。由此可见,绒毛白蜡的根系较刺槐更加发达,且主要分布在0~20 cm土壤表层内,而刺槐的根系主要分布在0~40 cm土层内。
刺槐根系的水平分布范围为距树干150 cm内,在0~50,50~100和100~150 cm内的生物量分别占根系总生物量的57.4%,30.2%和12.4%; 相比之下,绒毛白蜡在0~250 cm水平距离内均有较多根系分布,主要集中在0~100 cm,占根系总生物量的55.9%。在50~250 cm内的4个等距离区段内,绒毛白蜡的根系生物量均显著高于刺槐根系,而在0~50 cm内二者无显著差异。
3.3 不同径级根系的垂直分布人工混交林中刺槐和绒毛白蜡不同径级根系的分布特征随土壤不同深度的变化状况见表 2。研究结果表明,刺槐的大于5 mm根系在0~20,20~40和40~60 cm土层中的生物量分别占根系总生物量的51.6%,32.3%和2.9%,绒毛白蜡则分别为80.4%,11.7%和2.4%。刺槐和绒毛白蜡的小于2 mm细根也主要分布在0~20 cm表层,但所占比重相对较小,分别占各自根系总生物量的4.8%和2.2%。相比之下,绒毛白蜡细根的生物量要显著高于刺槐,分别为89.72和75.4 g。
|
|
人工刺槐绒毛白蜡混交林中2种林木不同径级根系的水平分布特征与其垂直分布存在很大差异。由表 3可以看出,刺槐和绒毛白蜡根系中大于5 mm粗根主要分布在距树干0~100 cm距离内,而较细的根系则主要分布在50~100 cm距离内。两树种的2~5 mm和小于2 mm根系均是在50~100 cm范围内分布最多,其次为100~150 cm。总体而言,绒毛白蜡的3个不同径级根系在水平方向的分布距离均明显大于刺槐。
|
|
细根是根系的重要组成部分,植物生长所需的水分和养分主要是由细根从土壤中摄取(Catalin et al.,2011),细根的生长特征是判断根系吸收利用养分和水分的重要参考。表 4列出了人工刺槐绒毛白蜡混交林地0~20 cm土层中林木细根的生长指标。
|
|
由表 4分析结果可以看出,绒毛白蜡细根的生物量、长度、表面积和体积均显著大于刺槐,而平均直径与刺槐细根没有显著性差异。绒毛白蜡细根的较大表面积有利于根系从土壤中吸收养分和水分,从而促进地上部林木生长。
3.6 细根的根系活力根系活力是根系对养分吸收能力的综合体现,它的强弱直接标志着地上部分生长发育的快慢,与植物产量高低也有密切关系(王媛等,2007)。因此,在根系生物量基础上研究其活力是很有必要的。由于人工刺槐绒毛白蜡混交林的细根主要分布在距树干50~150 cm距离内土壤中,因此本研究对这一区段内林木的细根活力进行了研究。由图 2可以看出,随着土层深度增加,这2种林木细根的活力呈逐渐降低的趋势。与刺槐相比,绒毛白蜡细根的根系活力显著高于刺槐细根,在0~20,20~40和40~60 cm土层中的细根活力分别是刺槐的6.77,7.95和1.68倍。由此可见,在滨海盐碱土立地条件下绒毛白蜡细根较刺槐细根具有更强的活力。
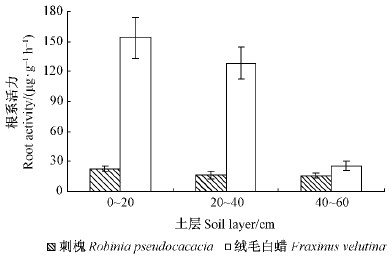 |
图 2 混交林中不同林木的细根活力
Fig. 2 Fine root viability of different trees in the mixed stands
|
由于受到黄河三角洲土壤盐渍化影响,试验地人工刺槐绒毛白蜡混交林的林木存活率较低。相比之下,绒毛白蜡的胸径、树高和存活率均显著大于刺槐,表明绒毛白蜡对滨海盐碱立地环境的适应能力要明显优于刺槐。在人工混交林生长20年时,刺槐和绒毛白蜡的保存率分别为52%和72%(曹帮华等,2008)。与7年前相比,刺槐和绒毛白蜡的保存率均有较大幅度下降,主要原因是受土壤盐渍化的持续影响,但绒毛白蜡在一定程度上也受到人为干扰。由于近几年绿化苗木市场对绒毛白蜡需求量增大,销售价格较高,尽管人工刺槐绒毛白蜡林得到管理部门的一定保护,但仍有部分绒毛白蜡被移走卖掉,从而导致绒毛白蜡存活率明显下降。
人工混交林内刺槐的根系主要分布在0~20 cm,与王俊波等(2007)和万子俊等(2010)的研究结果(20~30 cm和20~40 cm)存在差异。主要原因是立地条件的不同导致刺槐根系的垂直分布出现了较大差异。刺槐的根系有一半以上集中在表层土壤中,而40~60 cm土层中刺槐的根系生物量所占比重仅为4.9%,这可能与深层土壤含盐量较高有关(邢尚军等,2006)。
绒毛白蜡根系也主要集中在0~20 cm表层,同样以大于5 mm的粗根为主。绒毛白蜡的根系生物量80%以上分布在土壤表层,这种分布格局能够减轻土壤盐渍化对根系的危害,有利于林木生长,是导致绒毛白蜡生长状况明显优于刺槐的重要因素。国外一些研究证实,通常情况下深根型树种较浅根型树种具有更高的生产力,特别是在较差立地上。然而,在黄河三角洲滨海盐碱立地条件下,深根型树种较浅根型树种反而会更容易受到盐碱胁迫,降低其生产力。根系分布特征不仅由本身遗传特性决定,而且在很大程度上要受到所处生态环境的影响。
根系的生长是土壤水分、温度和养分综合作用的结果,既表现在不同的土壤层次之间,又表现在距树干水平方向上,而目前对刺槐和绒毛白蜡根系水平分布的研究报道甚少。有研究表明,黄土高原南部刺槐的最大有效根长和根密度在距树干30~90 cm处最大(王进鑫等,2004)。本研究表明,刺槐和绒毛白蜡根系生物量主要分布在距树干0~100 cm距离内,刺槐根系在0~50 cm距离内的生物量最大,而绒毛白蜡根系在50~100 cm的生物量最大,分别占各自根系总生物量的57.4%和32.6%。关于细根生物量与树干水平距离间关系的研究,目前结论并不一致。有的研究认为细根生物量随着距树干距离的增加而逐渐减少(Persson,1980),也有的研究表明林木的细根分布与水平距离无关(Kummerow et al.,1990)。
在黄河三角洲盐碱土壤上,人工刺槐绒毛白蜡混交林中2种林木虽然处于相同的立地环境条件,但它们在细根生长特征和根系活力上的表现存在显著差异。与刺槐相比,绒毛白蜡细根的生物量、根长、表面积、体积等生长指标明显较大,具有更强的根系活力,这可能主要是由树种本身的遗传特性决定的,这种差异也是刺槐和绒毛白蜡地上部分生长出现明显差异的重要原因之一。一些研究证实,在反映根系生长分布特征的各项指标中,根系表面积,尤其是细根,与林木生长的关系非常密切,能够更好地反映林木对土壤环境条件的利用程度(Jackson et al.,1997; 何维明,2000)。
本研究表明绒毛白蜡和刺槐2种林木根系在空间分布和细根生长特征上的差异是绒毛白蜡对滨海盐碱立地条件较刺槐具有更强适应能力的重要原因。在以后的研究中,还应进一步从更广的角度来探讨各环境因子及林分特征与林木根系生长动态间的关系,同时开展细根生产和周转研究,使盐碱胁迫环境下林木的根系研究更加深入。
| [1] |
曹帮华, 吴丽云, 宋爱云, 等. 2008. 滨海盐碱地刺槐 (Robinia pseudoacacia) 混交林土壤水盐动态. 生态学报, 28(3): 939-945.( 1) 1)
|
| [2] |
程瑞梅, 王瑞丽, 肖文发, 等. 2012. 三峡库区根系生物量的空间分布. 生态学报, 32(3): 823-832.( 1) 1)
|
| [3] |
董三孝. 2004. 渭北沟壑区人工刺槐林根系生长、分布与地上生长的关系.西北林学院学报, 19(3): 4-6.( 1) 1)
|
| [4] |
何维明. 2000. 不同生境中沙地柏根面积分布特征. 林业科学, 36(5): 15-21.( 1) 1)
|
| [5] |
李 鹏, 赵 忠, 李占斌, 等. 2002. 淳化县不同立地上刺槐根系的分布参数. 南京林业大学学报: 自然科学版, 26(5): 32-36.( 1) 1)
|
| [6] |
刘德玺, 王友平, 孙明高, 等. 2008. 不同树龄红梣营养器官中盐离子分布的研究. 四川农业大学学报, 26(3): 263-265.( 1) 1)
|
| [7] |
马凤云, 白世红, 侯本栋, 等. 2010. 黄河三角洲退化人工刺槐林地土壤特征. 中国水土保持科学, 18(2):74-79.( 1) 1)
|
| [8] |
万子俊, 万浩宇, 贺 亮, 等. 2010. 榆林南部丘陵沟壑区油松和刺槐人工林根系生物量与土壤有机碳垂直分布特征. 西北林学院学报, 25(6): 1-4.( 1) 1)
|
| [9] |
王进鑫, 王迪海, 刘广全. 2004. 刺槐和侧柏人工林有效根系密度分布规律研究. 西北植物学报, 24(12): 2208-2214.( 3) 3)
|
| [10] |
王俊波, 季志平, 自立强, 等. 2007. 刺槐人工林土壤有机碳与根系生物量的关系. 西北林学院学报, 22(4): 54-56.( 1) 1)
|
| [11] |
王 媛, 关 玲, 李顺平, 等. 2007. 根际微域环境的调节对毛白杨根系活力及抗病相关酶的影响. 中国森林病虫, 26(6): 1-4.( 1) 1)
|
| [12] |
吴丽云,曹帮华,黄彦新,等. 2010. 滨海盐碱地刺槐臭椿混交林土壤酶活性季节动态研究. 林业科学研究, 23(6): 889-894.( 1) 1)
|
| [13] |
西北农业大学植物生理生化教研组. 1986. 植物生理学实验指导. 西安: 陕西科学技术出版社.( 1) 1)
|
| [14] |
邢尚军, 张建锋. 2006. 黄河三角洲土地退化机制与植被恢复技术. 北京: 中国林业出版社.( 3) 3)
|
| [15] |
张小全, 吴可红, Murach D. 2000. 树木细根生产与周转研究方法评述. 生态学报, 20(5):875-883.( 1) 1)
|
| [16] |
Catalin P I, von Lupke B,Petritan A M. 2011. Fine roots of overstory Norway spruce (Picea abies): distribution and influence on growth of underplanted beech (Fagus sylvatica) and Douglas-fir (Pseudotsuga menziesii) saplings. Forest Systems, 20(3): 407-419.( 1) 1)
|
| [17] |
Jackson R B, Mooney H A, Schulze E D. 1997. A global budget for fine root biomass, surface area, and nutrient contents. Proceedings of the National Academy of Sciences of the United States of America, 94(14): 7362-7366.( 1) 1)
|
| [18] |
Kummerow J, Castillanos J, Maas M, et al. 1990. Production of fine roots and the seasonality of their growth in a Mexican deciduous dry forest. Plant Ecology, 90(1):73-80.( 1) 1)
|
| [19] |
Persson H. 1980. Spatial distribution of fine-root growth, mortality and decomposition in a young Scots pine stand in Central Sweden. Oikos, 34(1):77-87.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50
