文章信息
- 刘青, 汪玉凤, 赵韩生, 陈颖, 高志民
- Liu Qing, Wang Yufeng, Zhao Hansheng, Chen Ying, Gao Zhimin
- 麻竹同源异型盒基因DlKNOX1的克隆及功能初步分析
- Molecular Characteristics and Primary Functional Analysis of DlKNOX1 Gene from Dendrocalamus latiflorus
- 林业科学, 2014, 50(2): 56-62
- Scientia Silvae Sinicae, 2014, 50(2): 56-62.
- DOI: 10.11707/j.1001-7488.20140209
-
文章历史
- 收稿日期:2013-07-29
- 修回日期:2013-10-26
-
作者相关文章
2. 南京林业大学竹类研究所南京 210037
2. Bamboo Research Institute, Nanjing Forestry University Nanjing 210037
由同源异型盒基因家族(homeobox gene family)编码的蛋白作为转录因子,在生物体形态建成和细胞命运的决定中起着重要作用(Gehring et al.,1994;Williams,1998;Mukherjee et al.,2009;Mallo et al.,2010)。植物中发现的第1个同源异型盒基因是玉米(Zea mays)的Knotted-1(Vollbrecht et al.,1991),随后相继从水稻(Oryza sativa)(Matsuoka et al.,1993)、拟南芥(Arabidopsis thaliana)(Lincoln etal.,1994)、大豆(Glycine max)(Ma et al.,1994)、大麦(Hordeum vulgare)(Müller et al.,1995)、番茄(Solanum lycopersicum)(Hareven et al.,1996)和烟草(Nicotiana tabacum)(Tamaoki et al.,1997)等植物中获得,这些基因形成一个家族,即KNOX(knotted1-like homeobox)基因家族。根据基因的序列特征和表达模式,植物中的KNOX被划分为2类亚家族: KNOX Ⅰ和KNOX Ⅱ,其中KNOXⅠ在分生组织中高效表达,特别是茎顶端分生组织;KNOXⅡ在大部分组织中都表达(Kerstetter et al.,1994;Sentoku et al.,1999)。KNOX基因参与植物的生长发育和器官分化过程的多个方面,是分生组织发生与维持所必需的关键基因,调控与器官发生相关的细胞分化,最终影响侧生器官的形态建成,参与植物激素的调节等(李春苑等,2009;Hay et al.,2010)。
竹子是重要的速生植物资源,已有研究表明其顶端分生组织(shoot apical meristem,SAM)、居间分生组织具有旺盛的细胞分裂与分化能力,其速生与节间的快速伸长密切相关(熊文愈等,1980)。多数竹类植物长期处于营养生长,可在1个生长季内完成高生长和粗生长,节部形成的侧枝数量及其形态已成为竹类植物分类的重要参考依据。侧生器官形成于SAM的侧翼边缘(周围区),而位于SAM中央区下部的干细胞构成肋区,促成茎的伸长。在周围区和肋区的结构动态变化中,生长与发育的协同需要广泛的短距离和长距离细胞间的信号转导,这些信号通路涉及激素、转录因子和染色质修饰等(Castellano et al.,2005),其中KNOX Ⅰ对分生组织的形成和功能的维持至关重要。本研究以优良的速生笋材两用丛生竹种———麻竹(Dendrocalamus latiflorus)为材料,采用RT-PCR和RACE技术,从中克隆得到1个KNOX Ⅰ的同源基因,利用实时定量PCR技术对该基因的表达情况进行分析,同时通过构建植物过量表达载体,转化模式植物拟南芥对其功能进行初步分析,以期为从分子水平上揭示同源异型盒基因在竹子节部形态建成中的作用奠定基础。
1 材料与方法 1.1 试验材料麻竹2年生扦插苗盆栽于本实验室的培养室内,培养温度为25 ℃,光照200 μmol·m-2 s-1,光周期为光/暗=16 h/8 h。
1.2 总RNA分离与cDNA合成采用Trizol法(Gao et al.,2006)分别提取麻竹新根、新生枝条的幼茎和节、新生枝条顶部第3片叶的叶片和叶鞘的RNA,按照反转录试剂盒说明(Promega公司)合成cDNA,同时用SMART TM RACE试剂盒(Clontech公司)分离5'cDNA和3'cDNA。
1.3 基因分离、测序与分析根据水稻OSH1基因(AC145380)和玉米KNOTTED1基因(AY260164)DNA序列设计兼并引物,由北京六合华大基因科技股份有限公司合成。F: 5'-ATGGAGGAGATCHCCCAACACTTN-3';R: 5'-CTAGCCGAGCCDGTACAGCC-3'。PCR反应体系(20 μL): 10×Buffer 2 μL,dNTP(dATP,dTTP,dCTP和dGTP各2.5 mmol·L-1)1.6 μL,cDNA(0.04 μg·L-1)1 μL,正向引物(10 μmol·L-1)1 μL,反向引物(10 μmol·L-1)1 μL,Pyrobest酶(5 U·μL-1)0.1μL,超纯水13.3 μL。PCR产物用Biomiga公司试剂盒回收,加A后连接到Promega的pGEM-T easy载体上,转化大肠杆菌(Escherichia coli)Trans5α感受态细胞,筛选阳性克隆,由北京六合华大基因科技股份有限公司测序。
在对获得序列分析的基础上,分别设计RACE引物。5'-RACE引物5-1: 5'-AGGAGAGCCGAGTACTGGGGGTGCGAC-3';5-2: 5'-TGCAACGCGAGCGGCGAGCTGTGGTG-3'。3'-RACE引物3-1: 5'-TCAAGCACCAGCTCCTGAGGAAGTACGG-3';3-2:5'-AGGCGGCTTCCACGTCCCGGCGCTGTAC-3'。分别以5'cDNA和3'cDNA为模板,用引物5-1、 3-1分别与通用引物(UPM)配对进行第1轮PCR反应,对PCR产物电泳分析后,分别以第1轮产物为模板,用引物5-2、 3-2分别与巢式引物(NUP)配对进行PCR反应(程序参照SMART TM RACE试剂盒说明进行)。回收PCR产物中目的条带、连接到pGEM-T easy载体后送公司测序。
应用DNASTAR5.01、SMART(http:∥smart.embl-heidelberg. de/)等生物软件对测序获得cDNA序列及其编码蛋白质的结构特点进行分析,利用NCBI在线数据库比较分析目的基因序列与其他物种的一致性。
1.4 基因在麻竹不同组织中的表达检测根据已知目的基因序列设计实时荧光定量PCR的引物,RT-F: 5'-TTCTCAAGTCTCAACTCTCAATAC-3';RT-R: 5'-TGGACGGTGTCAGCATCAGCC-3'。分别以麻竹根、茎、节、叶片和叶鞘的cDNA为模板,用SYBR® Premix Ex Taq TM(TaKaRa)实时荧光定量PCR试剂盒进行试验。采用麻竹Actin(KC512910)作为内参,反应体系(20 μL):Maxima® SYBR Green Mix(2×)10 μL,Rox DyeⅡ(50×)0.4 μL,Forward/Reverse primer(10μmol·L-1)0.4 μL,cDNA 2 μL,超纯水6.8 μL。PCR反应在ABI PRISM 7500 Real-time PCR仪上进行,反应程式: 95 ℃预变性2 min;95 ℃变性30 s,61 ℃退火延伸60 s,45个循环;60 ℃收集荧光。每个反应重复3次,反应结束后,分析荧光值变化曲线和溶解曲线,并应用2-ΔΔCt算法分析PCR结果(Livak et al.,2001)。
1.5 基因植物表达载体构建根据植物表达载体pPZP的多克隆位点以及目的基因序列的酶切位点特征设计特异引物,上游引物5'端添加Xba Ⅰ酶切位点,F-1: 5'-AAtctagaATGGAGAGCTTCGCAAATCTTG-3';下游引物5'端添加BamHⅠ酶切位点,R-1: 5'-ggatccCGACCCCAGCCGGTACATGC-3'。采用高保真酶进行PCR扩增,回收的扩增产物加A后与pGEM-T easy连接,转化感受态细胞,选取阳性克隆测序。采用双酶切(XbaⅠ/BamHⅠ)将测序正确的克隆直接连入pPZP的多克隆位点,并对植物表达载体质粒进行酶切验证。
1.6 拟南芥转化、转基因植株检测与表型观察采用电击法将含有目的基因的植物表达载体质粒转入农杆菌(Agrobacterium tumefaciens)菌株GV1301感受态细胞,并转化拟南芥(徐芳等,2005)。筛选(卡那霉素50 mg·L-1)抗性植株,选择T3代没有抗性分离的株系提取RNA并反转录成cDNA,采用半定量RT-PCR方法对目的基因的表达进行检测,同时以质粒DNA和野生型拟南芥的cDNA作为对照。观察转基因植株的表型并拍照。
2 结果与分析 2.1 基因分离与序列分析用引物F和R进行扩增反应,PCR产物电泳检测显示在1 kb左右有1条特异亮带,与预测目的片段相符。经测序证实,插入片段为990 bp,初步分析为KNOX同源序列。通过第1轮PCR和第2轮巢式PCR,获得目的片段测序结果显示,5' RACE和3' RACE获得的末端序列分别为251 bp和429 bp,经过序列拼接,去掉重叠序列,得到1个1 452 bp的全长cDNA序列。该序列包含5'非翻译区106 bp、3'非翻译区353 bp、读码框993 bp,编码330个氨基酸,其预测蛋白的等电点和分子质量分别为6.384和36.910 74 kDa。蛋白结构分析表明,所编码蛋白包含1个KNOX1区(80—124)、 1个KNOX2区(132— 183)、1个ELK区(212—232)和1个Homeobox区(235—294),这与KNOXⅠ类蛋白结构(Kerstetter et al.,1994;Finn et al.,2010)相符。因此,将该基因(GenBank No. KF709955)命名为DlKNOX1(图 1)。
 |
图 1 DlKNOX1 核酸序列及编码的氨基酸序列
Fig. 1 Nucleotide sequence and deduced amino acid sequence of DlKNOX1
单下划线: KNOX1 区; 双下划线: KNOX2 区; 方框: ELK 区; 虚下划线: Homeobox 区。 Single underline: KNOX1 domain; Double underline: KNOX2 domain; Box: ELK domain; Dashed underline: Homeobox domain. |
利用NCBI在线软件blastx(http:∥blast.ncbi.nlm.nih.gov/Blastx)进行分析比较,结果显示DlKNOX1编码的蛋白与其他植物的KNOXⅠ类蛋白有较高的一致性,如与毛竹(Phyllostachys edulis)、谷子(Setaria italica)、玉米、小麦(Triticum aestivum)、大麦、水稻、拟南芥等植物KNOX蛋白的一致性都在60%以上,其中与毛竹的最高,达到89.9%。应用MEGA4软件的系统进化树分析表明,DlKNOX1与毛竹、谷子、玉米、二穗短柄草(Brachypodiumdistachyon)、节节麦(Aegilops tauschii)、小麦、乌拉尔图小麦(Triticum urartu)、水稻等单子叶植物的KNOX聚类到同一个分支,而双子叶植物卵叶天门冬(Asparagus asparagoides)、龙舌兰(Agavetequilana)、甘薯(Ipomoea batatas)、葡萄(Vitisvinifera)、毛白杨(Populus tomentosa)、拟南芥、大豆、鹰嘴豆(Cicer arietinum)、蒺藜苜蓿(Medicagotruncatula)等的KNOX则聚类在另一个分支上(图 2),这与形态学分类相吻合。
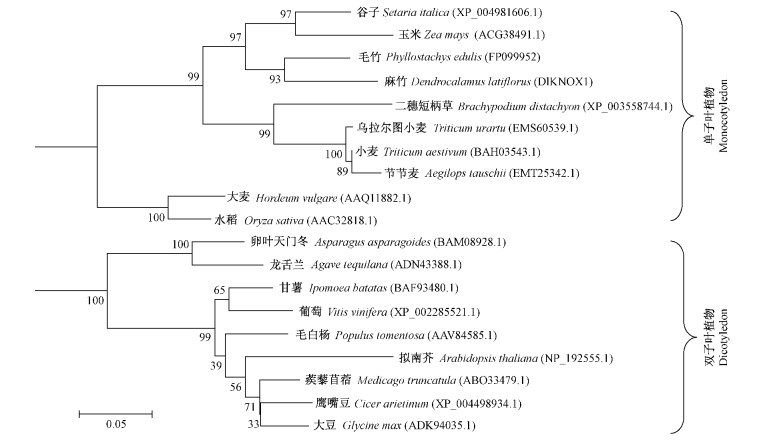 |
图 2 基于 KNOX 蛋白序列构建的系统进化树
Fig. 2 Phylogenetic tree analysis of proteins encoded by KNOX genes
每个分支上的数字表示 1 000 次重复搜索的靴带值。 Numbers on major branches indicate bootstrap estimates for 1 000 replicate analyses. |
利用实时荧光定量PCR技术对DlKNOX1基因在麻竹不同组织中的表达模式进行分析,结果表明:该基因为组成型表达,在麻竹的新根、幼茎、叶片、叶鞘、节中均检测到表达,但表达丰度存在着明显的差异,其中在节中的相对表达丰度最高,茎和叶鞘中次之,根中的表达丰度比较低,而叶片中最低(图 3)。
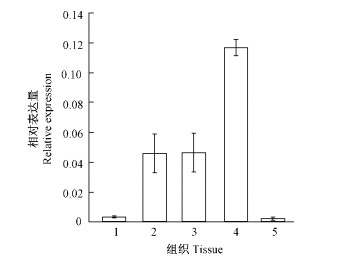 |
图 3 DlKNOX1 在麻竹不同组织中表达
Fig. 3 Expression of DlKNOX1 in different tissues of D. latiflorus
1:根;2:叶鞘;3:幼茎;4:节;5:叶。 1: Root; 2: Sheath; 3: Young stem; 4: Knob; 5: Leaf. |
为了进一步验证DlKNOX1基因的功能,构建了植物过量表达载体。转化拟南芥,对T0代进行卡那霉素抗性筛选,共获得抗性植株5个单株,对T1代单株收种并继续筛选,获得了不发生分离的T3代4个株系。RT-PCR检测结果表明,转基因植株中均含有与阳性对照一致的目的片段,而对照野生型拟南芥中没有检测到(图 4),表明DlKNOX1在转基因植株中得到了表达。
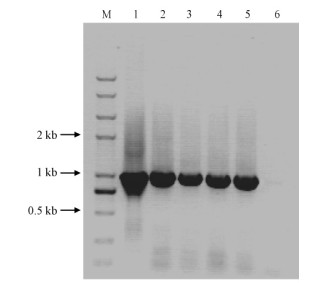 |
图 4 转 DlKNOX1 拟南芥植株 RT-PCR 检测
Fig. 4 Transgenic A. thaliana plants of DlKNOX1 checked by RT-PCR
1: 质粒对照;2 - 5: 转基因植株;6: 野生型对照。 1: Control of plasmid; 2 - 5: Transgenics; 6: Control of wild type. |
与野生型拟南芥相比(图 5A),转基因植株营养生长期明显延长,开花时间延迟,叶片出现缺刻、扭曲等;有的1个节长2个果荚(图 5B),有的果荚只生长在一侧(图 5C),有的果荚对称生长(图 5D);有的花冠呈不规则形状(图 5E);有的植株失去顶端优势,分枝数增多,无主枝和侧枝之分,发育后期生成多二级侧分(图 5F,G)。
 |
图 5 转基因拟南芥植株表型
Fig. 5 Phenotype of transgenic A. thaliana plants
A:野生型;B:双果荚;C:果荚单侧着生;D:果荚对称着生;E:不规则花冠;F, G:多分枝。 A: Wild type; B: Dual pods; C: Unilateral pods; D: Symmetrical pods; E: Irregular corolla;F, G: Multi-shoot. |
KNOX基因家族几乎存在于所有的植物中(Mukherjee et al.,2009),是分生组织发生与维持所必需的关键基因。麻竹的节部和节间的细胞几乎都能分裂,尤其是节部的居间分生组织是促进竹子快速生长的重要动力(熊文愈等,1980)。本研究对DlKNOX1表达模式的分析表明,该基因为组成型表达,但在不同部位的表达差异明显,其中在麻竹节部的表达丰度最高,是根中表达量的36.6倍,这与第1类KNOX基因主要是在分生组织中表达(Kerstetter et al.,1994)相符合。
同源异型盒基因编码蛋白的典型特征是C-端具有1个与特异DNA序列结合的高度保守结构域(Homeobox区),识别目的基因的启动子序列(Scofield et al.,2006),该蛋白作为转录因子对植物的形态建成起着重要的作用。另外,ELK区具有核定位信号功能(Meisel et al.,1996),推测能形成一种新型的两亲性螺旋,充当蛋白互作功能区域(Vollbrecht et al.,1991);但对水稻OSH15的研究表明,ELK区对核定位、蛋白互作、 DNA结合并非是必要的,可能对其靶基因具有功能抑制的作用(Nagasaki et al.,2001)。DlKNOX1基因编码的蛋白与水稻、玉米等单子叶植物具有较高的一致性,充分显示了该基因家族在进化上的保守性,且意味着它们拥有相似的功能。玉米的KNOTTED-1基因在烟草中过量表达时,产生未展开的有缺刻的花冠(Sinha et al.,1993)。DlKNOX1基因在拟南芥中过量表达时,转基因植株有的出现不规则花冠,还出现叶片缺刻、扭曲,果荚对生、双生、同侧着生,侧枝与主枝黏连,植株矮小、丛枝等现象,其中多分枝与转OSH1基因的拟南芥(Matsuoka et al.,1993)、转LeT6的番茄(Janssen et al.,1998)的表型相似,叶片缺刻与转PttKN1的矮牵牛(Petunia hybrida)(Hu et al.,2005)的表型相似,表明DlKNOX1参与了转基因拟南芥的形态建成,调控与器官发生相关的细胞分化,但其在麻竹中的功能需要进一步验证。
研究表明,KNOX基因可以调节植物中激素的表达,如KNOX基因能促进细胞分裂素合成(Ori et al.,1999;Hewelt et al.,2000;Frugis et al.,2001);细胞分裂素有助于细胞的分裂,促进植株的横向生长,这可能是导致麻竹枝条产生指状节部的原因。另外,KNOX基因和植物激素共同参与植物叶形态的调控,如生长素对KNOX基因的表达有抑制作用,反过来,KNOX基因的异位表达可干扰所处位点的生长素浓度梯度(Hay et al.,2006)。KNAT1基因在拟南芥中过量表达时,导致植株产生了具有异源分生组织的缺刻叶(Lincoln et al.,1994),这种表型在转IPT基因的烟草中也有发现(Hewelt et al.,2000)。麻竹DlKNOX1与激素间的相互调节机制尚未得到证实,尤其是其在麻竹发育过程中是如何影响激素变化的,有待于进一步深入研究。
| [1] |
李春苑, 阮美煜,贾海燕,等. 2009. 同源异型盒基因I类KNOX的表达调控及在植物形态建成中的作用. 细胞生物学杂志,31(5): 635-640.( 1) 1)
|
| [2] |
熊文愈,丁祖福,李又芬. 1980. 竹类植物的居间分生组织与节间生长Ⅰ: 秆茎的居间分生组织与节间生长. 林业科学,16(2): 81-89.( 2) 2)
|
| [3] |
徐 芳,熊爱生,彭日荷,等. 2005. 植物遗传转化的新方法: Floral Dip. 中国蔬菜,(3): 29-31.( 1) 1)
|
| [4] |
Castellano M M, Sablowski R. 2005. Intercellular signalling in the transition from stem cells to organogenesis in meristems. Curr Opin Plant Biol, 8(1): 26-31.( 1) 1)
|
| [5] |
Finn R D, Mistry J, Tate J, et al. 2010. The Pfam protein families database. Nucleic Acids Res, 38(Database issue): D211-D222.( 1) 1)
|
| [6] |
Frugis G, Giannino D, Mele G, et al. 2001. Overexpression of KNAT 1 in lettuce shifts leaf determinate growth to a shoot-like indeterminate growth associated with an accumulation of isopentenyl-type cytokinins. Plant Physiol, 126(4): 1370-1380.( 1) 1)
|
| [7] |
Gao Zhimin, Li Xueping, Li Lubin, et al. 2006. An effective method for total RNA isolation from bamboo. Chinese Forest Sci Tech, 5(3): 52-54.( 1) 1)
|
| [8] |
Gehring W J, Affolter M, Bürglin T. 1994. Homeodomain proteins. Annu Rev Biochem, 63: 487-526.( 1) 1)
|
| [9] |
Hareven D, Gutfinger T, Parnis A, et al. 1996. The making of a compound leaf: genetic manipulation of leaf architecture in tomato. Cell, 84(5): 735-744.( 1) 1)
|
| [10] |
Hay A, Barkoulas M, Tsiantis M. 2006. ASYMMETRIC LEAVES 1 and auxin activities converge to repress BREVIPEDICELLUS expression and promote leaf development in Arabidopsis. Development, 133(20): 3955-3961.( 1) 1)
|
| [11] |
Hay A, Tsiantis M. 2010. KNOX genes: versatile regulators of plant development and diversity. Development, 137(19): 3153-3165.( 1) 1)
|
| [12] |
Hewelt A, Prinsen E, Thomas M, et al. 2000. Ectopic expression of maize KNOTTED 1 results in the cytokinin-antotrophic growth of cultured tobacco tissues. Planta, 210(6): 884-889.( 2) 2)
|
| [13] |
Hu X, Wu Q F, Xie Y H, et al. 2005. Ectopic expression of the PttKN 1 gene induces alterations in the morphology of the leaves and flowers in Petunia hybrida Vilm. J Integr Plant Biol, 47(10): 1153-1158.( 1) 1)
|
| [14] |
Janssen B J, Lund L, Sinha N. 1998. Overexpression of a homeobox gene, LeT 6 , reveals indeterminate features in the tomato compound leaf. Plant Physiol, 117(3): 771-778.( 1) 1)
|
| [15] |
Kerstetter R, Vollbrecht E, Lowe B, et al. 1994. Sequence analysis and expression patterns divide the maize KNOTTED 1 -like homeobox genes into two classes. Plant Cell, 6(12): 1877-1887.( 3) 3)
|
| [16] |
Lincoln C, Long J, Yamaguchi J, et al. 1994. A KNOTTED 1 -like homeobox gene in Arabidopsis is expressed in the vegetative meristem and dramatically alters leaf morphology when overexpressed in transgenic plants. Plant Cell, 6(12): 1859-1876.( 1) 1)
|
| [17] |
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method. Methods, 25(4): 402-408.( 1) 1)
|
| [18] |
Ma H, McMullen M D, Finer J J. 1994. Identification of a homeobox containing gene with enhanced expression during soybean (Glycine max L.) somatic embryo development. Plant Mol Biol, 24(3): 465-473.( 1) 1)
|
| [19] |
Mallo M, Wellik D M, Deschamps J. 2010. Hox genes and regional patterning of the vertebrate body plan. Dev Biol, 344(1): 7-15. ( 1) 1)
|
| [20] |
Matsuoka M, Ichikawa H, Saito A, et al. 1993. Expression of a rice homeobox gene causes altered morphology of transgenic plants. Plant Cell, 5(9): 1039-1048.( 2) 2)
|
| [21] |
Meisel L, Lam E. 1996. The conserved ELK-homeodomain of KNOTTED-1 contains two regions that signal nuclear localization. Plant Mol Biol, 30(1): 1-14.( 1) 1)
|
| [22] |
Mukherjee K, Brocchieri L, Bürglin T R. 2009. A comprehensive classification and evolutionary analysis of plant homeobox genes. Mol Biol Evol, 26(12): 2775-2794. ( 2) 2)
|
| [23] |
Müller K, Romano N, Gerstner O, et al. 1995. The barley Hooded mutation caused by a duplication in a homeobox gene intron. Nature, 374(72): 7-30.( 1) 1)
|
| [24] |
Nagasaki H, Sakamoto T, Sato Y, et al. 2001. Functional analysis of the conserved domains of a rice KNOX homeodomain protein, OSH15. Plant Cell, 13(9): 2085-2098.( 1) 1)
|
| [25] |
Ori N, Juarez M T, Jackson D, et al. 1999. Leaf senescence is delayed in tobacco plants expressing the maize homoobox gene KNOTTED 1 under the control of a senescence-activated promoter. Plant Cell, 11(6): 1073-1080.( 1) 1)
|
| [26] |
Scofield S, Murray J A. 2006. KNOX gene function in plant stem cell niches. Plant Mol Biol, 60(6): 929-946.( 1) 1)
|
| [27] |
Sentoku N, Sato Y, Kurata N, et al. 1999. Regional expression of the rice KN 1 -type homeobox gene family during embryo, shoot and flower development. Plant Cell, 11(9): 1651-1664.( 1) 1)
|
| [28] |
Sinha N R,Williams R E, Hake S. 1993. Overexpression of the maize homeobox gene, KNOTFED- 1 , causes switch from determinate to indeterminate cell fates. Genes Dev, 7(5): 787-795.( 1) 1)
|
| [29] |
Tamaoki M, Kusaba S, Kano-Murakami Y, et al. 1997. Ectopic expression of a tobacco homeobox gene, NTH 15 , dramatically alters leaf morphology and hormone levels in transgenic tobacco. Plant Cell Physiol, 38(8): 917-927.( 1) 1)
|
| [30] |
Vollbrecht E, Veit B, Sinha N, et al. 1991. The developmental gene Knotted- 1 is a member of a maize homeobox gene family. Nature, 350(6315): 241-243.( 2) 2)
|
| [31] |
Williams R W. 1998. Plant homeobox genes: many functions stem from a common motif. Bioessays, 20(4): 280-282.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

