文章信息
- 吴彩娥, 范龚健, 李婷婷, 吴海霞, 徐文斌
- Wu Cai'e, Fan Gongjian, Li Tingting, Wu Haixia, Xu Wenbin
- 银杏营养贮藏蛋白质的分离纯化与结构鉴定
- Isolation, Purification and Structural Determination of Vegetative Storage Proteins in Ginkgo biloba
- 林业科学, 2014, 50(2): 37-41
- Scientia Silvae Sinicae, 2014, 50(2): 37-41.
- DOI: 10.11707/j.1001-7488.20140206
-
文章历史
- 收稿日期:2013-02-27
- 修回日期:2013-06-24
-
作者相关文章
2. 运城学院生命科学系 运城 044000
2. Department of Life Science, Yuncheng University Yuncheng 044000
营养贮藏蛋白质(vegetative storage protein,简称VSPs)能维持植物体内相对稳定的内环境,保证植物的正常生长发育,是多数落叶树种越冬期间贮藏氮素的主要形式(彭方仁等,2001)。贮藏蛋白质除了能防止树木养分损失外,还能为其生长发育提供必需的养分(董艳敏等,2007)。银杏(Ginkgo biloba)营养贮藏蛋白质主要存在于枝条的木质部和皮层中,已有研究表明银杏枝条皮层中的含量高于木质部,当年生枝条中含量高于2年生枝条(彭方仁等,2006;郭红彦,2007)。银杏营养贮藏蛋白质的细胞学特性和生化性质的研究已有报道(吴青霞等,2006;彭方仁等,2010)。郭娟等(2002)等对银杏营养贮藏蛋白质进行了准确定位,郭红彦等(2009)确定了银杏营养贮藏蛋白质的分子质量为32 kDa和36kDa。目前对银杏营养贮藏蛋白质结构与功能的关系还未见报道。为揭示银杏营养贮藏蛋白质结构与功能的关系,本文采用DEAE -SepharoseFF离子交换色谱和Sephadex G-75葡聚糖凝胶色谱分离纯化银杏营养贮藏蛋白质,并对获得的蛋白质进行结构初探,揭示其结构与功能的关系。
1 材料与方法 1.1试验材料银杏枝条于2011年12月采集于南京林业大学校园内2年生的雌株银杏健壮枝条。枝条皮层经液氮研磨成粉末、石油醚脱脂备用。
1.2 试验方法 1.2.1 银杏营养贮藏蛋白质提取及粗蛋白干粉制备蛋白提取:银杏枝条经液氮研磨,用石油醚以1: 5(m/v)的比例混匀,4 ℃脱脂。脱脂后的粉末用0.25 mol·L-1,pH 9.0的Tris-HCl缓冲液(TBS)以1: 10(m/v)的比例混匀,4 ℃浸提10 h。浸提液过滤,得到的滤液5 000 r·min-1、 4 ℃离心30 min,得到的上清液即为蛋白粗提液(蔡金星等,2007;陈振家等,2007)。
粗蛋白干粉制备:参照黄文等(2004)和徐文斌(2011)的方法并加以改进。采用80%的硫酸铵沉淀蛋白,经静止离心后得到的沉淀用少量0.01 mol·L-1 TBS(pH 8.5)溶解,转移至透析袋透析,最终得到的蛋白溶液经冷冻干燥备用。
1.2.2 36 kDa银杏营养贮藏蛋白质的分离纯化DEAE-SepharoseFF离子交换层析:将DEAESepharose FF用pH 8.5的0.5 mol·L-1 TBS洗涤平衡,真空脱气后装柱;银杏营养贮藏粗蛋白质经pH8.5的0.01 mol·L-1 TBS溶解,配制成10 mg·mL-1蛋白溶液。离子交换层析上样量为5 mL,洗脱流速为1 mL·min-1,起始缓冲液为pH 8.5的0.01 mol·L-1 TBS,极限缓冲液为pH 8.5的0.01 mol·L-1TBS,同时含0.3 mol·L-1 NaCl。调整流速让洗脱液以恒定速度流过色谱柱,分管收集洗脱液,每管收集6 mL(栾明明等,2007)。分管收集的洗脱液在280 nm测定吸光度。
Sephadex G-75凝胶层析:将预处理好的Sephadex G-75用0.01 mol·L-1 TBS(pH 8.5)洗涤平衡,真空脱气后装柱;以0.01 mol·L-1 TBS(pH 8.5)溶解银杏营养贮藏蛋白,上样体积为5 mL;调整流速让洗脱液以恒定速度流过色谱柱,蛋白质上样浓度15 mg·mL-1,上样量5 mL,洗脱液流速0.3mL·min-1,分管收集洗脱液,每管收集6 mL(王子佳等,2009)。分管收集的洗脱液在280 nm测定吸光度。
SDS-PAGE凝胶电泳:分离胶15% 、浓缩胶4.4%,上样量20 μL;电泳时,浓缩胶恒定电压60 V30 min,分离胶稳定电压120 V 90 min(郭红彦等,2007)。凝胶采用考马斯亮蓝染色法染色。所得凝胶采用Gel Doc 2000凝胶成像系统及Quantity One分析软件,根据低分子质量标准蛋白Marker分析计算。
银杏贮藏蛋白质含量的测定:在280 nm下测定蛋白溶液的吸光值,检测其浓度的变化趋势。
1.2.3 36 kDa银杏营养贮藏蛋白质的结构鉴定及数据分析1)质谱(LC-MS)检测 样品预处理:参考徐文斌等(2011)的方法并加以改进。对1.2.2中获得的银杏VSPs进行SDS-PAGE,获得目标蛋白条带,经胰酶酶解,获得银杏VSPs酶解液,进行LCMS检测。
2)傅里叶红外光谱检测 参考陈静涛等(2008)的方法,测定银杏VSPs的红外特征吸收曲线,记录4 000~400 cm-1区间背景光谱。
2 结果与分析 2.1 36 kDa银杏营养贮藏蛋白质的分离纯化 2.1.1 DEAE-Sepharose FF色谱分析DEAESepharose FF离子交换色谱如图 1所示。银杏VSPs经分离后得到Ⅰ,Ⅱ,Ⅲ和Ⅳ 4个组分,收集4个组分,浓缩后冷冻干燥,进行SDS-PAGE分析。
 |
图 1 DEAE-Sepharose FF 离子交换色谱
Fig. 1 DEAE-Sepharose FF ion-exchange chromatograph
图中曲线为银杏营养贮藏蛋白质经 DEAE-Sepharose FF 纯化时的
4 个洗脱峰,直线为线性梯度洗脱时所对应 NaCl 的浓度。 In figure the curve means four elution peaks were obtained on DEAE-Sepharose FF column chromatography of VSPs,the straight line means the concentration of NaCl in gradient elution. |
彭方仁等(2010)研究了银杏蛋白含量在1年中的动态变化规律,发现32 kDa和36 kDa蛋白质具有营养贮藏蛋白质的特征,符合营养贮藏蛋白质积累和降解受“源-库关系”调节的标准。本研究对峰Ⅰ~Ⅳ进行SDS电泳分析(图 2)。电泳结果表明:银杏32 kDa和36 kDa蛋白质存在于峰Ⅳ中,但是2种蛋白质分离效果较差,需要进一步分离。
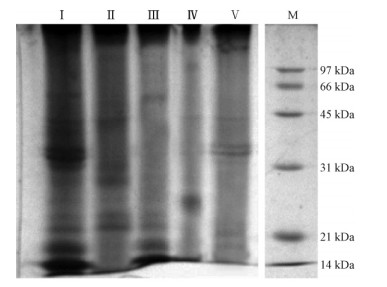 |
图 2 SDS-PAGE 电泳
Fig. 2 Result of SDS-PAGE
|
Sephadex G-75凝胶利用分子筛作用对蛋白质进行分级分离,待分离样品的上样浓度和洗脱液的流速对分离效果影响显著( Tommasi et al.,2006)。经2.1.1得到的银杏VSPs的峰Ⅳ,经Sephadex G-75凝胶色谱分离,结果如图 3所示。银杏营养贮藏蛋白质峰Ⅳ被分为3个组分,其中组分1是穿透峰,不含目标蛋白质,而Sephadex G-75的分子筛范围为3~80 kDa,因此峰2和3需进行SDS-PAGE分析,以明确32 kDa和36 kDa银杏VSPs的分布。
 |
图 3 SephadexG-75凝胶色谱
Fig. 3 Sephadex G-75 gel chromatograph
图中曲线为经DEAE-Sepharose FF分离得到的峰Ⅳ经Sephadex G- 75凝胶色谱分离所得3个洗脱峰。 In figure the curve means three elutionpeaks were obtained on Sephadex G- 75 column chromatography of peak Ⅳobtained by DEAE-Sepharose FF. |
峰2和峰3的电泳结果(图 4)表明:峰2中只存在1条36 kDa的蛋白条带,达到了电泳纯度;而峰3中则含有条带颜色较浅的32 kDa蛋白,同时也存在其他多条杂质蛋白,后续分离较为困难。因此,本研究对峰2中的36 kDa银杏VSPs进行后续质谱分析。
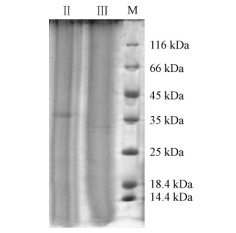 |
图 4 Sephadex G-75 色谱结果SDS-PAGE电泳分析
Fig. 4 SDS-PAGE result of ptoteins after Sephadex
G- 75 gel chromatograph
|
将2.1.2中获得的36 kDa银杏VSPs进行一级结构鉴定,通过LC-MS分析获得36 kDa银杏VSPs多条肽段的氨基酸序列。经NCBI数据库中植物贮藏蛋白库中肽质量指纹图谱比对分析发现,36 kDa银杏VSPs的2个肽段氨基酸序列与数据库中大豆(Glycine max)贮藏蛋白质(29 kDa)和薯蓣(Dioscorea opposita)块茎贮藏蛋白质(30 kDa)的部分序列完全吻合,蛋白信息和相应匹配肽段信息如表 1。
|
|
36 kDa银杏VSPs中匹配率较高的2个肽段序列氨基酸丰度见图 5,6。根据LC-MS分析结果发现,NCBI数据库中没有与36 kDa银杏VSPs完全匹配的蛋白质,但可以通过相似氨基酸序列来判断该蛋白质的部分功能特性。参考肽指纹图谱比对结果,结合NCBI网站上有关蛋白质的功能信息和结构域表明,银杏VSPs肽段KGNAGSLSINRVAYQLKRI与薯蓣块茎贮藏蛋白质部分肽段匹配部分,属于蛋白质碳酸酐酶活性结构域;而肽段RMNTGYGART- PEVKC与大豆营养贮藏蛋白质部分肽段匹配,属于酸性磷酸酶结构域。
 |
图 5 肽段 KGNAGSLSINRVAYQLKRI 相对丰度
Fig. 5 Relative abundance of peptide KGNAGSLSINRVAYQLKRI
|
 |
图 6 肽段 RMNTGYGARTPEVKC 相对丰度
Fig. 6 Relative abundance of peptide RMNTGYGARTPEVKC
|
36 kDa银杏VSPs的傅里叶红外光谱分析如图 7所示。36 kDa银杏VSPs在氢键区(4 000~2 500 cm-1)存在2个峰,其吸收频率分别为3 420.25和2 925.69 cm-1,前者是由游离的N—H键伸缩振动引起的波长吸收,后者是由—CH2结构不对称伸缩振动引起的。这也进一步说明36 kDa银杏VSPs中存在N—H和—CH2官能团,而且这些官能团是蛋白质固有的,在多种蛋白质中均能检测到。36 kDa银杏VSPs在三键和累积双键区(2 500~2 000 cm-1)出现1个峰,其吸收频率为2 141.13 cm-1,主要由伸缩振动的C≡C键所引起的波长吸收,但是该峰的透过率不高,说明36kDa银杏VSPs结构中三键所占比例不高。36 kDa银杏VSPs在双键区(2 000~1 500 cm-1)也出现2个峰,分别是由C =C键(1 635.49 cm-1)和—NO2(1 540.77 cm-1)基团的伸缩引起的波长吸收。36 kDa银杏VSPs在C—H键弯曲伸缩区(1 500 ~1 300 cm-1)存在2个峰,分别由—CH2(1 461.09cm-1)和—CH3(1 389.47 cm-1)的弯曲伸缩引起。此外,36 kDa银杏VSPs在指纹区(1 300~400cm-1)也存在2个峰(1 046.48和554.15 cm-1),前者透过率较大,是由羧基中的C =O的伸缩振动形成,后者则是由C—Br的伸缩引起的特征峰,这2个峰可以作为36 kDa银杏VSPs的特征吸收峰。
 |
图 7 36 kDa银杏VSPs红外光谱分析
Fig. 7 FT-IR spectra of 36 kDa ginkgo VSPs
|
此外,在红外光谱中沿着多肽骨架的1 700 ~1 600 cm-1之间,酰胺I带与羰基(C =O键)的拉伸振动相关结果可以预测蛋白质的二级结构。36 kDa银杏VSPs在此范围内仅有1个明显的峰,其峰值(1 635.49 cm-1)与β-折叠构象的特征曲线(1 640~1 630 cm-1)相吻合,因此可推测36 kDa银杏VSPs的二级结构以β-折叠构象为主。
3 讨论在蛋白质纯化工艺中,离子交换色谱的使用率占75%以上。本文采用离子交换剂DEAESepharose FF对银杏贮藏蛋白质进行分离纯化,但是没有获得高纯度的银杏贮藏蛋白质。张允允等(2011)采用2次葡聚糖Sephadex G-100层析,得到了高纯度的藻蓝蛋白质。本试验参考目标蛋白的分子质量后选用Sephadex G-75作为填料,对含银杏VSPs的组分Ⅳ进行了进一步分离,得到峰2和峰3,经电泳分析结果表明:峰2中仅有36 kDa 1条蛋白带,已经达到了电泳纯度;而峰3中除了32 kDa目标蛋白,还存在较多杂蛋白,需要进一步分离纯化。
由于木本植物的VSPs结构信息在蛋白质库中很少被采集,本研究获得的36 kDa银杏VSPs在蛋白质库中也没有完全匹配的蛋白质。但是,与不同来源的贮藏蛋白质相似的序列比较后发现,36 kDa的银杏VSPs具有碳酸酐酶(carbonic anhydrase,CA)和酸性磷酸酶(acid phosphatase,ACP)相似的氨基酸序列。碳酸酐酶能催化碳酸分解为二氧化碳和水,在植物体中参与CO2传导而进入羧化位点,其活性高低显著影响光合作用(黄瑾等,2010)。已有研究表明光合作用与CA活性呈正相关,据此推测,银杏VSPs可能具有光合作用酶的作用,为银杏芽萌发提供能量。酸性磷酸酶作为植物中重要的水解酶,与碳水化合物的转化、蛋白质的合成和有机磷的分解均有着密切的关系。银杏VSPs的肽段KGNAGSLSINRVAYQLKRI与大豆贮藏蛋白质结构中ACP功能域的氨基酸序列相,可能也具有ACP活性,因而可参与秋冬季银杏有机磷元素的富集。
傅里叶红外光谱结果表明:银杏VSPs中除了共有的—CH2,N—H,C =C,C≡ C等官能团之外,还发现了溴离子和硝基等特殊官能团,但是鉴于试验条件所限,未能对这些官能团作进一步的功能研究。蛋白质二级结构预测认为36 kDa银杏VSPs以β-折叠为主要的二级构象,且未发现明显的α-螺旋的特征波峰,这有待进一步分析。
| [1] |
蔡金星,刘秀凤,常学东,等.2007.蚕豆蛋白质提取分离及其物化性质研究.食品工业科技,28(10): 142-144.( 1) 1)
|
| [2] |
陈静涛,赵玉萍,徐政,等.2008.重组胶原蛋白与牛源Ⅰ型胶原蛋白红外光谱研究.材料导报,22(3): 119-121.( 1) 1)
|
| [3] |
陈振家,郝利平.2007.山西不同品种大豆贮藏蛋白提取及亚基分析.山西农业大学学报:自然科学版,27(1): 75-78.( 1) 1)
|
| [4] |
董艳敏,李小辉,晏月明.2007.小麦贮藏蛋白分子结构及其研究技术进展.麦类作物学报,27(6): 1143-1149.( 1) 1)
|
| [5] |
郭红彦.2007.银杏营养贮藏蛋白质的分离鉴定及特性研究.南京:南京林业大学博士学位论文.( 2) 2)
|
| [6] |
郭红彦,吴青霞,彭方仁.2009.银杏枝条营养贮藏蛋白质的组分及动态变化.林业科学,45(3): 24-28.( 1) 1)
|
| [7] |
郭红彦,谭鹏鹏,吴青霞.2007.银杏营养贮藏蛋白质的SDS-聚丙烯酰胺凝胶电泳研究.山西农业大学学报:自然科学版,27(1): 16-20.( 2) 2)
|
| [8] |
郭娟,彭方仁,黄金生.2002.银杏营养贮藏蛋白质的超微结构特征及季节变化.电子显微学报,21(2): 141-145.( 1) 1)
|
| [9] |
黄瑾,夏建荣,邹定辉.2010.微藻碳酸酐酶的特性及其环境调控.植物生理学通讯,46(7): 631-636.( 1) 1)
|
| [10] |
黄文,谢笔钧,王益.2004.白果蛋白的分离、纯化、理化特性及其抗氧化活性研究.中国农业科学,37(10): 1537-1545.( 1) 1)
|
| [11] |
栾明明,邬建敏,叶庆富.2007.多次循环离子交换色谱纯化Cry1Ab蛋白及其肽质量谱图的分析.浙江大学学报:理学版,34(5): 529-532.( 1) 1)
|
| [12] |
彭方仁,郭红彦,吴青霞.2010.银杏营养贮藏蛋白质的分离鉴定.林业科学,46(3): 52-56.( 2) 2)
|
| [13] |
彭方仁,郭娟,徐柏森.2001.木本植物营养贮藏蛋白质研究进展.植物学通报,18(4): 445-450.( 1) 1)
|
| [14] |
彭方仁,王改萍,郭娟.2006.银杏营养贮藏蛋白质的细胞学及生物化学元素分析.南京林业大学学报:自然科学版,30(4): 109-113.( 1) 1)
|
| [15] |
王子佳,李红梅,弓爱君,等.2009.蛋白质分离纯化方法研究进展.化学与生物工程,26(8): 8-11.( 1) 1)
|
| [16] |
吴青霞,樊莉丽,彭方仁.2006.银杏营养贮藏蛋白质的细胞学研究.林业科技开发,20(6): 19-22.( 1) 1)
|
| [17] |
徐文斌.2011.银杏营养贮藏蛋白的分离鉴定及特性研究.南京:南京林业大学硕士学位论文.( 2) 2)
|
| [18] |
徐文斌,吴彩娥,李婷婷.2011.均匀设计法优化提取银杏营养贮藏蛋白质及其电泳分析.福建农林大学学报:自然科学版,40(6): 448-452.( 2) 2)
|
| [19] |
张允允,陈敏.2011.蓝隐藻藻蓝蛋白的分离、纯化及性质研究.烟台大学学报:自然科学与工程版,24(4): 281-286.( 1) 1)
|
| [20] |
Tommasi F,Paciolla C,Pinto M C D,et al.2006.Effects of storage temperature on viability,germination and antioxidant metabolism in Ginkgo biloba L.seeds.Plant Physiology and Biochemistry,44(3): 359-368.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50
