文章信息
- 李菲菲, 李孟楼, 崔俊, 高锦明
- Li Feifei, Li Menglou, Cui Jun, Gao Jinming
- 花椒麻味素(酰胺类)含量的常规检测
- Conventional Determination of the Contents of Numbing Components (Acylamides) in Prickly Ash
- 林业科学, 2014, 50(2): 121-126
- Scientia Silvae Sinicae, 2014, 50(2): 121-126.
- DOI: 10.11707/j.1001-7488.20140217
-
文章历史
- 收稿日期:2013-05-07
- 修回日期:2013-10-19
-
作者相关文章
2. 西北农林科技大学林学院 杨凌 712100
2. College of Forestry, Northwest A & F University Yangling 712100
花椒属(Zanthoxylum)植物全世界约250种,分布于亚洲、美洲、非洲及大洋洲的热带和亚热带地区(Porter,1976;郭静,2008)。研究表明:花椒的化学成分主要有挥发油、生物碱、脂肪酸酰胺、木质素、香豆素和脂肪酸等;以花椒素为代表的链状不饱和脂肪酸酰胺是花椒特有的辛麻味成分,该类具有麻味的酰胺有8种,并统称为麻味素(Kashiwada et al.,1997;Bafi-Yeboa et al.,2005;Yang,2008)。长期以来,花椒品质的界定没有一个统一、科学的标准,其原因就在于未能找到一种快速、准确的麻味素检测方法。因此,研究花椒麻味素含量的快速检测方法,并针对不同产地不同花椒品种麻味素含量特征建立数据库,对建立花椒的质量评价体系、质量标准及品质的地理区划有着重要意义。
花椒酰胺类物质的测定和分析方法包括高效液相色谱分析、分光光度法、反相高效液相色谱法、GC-MC测定法、红外光谱法、薄层层析法、色差仪技术、微生物法等(Bayer et al.,1976;Yudkoff et al.,1982;Saleh et al.,1991;Stolcova et al.,1995;Barth,2007;Bilyk et al.,1991;Rose-Sallin et al.,2001)。但或因需要8种麻味酰胺的标准样、或分析仪器昂贵、或提取与检测操作繁琐、或稳定性与可靠性差等原因,而难以在花椒质量的常规检测中使用。为此,本文对红花椒( Z. bungeanum)和竹叶花椒(Z. armatum)麻味成分即脂肪酸酰胺总量的常规检测进行了研究。
1 材料与方法 1.1 测定原理花椒中含氮的成分有麻味素酰胺、蛋白质、游离氨基酸、生物碱等,在提取麻味素酰胺时为避免或减少同时提取出其他含氮成分,应选用乙醇作为提取溶剂(Varner et al.,1953;Rout et al.,2007;Vilkhu et al.,2008)。提取出浸膏后,用浓硫酸进行反应可将酰胺态氮转变为能够使用滴定法检测的铵态氮NH4+,而浸膏中其他含氮成分如氨基酸、蛋白质中的氮则被浓硫酸分解为N3+,不会对下一步测定花椒总酰胺含量产生影响。但由于NH4+酸性太弱(Ka=5.6×10-10),不能用NaOH标准溶液直接滴定,而应采用甲醛法进行测定(Bremner,1960;Campins-Falco et al.,2008)。
甲醛法常用于测定铵盐的含氮量,而采用甲醛法滴定花椒总酰胺的原理在于,甲醛与弱酸性酰胺的NH4+(Ka=5.6×10-10)相作用,生成质子化的六亚甲基四胺和H+,即4NH4++6HCHO=(CH2)6 N4 H++3H++6H2 O。在反应中4 molNH4+生成了4 mol的铵盐(CH2)6 N4 H+,而(CH2)6 N4 H+的Ka为7.1×10-10,酸性得到了强化,故(CH2)6 N4 H+可被NaOH准确滴定。(CH2)6 N4 H+中的氮与NaOH的化学计量数比为1,即NaOH所滴定出的(CH2)6 N4 H+量与花椒中总酰胺的含量相等。由于所提取的样品中可能含有游离酸和H+,在加入甲醛滴定之前应先以甲基红为指示剂,用NaOH将溶液中和至甲基红变为黄色(pH≈6),然后在提取液中加入甲醛,以酚酞为指示剂后方可用NaOH标准溶液滴定。
花椒麻味素含量在0.12%~0.87%,而酸碱分析方法的理论准确度可达10-3~10-7(刘雄,2003;王克强等,1989;徐刚等,1992)。花椒粉末提取浸膏中的花椒麻味物质含量与花椒粉末样相比较,浓缩率至少在10倍以上,因此,采用甲醛测定法的准确度完全能够满足花椒麻味物质含量检测的需要。
1.2 样品、主要试剂和仪器1)仪器CHJ-1磁力恒温搅拌器,KQ-100数控超声波清洗器(超声频率40 kHz,功率100 W,温度范围20~80 ℃),万分之一电子天平,RE-52旋转蒸发器,PHS-3B酸度计,300 mL/14* 2球型冷凝器一套。LC-10A分析型高效液相色谱仪(日本岛津公司)。
2)试剂邻苯二甲酸氢钾(KHC8H4O4,相对分子质量204.23),1 mol·L-1 NaOH溶液,95%乙醇,18%甲醛溶液,50%浓H2SO4,准确标定0.098 2 mol·L-1的NaOH溶液,18%(1+1)除酸甲醛,酚酞指示剂,甲基红指示剂,pH=5.0~7.0的颗粒状活性炭,蒸馏水。
3)花椒麻味素(江津、兰州、茂汶)及花椒样品花椒麻味素由重庆四面山花椒公司提供。14个产地的花椒样品:红花椒分别来自山西芮城阳城镇,陕西洛南城关、宝鸡凤县、韩城,山东淄博博山、青岛崂山,甘肃积石山县、陇南康县,湖北恩施来凤县,云南昆明,西藏朗县甲格;竹叶花椒产自云南永善、丽江永顺洲,重庆江津。测定前于50~55 ℃下恒温干燥4 h,再定量取样。花椒麻味物质标准品(8种酰胺的混合物)由西南大学食品科学学院提供。
1.3 花椒中总酰胺含量的测定1)总酰胺浸膏的提取笔者研究证实:花椒的粉碎颗粒越细碎,浸膏相对提取率越低;液料比越大,浸膏相对提取率越高(郭新荣等,2000)。预试验表明,在30 ℃下用95%乙醇浸泡花椒粉碎样1.5 h,浸膏提取率只要达到9%,其所含的花椒麻味物质就可完全被提净;提取率再高,只能增加提取浸膏中的杂质含量。资料显示,在30~80 ℃温度范围内,温度越高、浸膏提取率也越高(仝其根等,2008)。尽管花椒浸膏提取率与提取时间、液料比和温度的关系已散见于不同文献,但过去的研究未能进行该4因素的综合研究;因而参考预试验及文献中的研究结果,在保证完全提净花椒麻味物质的前提下,设置了3水平4因素正交试验提取试验,以确定最优提取条件。具体步骤如下。
粉碎待测花椒,18目筛网过筛。提取溶剂用95%乙醇,每处理称取花椒粉末样10.00 g(T1)、放入500 mL三角瓶中,按照液料比加入溶剂。设置9个处理的L9(3 4)正交设计,即提取时间A(1,2.5,4 h),液料比B(1: 5,1 : 10,1 : 15),提取温度C(30,40,50 ℃),以选择最佳的超声波辅助提取条件。提取物用布氏漏斗抽滤、旋转蒸发器浓缩,称量所得浸膏(T2,g)留用。试验结果采用方差分析方法及SPASS统计软件进行分析(Larson et al.,2004)。
2)酰胺转变为铵态氮取上述浸膏3.00 g(T3),加入球型冷凝器的锥形瓶中后用15 mL乙醇溶解,再加入20 mL的50%浓H2 SO4,120 ℃下用磁力搅拌器搅拌反应25 min。反应完全后加2 g颗粒状活性炭,100 ℃下用球型冷凝器加热回流脱色30 min,趁热过滤,滤液用蒸馏水定容至250 mL(V1)留用。
3)铵态氮含量测定采用甲醛法测定,但有改进(肖玲,2003;李荣志等,1999)。取上述滤液50 mL(V2)放入250 mL锥形瓶,加入2~3滴甲基红指示剂,用1 mol·L-1 NaOH溶液滴定至呈现黄色(PHS-3B计酸度测定使pH≈6),以除去滤液中的剩余酸;然后加入10 mL的18%甲醛溶液、 2~3滴酚酞指示剂后充分摇匀,静置5 min后用0.1 mol·L-1NaOH滴定至橙红色,并保持0.5 min内不褪色即为终点(PHS-3B酸度计测定使pH ≈ 9),记录所用0.1 mol·L-1NaOH溶液体积(V3)。该测定重复3次。
1.4 验证试验分别对重庆四面山花椒公司提供的麻味素(产地为江津、兰州、茂汶花椒),采用液相色谱和滴定法检测其总酰胺含量,以验证和校正滴定法检测结果,得出甲醛滴定法的校正系数。
1)液相色谱检测以花椒麻味素标准品为标样,采用高效液相色谱法检测(余晓琴等,2009)。
2)滴定法检测称取花椒麻味素(江津、兰州、茂汶)约0.5 g(T4),加入45 mL乙醇溶液,待溶解完全后,滤除不溶性杂质。加入20 mL的50%浓H2 SO4,在120 ℃下消化反应25 min,反应完成后加入约1 g活性炭,加热回流脱色30 min,滤纸过滤,定容至250 mL(V1)。取25 mL溶液(V' 2)3份,各加入2~3滴甲基红指示剂,其余方法与铵态氮含量测定方法相同。
1.5 不同产地的花椒的麻味物质含量测定利用上述改进和校正后的甲醛滴定法,对来自不同地区的14种花椒的麻味成分含量进行测定。
1.6 花椒中酰胺类麻味物质含量计算用滴定法测定时,每克花椒粉末样品中总酰胺含量Q(mg·g-1)=a[(∑ V3i/3)×C×14.006 7×b×T2]/(T1×T3);验证试验中,每克样品中总酰胺含量Q'(mg·g-1)=a[V NaOH-i×C×14.006 7×b']/T4。式中,V3i 为铵态氮含量测定中消耗的NaOH溶液体积(mL),C为NaOH溶液的准确标定浓度,T1为花椒粉末样质量(g),T2为花椒粉末样所得浸膏质量(g),T3为酰胺转变为铵态氮时的浸膏质量(g),T4为验证试验中花椒麻味素质量(g),V NaOH-i为验证试验中消耗的NaOH溶液体积(mL),14.006 7为N的分子量,a为系统误差矫正系数,b=V1/V2,b'=V1/V2 ',i为重复数。
2 结果与分析 2.1 花椒总酰胺超声波辅助提取条件花椒总酰胺超声波辅助提取的L9(3 4)正交试验结果如表 1所示。方差分析表明,A因素的显著值P=0.318,B因素的显著值P=0.341,C因素的显著值P=0.046,即时间和料液比对花椒总酰胺的提取效果无显著影响,温度对提取效果影响显著。因此,据表 1的直观分析,A因素应选水平2,B因素应选水平2,C因素应选水平3,最佳提取条件为A2 B2 C3,即超声波辅助提取花椒酰胺的最佳条件为: 50 ℃,料液比为1: 10,提取2.5 h。
|
|
滴定法与用液相色谱测定的花椒麻味素中的总酰胺含量如表 2所示。由图 1可知,滴定法测定值W'与液相色谱测定值q之间存在系统误差,其线型关系符合q=2.269 6W'(R2=0.978 1),即采用滴定法检测花椒总酰胺含量时,应使用校正系数2.269 6对其测定值进应校正。对表 2中滴定法测定值进行校正后与液相色谱测定值采用t检验表明,t=0.018 <t(0.0 5,16)=2.120,即液相色谱与滴定法校正测定
|
|
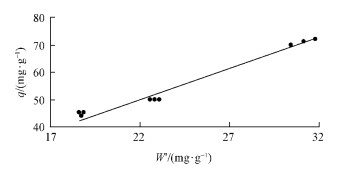 |
图 1 高效液相色谱测定值 q 与甲醛滴定法测定值 W'拟合曲线
Fig. 1 The fitting curve of HPLC detection value q and
formaldehyde titration determination value W'
|
据验证试验结果,滴定法测定时每克花椒粉末样品中总酰胺含量Q(mg·g-1)=[(∑V3i/3)×C×14.006 7×2.269 6×T2]/(T1×T3)。据此,来自全国各地14个花椒样品的酰胺含量测定结果如表 3所示。从表 3可以看出,不同花椒产区的花椒总酰胺的含量有较大差异,表现为高山区红花椒(陕西韩城、山东青岛崂山、甘肃陇南康县、陕西洛南、西藏朗县)较高于低山区(山西芮城、云南昆明、宝鸡凤县、湖北恩施来凤县、山东淄博博山)及竹叶花椒,竹叶花椒的总酰胺含量也以栽培区地势较高的为高。
|
|
自花椒粉末样中提净含有麻味物质的总酰胺浸膏,是精确检测花椒中麻味物质含量的前提。花椒总酰胺浸膏的提取有常规溶剂、微波、超临界CO2等技术,但其提取率多在7.3%~24.2%(Rout et al.,2007;郭新荣等,2000;Wang et al.,2010);而采用50 ℃、料液比为1: 10、提取2.5 h超声波辅助提取时,提取率达53.50%,为保障花椒麻味物质含量检测的可靠性提供了基础。
花椒的麻味物质为其所含的8种酰胺,目前在花椒麻味物质总含量的测定主要采用高效液相色谱、气质联用和分光光度法(Bayer et al.,1976;Yudkoff et al.,1982;Saleh et al.,1991;Stolcova et al.,1995;Barth,2007;Bilyk et al.,1991;RoseSallin et al.,2001),但均需要提取和分离技术较复杂的8种酰胺作标准品,因此该3种方法难以在花椒及其产品的质量检验中广泛使用。本研究比较了甲醛法与液相色谱法测定花椒总酰胺含量的差异,结果表明甲醛法与液相色谱法间的系统误差系数仅为2.269 6,其原因可能在于:采用液相色谱法测定时对样品质量要求相对严格,在制样过程中致使总酰胺损失较大;而甲醛法直接用总酰胺浸膏进行测定,测定过程几乎完全是化学反应过程,在花椒总酰胺转化为最终测定物质即铵盐(CH2)6 N4 H+时损耗量很小。用甲醛法对来自全国14个花椒样品的总酰胺含量测定说明,高山区红花椒>竹叶花椒>低山区红花椒。
花椒是我国传统的烹饪和食品调味料,随着中华餐饮文化逐渐被世界各国所认可,花椒调味料出口量的增加,为控制花椒及其产品质量、明确花椒调味料在餐饮品中的确切用量,建立花椒调味主成分的检测与检验方法已是需要解决的一个现实问题。在我国已建立的与花椒相关的标准当中,仅规定了含水量和挥发油含量等理化指标及测定方法,并无麻味物质含量指标及测定方法,其原因就在于未能确立切实可行的花椒麻味物质含量的检测与检验技术(LY/T 1652—2005)。因此,本研究建立的花椒麻味物质(酰胺类)总含量的快速检测技术,即甲醛滴定法,与目前国内外的花椒麻味物质测定方法相比较,本方法所使用的设备易得、检测成本较低廉,操作简单、快捷,且能够准确检测出花椒所含的总酰胺含量。与LY/T1652—2005气相和液相色谱检测技术相比较,尽管甲醛滴定法在花椒麻味物质检测中可能还存在灵敏度不高等问题,但在目前情况下本研究结果将能够为花椒麻味物质含量的快速检测与检验提供较为科学的依据。
| [1] |
郭静.2008.花椒麻味物质的分析测定方法和功能作用研究.中国调味品,33(5): 73-76.( 1) 1)
|
| [2] |
郭新荣,李孟楼,逄焕明,等.2000.花椒果皮提取超浓缩调味剂的试验研究.陕西农业科学,(9): 13-14.( 2) 2)
|
| [3] |
李荣志,李江南,刘金辉,等.1999.甲醛法测定化肥中氨态氮的研究.辽宁大学学报:自然科学版,26(1): 69-73.( 1) 1)
|
| [4] |
刘雄.2003.花椒风味物质的提取与分离技术研究.重庆:西南农业大学硕士学位论文.( 1) 1)
|
| [5] |
仝其根,闫聃,周敏.2008.花椒油树脂提取及稳定性研究.食品科技,33(12): 151-154.( 1) 1)
|
| [6] |
王克强,靳占清.1989.酸碱滴定浓度下限的理论探讨.化学通报,(9): 52-54.( 1) 1)
|
| [7] |
肖玲.2003.甲醛法测定铵盐含氮量.化工技术与开发,32(5): 25-26.( 1) 1)
|
| [8] |
徐刚,卫平,薛育成,等.1992.一种新型的极弱酸碱分析方法——固定pH滴定法.分析测试通报,11(1): 68-71.( 1) 1)
|
| [9] |
余晓琴,郑显义,阚建全,等.2009.红花椒和青花椒主要品质特征指标值的评价.食品科学,30(15): 45-48.( 1) 1)
|
| [10] |
Bafi-Yeboa N F A,Arnason J T,Baker J,et al.2005.Antifungal constituents of Northern prickly ash,Zanthoxylum americanum Mill.Phytomedicine,12(5): 370-377.( 1) 1)
|
| [11] |
Barth A.2007.Infrared spectroscopy of proteins.Biochimica et Biophysica Acta,1767(9): 1073-1101.( 2) 2)
|
| [12] |
Bayer E,Grom E,Kaltenegger B,et al.1976.Separation of amino acids by high performance liquid chromatography.Analytical Chemistry,48(8): 1106-1109.( 2) 2)
|
| [13] |
Bilyk A,Piazza G J,Bistline R G,et al.1991.Separation of cholesterol,and fatty acylglycerols,acids and amides by thin-Layer chromatography.Lipids,26(5): 405-406.( 2) 2)
|
| [14] |
Bremner J M.1960.Determination of nitrogen in soil by the Kjeldahl method.The Journal of Agricultural Science,55: 11-33.( 1) 1)
|
| [15] |
Campins-Falco P,Meseguer-Lloret S,Climent-Santamaria T,et al.2008.A microscale Kjeldahl nitrogen determination for environmental waters.Talanta,75(4):1123-1126.( 1) 1)
|
| [16] |
Kashiwada Y,Ito C,Katagiri H,et al.1997.Amides of the fruit of Zanthoxylum spp.Phytochemistry,44(6): 1125-1127.( 1) 1)
|
| [17] |
Larson R,Farber E.2004.Elementary Statistics: Picturing the World.2nd ed.Beijing: Tsinghua University Press,1-3000.( 1) 1)
|
| [18] |
Porter D M.1976.Zanthoxylum(Rutaceae)in north America north of Mexico.Brittonia,28(4): 443-447.( 1) 1)
|
| [19] |
Rose-Sallin C,Blake C J,Genoud D,et al.2001.Analytical,nutritional and clinical methods section.Comparison of microbiological and HPLC-fluorescence detection methods for determination of niacin in fortified food products.Food Chemistry,73(4): 473-480.( 2) 2)
|
| [20] |
Rout P K,Naik S N,Rao Y R,et al.2007.Extraction and composition of volatiles from Zanthoxylum rhesta: Comparison of subcritical CO2 and traditional processes.The Journal of Supercritical Fluids,42(3): 334 - 341.( 2) 2)
|
| [21] |
Saleh G A,Askal H F.1991.Spectrophotometric determination of some pharmaceutical amides through charge-transfer complexation reactions.Journal of Pharmaceutical and Biomedical Analysis,9(3): 219-224.( 2) 2)
|
| [22] |
Stolcova M,Kaszonyi A,Hronec M,et al.1995.Reversed-phase high-performance liquid chromatographic method for the quantitative determination of alkylbis(2-benzothiazolylsulfen)amides.Journal of Chromatography A,710(2): 351-356.( 2) 2)
|
| [23] |
Varner J E,Bulen W A,Vanecko S,et al.1953.Determination of ammonium,amide,nitrite,and nitrate nitrogen in plant extracts.Analytical Chemistry,25(10): 1528-1529.( 1) 1)
|
| [24] |
Vilkhu K,Mawson R,Simons L,et al.2008.Applications and opportunities for ultrasound assisted extraction in the food industry —A review.Innovative Food Science and Emerging Technologies,9(2): 161-169.( 1) 1)
|
| [25] |
Wang L,Wang Z M,Li X Y,et al.2010.Analysis of volatile compounds in the pericarp of Zanthoxylum bungeanum Maxim.by ultrasonic nebulization extraction coupled with headspace single-drop microextraction and GC-MS.Chromatographia,71(5-6): 455-459.( 1) 1)
|
| [26] |
Yang X G.2008.Aroma constituents and alkylamides of red and green Huajiao(Zanthoxylum bungeanum and Zanthoxylum schinifolium).Journal of Agricutural and Food Chemistry,56(5): 1689-1696.( 1) 1)
|
| [27] |
Yudkoff M,Nissim I,Segal S.1982.Determination of glutamine in plasma with gas chromatography-mass spectrometry.Clinica Chimica Acta,118(2/3): 159-166.( 2) 2)
|
 2014, Vol. 50
2014, Vol. 50

