文章信息
- 刘瑞强, 何宗明, 黄志群, 范少辉, 万晓华, 杜婷, 苏慧琴
- Liu Ruiqiang, He Zongming, Huang Zhiqun, Fan Shaohui, Wan Xiaohua, Du Ting, Su Huiqin
- 采伐剩余物管理对杉木人工林土壤和叶片δ15N的长期效应
- Long-Term Effects of Harvest Residue Management on Soil and Foliar δ15N of Chinese Fir Plantations
- 林业科学, 2014, 50(12): 7-13
- Scientia Silvae Sinicae, 2014, 50(12): 7-13.
- DOI: 10.11707/j.1001-7488.20141202
-
文章历史
- 收稿日期:2014-06-14
- 修回日期:2014-11-04
-
作者相关文章
2. 福建师范大学地理科学学院 福州 350007;
3. 福建农林大学林学院 福州 350002;
4. 国际竹藤中心 北京 100102;
5. 福建峡阳国有林场 南平 353005
2. College of Geographical Science, Fujian Normal University Fuzhou 350007;
3. Forestry College, Fujian Agriculture and Forestry University Fuzhou 350002;
4. International Center for Bamboo and Rattan Beijing 100102;
5. Xiayang State Forest Farm of Fujian Province Nanping 353005
森林采伐会导致土壤养分大量流失。当养分输入不足以补偿丧失的养分数量时,森林生产力变得难以维持(Corbeels et al., 2005)。保留采伐剩余物能够减少土壤养分的流失,为树木生长提供更多养分(Hernández et al., 2009)。但也有研究表明,采伐剩余物管理措施的养分效应可能因气候(Sathre et al., 2011)、土壤肥力(Hacker,2004)、处理时间长短(Fernández et al., 2009)而异。有研究发现,保留采伐剩余物能够有效促进土壤的氮循环和提高氮的有效性(Piatek et al., 1999; O′Connell et al., 2004)。但也有研究发现,在土壤肥沃的地区(Smith et al., 2000),采伐剩余物管理措施对土壤氮循环无显著影响(Fernández et al., 2009)。可见,有关采伐剩余物管理措施对土壤氮循环的影响还需要更深入、全面的研究。
土壤和叶片δ15N可以有效地指示陆地生态系统的氮循环过程(Kahmen et al., 2008; Cheng et al., 2010)。土壤中99%以上的氮素是以有机态存在,而这种形式的氮素不能直接被植物吸收,需要经过微生物的矿化作用将其转化为无机氮。在此过程中,微生物会优先利用质量较轻的14N,从而导致反应底物的15N富集(苏波等,1999)。有研究表明,土壤15N与土壤氮循环速率(Templer et al., 2007)、氮有效性(Nardoto et al., 2013)和氮损失(Callesen et al., 2013)之间具有显著的正相关性。叶片δ15N可以反映土壤δ15N和氮循环过程(Ibell et al., 2013)。在土壤氮缺乏的情况下,植物会更多地依靠菌根吸收15N贫化的有机质(Hobbie et al., 2006)。随着土壤氮循环加快和土壤氮有效性提高,植物会更多地吸收15N富集的无机氮,从而提高植物叶片的δ15N(Takebayashi et al., 2010)。
杉木(Cunninghamia lanceolata)是中国中亚热带地区最重要的造林树种之一。第七次全国森林资源清查数据表明,我国杉木人工林面积为8.54万hm2,占人工林总面积的21.4%,保存面积居人工林面积首位。杉木的大面积种植和采伐会导致土壤肥力下降和养分流失。采伐剩余物管理是一种常见的人工林经营措施,研究采伐剩余物管理措施对人工林土壤氮循环的影响具有重要意义。然而,国内尚无关于采伐剩余物管理措施对土壤氮循环影响的报道。为此,在世界林业研究中心(CIFRO)的发起和资助下,本研究在杉木中心产区福建省南平市峡阳国有林场,分析试验地不同采伐剩余物管理措施下0~40 cm土层土壤δ15N 15年数据以及造林15年后叶片δ15N和氮磷养分含量的差异,探讨采伐剩余物管理措施对杉木林土壤氮循环的长期效应,旨在为森林经营与管理提供理论依据。
1 研究区概况研究区位于福建省南平市峡阳国有林场(117°59′E,26°48′N),属于武夷山系南伸支脉,海拔200~260 m,平均坡度28°~ 36°。研究区为中亚热带海洋季风气候,年均气温19.5 ℃,1月平均气温9.7 ℃,7月平均气温28.7 ℃。年均降水量1 653 mm,多集中在3—8月,年均蒸发量1 143 mm,年均相对空气湿度83%。试验地土壤为绿泥片岩发育的山地红壤,表层疏松,土层深厚,土壤肥沃,但均含有少量的石砾。林下主要植被组成有观音座莲(Angiopteris fokiensis)、狗脊(Woodwardia japonica)和芒萁(Dicranopteris dichotoma)等。
2 研究方法 2.1 试验设计试验地前茬为29年生一代杉木纯林,1996年10月采用随机区组设计试验地,共设4个区组,每个区组设5个处理小区,小区面积为600 m2(胡振宏等,2013a)。5个处理为: 1)将采伐剩余物和地被层火烧(炼山);2)去除采伐剩余物和地被层(林下植被去除);3)清理采伐剩余物,保留地被层(全树收获);4)仅收获树干和树皮,保留采伐剩余物(保留采伐剩余物);5)保留采伐剩余物,同时将清理采伐剩余物处理样地的采伐剩余物移放至此小区(加倍采伐剩余物)。试验地1代杉木林皆伐后产生的采伐剩余物生物量为26.1 Mg·hm-2,地被层生物量为9.9 Mg·hm-2。1997年1月采用穴状整地方式进行整地,穴规格为50 cm×50 cm×40 cm(长度×宽度×深度),当年次月种植杉木1年生实生苗于穴内(平均苗高0.4 m,地径0.6 cm)。杉木种植密度为2 500株·hm-2,与生产上的常规造林密度相同。
2.2 杉木叶样品采集和分析于2011年11月在每个试验小区中根据平均树高和胸径选取4株标准木,在每株标准木树冠中部采集活叶样品。然后将同一个区组4株标准木的样品均匀混合,取混合样带回实验室。随后将树叶样品放入60 ℃的烘箱中烘干至恒质量,利用自动球磨仪将样品磨碎过0.154 mm筛。利用浓硫酸-高氯酸消煮法,钼锑抗比色法测定叶片磷含量。利用碳氮元素分析仪(Elemental Analyzer Vario ELIII)测定待测杉木叶样品的氮含量(%)。利用同位素质谱仪(Thermo Scientific MAT253)测定氮稳定同位素比率,并分别用δ15N表示,由下式(Oelbermann et al., 2002)计算得到:
δ15N(‰)=(R1-R2)/R2×1 000。
式中: R1为测定样品的15N/14N的比值; R2为大气中的15N/14N比值。
2.3 土壤样品采集与分析土样采集时间为1999(第3年),2002(第6年),2005(第9年),2008(第12年)和2011年(第15年)的12月或翌年1月,在每个小区内沿小区对角线选择12个样点,用直径为3.7 cm的土钻钻取0~ 10,10~20和20~40 cm土层土壤。同一个小区相同土层土样装入同一个自封袋带回实验室。在室内,去除土壤中的根系和石块,将土壤风干后过2 mm钢筛常温保存。土壤样品研磨后过0.154 mm钢筛。土样样品的δ15N值利用同位素质谱仪(Thermo Scientific MAT253)测定。选择测定20个小区中0~10 cm土层土壤样品的δ15N值,由于研究经费的限制,对10~20和20~40 cm土层土壤样品只选择4个区组中的1个区组测定。造林后第15年叶片15N富集指数(EF)通过下式计算得到:
EF=δ15Nfoliar-δ15Nsoil。
式中: δ15Nfoliar为15年生的叶片δ15N值; δ15Nsoil为15年生0~10 cm土层土壤δ15N值。
将2011年所取的土壤样品过2 mm筛,土壤易变性有机氮用热水浸提(Sparling et al., 1998; Huang et al., 2013a)。土壤微生物生物量碳(MBC)含量和微生物生物量氮(MBN)含量用氯仿-熏蒸浸提法测定(Huang et al., 2013b)。采用德国Elementar公司生产的碳氮元素分析仪(Vario Max)测定土壤全氮含量。造林前土壤全碳、全氮含量分别采用硫酸-重铬酸钾外加热法和凯氏定氮法分析,pH值采用水浸提-酸度计法,土壤密度采用环刀法测定。试验地造林前土壤概况见表 1。
|
|
从2002年1月份开始,在每个试验小区内随机布设7~8个凋落物收集框,框子面积为 1.0 m×0.5 m,框子离地面0.5 m。凋落物收集时间为2002(第6年)、2005(第9年)、2008(第12年)和2011年(第15年)的1-12月。每月将收集的凋落物在60℃下烘干至恒质量,然后称质量,估算月凋落物量。
2.5 数据分析采用单因素方差分析(One-way ANOVA)检验采伐剩余物管理措施对叶片δ15N、叶片δ15N富集指数、叶片氮磷养分含量和土壤养分因子的影响,重复测量方差分析(Repeated-measures ANOVA)检验采伐剩余物管理措施对土壤δ15N和凋落物量的影响。以上所有分析和作图在SPSS 17.0和Excel 2003软件上进行。
3 结果与分析 3.1 土壤δ15N的变化单因素方差分析显示,在所有取样年份采伐剩余物管理措施对土壤δ15N均无显著影响。重复测量方差分析表明,取样年份对土壤δ15N有极显著影响(P=0.001,图 1和表 2),但处理方式、处理方式和取样年份的交互效应对土壤δ15N均无显著影响(P>0.05,图 1)。土壤δ15N随取样年份的增加呈上升的趋势。造林后第15年,土壤δ15N各处理的平均值为7.5‰,显著高于造林后第3年(6.39‰)。
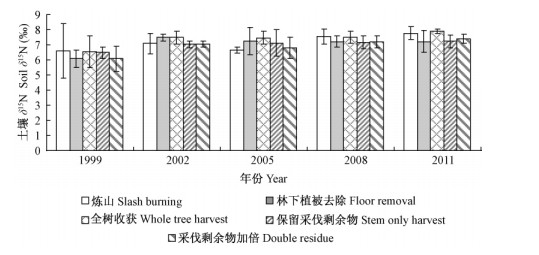 |
图 1 各年份不同处理0~10 cm土层的土壤δ15N Fig. 1 Soil δ15N at 0-10 cm soil layer under different residue treatments in each years |
|
|
从土壤δ15N的垂直变化上看,不同取样年份土壤δ15N均随土层(0~10 cm、10~20 cm和20~40 cm)增加呈显著递增趋势(P <0.05,图 2)。
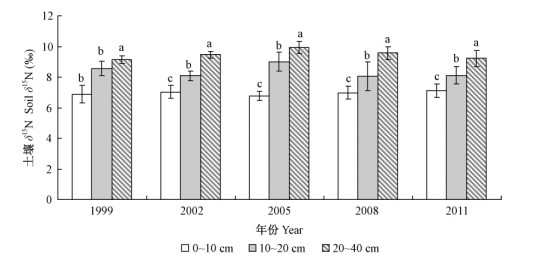 |
图 2 各年份土壤δ15N的垂直变化 Fig. 2 Soil δ15N in soil in each year |
叶片δ15N为-3.39‰~0.93‰。叶片δ15N富集指数(δ15Nfoliar-δ15Nsoil)为-7.25‰~-10.65‰。叶片氮、磷含量分别为10.3~17.1和0.45~0.95 mg·g-1。叶片氮磷比为14~26.8。单因素方差分析显示,采伐剩余物管理措施对叶片δ15N、叶片δ15N富集指数、氮和磷含量以及氮磷比均无显著影响(P>0.05,表 3)。
|
|
0~10 cm土层土壤总氮含量和热水浸提的有机氮含量平均值分别为1.72 g·kg-1和38.7 mg·kg-1。采伐剩余物管理措施对土壤总氮含量和热水浸提的有机氮含量均无显著影响(P>0.05)。相关分析显示,土壤和叶片δ15N与土壤总氮含量和热水浸提的有机氮含量均显著负相关(P<0.05,表 4)。
|
|
0~10 cm土层土壤MBC和MBN平均值分别为738和110.4 mg·kg-1。采伐剩余物管理措施对土壤MBC和MBN均无显著影响(P<0.05)。相关分析显示,土壤MBN与土壤δ15N极显著负相关(P=0.002),与叶片δ15N无显著相关性(P>0.05,表 4)。土壤和叶片δ15N与MBC均无显著相关性(P>0.05,表 4)。
3.4 凋落物量与土壤δ15N和矿质氮的关系凋落物量(造林后第6,9,12,15年)年平均值分别为0.14,0.36,2.4,和3.62 Mg·hm-2。重复测量方差分析显示,采伐剩余物管理方式对凋落物量无显著影响(P>0.05,表 2)。相关分析显示,凋落物量与土壤δ15N显著正相关。造林后第15年,土壤铵态氮和销态氮分别为7.19~13.4和0.31~2.29 μg·g-1。采伐剩余物管理方式对土壤铵态氮和销态氮含量均无显著影响。凋落物量与土壤铵态氮含量极显著正相关(P<0.01),相关系数为0.644。
4 结论与讨论土壤δ15N可以作为森林土壤氮循环相对速率的有效指标。本研究发现,所有取样年份,采伐剩余物管理措施对土壤δ15N均无显著影响。这说明,采伐剩余物管理措施可能对土壤氮矿化和氮循环无显著影响。这与Fernández等(2009)的研究结果相一致。Fernández等(2009)认为,采伐剩余物管理措施对土壤氮循环的效应受气候、降水、土壤碳氮含量等因素的影响。亚热带地区水热条件好,树木生长快速,采伐剩余物的养分释放和利用的速率快。采伐剩余物在1~3年内几乎分解殆尽(陈清山等,2008;杨玉盛等,2005)。较高的分解速率可能是造成采伐剩余物对氮循环长期效应不显著的重要原因。
土壤碳氮的初始含量是影响采伐剩余物效应的另一个重要因素(Smith et al., 2000; Hacker,2004)。在土壤碳氮养分含量低的情况下,采伐剩余物管理措施的效应会更显著,持续时间更长。Fernández等(2009)认为,较高的土壤全碳含量可能会增加土壤的氮固定,削弱采伐剩余物管理措施对土壤氮矿化的效应。本区土壤全碳、全氮含量分别是南半球同纬度湿地松人工林的2~3倍和5~10倍(Chen et al., 2005)。较高的土壤肥力可能降低采伐剩余物有机质输入的效应,导致其对土壤氮循环的影响不显著。
微生物活动是土壤氮循环的重要部分。土壤有机氮通过微生物的氨化和硝化作用转换为无机氮。微生物生物量氮是土壤的主要氮源之一,与土壤潜在净氮矿化速率显著相关(Lipson et al., 1999)。本研究中,造林15年后,采伐剩余物管理措施对土壤易变性氮库(胡振宏等,2013a)和微生物生物量碳氮(Huang et al., 2013a)均无显著影响。这可能是造成土壤δ15N和氮循环差异不显著的重要原因。土壤易变性氮库代表着最新被矿化的土壤有机质。一般研究认为,土壤易变性有机氮与土壤氮矿化速率和δ15N具有显著的正相关性(Ros et al., 2011)。但也有研究发现,土壤易变性有机氮与土壤δ15N显著的相关(Ibell et al., 2013)。Ibell等(2013)发现,剩余物的有机质输入能够显著提高土壤易变性碳氮库。但易变性碳输入可能提高了土壤的碳氮比,从而降低了土壤的氮循环。本研究发现,造林后第15年,土壤δ15N与土壤易变性有机氮、总氮和微生物生物量氮含量均显著负相关,与Ibell等(2013)的研究结果相一致。这可能是由于采伐剩余物的易变性碳输入提高了土壤碳氮比,从而抑制了土壤的氮循环。
凋落物的有机质输入会影响土壤氮循环。李茂金等(2012)研究发现,凋落物添加/移除会显著提高/降低土壤的净氮矿化水平。本研究中,一代杉木林皆伐后产生的采伐剩余物生物量约为26.1 Mg·hm-2,并且大部分在第1次取样前已经分解(陈清山等,2008)。造林后6~15年间,总凋落物量平均值为15.7 Mg·hm-2。相关性分析发现,凋落物量与土壤δ15N和土壤矿质氮均呈显著相关性(P<0.05)。这说明,凋落物量对土壤氮循环具有显著的影响。方差分析显示,所有取样年份,采伐剩余物管理措施对凋落物量均无显著影响(Huang et al., 2013a)。凋落物的有机质输入可能掩盖了采伐剩余物对土壤氮循环的效应。
叶片δ15N可以作为森林土壤氮循环相对速率的另一种有效指标。许多研究发现,叶片δ15N与土壤氮库(Gebauer et al., 1991; Emmett et al., 1998)、氮循环速率(Schafer et al., 2010; Pardo et al., 2006)和氮损失(Chen et al., 2006)均显著正相关。叶片δ15N主要受土壤无机氮含量和菌根作用的影响。有研究发现,在受氮限制的情况下,陆地植物多数会形成菌根来吸收养分(Hobbie et al., 2006)。外生菌根可以直接吸收土壤和凋落物层中的可溶性有机氮。由于15N的分馏作用会使得菌丝产生15N富集和受菌丝侵染的菌根15N贫化,进而降低叶片δ15N。叶片δ15N同土壤δ15N间的差值越小,菌根真菌对氮素的分馏作用越弱,土壤无机氮含量越高。有研究指出,叶片δ15N富集指数(叶片δ15N-土壤δ15N)可以指示植物菌根侵染状况(Hobbie et al., 2006)、土壤无机氮相对含量(Cheng et al., 2010)和生态系统氮饱和程度(Garten et al., 1994)。本研究造林后第15年,采伐剩余物管理措施对叶片δ15N和δ15N富集指数均无显著影响。这说明不同采伐剩余物管理措施下菌根侵染状况无显著差异。同时也说明,采伐剩余物管理措施对土壤无机氮和氮循环的长期影响不显著。
叶片氮含量反映了植物对土壤氮养分状况的适应情况(Güsewell,2004),可以指示土壤可利用性氮的含量。本研究中造林后第15年,采伐剩余物管理措施对叶片氮含量和矿质氮(Huang et al., 2013a)均无显著影响。这表明采伐剩余物管理措施对土壤可利用性氮的长期影响不显著。土壤是植物生长的重要环境因子之一,植物主要通过根部从土壤中吸收养分,然后再运输到各个部位。叶片氮磷比通常用来作为描述氮和磷相对限制的指标。当氮磷比小于14时,植物生长主要受氮限制;当氮磷比为14~16时,植物生长受氮和磷共同限制;当氮磷比大于16时,植物生长主要受磷限制(任书杰等,2008)。本研究中叶片氮磷比为14~26.8。这说明杉木人工林生产力受氮和磷养分因子的共同限制,但土壤磷可能对杉木的生长起更大的限制作用(氮磷比的平均值为17.7,大于16)。这一研究结果与刘兴诏等(2010)的研究结果相一致。土壤磷的缺乏可能会限制树木对土壤氮素的吸收和树木养分的循环。这也可能会限制采伐剩余物对土壤氮循环的长期效应。
| [1] |
陈清山,何宗明,范少辉,等. 2006. 29年生杉木林采伐剩余物长期分解速率. 福建林学院学报,26(3): 202-205.( 2) 2)
|
| [2] |
胡振宏,范少辉,黄志群,等. 2013. 采伐剩余物管理措施对杉木人工林土壤呼吸的影响. 林业科学,49(5): 25-29.( 2) 2)
|
| [3] |
李茂金,闫文德,李树战,等. 2012. 改变碳源输入对针阔叶混交林土壤氮矿化的影响. 中南林业科技大学学报,32(5): 108-112.( 1) 1)
|
| [4] |
刘兴诏,周国逸,张德强,等. 2010. 天童常绿阔叶林不同演替阶段常见种叶片N、P化学计量学特征. 植物生态学报,34(1): 64-71.( 1) 1)
|
| [5] |
任书杰,于贵瑞,陶 波,等. 2008. 中国东部南北样带 654 种植物叶片氮和磷的化学计量学特征研究. 环境科学,28(12): 2665-2673.( 1) 1)
|
| [6] |
苏波,韩兴国,黄建辉. 1999. 15N自然丰度法在生态系统氮素循环研究中的应用. 生态学报, 19(3): 408-416.( 1) 1)
|
| [7] |
杨玉盛,陈光水,王小国,等. 2005. 皆伐对杉木人工林土壤呼吸的影响. 土壤学报, 42(4): 584-590.( 1) 1)
|
| [8] |
Callesen I,Nilsson L O,Schmidt I K,et al. 2013. The natural abundance of 15N in litter and soil profiles under six temperate tree species: N cycling depends on tree species traits and site fertility. Plant and Soil, 368(1): 375-392.( 1) 1)
|
| [9] |
Chen C R,Xu Z H. 2005. Soil carbon and nitrogen pools and microbial properties in a 6-year-old slash pine plantation of subtropical Australia: impacts of harvest residue management. Forest Ecology and Management, 206(1): 237-247.( 1) 1)
|
| [10] |
Chen Y,Högberg P. 2006. Gross nitrogen mineralization rates still high 14 years after suspension of N input to a N-saturated forest. Soil Biology and Biochemistry, 38(7): 2001-2003.( 1) 1)
|
| [11] |
Cheng S L,Fang H J,Yu G R,et al. 2010. Foliar and soil 15N natural abundances provide field evidence on nitrogen dynamics in temperate and boreal forest ecosystems. Plant and Soil, 337(1/2): 285-297.( 2) 2)
|
| [12] |
Corbeels M,McMurtrie R E,Pepper D A,et al. 2005. Long-term changes in productivity of eucalypt plantations under different harvest residue and nitrogen management practices: a modelling analysis. Forest Ecology and Management, 217(1): 1-18.( 1) 1)
|
| [13] |
Emmett B A,Kjønaas O J,Gundersen P,et al. 1998. Natural abundance of 15N in forests across a nitrogen deposition gradient. Forest Ecology and Management, 101(1): 9-18.( 1) 1)
|
| [14] |
Fernández C,Vega J A,Bará S,et al. 2009. Nitrogen mineralization after clearcutting and residue management in a second rotation Eucalyptus globulus Labill. stand in Galicia (NW Spain). Annals of Forest Science, 66(8): 807.( 4) 4)
|
| [15] |
Garten Jr C T,Miegroet H V. 1994. Relationships between soil nitrogen dynamics and natural 15N abundance in plant foliage from Great Smoky Mountains National Park. Canadian Journal of Forest Research, 24(8): 1636-1645.( 1) 1)
|
| [16] |
Gebauer G,Schulze E D. 1991. Carbon and nitrogen isotope ratios in different compartments of a healthy and a declining Picea abies forest in the Fichtelgebirge, N E Bavaria. Oecologia, 87(2): 198-207.( 1) 1)
|
| [17] |
Güsewell S. 2004. N:P ratios in terrestrial plants: variation and functional significance. New Phytologist, 164(2): 243-266.( 1) 1)
|
| [18] |
Hacker J J. 2004. Effects of logging residue removal on forest sites: a literature review. West Central Regional Planning Commission, 261(11): 1919-1927.( 2) 2)
|
| [19] |
Hernández J,del Pino A,Salvo L,et al. 2009. Nutrient export and harvest residue decomposition patterns of a Eucalyptus dunnii Maiden plantation in temperate climate of Uruguay. Forest Ecology and Management, 258(2): 92-99.( 1) 1)
|
| [20] |
Hobbie J E,Hobbie E A. 2006. 15N in symbiotic fungi and plants estimates nitrogen and carbon flux rates in arctic tundra. Ecology, 87(4): 816-822.( 3) 3)
|
| [21] |
Huang Z Q,He Z M,Wan X H,et al. 2013a. Harvest residue management effects on tree growth and ecosystem carbon in a Chinese fir plantation in subtropical China. Plant and Soil, 364(1): 303-314.( 4) 4)
|
| [22] |
Huang Z Q,Wan X H,He Z M,et al. 2013b. Soil microbial biomass, community composition and soil nitrogen cycling in relation to tree species in subtropical China. Soil Biology and Biochemistry, 62: 68-75.( 1) 1)
|
| [23] |
Ibell P T,Xu Z H,Blumfield T J. 2013. The influence of weed control on foliar δ15N, δ13C and tree growth in an 8 year-old exotic pine plantation of subtropical Australia. Plant and Soil, 369(1/2): 199-217.( 3) 3)
|
| [24] |
Kahmen A,Wanek W,Buchmann N. 2008. Foliar δ15N values characterize soil N cycling and reflect nitrate or ammonium preference of plants along a temperate grassland gradient. Oecologia, 156(4): 861-870.( 1) 1)
|
| [25] |
Lipson D A,Schmidt S K,Monson R K. 1999. Links between microbial population dynamics and nitrogen availability in an alpine ecosystem. Ecology, 80(5): 1623-1631.( 1) 1)
|
| [26] |
Nardoto G B,Quesada C A,Patiño S,et al. 2013. Basin-wide variations in Amazon forest nitrogen-cycling characteristics as inferred from plant and soil 15N: 14N measurements. Plant Ecology & Diversity, 7(1/2): 173-187.( 1) 1)
|
| [27] |
O'Connell A M,Grove T S,Mendham D S,et al. 2004. Impact of harvest residue management on soil nitrogen dynamics in Eucalyptus globulus plantations in south western Australia. Soil Biology and Biochemistry, 36(1): 39-48.( 1) 1)
|
| [28] |
Oelbermann K, Scheu S. 2002. Stable isotope enrichment (δ15N and δ13C) in a generalist predator (Pardosa lugubris, Araneae: Lycosidae): effects of prey quality. Oecologia, 130(3): 337-344.( 1) 1)
|
| [29] |
Pardo L,Templer P,Goodale C,et al. 2006. Regional assessment of N saturation using foliar and root δ15N. Biogeochemistry, 80(2): 143-171.( 1) 1)
|
| [30] |
Piatek K B,Allen H L. 1999. Nitrogen mineralization in a pine plantation fifteen years after harvesting and site preparation. Soil Science Society of America Journal, 63(4): 990-998.( 1) 1)
|
| [31] |
Ros G H, Temminghoff E J M, Hoffland E. 2011. Nitrogen mineralization: a review and meta-analysis of the predictive value of soil tests. European Journal of Soil Science, 62(1): 162-173.( 1) 1)
|
| [32] |
Sathre R,Gustavsson L. 2011. Time-dependent climate benefits of using forest residues to substitute fossil fuels. Biomass and Bioenergy, 35(7): 2506-2516.( 1) 1)
|
| [33] |
Schafer J L,Mack M C. 2010. Short-term effects of fire on soil and plant nutrients in palmetto flatwoods. Plant and Soil, 334 (1/2): 433-447.( 1) 1)
|
| [34] |
Smith C T,Lowe A T,Skinner M F,et al. 2000. Response of radiata pine forests to residue management and fertilisation across a fertility gradient in New Zealand. Forest Ecology and Management, 138(1): 203-223.( 2) 2)
|
| [35] |
Sparling G,Vojvodi Dć -Vukovi Dć M,Schipper L A. 1998. Hot-water-soluble C as a simple measure of labile soil organic matter: the relationship with microbial biomass C. Soil Biology and Biochemistry, 30(10): 1469-1472.( 1) 1)
|
| [36] |
Takebayashi Y,Koba K,Sasaki Y,et al. 2010. The natural abundance of 15N in plant and soil-available N indicates a shift of main plant N resources to NO3- from NH4+ along the N leaching gradient. Rapid Communications in Mass Spectrometry, 24(7): 1001-1008.( 1) 1)
|
| [37] |
Templer P H,Arthur M A,Lovett G M,et al. 2007. Plant and soil natural abundance δ 15N: indicators of relative rates of nitrogen cycling in temperate forest ecosystems. Oecologia, 153(2): 399-406.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

