文章信息
- 史倩倩, 周琳, 王雁
- Shi Qianqian, Zhou Lin, Wang Yan
- 云南野生黄牡丹谷胱甘肽转移酶(GST)基因的分离及表达分析
- Isolation and Expression Analysis of GST Gene Encoding Glutathione S-Transferase of Paeonia delavayi var. lutea Wild Population in Yunnan
- 林业科学, 2014, 50(12): 63-72
- Scientia Silvae Sinicae, 2014, 50(12): 63-72.
- DOI: 10.11707/j.1001-7488.20141209
-
文章历史
- 收稿日期:2014-06-17
- 修回日期:2014-07-27
-
作者相关文章
植物谷胱甘肽转移酶(glutathione S-transferases,GSTs)是由多个基因编码、具有多种功能的超家族酶,根据蛋白质同源性和基因组结构,分为U(tau)、T(theta)、F(phi)、Z(zeta)、L(lamda)5类(Buetler et al., 1992),在植物的初级和次级代谢、胁迫和信号传导过程中具有许多不同的功能(Moons,2003)。
花色作为观赏植物的一个重要观赏性状,也是观赏植物重要的品质指标之一。因此,培育具有新型花色的新品种一直是观赏植物育种领域的研究热点。花色素是决定花色的主要色素(Harborne et al., 2000),能控制花的黄色、橘黄、红色、紫色和蓝色等颜色的形成,其在细胞质中合成,然后转运到液泡。花色素在液泡中的积累对花色的形成和改变具有重要作用(Winkel-Shirley,1999; Winkel,2004; Grotewold,2004)。另外,矮牵牛(Petunia hybrida)的花色素甲基转移酶(Jonsson et al., 1983)及龙胆(Gentiana scabra)和紫苏(Perilla frutescens)的花色素酰基转移酶(Fujiwara et al., 1998; Yonekura-Sakakibara et al., 2000)在细胞质中的定位证明了所有花色素被转运到液泡中。
前人研究证明,谷胱甘肽转移酶家族(GSTs)的一些成员参与了花色素的运输。例如,在玉米(Zea mays)中,由于BZ2基因的敲除突变,导致了花色素只在细胞质中积累(Mueller et al., 2001; Goodman et al., 2004)。后来花色素转运 GSTs基因还在其他物种中发现,如拟南芥(Arabidopsis thaliana)AtTT19(Kitamura et al., 2004)、矮牵牛PhAn9(Alfenito et al., 1998)、葡萄(Vitis vinifera)VvGST4(Conn et al., 2008)、紫苏PfGST1(Yamazaki et al., 2008)、仙客来(Cyclamen persicum)CkmGST3(Kitamura et al., 2012)、香石竹(Dianthus caryophyllus)DcGSTF2(Larsen et al., 2003; Sasaki et al., 2012)和瓜叶菊(Senecio cruentus)ScGSTs(金雪花等,2013)等。
云南野生黄牡丹(Paeonia delavayi var. lutea)作为中国西南地区特有种,是具有极高观赏价值的特有园艺资源和极高药用价值的药材资源。因其花为黄色,在牡丹花色改良研究中具有重要地位(王志芳等,2007)。目前牡丹(P. suffruticosa)品种‘彩绘’(P. suffruticosa ‘Cai Hui’)的花色素合成途径的部分结构基因虽已被分离及验证,但黄牡丹花瓣的研究仅局限在花色素成分的分析上(周琳,2010; 周琳等,2011),并且关于黄牡丹的花色素代谢途径的基因和GSTs基因还未见报道。本研究根据黄牡丹转录组测序获得的Unigene信息设计特异性引物,结合RACE技术和RT-PCR技术,克隆并筛选出与花色素相关的候选基因PlGST5,并对其在不同花色不同开放时期和盛开期的不同组织中的表达模式进行分析,为研究花色素转运机制,探讨牡丹黄色花形成机制奠定基础。
1 材料与方法 1.1 试验材料4月底至5月上旬,于滇西北香格里拉县城以西25 km左右的滑雪场附近(27°57′N,99°35′E),采集黄牡丹和紫牡丹(P.delavayi)5个时期(硬蕾期、圆桃期、透色期、初开期和盛开期)的花瓣(图 1 A)及盛开期的叶片、茎、萼片、雄蕊和雌蕊,并剪下盛开期花瓣的紫色斑纹,分别用锡箔纸包好,立即用液氮速冻后于-80 ℃冰箱中保存备用;采用同样的方法于中国林业科学研究院的玉泉山牡丹圃中采集牡丹品种‘赵粉’(P.suffruticosa ‘Zhao Fen’)(粉色)和‘玉板白’(P.suffruticosa ‘Yu Banbai’)(白色)(图 1 B)的5个时期(硬蕾期、圆桃期、透色期、初开期和盛开期)的花瓣及盛开期的叶片、茎、萼片、雄蕊和雌蕊,并保存于-80 ℃冰箱中。
 |
图 1 试验材料
Fig. 1 The materials for this experiment
A: 黄牡丹花的5个发育阶段;B:不同花色的牡丹. A: Five flower developmental stages of P. delavayi var. lutea; B: Tree peony with dfferent flower colors. |
采用改进的CTAB法(孟丽等,2006)提取试验材料的总RNA。检测质量合格后,以1 μg总RNA为模板,利用Promega公司的M-MLV反转录酶合成cDNA第1链; 然后根据转录组数据中的Unigene信息设计特异引物(表 1)。PCR扩增产物通过1.0%琼脂糖凝胶电泳检测、回收,然后连接到PMD-T19载体(Takara)上,再转化到大肠杆菌(Escherichia coli)感受态细胞TOP10,经蓝白斑筛选,由北京中美泰和科技公司进行测序。其中引物设计采用PrimerPremier5.0和DNAMAN(ver.6.0.3.99)软件进行。除RACE试验中通用引物为试剂盒附带以外(序列见SMARTTMRACE cDNA Amplification Kit说明书),其余各基因扩增引物(表 1)委托上海生工生物公司合成。
|
|
用DNAMAN6.0软件进行氨基酸序列相似性比对,并在ExPASY Protparam(http://www.expasy.org/compute_pi/)上运用ComputePI/Mw软件预测编码蛋白的分子量及理论等电点。利用NCBI数据库(http://www.ncbi.nlm.nih.gov/structure/cdd/.wrpsb.cgi)预测编码蛋白的保守结构域和MEGA5.2.2软件中的Neighbor-Joining(邻位相连,NJ)法构建系统进化树。
1.4 表达模式分析采用RT-PCR技术分析PlGST1,PlGST5,PlGST6,PlGST7,PlGST8在黄牡丹、紫牡丹、‘赵粉’和‘玉板白’的花瓣不同发育阶段的表达模式。同样以Helicase为内参基因,应用qRT-PCR法分析PlGST1-10在不同发育阶段和不同组织的表达模式,引物序列见表 1。参照TaKaRa公司的荧光定量试剂盒STBR PrimeScriptTMRT-PCR Kit说明书,建立20 μL反应体系(表 2)。荧光定量PCR在Roche Light Cyder 480实时定量PCR仪上进行,反应程序为: 95 ℃ 30 s; 95 ℃ 5 s,60 ℃ 30 s,40个循环; 然后通过加热扩增产物60 ℃至95 ℃,获得溶解曲线。采用Livak等(2001)的2-△△CT法计算目的基因的相对表达量。所有的qRT-PCR反应均进行生物学重复和技术重复(每个样品3个生物学重复,每个生物学重复3个技术重复)。
|
|
对本课题组前期构建的黄牡丹花瓣转录组数据库(未发表)分析发现有19个Unigene与GSTs基因同源性较高(表 3)。但其中同一Unigene的不同Contig的序列基本相同,如CL7322.Contig1与CL7322.Contig2,3,4,5的序列一致,CL5164.Contig1与CL5164.Contig2序列完全相同,因此推测10个序列可能与参与花色素运输的GST酶有关。根据Unigene信息设计特异引物,进行PCR扩增,将得到的10个GST成员分别命名为PlGST1-10。将这10个GST成员编码的氨基酸序列与拟南芥GSTs成员(Wagner et al., 2002;Kitamura et al., 2004)和其他与花色素相关的GSTs成员构建系统进化树(图 2)。由图可见: PlGST2,PlGST3,PlGST4,PlGST9,PlGST10先聚类在一起,然后与PlGST1聚在tau型(AtGSTU)分支上;PlGST5,PlGST8与拟南芥phi型(AtGSTF)聚在一支;PlGST6,PlGST7与拟南芥theta型(AtGSTT)聚类在一起。分析发现PlGST5与花色素相关GST(AtTT19,DcGSTF2,PfGST1,VvGST4,CkmGST3和PhAn9)的同源性最高。
|
|
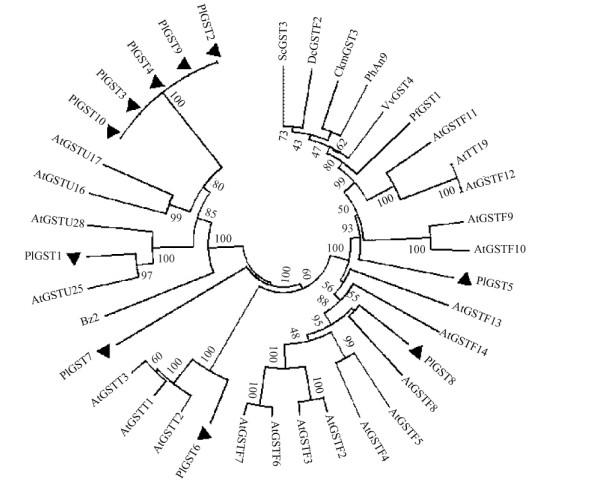 |
图 2 PlGSTs和不同物种GSTs的系统进化树 Fig. 2 The phylogenetic tree derived from deduced amino acid sequences of PlGSTs and other known GSTs AtGSTU: tau型tau type; AtGSTF: phi型phi type; AtGSTT: theta型theta type. Pl: 黄牡丹 P. delavayi var. lutea; At: 拟南芥 Arabidopsis thaliana; Pf: 紫苏Perilla frutescens; Vv: 葡萄 Vitis vinifera; Ph: 矮牵牛Petunia hybrida; Ckm: 仙客来Cyclamen persicum; Dc: 香石竹 Dianthus caryophyllus; Sc: 瓜叶菊Senecio cruentus. |
利用RT-PCR技术,对进化树中与其他物种花色素转运相关GST关系较近的PlGST5和另外4个聚在同一大分支上的PlGST基因在4个花色牡丹花瓣的不同发育时期中的表达模式进行分析,结果显示PlGST5在黄牡丹和紫牡丹中的表达量比在‘赵粉’和‘玉板白’中高很多,且除了在‘玉板白’的硬蕾期(第1阶段)有少量表达外,在其他4个发育阶段中几乎无表达(图 3)。而PlGST6,PlGST7,PlGST8的表达模式基本无变化,可断定为组成型表达;PlGST1基因在不同花色不同发育阶段的表达模式基本上没有规律(图 3)。因此推测PlGST5可能与牡丹的花色素转运相关。
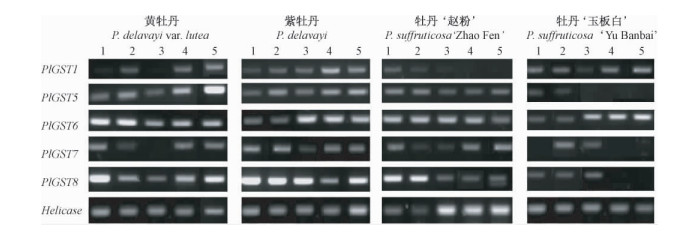 |
图 3 PlGST1,5,6,7,8在不同花色花瓣的5个发育时期的表达模式 Fig. 3 The expression pattern of PlGST1,5,6,7,8 in tree peony petals with different flower color 1-5: 牡丹花瓣发育阶段 Developmental stages of tree peony flowers 1: 硬蕾期;2:圆蕾期;3:透色期;4:初开期;5:盛开期。 下同。 1: Unpigmented tight bud; 2: Slightly pigmented soft bud; 3: Initially opened flower; 4: Half opened flower; 5: Fully opened flower. The same below. |
根据黄牡丹花瓣转录组数据库(未发表)筛选出的PlGST5基因的Unigene序列(Unigene11611),设计特异引物并利用RACE技术扩增ORF编码区,然后利用NCBI提供的ORF Finder进行分析,发现PlGST5 cDNA的扩增序列全长919 bp,包含675 bp的开放阅读框(open reading frame,ORF)和一个poly(A)尾巴,5′非编码区长64 bp,3′非编码区长154 bp。其ORF编码一个含224个氨基酸的蛋白质,Protparam(http://www.expasy.org/compute_pi/)预测所编码蛋白的分子量为25.137 8 kDa,理论等电点(pI)为8.65。
利用BlastP对PlGST5编码的蛋白保守域进行预测发现,PlGST5编码的蛋白的保守结构域为GST(PIN02395,glutathione S-transferase),含有2个保守域: 一个为Thioredoxin_like superfamily结构域(cl00388,蛋白质二硫氧化还原酶和其他具有硫氧还蛋白折叠的蛋白质,GST_N_Phi subfamily); 另一个为GST_C_family superfamily结构域(cl02776,GST家族的羧基端,α螺旋域,GST_C_Phi subfamily)(图 4)。
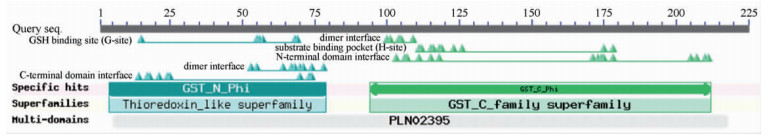 |
图 4 BlastP 推导的PlGST5氨基酸序列保守区检索 Fig. 4 Search for conserved domains in deduced sequence of amino acid of PlGST5 gene |
谷胱甘肽GSH结合位点包括: 一是由氨基端TRX-折叠域的氨基酸残基形成的GSH特异结合位点(G位点),二是包括羧基端α螺旋域残基的非特异底物结合位点(H位点)。PlGST5氨基酸序列分析结果显示,位于第14,45,46,47,58和59氨基酸残基为G位点(图 5“#”表示); 而位于第112,113,116,117,119,120,124,127,175和178氨基酸残基为H位点(图 5“*”表示)。
 |
图 5 PlGST5基因cDNA全长及推导的氨基酸序列 Fig. 5 Nucleotide and deduced amino acid sequences of the complete cDNA of PlGST5 ATG为起始密码子;TGA为终止密码子。标注‘#’处为6个G位点;标注‘*’处为10个H位点。Start and stop codons are underlined. The six amino acide residues of the G site are noted with ‘#’, while ‘*’ denote the residues of ten H sites. |
为对黄牡丹PlGST5与其他物种GST进行同源性分析,利用DNAMAN软件对包括PlGST5在内的8个物种的GST蛋白氨基酸序列(Wagner et al., 2002;Kitamura et al., 2004;2012;Yamazaki et al., 2008;Conn et al., 2008;Sasaki et al., 2012;金雪花等,2013)进行了多重比对(图 6)。结果发现,黄牡丹PlGST5与已知的花色素相关的GST蛋白氨基酸序列有相似的同源性,其中与葡萄VvGST4相似性最高,达45.15%;与拟南芥AtTT19和香石竹DcGSTF2相似性相对较低,为39.24%。
 |
图 6 黄牡丹PlGST5与其他已知花色素苷相关GST氨基酸序列比对 Fig. 6 Alignment of amino acid sequence of PlGST5 in P.delavayi var. lutea and other known GST related to anthocyanin |
对构建的系统发育树(图 2)分析发现,10个GST成员中,仅有PlGST5与已知花色素转运相关的GST聚类在一起,说明PlGST5可能也具有转运花色素的功能。
以黄牡丹花瓣gDNA为模板,扩增了PlGST5基因组DNA。由图 7可知PlGST5 gDNA从起始密码子到终止密码子约长821 bp,含有3个外显子和2个内含子,内含子总长为146 bp(图 7),属于GT-AG内含子。Blastn比对结果说明PlGST5属于phi型GST。
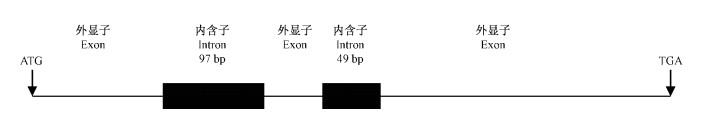 |
图 7 黄牡丹PlGST5 基因组结构 Fig. 7 The structure of PlGST5 genome in P.delavayi var. lutea |
qRT-PCR分析PlGST5在黄牡丹(黄色)、紫牡丹(紫色)、‘玉板白’(白色)和‘赵粉’(粉色)花瓣不同开放时期的表达模式发现,在花色素含量较高的黄牡丹、紫牡丹和‘赵粉’花瓣中表达量较高,而在不含花色素或含量极少的‘玉板白’花瓣中的表达量很少(图 8)。在花色较深的黄牡丹和紫牡丹的盛开期(第5阶段),PlGST5表达量最高,与硬蕾期(第1阶段)的表达量存在极显著差异,这与黄牡丹和紫牡丹在盛开期的花色着色最深相符合。在花色为粉色的‘赵粉’的硬蕾期表达最高,随着花的开放表达量不断下降,且在透色期(第3阶段)、初开期(第4阶段)和盛开期的表达量较硬蕾期显著降低。在花色为白色的‘玉板白’的硬蕾期高丰度表达,随着花朵的开放不断降低,最终在盛开期基本无表达。
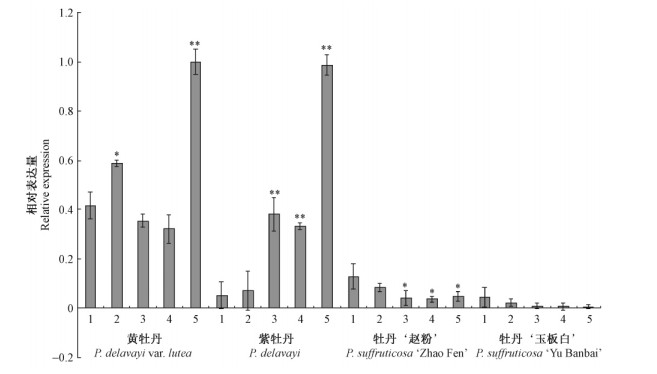 |
图 8 PlGST5在不同花色牡丹花瓣中的表达模式 Fig. 8 Expression patterns of PlGST5 in tree peony petals with different flower color 1-5. 牡丹花发育阶段 Developmental stages of tree peony flowers. |
进一步对黄牡丹(黄色)、紫牡丹(紫色)、‘玉板白’(白色)和‘赵粉’(粉色)的盛开期的花瓣、萼片、雄蕊、心皮和叶片、茎中的表达模式进行qRT-PCR分析发现,PlGST5在花瓣和心皮中表达最低,在萼片、叶片和茎中高丰度表达。PlGST5在黄牡丹、紫牡丹和‘玉板白’的各组织中的表达模式相似,在花药、萼片、叶片和茎中的表达量比花瓣中的表达量极显著或显著升高,而黄牡丹的心皮中的表达量比花瓣中的表达量稍低,紫牡丹的心皮中的表达量较花瓣中的表达量显著升高。PlGST5在‘赵粉’的萼片、叶片和茎中的表达显著比花瓣高,而在花药和心皮中的表达与花瓣中的表达相似(图 9)。整体上看,PlGST5在浅色系的‘赵粉’和‘玉板白’各组织中的表达量比深色系的黄牡丹和紫牡丹的表达量低,这与在各色系的花瓣发育过程中的表达相一致。
 |
图 9 PlGST5 在不同花色牡丹的盛开期(第5阶段)不同组织中的表达模式 Fig. 9 The expression pattern of PlGST5 in different tissues of tree peony with different flower color at fully opened flower(stage 5) |
花色素先在细胞质中合成,然后被转运并积累在液泡中。已有研究证明花色素分子运输到液泡中有3种方式: 以膜为介质、以囊泡为介质和以转运子为介质。其中以膜为介质的运输途径中,谷胱甘肽转移酶(GST)是起关键作用的一个酶,在多种植物中参与花色素分子的运输(Goodman et al., 2004)。本研究根据黄牡丹转录组数据中的Unigene 序列并结合RACE技术克隆了10 个GST 成员,并通过构建系统进化树和RT-PCR分析筛选出黄牡丹花色素转运相关的GSTs基因PlGST5。
前人通过突变体研究证明具有转运花色素功能的GST蛋白在物种之间是相当保守的(Alfenito et al., 1998; Marrs et al., 1995; Satoshi et al., 2004)。为了进一步证明PlGST5 参与花色素转运,对其进行了序列及表达模式分析。序列分析表明,PlGST5 所推测编码的蛋白序列具有GST蛋白家族典型的2个保守结构域和2个功能位点,与已发表的花色素相关GST 也具有较高的相似性,而且与花色素转运相关GSTs 亲缘关系近,尤其是与葡萄和拟南芥的花色素转运相关GSTs(Wagner et al., 2002; Kitamura et al., 2004; Conn et al., 2008),说明PlGST5具有相似的功能。GSTs 的高度保守性也许是GSTs 比ATP结合盒式蛋白(ATP-binding cassette transporter,ABC)和多药抗性转运蛋白(multidrug and toxic compound extrusion,MATE)研究更广泛的原因之一。ABC 转运蛋白直接利用水解ATP供能,底物可以是离子、单糖、氨基酸、磷脂、肽、多糖和蛋白质; 而植物MATE 蛋白是一种能利用ATP的能量将各种药物从细胞质转运到细胞外,底物主要是多药和有毒化合物(Yazaki et al., 2008)。
花色素转运相关GST表达模式与花色素积累模式密切相关,而且研究证明GSTs也参与类黄酮的合成和积累(Kitamura et al., 2004)。矮牵牛PhAn9在花瓣中表达模式与花色素的合成相一致(Alfenito et al., 1998)。在果实着色过程中,山葡萄VAmGST4在果皮中的表达随花色苷的合成上调(刘海峰等,2011)。紫苏PfGST1的表达模式与紫苏不同组织中花色素积累模式一致(Yamazaki et al., 2003; 2008),且优先在橙黄色果实中表达(Lo Piero et al., 2006)。PlGST5 在花色素含量较高的黄牡丹、紫牡丹和‘赵粉’花瓣中表达量高,而在不含或含少量花色素的‘玉板白’花瓣中的表达量极少; 不同组织中,在萼片、叶片和茎中高丰度表达,而在花瓣和心皮中表达最低。这与金雪花等(2013)对瓜叶菊ScGST3在组织和花瓣的表达模式的研究结果相吻合。
花色素转运相关GSTs 表达模式也与合成花色素的组织发育过程有关。如拟南芥AtTT19 的表达模式与积累类黄酮的组织的发育阶段密切相关(Kleindt et al., 2010)。本研究发现,在花色较深的黄牡丹和紫牡丹的盛开期,PlGST5表达量最高,与硬蕾期的表达量极显著差异,这与在香石竹花发育后期的花瓣中大量检测到DcGST2的转录本的报道相吻合(Sasaki et al., 2012); 在花色为粉红色的‘赵粉’的硬蕾期表达最高,随着花的开放表达量不断下降,与仙客来和矮牵牛(Quattrocchio et al., 1993; Alfenito et al., 1998; Kitamura et al., 2012)的研究结果相似,即在花发育早期高表达,而在发育后期表达很弱。本研究中出现的关于花发育过程中的2种不同表达模式可能与试验材料所属的居群不一样有关,即黄牡丹和紫牡丹均为云南野生种,而‘赵粉’和‘玉板白’均为中原牡丹的栽培品种,它们花色素合成的变化趋势也许不同。本结果与5个PlGSTs成员的RT-PCR分析相一致(图 3)。
综上所述,PlGST5可能参与黄牡丹花色素的转运和积累。但由于GST 在植物体内行使多种功能,如解除外界毒素以及内源有毒代谢物的侵害、调节细胞程序衰老和作为胁迫信号等功能(Edwards et al., 2000; Dixon et al., 2002; Loyall et al., 2000),黄牡丹的其他9个GST成员的功能还有待进一步确定。
黄牡丹花色素转运相关基因PlGST5 的分离及表达模式的分析,将为更好地认识PlGST5 在黄牡丹花瓣着色过程中的作用,培育出更多牡丹新品种奠定了良好的基础。
| [1] |
金雪花,洪艳,黄河,等.2013.瓜叶菊谷胱甘肽转移酶基因GST的分离及表达分析.园艺学报,40(6): 1129-1138.( 3) 3)
|
| [2] |
刘海峰,王军.2011.山葡萄谷胱甘肽S–转移酶基因(VAmGST 4 )克隆及表达分析.植物生理学报,47(12): 1161-1166.( 1) 1)
|
| [3] |
孟丽,周琳,张明珠,等.2006.一种有效的花瓣总RNA的提取方法.生物技术,16(1): 38- 40.( 1) 1)
|
| [4] |
王志芳,王雁,岳桦.2007.珍稀资源:黄牡丹.中国城市林业,5(2): 59- 60.( 1) 1)
|
| [5] |
周琳.2010.牡丹花色形成分子机制的研究及云南野生黄牡丹色素成分的分析与鉴定.北京:中国林业科学研究院博士后出站报告.( 1) 1)
|
| [6] |
周琳,王雁,律春燕,等.2011.云南野生黄牡丹花色素成分的鉴定.东北林业大学学报,39(8): 52-54.( 1) 1)
|
| [7] |
Alfenito M R,Souer E,Goodman C D,et al. 1998.Functional complementation of anthocyanin sequestration in the vacuole by widely divergent glutathione S-transferases.Plant Cell,7(10):1135-1149.( 4) 4)
|
| [8] |
Buetler T M,Eaton D L.1992.Glutathione S-transferases: amino acid sequence comparison,classification and phylogenetic relationship.Environmental Carcinogen and Ecotoxicology Reviews,C10:181- 203.( 1) 1)
|
| [9] |
Conn S,Curtin C,Bézier A, et al.2008.Purification,molecular cloning and characterization of glutathione S-transferases(GSTs)from pigmented Vitis vinifera L.cell suspension cultures as putative anthocyanin transport proteins.J Exp Bot,59(13): 3621- 3634.( 3) 3)
|
| [10] |
Dixon D P,Lapthorn A,Edwards R.2002.Plant glutathione transferases.Genome Biology,3(3):3004.1-3004.10.( 1) 1)
|
| [11] |
Edwards R,Dixon D P.2000.Plant glutathione S-transferases:enzymes with multiple functions in sickness and in health.Trends Plant Sci,5(5): 193-198.( 1) 1)
|
| [12] |
Fujiwara H,Tanaka Y,Yonekura-Sakakibara K,et al. 1998.cDNA cloning,gene expression and subcellular localization of anthocyanin 5-aromatic acyltransferase from Gentiana triflora. The Plant Journal,16(4): 421-431.( 1) 1)
|
| [13] |
Goodman C D,Casati P,Walbot V.2004.A multidrug-resistance associated protein involved in anthocyanin transport in Zea mays. Plant Cell,16(7): 1812-1826.( 2) 2)
|
| [14] |
Grotewold E.2004.The challenges of moving chemicals within and out of cells: Insights into the transport of plant natural products.Planta,219(7): 906-909.( 1) 1)
|
| [15] |
Harborne J B,Williams C A.2000.Advances in flavonoid research since 1992.Phytochemistry,55(6): 481-504.( 1) 1)
|
| [16] |
Jonsson L M V,Donker-Koopman W E,Uitslager P, et al.1983.Subcellular localization of anthocyanin methyltransferase in flowers of Petunia hybrida. Plant Physiology,72(2): 287-290.( 1) 1)
|
| [17] |
Kitamura S,Akita Y,Ishizaka H, et al.2012.Molecular characterization of an anthocyanin-related glutathione S-transferase gene in cyclamen.Journal of Plant Physiology,169(6): 636-642.( 3) 3)
|
| [18] |
Kitamura S,Shikazono N,Tanaka A.2004.TRANSPARENT TESTA 19 is involved in the accumulation of both anthocyanins and proanthocyanidins in Arabidopsis. Plant J,37: 104-114.( 5) 5)
|
| [19] |
Kleindt C K,Stracke R,Mehrtens F,et al. 2010.Expression analysis of flavonoid biosynthesis genes during Arabidopsis thaliana silique and seed development with a primary focus on the proanthocyanidin biosynthetic pathway.BMC Res Notes,3: 255.( 1) 1)
|
| [20] |
Larsen E S,Alfenito M R,Briggs W R, et al.2003.A carnation anthocyanin mutant is complemented by the glutathione S-transferases encoded by maize Bz2 and petunia An9.Plant Cell Rep,21(9): 900- 904.( 1) 1)
|
| [21] |
Livak K J,Schmittgen T D.2001.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method.Methods,25(4): 402- 408.( 1) 1)
|
| [22] |
Lo Piero A R,Puglisi I,Petrone G.2006.Gene isolation,analysis of expression,and in vitro synthesis of glutathione S-transferase from orange fruit [Citrus sinensis L.(Osbeck)]J Agric Food Chem,54(24): 9227- 9233.( 1) 1)
|
| [23] |
Loyall L,Uchida K,Rraun S,et al. 2000.Glutathione and a UV light-induced glutathione S-transferase are involved in signaling to chaconne synthase in cell cultures.Plant Cell,12(10):1939-1950.( 1) 1)
|
| [24] |
Marrs K A,Alfenito M R,Lioyd A M,et al. 1995.A glutathione S-transferase involved in vacuolar transfer encoded by the maize gene Bronze-2.Nature,375: 397-400.( 1) 1)
|
| [25] |
Moons A.2003.Osgstu 3 and osgtu4,encoding tau class glutathione S-transferases,are heavy metal- and hypoxic stress-induced and differentially salt stress-responsive in rice roots.FEBS Letters,553(3): 427- 432.( 1) 1)
|
| [26] |
Mueller L A,Walbot V.2001.Models for vacuolar sequestration of anthocyanins.Recent Advances in Phytochemistry,35:291-312.( 1) 1)
|
| [27] |
Quattrocchio F,Wing J F,Leppen H T C,et al. 1993.Regulatory genes controlling anthocyanin pigmentation are functionally conserved among plant species and have distinct sets of target genes.Plant Cell,5: 1497- 1512.( 1) 1)
|
| [28] |
Sasaki N,Nishizaki Y,Uchida Y, et al.2012.Identification of the glutathione S-transferase gene responsible for flower color intensity in carnations.Plant Biotechnology,29: 223- 227.( 3) 3)
|
| [29] |
Satoshi K,Naoya S,Atsushi T.2004.TRANSPARENT TESTA 19 is involved in the accumulation of both anthocyanins and proanthocyanidins in Arabidopsis. The Plant Journal,37: 104-114.( 1) 1)
|
| [30] |
Wagner U,Edwards R,Dixon D P,et al. 2002.Probing the diversity of the Arabidopsis glutathione S-transferase gene family.Plant Mol Biol,49(5): 515- 532.( 3) 3)
|
| [31] |
Winkel B S J.2004.Metabolic channeling in plants.Annu Rev Plant Biol,55: 85-107.( 1) 1)
|
| [32] |
Winkel-Shirley B.1999.Evidence for enzyme complexes in the phenylpropanoid and flavonoid pathways.Physiol Plant,107(1): 142- 149.( 1) 1)
|
| [33] |
Yamazaki M,Nakajima J,Yamanashi M,et al. 2003.Metabolomics and differential gene expression in anthocyanin chemo-varietal forms of Perilla frutescens. Phytochemistry,62: 987- 995.( 1) 1)
|
| [34] |
Yamazaki M,Shibata M,Nishiyama Y,et al. 2008.Differential gene expression profiles of red and green forms of Perilla frutescence leading to comprehensive identification of anthocyanin biosynthetic genes.FEBS J,275(13): 3494- 3502.( 3) 3)
|
| [35] |
Yazaki K,Sugiyama A,Morita M,et al. 2008.Secondary transport as an efficient membrane transport mechanism for plant secondary metabolites.Phytochemistry Reviews,7(3): 513- 524.( 1) 1)
|
| [36] |
Yonekura-Sakakibara K,Tanaka Y,Fukuchi-Mizutani M,et al. 2000.Molecular and biochemical characterization of a novel hydroxycinnamoyl-CoA: anthocyanin3-O-glucoside-6-O-acyltransferase from Perilla frutescens. Plant and Cell Physiology,41:495-502.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

