文章信息
- 张通, 李巧玲, 张凌云
- Zhang Tong, Li Qiaoling, Zhang Lingyun
- PwEXP1在青杄种子萌发及逆境响应中的表达特征
- Expression Characteristics of PwEXP 1 Gene in Seed Germination and Adversity in Picea wilsonii
- 林业科学, 2014, 50(12): 56-62
- Scientia Silvae Sinicae, 2014, 50(12): 56-62.
- DOI: 10.11707/j.1001-7488.20141208
-
文章历史
- 收稿日期:2014-01-22
- 修回日期:2014-06-18
-
作者相关文章
2. 森林培育与保护教育部重点实验室 北京 100083
2. Key Laboratory of Forest Silviculture and Conservation of Ministry of Education Beijing 100083
植物在整个生命过程中都会遭受盐、干旱等胁迫危害,因而也产生了一系列的综合机制适应环境变化(Wang et al., 2003)。其中植物可以通过延迟细胞分裂和伸长等方式限制植物生长从而适应胁迫条件,细胞壁修饰就是植物进化来适应环境的一个重要方面,这种方式是通过细胞壁修饰蛋白的介导调节植物生长从而帮助植物适应环境(Sasidharan et al., 2011)。扩展蛋白是一种细胞壁修饰蛋白,包含了α-expansin(EXPA),β-expansin(EXPB),γ-expansin(EXLA)和δ-expansin(EXLB)4个亚基(Sharova,2007),在一定的pH值下通过打断多糖和纤维素之间的非共价键来调节细胞壁的松弛(McQueen-Mason et al., 1994;1995)。一些扩展蛋白已经在不同物种中鉴定,并在多种发育过程中起作用。如Chen等(2001)鉴定的2个番茄(Lycopersicon esculentum)扩展蛋白基因在种子萌发的不同时期有不同的表达模式,并在ABA处理下种子的萌发率与扩展蛋白的表达量呈正相关; 玫瑰(Rosa rugosa)的RhEXP1基因主要涉及花瓣的生长与花的开放(Yamada et al., 2009); 水稻(Oryza sativa)节间伸长也与扩展蛋白基因的表达相关(Choi et al., 2003)。越来越多的研究表明,扩展蛋白也参与了植物逆境胁迫响应。Han等(2012)发现,在水分胁迫下小麦(Triticum aestivum)TaEXPB23在转录水平诱导表达,并显著提高了转基因烟草(Nicotiana tabacum)的抗旱能力; 高粱(Sorghum bicolor)在盐胁迫下β扩展蛋白的转录丰度增加,在耐盐品种中的表达水平高于一般品种(Buchanan et al., 2005); 徐筱等(2010)鉴定出一个剪股颖(Agrostis stolonifera)热响应扩展蛋白AsEXP1并标明其可以作为一个标记基因来筛选耐热的草坪草种质。一些植物在ABA处理后扩展蛋白基因的表达量没有改变(Vreeburg et al., 2005),但最近的研究显示在渗透胁迫下ABA可以增加扩展蛋白基因的表达来促进小麦胚芽鞘的伸长(Zhao et al., 2012),也预示着扩展蛋白家族成员的异质性和在不同植物中发挥不同的功能。
青杄(Picea wilsonii)为松科(Pinaceae)云杉属(Picea)常绿乔木,是我国特有的树种。青杄在我国有广泛的地理分布和较强的环境适应能力,对逆境环境具有较强的抵抗能力(魏强等,2011)。本研究从青杄中克隆一个扩展蛋白基因PwEXP1,并分析了该基因在青杄不同组织和种子萌发过程中的相对表达情况。同时还针对该基因对模拟干旱胁迫、NaCl、ABA处理及温度胁迫响应做了表达分析,探讨该基因对逆境条件的反应,研究其抗逆功能。
1 材料与方法 1.1 试验材料供试青杄cDNA文库通过Gateway技术构建(张盾等,2012),本实验室保存。青杄花粉和种子采于北京植物园。将青杄种子播种于泥炭土:蛭石(V/V)=1:1的培养盘中,培养条件: 温度24 ℃,湿度60%~70%,光照每天16 h。生长3个月后,收集根部、茎和针叶,液氮速冻-80 ℃ 保存。
Taq DNA聚合酶、克隆载体pGM-T、感受态细胞DH5α、RNA提取试剂盒、cDNA第1链合成试剂盒购于北京艾德来公司,荧光定量试剂盒(Quant one step qRT-PCR)购于天根(北京)公司,其他试剂购于AMRESICO公司。
1.2 PwEXP1的克隆以本实验室前期构建的多年生青杄cDNA文库为模板,根据PwEXP1的EST序列和pDONR222载体两端序列设计特异引物进行5′-RACE和3′-RACE试验。将RACE-PCR扩增的片段连接T载体测序,并与EST序列拼接得到PwEXP1的cDNA序列。根据拼接得到的基因cDNA全长设计特异引物ORF-f和ORF-r,经PCR扩增连接T载体测序后,验证所获得基因全长的准确性。引物序列见表 1。
|
|
利用DNAMAN软件推测编码的蛋白序列,用ProtParam分析蛋白的等电点等理化性质(http://web.expasy.org/ProtParam/); 用SubLoc工具分析蛋白质的亚细胞定位(http://www.bioinfo.tsinghus.edu.cn/SubLoc); 用ScanProsite工具对该蛋白进行保守结构域预测(http://prosite.expasy.org/scanprosite/); 用NCBI的tblastN工具搜索其他物种中同源性较高的EXP蛋白,利用CLUSTAL-X软件进行氨基酸多序列比对,利用MEGA-5软件依据邻位相接法构建不同植物的EXP蛋白进化树,分析它们之间的进化关系。
1.4 PwEXP1的表达分析 1.4.1 组织特异性表达试验用AidLab公司的植物RNA提取试剂盒提取上述速冻的青杄幼根、幼茎、嫩叶及多年生青杄种子和花粉的RNA。紫外分光光度计检测RNA纯度,琼脂糖凝胶电泳检测RNA完整性后反转录成cDNA,并以此为模板进行荧光定量PCR和半定量PCR试验,对该基因的组织表达特异性进行分析。实时荧光定量PCR使用引物EXP1-qrt-f和EXP1-qrt-r,半定量使用引物RT-f和RT-r(表 1),由于EF-α在青杄各组织表达丰度较高且一致,设置EF1-α为内参(Yu et al., 2011)。设置3次重复试验检测PwEXP1在各组织中的表达情况。
1.4.2 种子萌发试验将青杄种子撒于布有浸水滤纸的培养皿中,将培养皿置于24 ℃的光照培养箱中,光照/黑暗时间为16 h/8 h,并保持滤纸湿润。在种子开始萌发的第2,4,6,8,10天将萌发后的整体液氮速冻保存,分析种子萌发时PwEXP1表达量的变化。所用引物同1.4.1,各个时期取样及RT-qPCR试验均设置3次重复。
1.4.3 逆境胁迫试验参照李长江等(2013)的方法,有改动。胁迫处理时分别用水(对照)、500 mmol·L-1 NaCl、20%PEG和150 μmol·L-1 ABA浇灌正常生长100天的青杄幼苗,分别处理3,6,9,12,24 h或将上述青杄幼苗置于4 ℃和45 ℃各30,60,90 min。将胁迫处理后的青杄幼苗分别收集根部(地下部分)和叶部(地上部分)组织,提取RNA并反转录后进行荧光定量PCR试验。试验所用引物同1.4.1,每个处理设置3个重复。
2 结果与分析 2.1 青杄PwEXP1的克隆用RACE-PCR的方法得到的末端序列,与EST序列拼接后得到PwEXP1的cDNA全长。DNAMAN软件分析发现,青杄PwEXP1 cDNA共1 186 bp,在53 bp处出现起始密码子ATG,在830 bp处出现终止密码子TGA,编码区共777 bp,编码259个氨基酸,在1 164 bp处出现Poly(A)23尾巴。cDNA全长已登录GenBank(KJ524102)。
2.2 生物信息学分析 2.2.1 理化性质分析ProtParam预测该基因编码的蛋白质分子量为27.90 kDa,理论等电点(pI)为8.07。预测该氨基酸序列中,酸性残基(Asp,Glu)总数为16,碱性残基(Arg,Lys)总数为18; 亲水性平均系数-0.069; 分析预测PwEXP1的分子式为C1239H1882N338O344S15。肽链中Gly含量最多,有28个,占总数的10.8%; 其次是Ala,共27个,占总数的10.4%; 不稳定指数为29.86,低于50的阈值,表明该蛋白比较稳定。亚细胞定位预测其分布于细胞外(certainty=0.864),这与扩展蛋白在细胞壁发挥作用的功能相符。从保守氨基酸组成上来看,该蛋白具有典型的扩展蛋白结构: 氨基酸N端有8个半胱氨酸(C)残基,中间区域有1个组氨酸折叠结构域(HFD),C末端有4个保守的色氨酸(W)残基,N末端有一段信号肽。
2.2.2 多序列比对及系统进化树分析通过BLASTP多序列比对,选择与青杄PwEXP1蛋白相似度较高的8种扩展蛋白进行多序列比对(图 1),它与毛白杨(Populus tomentosa)PtEXP1(AFZ78603.1)、拟南芥(Arabidopsis thaliana)AtEXP2(XP_002871148.1)、黄瓜(Cucumis sativus)CsEXP8(XP_004138396.1)、紫茉莉(Mirabilis jalapa)MjEXP3(AAL87022.1)、矮牵牛(Petunia hybrida)PhEXP2(AAR82850.1)、北美云杉(Picea sitchensis)PsEXP(ABR17119.1)、蚕豆(Vicia faba)VfEXP1(ABM66452.1)、葡萄(Vitis vinifera)VvEXP8(XP_002276565.2)的氨基酸相似性分别为72.83%,64.53%,69.81%,67.55%,60.38%,73.58%,70.19%和65.66%。从比对结果上看,序列氨基端含有丰富的半胱氨酸(C),半胱氨酸可能与二硫键的形成有关,是扩展蛋白的催化区。序列羧基端有与纤维素酶类似的吸附区,拥有丰富的色氨酸(W),色氨酸对环境pH的变化很敏感,微弱的pH改变会导致酶分子构象发生较大变化,进而影响扩展蛋白行使功能(阎伯旭等,1998)。利用MEGA软件进行不同物种EXP蛋白进化树分析发现,PwEXP1与北美云杉的EXP蛋白聚为一簇,并与木本植物毛白杨的亲缘关系较近(图 2)。
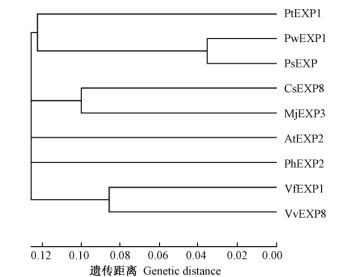 |
图 2 不同物种EXP蛋白同源比较 Fig. 2 Homology analysis of plant EXP C和W分别表示保守的半胱氨酸和色氨酸,划线部分为保守HFD基序。The conserved Cys and Trp residues are indicated by C and W; The black line is HFD structure. PwEXP1: 青杄Picea wilsonii(KJ524102); AtEXP2: 拟南芥Arabidopsis thaliana(XP002871148.1); CsEXP8: 黄瓜Cucumis sativus(XP004138396.1); MjEXP3: 紫茉莉Mirabilis jalapa(AAL87022.1); PhEXP2: 矮牵牛Petunia hybrida(AAR82850.1); PsEXP1: 北美云杉Picea sitchensis(ABR17119.1); PtEXP1: 毛白杨Populus tomentosa(AFZ78603.1); VfEXP1: 蚕豆Vicia faba(ABM66452.1); VvEXP8: 葡萄Vitis vinifera(XP002276565.2). 下同。The same below. |
提取青杄各组织RNA,琼脂糖凝胶电泳结果显示有18 S和28 S清晰条带,OD值在1.8~2.0之间,表明提取的RNA良好,可以用于后续试验。将检测合格的RNA反转录后用于荧光定量PCR和半定量PCR。如图 3所示,青杄PwEXP1在针叶中表达量最高,其次是根中,在成熟种子中的表达量相对较低。半定量PCR的结果与荧光定量PCR一致。
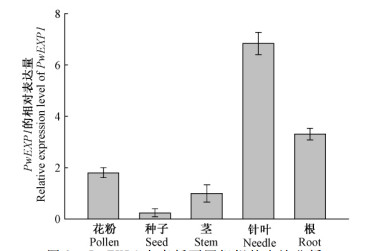 |
图 3 PwEXP1在青杄不同组织的表达分析 Fig. 3 Expression analysis of PwEXP1 in different organs of Picea wilsonii |
提取各时期青杄种子RNA后进行荧光定量PCR和半定量PCR试验。在种子萌发过程中,成熟干燥种子(0天)中PwEXP1表达量较低,在种子萌发前期(第2天和第4天)表达量开始提高,在第6天表达量迅速提高,为开始的11倍,并在之后的第8和第10天维持在较高水平(图 4)。
 |
图 4 PwEXP1青杄种子在不同萌发时期的表达分析
Fig. 4 Phenotype and expression analysis of PwEXP1
during seed germination
A: 青杄种子在不同时间萌发情况;B: 相应萌发时间PwEXP1的相对表达量。 A: Phenotype during seed germination; B: Expression analysis of PwEXP1 during seed germination. |
为研究PwEXP1在NaCl,PEG,ABA及低温和高温胁迫下的表达模式,取胁迫处理后的青杄幼苗,提取各组织RNA后进行反转录,浓度均一化后进行荧光定量PCR试验分析PwEXP1在叶、根中的表达情况。NaCl胁迫(图 5A)显著提高了PwEXP1在根中的表达,最高值出现在9 h; 在叶中,NaCl处理3 h后没有显著改变PwEXP1的表达,随后的6 h表达被抑制,9 h,12 h和24 h的表达量显著上调,12 h时表达量最高。在PEG处理下(图 5B),PwEXP1在处理6 h后的根中表达量维持在较高水平; 而在叶中,胁迫3 h和6 h时PwEXP1基因被诱导表达,9 h和12 h表达受到抑制,24 h又被重新诱导表达,呈升-降-升趋势。ABA处理时(图 5C),根和叶部PwEXP1的表达量受到不同程度抑制,但总体表达变化不显著。4 ℃时PwEXP1在叶部表达不明显,在根部处理的30,60和90 min的节点上表现出逐渐下降的趋势; 45 ℃高温处理,PwEXP1在根和叶中都诱导表达,与NaCl胁迫产生的表达丰度相似,而表达高峰分别出现在90 min和60 min(图 5D)。
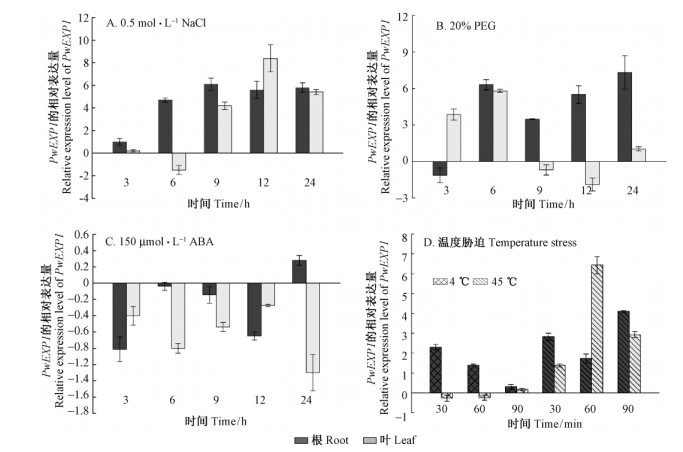 |
图 5 青杄PwEXP1对不同胁迫的表达模式分析
Fig. 5 Expression analysis of PwEXP1 in Picea wilsonii under several abiotic stress
相对表达水平为处理组与对照组log2处理后的比值: >0表示表达上调,7 0表达下调,=0表达量无变化。平均值上面的误差线表示的是均值标准误差SE。 Relative expression level represent by log2 conversion of treatment group and control group: “>0” indicates up-regulation, “<0” indicates down-regulation, “=0” indicates no change. Values are means ±SE from three independent assays. |
植物中的EXP基因最早于黄瓜下胚轴细胞壁中分离,分别命名为CsEXP1和CsEXP2(McQueen-Mason et al., 1992),随后在腊梅(Chimonanthus praecox)(Ma et al., 2012)、葡萄(Dal et al., 2013)等植物中得到鉴定。本试验从青杄中分离出1个PwEXP1基因,并基于其氨基酸序列进行生物信息学分析(图 1)。在与同源蛋白比对时发现它们均有相同的保守结构域,即N端有8个保守的半胱氨酸组成丰富域,中间1个组氨酸(HFD)功能域,C端有4个保守的色氨酸丰富域。系统进化树分析发现木本植物青杄、北美云杉和毛白杨的扩展蛋白与其他植物发生明显分离,其中青杄PwEXP1与北美云杉PsEXP亲缘关系最近,由于二者均属松科云杉属,推测二者进化上有相同的祖先。
扩展蛋白的表达存在组织和器官的特异性。拟南芥AtEXPA5主要在茎、叶、花等地上器官中表达(Park et al., 2010),萝卜(Raphanus sativus)RsEXPB1则主要在生育前期的幼叶、肉质根木质部和韧皮部中表达(荆赞革等,2009)。在本试验中,相比于其他器官,青杄PwEXP1在针叶中的相对表达量较高,而在干燥的种子中表达量较低(图 3)。在种子萌发过程中,PwEXP1在萌发前期被诱导表达,后期PwEXP1的表达量急剧上升(图 4),表明其参与了种子萌发过程,并且这种表达现象可能与种子萌发后期出现幼根和幼茎的分化、细胞分裂旺盛有关(Yamada et al., 2009; Choi et al., 2003)。
扩展蛋白是细胞壁的主要成分。研究发现在胁迫条件下扩展蛋白基因的表达可增加细胞壁的延展性,防止细胞壁的机械损伤(McQueen-Mason et al., 1995),但由于扩展蛋白基因是一个大家族,成员间的作用不尽相同(Sampedro et al., 2005)。在玉米(Zea mays)中,NaCl胁迫下的敏感型玉米EXPB的表达丰度降低,茎生长受到抑制,而抗盐品种的茎能在一定盐胁迫下继续伸长,证实EXPB基因参与了玉米对NaCl胁迫的响应过程(Geilfus et al., 2010); 而Park等(2010)在拟南芥中得出相反的结论,发现AtEXP3和AtEXP4在拟南芥中过表达后,通过不同的机制分别增加了拟南芥对盐胁迫的敏感性。在本试验中,NaCl处理青杄幼苗后,PwEXP1在根中的表达量提高,在叶中处理后期表达量大幅提高,但表达时间略迟于根中表达(图 5)。以往的研究显示,扩展蛋白的表达也可能受到多重胁迫的共同诱导表达。如单一干旱处理翦股颖PennA-4品种,AsEXP1没有表达,而单一高温处理和高温干旱双重处理中,AsEXP1基因得到强势表达(徐筱等,2010)。本研究则发现青杄PwEXP1在不同非生物胁迫下表达模式不同。NaCl胁迫下PwEXP1在根和叶中均能响应,叶中的响应时间要延迟于根中。低温胁迫下,PwEXP1在叶中表达程度较低,根中的表达量在本试验时间内逐渐降低; 高温胁迫下PwEXP1在根和叶中均可表达,表达程度与NaCl胁迫下的一致。经PEG处理后,PwEXP1在根中6 h后表达量较高,在茎中呈现上升—下降—上升的模式。与此同时,ABA作为植物应答干旱胁迫通路中的关键元件,PwEXP1在ABA处理下的根和茎中均被微弱抑制表达,表明PwEXP1可能参与不依赖ABA的逆境响应。对于PwEXP1在不同胁迫下表达差异的深层次的分子机制及青杄其他扩展蛋白基因的克隆和功能还有待进一步研究。
| [1] |
荆赞革,柳李旺,龚义勤,等.2009.萝卜扩展蛋白基因克隆与表达特征分析.分子植物育种,7(4): 801-805.( 1) 1)
|
| [2] |
李长江,孙凡,张通,等.2013.青杄PwPSAF基因的克隆与组织表达分析.林业科学,49(10): 40-47.( 1) 1)
|
| [3] |
魏强,凌雷,张广忠,等.2011.甘肃兴隆山主要森林类型凋落物累积量及持水特性.应用生态学报,22(10): 2589-2598.( 1) 1)
|
| [4] |
徐筱,黄炳如,徐吉臣.2010.翦股颖AsEXP 1基因的抗旱性分析.北京林业大学学报,32(5): 126-131.( 2) 2)
|
| [5] |
阎伯旭,曲音波,高培基.1998.色氨酸残基在内切葡聚糖酶分子中的作用.中国生物化学与分子生物学报,14(2): 181-185.( 1) 1)
|
| [6] |
张盾,刘亚静,李长江,等.2012.青杄均一化cDNA文库构建及EST序列分析.生物技术通报,8(6): 71-76.( 1) 1)
|
| [7] |
Buchanan C D,Lim S,Salzman R A,et al.2005.Sorghum bicolor's transcriptome response to dehydration,high salinity and ABA.Plant Mol Biol,58(5): 699-720.( 1) 1)
|
| [8] |
Chen F,Dahal P,Bradford K J.2001.Two tomato expansin genes show divergent expression and localization in embryos during seed development and germination.Plant Physiol,127(3): 928-936.( 1) 1)
|
| [9] |
Choi D,Lee Y,Cho H T,et al.2003.Regulation of expansin gene expression affects growth and development in transgenic rice plants.Plant Cell,15(6): 1386-1398.( 2) 2)
|
| [10] |
Dal Santo S,Vannozzi A,Tornielli G B,et al.2013.Genome-wide analysis of the expansin gene superfamily reveals grapevine-specific structural and functional characteristics.PlosOne,8(4):e62206.DOI: 10.1371/journal.pone.0062206.( 1) 1)
|
| [11] |
Geilfus C M,Zorb C,Muhling K H.2010.Salt stress differentially affects growth-mediating beta-expansins in resistant and sensitive maize(Zea mays L.).Plant Physiology and Biochemistry,48(12): 993-998.( 1) 1)
|
| [12] |
Han Y Y,Li A X,Li F,et al.2012.Characterization of a wheat(Triticum aestivum L.)expansin gene,TaEXPB 23,involved in the abiotic stress response and phytohormone regulation.Plant Physiology and Biochemistry,54: 49-58.( 1) 1)
|
| [13] |
Ma J,Li Z,Wang B,et al.2012.Cloning of an expansin gene from Chimonanthus praecox flowers and its expression in flowers treated with ethephon or 1-methylcyclopropene.Hortscience,47(10): 1472-1477.( 1) 1)
|
| [14] |
McQueen-Mason S,Durachko D M,Cosgrove D J.1992.Two endogenous proteins that induce cell wall extension in plants.Plant Cell,4: 1425-1433.( 1) 1)
|
| [15] |
McQueen-Mason S,Cosgrove D J.1994.Disruption of hydrogen bonding between plant cell wall polymers by proteins that induce wall extension.Proc Natl Acad Sci USA,91(14): 6574-6578.( 1) 1)
|
| [16] |
McQueen-Mason S,Cosgrove D J.1995.Expansin mode of action on cell walls.Analysis of wall hydrolysis,stress relaxation,and binding.Plant Physiol,107(1): 87-100.( 2) 2)
|
| [17] |
Park C H,Kim T W,Son S H,et al.2010.Brassinosteroids control AtEXPA 5 gene expression in Arabidopsis thaliana.Phytochemistry,71(4): 380-387.( 2) 2)
|
| [18] |
Sampedro J,Cosgrove D J.2005.The expansin superfamily.Genome Biology,6(12):242.1-242.11.( 1) 1)
|
| [19] |
Sasidharan R,Voesenek L A,Pierik R.2011.Cell wall modifying proteins mediate plant acclimatization to biotic and abiotic stresses.Critical Reviews in Plant Sciences,30(6): 548-562.( 1) 1)
|
| [20] |
Sharova E I.2007.Expansins: Proteins involved in cell wall softening during plant growth and morphogenesis.Russian Journal of Plant Physiology,54(6): 713-727.( 1) 1)
|
| [21] |
Vreeburg R A,Benschop J J,Peeters A J,et al.2005.Ethylene regulates fast apoplastic acidification and expansin a transcription during submergence-induced petiole elongation in Rumex palustris.Plant J,43(4): 597-510.( 1) 1)
|
| [22] |
Wang W,Vinocur B,Altman A.2003.Plant responses to drought,salinity and extreme temperatures: towards genetic engineering for stress tolerance.Planta,218(1): 1-14.( 1) 1)
|
| [23] |
Yamada K,Takahashi R,Fujitani C,et al.2009.Cell wall extensibility and effect of cell-wall-loosening proteins during rose flower opening.Journal of the Japanese Society for Horticultural Science,78(2): 242-251.( 2) 2)
|
| [24] |
Yu Y,Li Y,Huang G,et al.2011.PwHAP5,a CCAAT-binding transcription factor,interacts with PwFKBP12 and plays a role in pollen tube growth orientation in Picea wilsonii.J Exp Bot,62(14): 4805-4817.( 1) 1)
|
| [25] |
Zhao M R,Han Y Y,Feng Y N,et al.2012.Expansins are involved in cell growth mediated by abscisic acid and indole-3-acetic acid under drought stress in wheat.Plant Cell Reports,31(4):671-685.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

