文章信息
- 张丽娜, 朱天辉, 彭艳, 郑磊, 赵芳
- Zhang Lina, Zhu Tianhui, Peng Yan, Zheng Lei, Zhao Fang
- 抗菌蛋白AMP对杂交竹梢枯病防治效果及其抗性相关酶活性的影响
- Control Efficacy of Antifungal Protein AMP to Hybrid Bamboo Blight and It's Effect on the Activities of Defense-Related Enzymes in Hybrid Bamboo
- 林业科学, 2014, 50(11): 82-89
- Scientia Silvae Sinicae, 2014, 50(11): 82-89.
- DOI: 10.11707/j.1001-7488.20141111
-
文章历史
- 收稿日期:2013-10-21
- 修回日期:2014-07-10
-
作者相关文章
2. 四川农业大学林学院 雅安 625014;
3. 四川农业大学森林保护省级重点实验室 雅安 625014
2. College of Forestry, Sichuan Agricultural University Ya'an 625014;
3. Provincial Key Laboratory of Forest Protection, Sichuan Agricultural University Ya'an 625014
诱导抗性,即利用生物或非生物因子激发植物的防卫基因,使植物产生局部的或系统的抗病性而达到防病的效果,在植物病害防治中具有重要的意义。大量研究表明一些微生物本身可作为激发子诱导植物产生抗病性(陈祖静等,2010;梁建根等,2006;刘晓光等,2007;童蕴慧等,2004)。一些来源于微生物的诱导因子也可以诱导寄主植物产生防卫反应,尤其是诱导植保素的合成和积累(Hahn,1996)。Thakker等(2011)利用从Fusarium oxysporum f.sp cubense获得的激发子处理香蕉(Musa paradisiaca)根部,可引起香蕉叶片防御性相关酶的积累,能有效提高感病品种的抗性;Mao等(2010)从Alternaria tenuissima的菌丝中纯化得到的耐热酸性蛋白激发子PeaT1,能够诱导烟草(Nicotiana spp.)对TMV产生系统抗病性;李云锋等(2004)利用从稻瘟病菌(Mapnaporthe grisea)细胞壁中纯化获得的糖蛋白激发子CSBⅠ(相对分子质量为102 kDa)接种水稻(Oryza sativa),引起叶片内过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)、LOX活性以及绿原酸和木质素含量的显著增加。用来源于水稻白叶枯病菌(Xanthomonas oryzae)的蛋白质激发子Harpinxoo喷雾处理烟草,对烟草花叶病毒表现较好的诱导抗病性,一定浓度下可引起叶片中PAL、POD、多酶氧化酶(PPO)活性的增加(闻伟刚等,2003);Jung等(2011)发现从芽孢杆菌(Bacillus)菌株中纯化获得的细菌素(class Ⅱd)可诱导大豆(Glycine max)PAL、APX、超氧化物歧化酶(SOD)和PPO等活性的增加;蒋继志等(2010)从31种微生物中筛选出了2种放线菌源激发子,其中放线菌A5295发酵液型激发子诱抗效果最好,达63.97%,并推测发酵液中有效诱抗物质可能是蛋白质类、多糖类等物质。
已有研究表明,植物的抗性与多种酶的活性及某些物质含量的变化有关。目前在植物抗病机制研究中,还未见杂交竹抗性相关酶与梢枯病关系的报道,特别是国内外对微生物源激发子的研究主要集中在真菌和细菌来源的微生物中,对放线菌来源激发子的研究不多。为此,本研究以来源于绛红褐链霉菌YSSPG3的抗菌蛋白为诱导因子,测定抗菌蛋白诱导以及诱导后挑战接种的杂交竹体内SOD、PPO、POD、CAT和PAL活性的时序变化,探究这些生理指标与病害发生的关系,以期从多角度反映抗菌蛋白对杂交竹梢枯病的生防机制。
1 材料与方法 1.1 供试材料 1.1.1 供试菌株杂交竹梢枯病菌(Arthrinium phaeospermum)由四川农业大学森林保护省级重点实验室提供;绛红褐链霉菌(Streptomyces purpeofuscus)YSSPG3由撑绿杂交竹(Bambusa pervariabilis×Dendrocalamopsis daii)健康植株根际分离获得,在葡萄糖酵母膏培养基(阎逊初,1975)上扩繁保存。
1.1.2 供试植物将苗高1.2 m、规格一致的撑绿杂交竹苗用于试验。用于喷雾处理的竹苗分株盆栽。
1.1.3 供试试剂聚乙烯吡咯烷酮(PVP,分析纯)、磷酸(分析纯)、氯化硝基四氮唑蓝(NBT,99%)、99% D-甲硫氨酸、EDTA-Na2、核黄素、邻苯二酚(分析纯)、三氯乙酸(分析纯)、愈创木粉(分析纯)、30%过氧化氢(分析纯)、硼酸(分析纯)、β-巯基乙醇、丙三醇(分析纯)、99% D-苯丙氨酸等均购自上海实验试剂有限公司。
1.2 抗菌蛋白的制备采用优化发酵培养基配方及发酵条件,使用全温震荡培养箱(ZQ-F160)分批次进行发酵,发酵液于8 000 r·min-1离心15 min(张丽娜等,2012a),取上清液经硫酸铵沉淀和柱层析法分离纯化获得抗菌蛋白AMP(张丽娜等,2012b),利用不连续SDS-PAGE测定分子量,验证不同批次抗菌蛋白AMP的纯度。将从36 L培发酵培养液中获得的73.66 mg抗菌蛋白AMP配置成360.56 μg·mL-1的母液,备用。
1.3 抗菌蛋白的诱导处理用无菌水将抗菌蛋白母液进行稀释,分别用10,20,50,100倍抗菌蛋白稀释液对撑绿杂交竹进行叶片喷雾诱导或浸根诱导。叶面喷雾方法: 各诱导液均匀喷洒于叶片,以叶面刚好滴水为准,24 h内喷施3次。浸根方法: 根部浸泡于各诱导液中,24 h后植入盆土中。以无菌水作对照。诱导处理后套袋保湿。每处理重复3次。
试验设置2组处理: 抗菌蛋白诱导但不接种,抗菌蛋白诱导后间隔3天挑战接种杂交竹梢枯病菌。挑战接种方法: 从PDA培养基上的菌落边缘切取菌龄为3天、直径为6 mm的撑绿杂交竹梢枯病菌菌饼,在叶片正面用无菌针刺出伤口,接种菌饼,菌面朝下,无菌湿润滤纸覆盖,套袋。以无菌水处理后接种杂交竹梢枯病菌为对照。每处理重复3次,每次重复接种10片叶。
逐日观察发病情况,按照以下方法计算接种后第7天的病情指数和防治效果(张丽娜等,2012b)。病情分级标准: 0级,无病斑; 1级,病斑面积10%以下;3级,11%~25%; 5级,26%~40%; 7级,41%~65%; 9级,65%以上。病情指数=[∑(病级叶数×代表数值)/(叶数总和×发病最重级的代表数值)]×100; 防治效果(%)=[(对照病情指数-处理病情指数)/发病对照病情指数]×100。
1.4 抗性相关酶活性测定在接种后的第1,3,5,7,9天取样,测叶片SOD,POD,PPO,PAL,CAT活性变化。SOD,POD,PPO,PAL粗酶液的制备:取0.2 g叶片,液氮研磨,加入2 mL含1%PVP的提取介质(SOD用0.05 mol·L-1 pH7.8磷酸缓冲液;POD与PPO用0.1 mol·L-1 pH6.5磷酸缓冲液;PAL用内含50 mmol·L-1硼酸缓冲液、5 mmol·L-1巯基乙醇、1 mmol·L-1 EDTA-Na2、5%甘油,pH8.3的提取液),于冰浴上研磨成匀浆,在10 000 r·min-1、4 ℃下离心10 min,上清液即为粗酶液。CAT粗酶液的制备: 0.2 g叶片,液氮研磨,加入适量4 ℃下预冷的0.2 mol·L-1 pH7.8的磷酸缓冲液(内含1%PVP)匀浆,之后转入10 mL容量瓶,用提取缓冲液定容至刻度,将容量瓶置入4 ℃冰箱静置10 min,取上部澄清液在4 000 r·min-1下离心15 min,上清液即为粗酶液。
SOD活力测定采用氮蓝四唑NBT光还原法(孔祥生等,2008; Giannopolitis et al.,1977),以1 h内抑制NBT光化还原的50%的酶用量为1个酶活性单位; PPO活力测定采用邻苯二酚法(赵会杰,2004; Liang et al.,2005),以1 min 吸光值变化0.001的酶量为1个酶活力单位; POD活力测定采用愈创木酚法(张治安等,2008; Saby et al.,2002),以1 min 吸光值变化0.001的酶量为1个酶活力单位; CAT活力测定采用紫外吸收法(孔祥生等,2008),以1 min内吸光值减少0.1的酶量为1个酶活力单位; PAL活力测定采用苯丙氨酸解氨法(张治安等,2008),以30 min增加0.01的酶量为1个酶活性单位。
1.5 数据统计分析应用SPSS 13.0统计软件进行分析,采用最小显著差数法(LSD法)进行不同处理间的差异显著性分析; 计算Pearson相关系数并进行相关性分析(徐向宏,2010)。
2 结果与分析 2.1 抗菌蛋白诱导对撑绿杂交竹叶片内抗性相关酶活性的影响 2.1.1 对SOD活性的影响各浓度抗菌蛋白喷雾诱导并接种后,各处理的SOD活性都高于对应浓度只诱导不接种的处理,浸根诱导处理后期(7~9天)也存在类似情况,说明病原菌在诱导SOD活性变化上起着重要的作用(图 1)。在只诱导不接种的处理中,喷雾诱导处理酶活性在整个阶段变化幅度较大,在第3天和第7天出现2个酶活性峰,但只有10倍稀释液处理的酶活性始终高于对照;浸根诱导酶活性变化虽较为缓和,但不同浓度抗菌蛋白诱导的酶活性都高于对应浓度的喷雾诱导处理,并且除100倍稀释液在第3天酶活性低于对照外,其他处理均高于对照,10倍和20倍处理与对照的差异都达到了显著水平(图 1A,C)。总体来看,在诱导并挑战接种的处理中都以10倍稀释液诱导效果最佳,20倍次之;在处理阶段后期(5~9天),浸根处理的诱导效果优于喷雾处理,对应浓度下酶活性的差异都达到了显著水平(图 1B,D)。
 |
图 1 不同浓度抗菌蛋白对撑绿杂交竹叶片SOD活性的影响 Fig. 1 Effect of antifungal protein at different concentration on SOD activity of the hybrid bamboo leaves A.喷雾抗菌蛋白不接种 Spray antifungal protein solution; B.喷雾抗菌蛋白并接种梢枯病菌 Spray antifungal protein solution and inoculated with A. phaeospermum; C.抗菌蛋白浸根不接种Soak root with antifungal protein solution; D.抗菌蛋白浸根诱导并接种梢枯病菌Soak root with antifungal protein solution and inoculated with A. phaeospermum.下同The same below. |
撑绿杂交竹经抗菌蛋白诱导及诱导后挑战接种,均可引起叶内PPO活性增强,在时序变化上都呈现先降后升的趋势; 各浓度抗菌蛋白浸根诱导处理的酶活性及其随时间的变化幅度都高于相应浓度的喷雾诱导处理(图 2)。在只诱导不接种的处理中,除100倍稀释液在第3天酶活性低于对照外,其他浓度在整个处理阶段均显著高于对照(图 2A,C); 经抗菌蛋白喷雾或浸根诱导并接种的处理中,都在第3天时出现一个酶活性低谷,此后酶活性开始不同程度上升(图 2B,D); 在整个处理阶段,10倍稀释液诱导的酶活性在第1,5和7天高于20倍稀释液,但二者都显著高于对照,而50倍和100倍稀释液诱导的酶活性有时则低于对照。
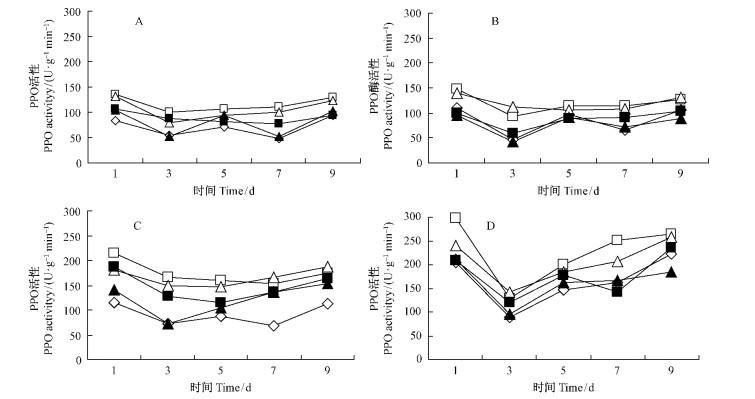 |
图 2 不同浓度抗菌蛋白对撑绿杂交竹叶片PPO活性的影响 Fig. 2 Effect of antifungal protein at different conentration on PPO activity of the hybrid bamboo leaves |
撑绿杂交竹经抗菌蛋白诱导及诱导后挑战接种,叶片内POD活性都在持续上升,且各浓度抗菌蛋白浸根诱导的酶活性变化幅度大于喷雾诱导(图 3)。喷雾或浸根诱导但不接种的处理中,除100倍稀释液喷雾处理外,其他处理的酶活性都高于对照,而且随时间变化差异显著增大(图 3A,C)。喷雾或浸根诱导并接种的处理中,在整个处理阶段,10倍和20倍稀释液喷雾诱导的酶活性都高于对照,而50倍和100稀释液诱导的酶活性则有时高于对照有时低于对照; 各浓度浸根诱导的的酶活性都始终明显高于对照。 2种诱导方法都以10倍稀释液诱导的酶活性变化幅度最大,20倍次之; 各浓度抗菌蛋白浸根诱导的酶活性都高于对应浓度的喷雾诱导 (图 3B,D)。
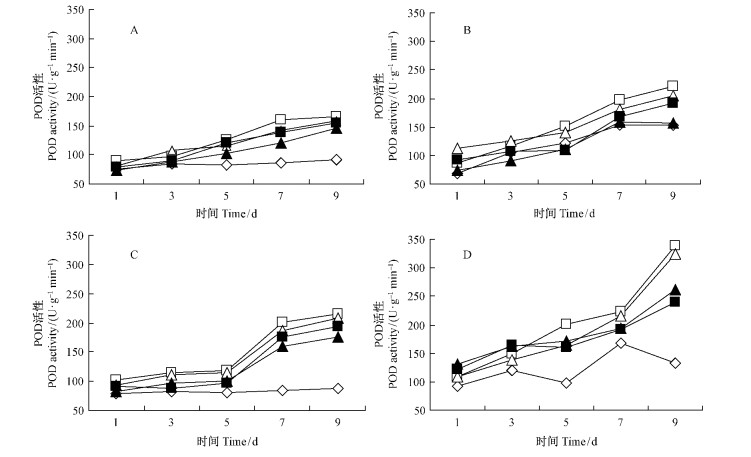 |
图 3 不同浓度抗菌蛋白对撑绿杂交竹叶片POD活性的影响 Fig. 3 Effect of antifungal protein at different concentration on POD activity of the hybrid bamboo leaves |
杂交竹经不同浓度抗菌蛋白诱导及诱导后挑战接种,CAT活性的时序变化差异较大。总体上看,10倍和20倍稀释液诱导后CAT活性变化幅度较大,均表现较高的活性水平,这与活性氧的有效清除有关,而50倍和100倍稀释液诱导后CAT活性变化幅度较小,活性水平相对较低;在诱导并接种的处理中,10倍和20倍稀释液浸根诱导处理在第5天时低于喷雾处理,除此之外,各浓度抗菌蛋白浸根处理的CAT活性均高于同期对应浓度的喷雾处理(图 4)。在喷雾诱导及诱导后挑战接种的处理中,20倍稀释液处理的CAT活性在1~5天内高于10倍稀释液,此后则相反(图 4A,B);在浸根诱导及诱导后挑战接种的处理中,20倍稀释液处理的CAT活性在第1天时高于10倍稀释液处理,3~5天内二者差异不显著,7~9天则低于10倍稀释液(图 4C,D)。
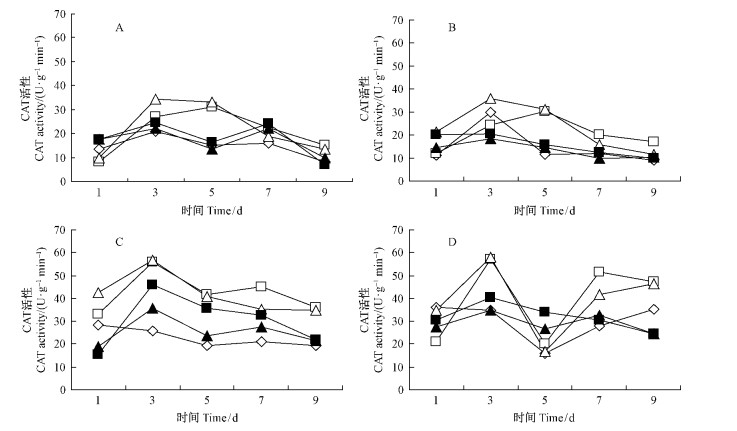 |
图 4 不同浓度抗菌蛋白对撑绿杂交竹叶片CAT活性的影响 Fig. 4 Effect of antifungal protein at different concentration on CAT activity of the hybrid bamboo leaves |
在喷雾或浸根诱导但不接种的处理中,经10倍稀释液诱导的酶活性变化幅度最大,酶活性在第3天时最大,分别为158.20和150.33 U·g-1·min-1,显著高于其他浓度,在第5天时最小,分别为101.38和120.00 U·g-1min-1,而且前者还小于对照;在整个处理阶段,只有20倍稀释液诱导处理的酶活性都显著高于对照(图 5A,C)。与只诱导不接种的处理相比,经不同浓度抗菌蛋白诱导后再挑战接种的酶活性都有不同程度的升高,特别是在5~9天上升幅度较大;在喷雾诱导中,10倍和20倍稀释液诱导的酶活性在第1天时低于对照,在3~9天都显著高于对照,50倍稀释液诱导的酶活性只有在第3天时高于对照,100倍稀释液处理酶活性均低于对照;在浸根诱导处理中,10倍和20倍稀释液诱导的酶活性高于对照以及50倍和100倍的处理,50倍和100倍处理的酶活性则有时低于对照;各浓度浸根诱导处理的PAL活性都高于对应浓度的喷雾诱导处理(图 5B,D)。
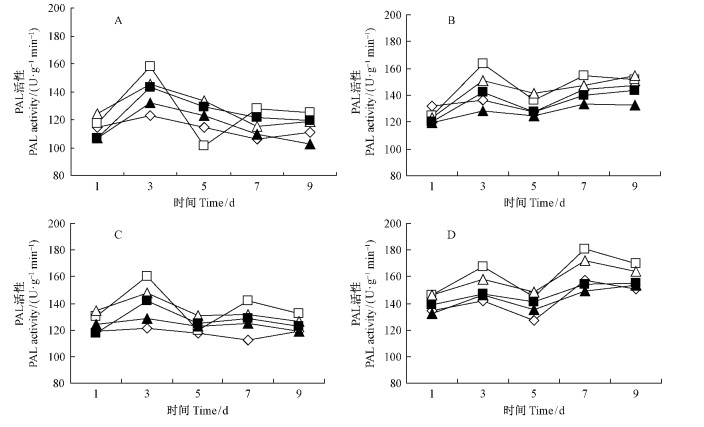 |
图 5 不同浓度抗菌蛋白对撑绿杂交竹叶片PAL活性的影响 Fig. 5 Effect of antifungal protein at different concentration on PAL activity of the hybrid bamboo leaves |
从感病程度分析,不论是喷雾或是浸根诱导,不同浓度抗菌蛋白处理的病情指数差异显著,除100倍稀释液处理与对照差异不显著外,其余均显著低于对照(P<0.05),其中,以10倍稀释液处理的病情指数最低,分别是23.95和20.89,20倍稀释液次之。喷雾和浸根2种诱导方法都以10倍抗菌蛋白稀释液的防治效果最好,分别为56.22%和62.88%,其次是20倍稀释液的处理,分别为45.39%和51.18%。50倍稀释液的防治效果均在20%以上。 100倍稀释液诱导后挑战接种,发病最为严重,防治效果仅为0.10%~2.77%。这表明随着抗菌蛋白处理浓度的升高,撑绿杂交竹的抗病能力也随之增强(表 1)。
|
|
抗性相关酶活性与病情指数的相关程度因诱导方法不同而有所差异(表 1)。在喷雾诱导处理中,PPO,POD,CAT与病情指数呈显著负相关,其他酶活性的相关系数均未达到显著水平; 在浸根诱导处理中,SOD,PAL与病情指数相关性达显著水平,其他酶活性的相关性较低。
3 结论与讨论 3.1 寄主防御酶系对抗菌蛋白的响应植物在逆境下,体内活性氧的积累可激发植物的抗病反应(Thoma et al.,2003),但活性氧的累积可使膜脂过氧化而导致膜系统受损,使植物组织受到伤害。在植物保护酶系中,SOD 是主要的活性氧清除酶类,它催化O2-·转化为H2O2和O2,POD和CAT 又使H2O2转化为H2O和O2,这3种酶共同作用可维持体内的活性氧代谢平衡,保护膜结构,从而使植物能在一定程度上忍耐、减缓或抵抗逆境胁迫(宋凤鸣等,1996; Paczkowska et al.,2007)。本试验结果显示,接种杂交竹梢枯病菌能够引起SOD,POD和CAT 3种酶活性的升高,这与李姝江等(2011)的研究结果一致,用适当浓度的抗菌蛋白诱导也能够引起3种酶活性的升高; 在诱导后再挑战接种的处理中,10倍和20倍抗菌蛋白稀释液诱导后3种酶均表现较高的活性水平。在整个处理阶段,SOD和POD活性都高于染病对照,CAT活性在第3~9天也高于染病对照; 而50倍和100倍稀释液诱导后酶活性水平相对较低,甚至在某处理阶段低于染病对照。可见适当浓度的抗菌蛋白可诱导撑绿杂交竹中SOD,POD和CAT的活性,抑制由于病原菌侵染而造成的活性氧的增加,维持体内活性氧的代谢平衡,从而增强了抗病性。
PAL是沿苯丙烷类代谢途径合成木质素与植保素的关键调节酶,可使木质素大量生成并沉积在细胞壁周围,将病原菌限制在一定的细胞范围之内,从而修复伤口,抑制病原菌的繁殖(Pellegrini et al.,1994; Avdiushko et al.,1993); POD不仅可清除细胞内的活性氧,还可催化酚类物质的前体聚合为木质素,起到加固植物细胞壁、抵抗病原物入侵的作用(Ray et al.,1998); PPO是植物体内普遍存在的一种酚类氧化酶,主要功能是将酚类物质氧化成对病原菌毒性更强的醌类物质,其活性增强对植物抗病反应十分有利(Volpin et al.,1995)。三者联合作用构成了保护性屏障,进而限制病原菌的扩展。本试验结果显示,PAL,POD和PPO 3种酶活性的变化趋势不同,可能在时序上存在互补作用。接种撑绿杂交竹梢枯病菌或抗菌蛋白诱导都可以引起撑绿杂交竹叶内3种酶活性的升高,但是经适当浓度抗菌蛋白诱导处理的酶活性,其升高幅度较病原菌诱导的大。抗菌蛋白诱导后再挑战接种的情况下,不同浓度抗菌蛋白处理的酶活性与染病对照之间的差异因诱导方法不同而有所不同,但总体上,10倍和20倍稀释液处理的3种酶活性水平都较高,除喷雾处理第1天 PAL酶活性低于染病对照外,其余都高于染病对照。说明适当浓度的抗菌蛋白可诱导撑绿杂交竹中PAL,POD和PPO的活性,增强其抗病性,从而限制病原菌的扩展。
3.2 抗性相关酶活性因诱导方法不同而有差异诱导因子在诱导植物抗病性过程中,诱导方法与诱导抗性效应间有着密切的关系,选择适宜的诱导方法是能否成功诱导抗病性的关键。总体上看,POD,PPO,CAT 3种酶活性用浸根处理的时序变化幅度及同时期升高幅度大于喷雾处理,SOD和PAL的差异不明显。由此可见,在诱导因子相同的情况下,各种防御酶活性受诱导方法的影响而有差异,在实际应用中可考虑2种方法结合使用。
3.3 抗性相关酶活性与感病程度存在相关性余晔等(2010)认为营养液中加硅处理黄瓜幼苗并接种黄瓜霜霉病菌(Pseudoperonospora cubensis),在一定硅浓度范围内,硅浓度、酶活性和病情指数的变化呈现一致性。李姝江等(2011)报道山茶(Camellia japonica)的抗病能力随SA处理浓度的升高而增强,其抗病性与CAT,PAL和POD活性有很高的相关性。本研究发现,随着抗菌蛋白处理浓度的升高,撑绿杂交竹的抗病能力也随之增强;抗性相关酶活性与抗病性的相关程度因诱导方法不同而有所差异,抗病性在喷雾诱导处理中与PPO,POD和CAT活性相关性显著,在浸根诱导处理中与SOD,PAL活性相关性显著,说明抗性酶与病情指数的变化存在内在的关联性。由于抗菌蛋白对杂交竹枯梢病菌有抑菌作用,因此,撑绿杂交竹梢枯病防病效果是抗菌蛋白自身抑菌作用和通过诱导寄主产生抗病性综合作用的反映。
| [1] |
陈祖静,曹支敏,苟兴庆,等.2010.杨树与松杨栅锈菌互作中寄主活性氧及抗性相关酶变化.林业科学,46(8): 101-106.( 1) 1)
|
| [2] |
蒋继志,孙琳琳,郭会婧,等.2010.几种微生物提取物诱导马铃薯抗晚疫病及机理的初步研究.植物病理学报,40(2): 173-179.( 1) 1)
|
| [3] |
孔祥生,易现峰.2008.植物生理学实验技术.北京:中国农业出版社,129-131,259-261.( 2) 2)
|
| [4] |
李姝江,朱天辉,黄艳娜.2011.防御酶系对山茶灰斑病诱导抗性的响应.植物保护学报,38(1): 59-64.( 2) 2)
|
| [5] |
李姝江,朱天辉,杨莉,等.2011.暗孢节菱孢菌非蛋白类毒素对杂交竹生理代谢的影响.植物病理学报,41(6): 587-595.( 2) 2)
|
| [6] |
李云锋,王振中,贾显禄.2004.稻瘟菌激发子CSBⅠ诱导水稻防御性相关酶的活性变化.作物学报,30(6): 613-617.( 1) 1)
|
| [7] |
梁建根,张炳欣,陈振宇,等.2006.促生菌CH1诱导黄瓜对猝倒病抗性的研究.园艺学报,33(2): 283-288( 1) 1)
|
| [8] |
刘晓光,高克祥,康振生,等.2007.生防菌诱导植物系统抗性及其生化和细胞学机制.应用生态学报,18(8): 1861-1868.( 1) 1)
|
| [9] |
宋凤鸣,郑重,葛秀春.1996.活性氧及膜脂过氧化在植物-病原物互作中的作用.植物生理学通讯,32(5): 377-385.( 1) 1)
|
| [10] |
童蕴慧,郭桂萍,徐敬友,等.2004.拮抗细菌对番茄植株抗灰霉病的诱导.中国生物防治,20(3);187-189.( 1) 1)
|
| [11] |
闻伟刚,邵敏,陈功友,等.2003.水稻白叶枯病菌蛋白质激发子Harpinxoo诱导植物的防卫反应.农业生物技术学报,11(2): 192-197.( 1) 1)
|
| [12] |
徐向宏,何明珠.2010.试验设计与Design-Expert、SPSS应用.北京:科学出版社,72-78.( 1) 1)
|
| [13] |
阎逊初.1975.链霉菌鉴定手册.北京:科学出版社.( 1) 1)
|
| [14] |
余晔,杜金萍,杜相革.2010.硅对黄瓜霜霉病抑制效果和抗性相关酶活性的影响.植物保护学报,37(1): 36-41.( 1) 1)
|
| [15] |
张丽娜,朱天辉,李芳莲.2012a.绛红褐链霉菌YSSPG3的鉴定及其抗菌蛋白纯化.植物病理学报,42(3): 242-251.( 1) 1)
|
| [16] |
张丽娜,朱天辉,张继甫.2012b.绛红褐链霉菌YSSPG3的发酵条件及其发酵滤液对杂交竹梢枯病的防治作用.植物保护学报,39(3): 237-245.( 2) 2)
|
| [17] |
张治安,陈展宇.2008.植物生理学实验技术.长春:吉林大学出版社,182-183,202-203.( 2) 2)
|
| [18] |
赵会杰.2004.现代植物生理学实验指南.北京:科学出版社,317-318.( 1) 1)
|
| [19] |
Avdiushko S A,Ye X S,Kuc J.1993.Detection of several enzymatic activities in leaf prints of cucumber plants.Physiological and Molecular Plant Pathology,42(6): 441-454.( 1) 1)
|
| [20] |
Giannopolitis C N,Ries S K.1977.Superoxide dismutases: I.Occurrence in higher plants.Plant Physiology,59(2): 309-314.( 1) 1)
|
| [21] |
Hahn M G.1996.Microbial elicitors and their receptors in plants.Annual Review of Phytopathology,34: 387-412.( 1) 1)
|
| [22] |
Jung W J,Mabood F,Souleimanov A,et al. 2011.Induction of defense-related enzymes in soybean leaves by class Ⅱd bacteriocins(thuricin 17 and bacthuricin F4)purified from Bacillus strains.Microbiological Research,167(1): 14-19.( 1) 1)
|
| [23] |
Liang Y C,Sun W C,Si J,et al. 2005.Effects of foliar and root applied silicon on the enhancement of induced resistance to powdery mildew in Cucumis sativus. Plant Pathology,54(5): 678- 685.( 1) 1)
|
| [24] |
Mao J,Liu Q,Yang X,et al. 2010.Purification and expression of a protein elicitor from Alternaria tenuissima and elicitor-mediated defence responses in tobacco.Annals of Applied Biology,156(3): 411-420.( 1) 1)
|
| [25] |
Paczkowska M,Kozlowska M,Golinski P.2007.Oxidative stress enzyme activity in Lemna minor L.exposed to cadmium and lead.Biological Cracoviensia Series Botanica,49(2): 33-37.( 1) 1)
|
| [26] |
Pellegrini L,Rohfritsch O,Fritig B,et al. 1994.Phenylalanine ammonia-lyase in tobacco.Plant Physiology,106(3): 877-886.( 1) 1)
|
| [27] |
Ray H,Douches D S,Hammerschmidt R.1998.Transformation of potato with cucumber peroxidase: Expression and disease response.Physiological and Molecular Plant Pathology,53(2): 93-103.( 1) 1)
|
| [28] |
Saby John K,Bhat S G,Prasada Rao U J S.2002.Involvement of peroxidase and polyphenol oxidase in mango sap-injury.Journal of Food Biochemistry,26(5): 403-414.( 1) 1)
|
| [29] |
Thakker J N,Patel P,Dhandhukia P C.2011.Induction of defence-related enzymes in susceptible variety of banana: role of Fusarium-derived elicitors.Archives of Phytopathology and Plant Protection,44(20): 1976-1984.( 1) 1)
|
| [30] |
Thoma I,Loeffler C,Sinha A K.2003.Cyclopentenone isoprostanes induced by reactive oxygen species trigger defense gene activation and phytoalexin accumulation in plants.The Plant Journal,34(3): 363-375.( 1) 1)
|
| [31] |
Volpin H,Phillips D A,Okon Y,et al. 1995.Suppression of an isoflavonoid phytoalexin defense response in mycorrhizal alfalfa roots.Plant Physiology,108(4): 1449-1454.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

