文章信息
- 王曦茁, 马建伟, 汪来发, 李永, 余明忠
- Wang Xizhuo, Ma Jianwei, Wang Laifa, Li Yong, Yu Mingzhong
- 厚垣普可尼亚菌液体发酵动力学
- Kinetic Study of the Liquid Fermentation for Pochonia chlamydosporia
- 林业科学, 2014, 50(11): 75-81
- Scientia Silvae Sinicae, 2014, 50(11): 75-81.
- DOI: 10.11707/j.1001-7488.20141110
-
文章历史
- 收稿日期:2013-09-20
- 修回日期:2014-03-19
-
作者相关文章
2. 四川省茂县林业局 茂县 623200
2. Maoxian Forestry Bureau of Sichuan Province Maoxian 623200
植物线虫是一类对农林业生产危害十分严重且分布广、难以防治的植物病原物,线虫病害已成为农林业生产上的重要问题(刘维志,2004)。使用杀线虫剂对环境污染严重,甚至会引起食物安全问题,使用过程对人、畜也不安全,许多化学杀线剂如呋喃丹、铁灭克等已被禁用,因此植物线虫病害的生物防治日益受到重视。
在植物线虫的生物防治中,厚垣普可尼亚菌(Pochonia chamydosporia=Verticillium chlamydosporium)(Zare et al., 2001)是有应用潜力的真菌之一(Kerry,1988)。早在1974年就发现厚垣普可尼亚菌能够寄生线虫的卵(Willcox et al.,1974),后来发现该菌对南方根结线虫(Meloidogyne incognita)、花生根结线虫(M.arenaria)和大豆孢囊线虫(Heterodera glycines)等线虫的雌虫、孢囊、卵囊或虫卵有很强的寄生能力(林茂松等,1994;Chen et al.,1996;刘畅,2004;卢明科等,2004)。厚垣普可尼亚菌主要通过内寄生的方式寄生于卵及雌虫体内,通过大量繁殖使线虫死亡;该菌具有较广的适应能力,对营养和环境的要求不高,对pH值的适应范围也较广,可以人工大量繁殖。该菌易于培养,且可以寄生多种植物线虫,因而有利于田间防治的应用,目前已成功地用于防治花椒根结线虫病(Wang et al.,2013)。
液体发酵是目前多数丝孢类真菌杀虫制剂的主要生产方法(Papavizas et al.,1984),如金龟子绿僵菌(Metarhizium anisopliae)(宋漳,2001;王乔等,2012)、蜡蚧轮枝菌(Verticillium lecanii)(殷华等,2004)和莱氏野村菌(Normuraea rileyi)(冯冬梅,1989)等。该方法生产周期短、效率高、污染率低,易于规模化工业生产。对于厚垣普可尼亚菌生产方法的研究主要集中在发酵条件和培养基的优化方面(Liu et al.,2003;Mo et al.,2005;刘春秀等,2006),液体发酵的控制还仅限于pH、温度、压力和转速等理化参数的调控(刘春秀,2006),对具体代谢途径及发酵动力学的研究较少,因此无法对发酵过程实现精细控制和规模化生产。为了最大限度地利用厚垣普可尼亚菌这一生防资源,解决工业生产过程中出现的问题,开发出高效、稳定和产业化的真菌杀线虫剂,笔者对其液体培养基及培养条件和发酵动力学进行了研究。
1 材料与方法 1.1 菌种厚垣普可尼亚菌源自美国,经寄生率测定,对南方根结线虫卵的寄生率为80.0%(汪来发等,1999),菌种保藏于中国林业科学研究院森林生态环境与保护研究所。
1.2 发酵条件的优化选择以复合培养基配方[碳源40.0 g·L-1(葡萄糖20.0 g·L-1,玉米粉20.0 g·L-1),氮源黄豆粉20 .0 g·L-1,无机盐1.0 g·L-1(KH2PO4 0.5 g·L-1,MgSO4·7 H2O 0.5 g·L-1)](刘春秀等,2006)为基础,对碳源、氮源、接种量、pH值、无机盐、装量和转速7因素3水平进行L18(37)的正交设计(表 1),以产孢量作为筛选标准,进行发酵条件的优化选择。
|
|
取灭菌的浓度为0.05 %的吐温80 15.0 mL,倒入经PDA培养10天的厚垣普可尼亚菌平板中,用无菌水洗下孢子,振荡混匀,制成孢子悬浮液,计数为4.0×108个·mL-1。
1.3.2 培养条件分别于500 mL 三角瓶中装入培养基(100,200,300 mL),121 ℃下湿热灭菌30 min,冷却至室温,用0.5 mol·L-1 HCl和50.0 g·L-1NaOH 调节初始 pH 值(5.0,6.0和7.0)。在无菌条件下,接种孢子悬浮液,置 28 ℃ 摇床培养,每处理设3次重复。
1.3.3 生物测定内容及方法以正交试验组6的条件进行液体发酵,自发酵24 h开始,每隔12 h取发酵液进行孢子数量、还原糖和氨基氮含量的测定,并绘制必要的曲线。
孢子数目通过发酵液稀释一定倍数后用血球计数板计数得到,每个样品重复计数10次。
还原糖(葡萄糖)浓度测定采用3,5-二硝基水杨酸(DNS)比色法(张龙翔等,1997)。
氨基氮(NH2-N)浓度测定采用中性甲醛法(刘春秀,2006)。
1.4 发酵模型构建及发酵动力学比速率求解以正交试验组6的条件进行液体发酵(方法同1.3.2),取发酵过程中的孢子量、还原糖和氨基氮含量的统计数据作为发酵动力学拟合数据。采用Origin Pro V8.6软件对数据分别进行产孢量变化、还原糖和氨基氮的动力学拟合和比速率求解。
1)产孢量拟合 采用Grow/Sigmoidal模型中的非线性拟合方程Logistic函数,其表达式为
| $ Y = \frac{{{A_1} - {A_2}}}{{1 + {{\left( {X/{X_0}} \right)}^P}}} + {A_2}。 $ |
式中:X为发酵时间,单位h;A1为函数曲线的初始值,A2为曲线的上渐近线,X0为曲线上渐近线和Y=A1这2条直线的中线与曲线的交点所对应的X值;p为常数。
采用Grow/Sigmoidal模型中的非线性拟合方程Boltzmann函数拟合还原糖消耗和氨基氮生成曲线,其表达式为
| $ Y = \frac{{{A_1} - {A_2}}}{{1 + {e^{\left( {X/{X_0}} \right)/dX}}}} + {A_2}。 $ |
式中:X为发酵时间,单位h;A1和A2分别为曲线的下渐近线和上渐近线;X0为曲线与2条渐近线的中线的交点对应的X值。dX为时间常数,dX=1时,Y值为2条渐进线与拐点处S型曲线切线斜率比值的1/4。
2)比速率求解 比速率方程为:
| $ \mu = \frac{1}{X}\frac{{dX}}{{dt}},qS\left( C \right) = \frac{1}{X}\frac{{dS\left( C \right)}}{{dt}},qS\left( N \right) = \frac{1}{X}\frac{{dS\left( N \right)}}{{dt}}。 $ |
式中:μ为孢子量比生长速率,qS(C)为还原糖比消耗速率,qS(N)为氨基氮比生成速率,单位为h-1;X为孢子浓度,单位为107个·mL-1;S(C)和S(N)分别为发酵液中还原糖浓度或氨基氮浓度,单位为g·L-1。
3)插值计算 对拟合曲线通过 Origin Pro V8.6 软件中的 Interpolate/Extrapolate 功能进行差值 计算,对优化培养基的产孢量、还原糖消耗或氨基氮生成速率拟合曲线插值计算时的间隔时间是0.120 h。由于间隔时间很短,可利用Excel软件 通过下式分别计算不同时间的μ和qS(C)和 qS(N):
| $ \begin{array}{l} \mu \approx \frac{1}{X}\mathop {\lim }\limits_{\Delta t \to \infty } \frac{{\Delta X}}{{\Delta t}},\\ qS\left( C \right) \approx \frac{1}{X}\mathop {\lim }\limits_{\Delta t \to 0} \frac{{\Delta S\left( C \right)}}{{\Delta t}},\\ qS\left( N \right) \approx \frac{1}{X}\mathop {\lim }\limits_{\Delta t \to 0} \frac{{\Delta S\left( N \right)}}{{\Delta t}}。 \end{array} $ |
式中:ΔX表示在Δt时间的孢子量的增量,ΔS(C)表示在Δt时间的还原糖的消耗量,ΔS(N)为氨基氮生成量,X表示该时间的产孢量。
将用Excel计算的各时间的μ,qS(C)或qS(N)利用Origin Pro V8.6软件分别作图,并利用Smooth功能进行平滑处理,分别得到厚垣普可尼亚菌孢子量比生长速率和还原糖比消耗速率或氨基氮比生成速率曲线图。
2 结果与分析 2.1 产孢的优化培养基及培养条件通过正交试验产孢量表可知,在正交设计部分试验组合条件下,试验组6和17平均产孢量较高,试验组6的最高产孢量达到105.25×107个·mL-1。各试验重复的标准差和变异系数分析表明,试验产孢量结果较为稳定,产孢量较高的试验组6和17的变异系数分别为6.46%和8.68%,各试验组变异不大(表 2)。经方差分析,正交试验结果表明:转速对孢子产量影响显著;经极差分析(表 3),各试验因子对产孢量的影响表现为:转速>接种量>装量>pH值> C源>无机盐> N源。最优试验条件为A2B3C3D1E1F2G2,试验组6是比较适合产孢的优化培养基及培养条件,其编码值转换成实际值如下:葡萄糖15.0 g·L-1,玉米粉15.0 g·L-1,大豆粉20.0 g·L-1,KH2PO4 0.25 g·L-1,MgSO4·7 H2O 0.25 g·L-1,接种量5%,初始pH 5.0,装量40%和转速190 r·min-1。
|
|
|
|
厚垣普可尼亚菌液生孢子是在菌丝生长的基础上产生的。在发酵培养初期有菌丝产生,但基本上无孢子产生或仅产生少量孢子;随发酵时间的延长,孢子快速产生,发酵后期当菌体不再继续生长时,仍可产生大量孢子。由图 1可以看出:从发酵开始至36 h是孢子生长的滞留期,36~72 h产孢量增长缓慢,72 h开始孢子产量急剧增加,进入高峰期,120 h以后产孢量增长趋势减弱,进入稳定期,发酵终点来临,发酵结束,此时菌丝体逐渐衰老甚至开始出现自溶现象,发酵液黏稠度降低。从图中可以发现普可尼亚菌液生孢子生长呈现S型曲线(图 1),符合真菌生长的特点。
 |
图 1 厚垣普可尼亚菌发酵过程中产孢量随时间的变化 Fig. 1 Change of the spore output during the fermentation of P. chlamydosporia |
在微生物发酵生产工艺中,发酵终点的选择非常重要。适宜的放罐时间既有利于节省大量的原材料,又有利于获得高品质的发酵产物,一般放罐时间应设在产物产量的高峰期。本试验根据产孢曲线,初步确定发酵周期为 120 h 左右。
2.2.2 碳源和氮源的代谢分析图 2表明,随着发酵的继续,还原糖浓度呈明显的下降趋势。在发酵的0~84 h,还原糖消耗速度较慢,这时正是发酵的滞留适应期及对数生长期;84~96 h还原糖浓度急剧下降,此时产孢量正急剧升高,处在发酵的快速生长期;96 h以后还原糖浓度缓慢下降,至菌体不再继续生长时,孢子仍可大量产生,120 h后还原糖浓度下降趋势明显减弱,趋于稳定,产孢处在稳定期。
 |
图 2 厚垣普可尼亚菌发酵过程中还原糖质量浓度随时间的变化 Fig. 2 Change of the reducing sugar concentration during the fermentation of P. chlamydosporia |
图 3表明: 氨基氮浓度在发酵24~108 h有缓慢上升趋势,在108~120 h 加速增加,120 h时达到最大值,到达最大值后逐渐趋于稳定。这可能是由于菌丝生长和孢子形成时,厚垣普可尼亚菌为满足生长的需要而诱导培养基中的大豆粉产生大量的氨基氮,从而使氨基氮积累,分解速度大于利用速度,氨基氮浓度升高。
 |
图 3 厚垣普可尼亚菌发酵过程中氨基氮质量浓度随时间的变化 Fig. 3 Change of the amino nitrogen during the fermentation of P. chlamydosporia |
根据碳源和氮源的代谢分析可知,在考虑添加补料时,要适时补充碳源,由于在发酵过程中氨基氮不断积累,所以不必考虑补充N源。
2.3 发酵动力学模型的拟合以厚垣普可尼亚菌液生孢子产量为目标的液体发酵动力学,包括孢子生长动力学、底物消耗动力学和产物生成动力学3个重要方面。采用Grow/Sigmoidal模型中的非线性拟合方程Logistic函数和Boltzmann函数对厚垣普可尼亚菌发酵过程中孢子产量、还原糖消耗和氨基氮生成进行拟合,表 4为厚垣普可尼亚菌孢子产量、还原糖和氨基氮拟合后求解出的模型参数。模型预测值与试验检测值(图 4—6)较好吻合,并且拟合模型的判定系数均在0.97以上(表 4),表明Grow/Sigmoidal模型在对厚垣普可尼亚菌的液体发酵规律拟合方面具有较好的适应性。
|
|
 |
图 4 厚垣普可尼亚菌发酵过程中产孢量模拟 Fig. 4 Simulation of the spore output during the fermentation of P.chlamydosporia |
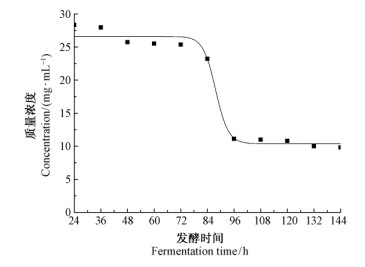 |
图 5 厚垣普可尼亚菌发酵过程中还原糖质量浓度变化模拟 Fig. 5 Simulation of the reducing sugar concentration during the fermentation of P.chlamydosporia |
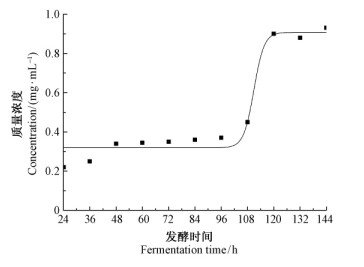 |
图 6 厚垣普可尼亚菌发酵过程中氨基氮质量浓度变化模拟 Fig. 6 Simulation of the amino nitrogen concentration during the fermentation of P.chlamydosporia |
在限制性条件下群体生长的特点是培养初期生长受抑制或生长速度较慢,随后生长加快,当比生长速率达到最大值后会逐渐降低直至停止生长(宋健等,2007)。普可尼亚菌发酵过程(图 7—9)表明,孢子比生长速率在88.1 h时达到最大,最大值为0.030 2 h-1; 还原糖比消耗速率在86.8 h时达到最大,最大值为0.033 4 h-1; 氨基氮比生成速率在110.8 h时达到最大,最大值为6.864×10-4h-1。这表明孢子产生与碳源和氮源的消耗是部分偶联关系。
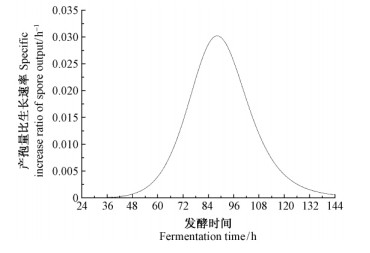 |
图 7 厚垣普可尼亚菌发酵过程中产孢量比生长速率 Fig. 7 Increase ratio of the spore output during the fermentation of P.chlamydosporia |
 |
图 8 厚垣普可尼亚菌发酵过程中还原糖比消耗速率 Fig. 8 Consumption ratio of the reducing sugar during the fermentation of P.chlamydosporia |
 |
图 9 厚垣普可尼亚菌发酵过程中氨基氮比生成速率 Fig. 9 Generation ratio of the amino nitrogen during the fermentation of P.chlamydosporia |
高效和经济的发酵工艺,可以有效提高发酵产品在市场上的竞争力,因此必须进行发酵过程的优化。本研究在前期工作的基础上,通过正交试验设计优化出一种最适培养基和培养条件,使孢子产量提高到105.25×107个·mL-1,比筛选基础培养基的产孢量提高了147.6%,比刘春秀等(2006)筛选出的复合培养基产孢量提高了28.4%,也高于其他研究的结果(Liu et al.,2003;Mo et al.,2005;Cao et al.,2007),具有发酵终点时间短、产孢量高的特点。
发酵动力学是研究各种环境因素与微生物代谢活动之间的相互作用随时间变化规 律的科学,开展此类研究是实现发酵过程最优化控制及发酵过程放大的前提条件。由于微生物生长和代谢产物形成过程的复杂性,要建立一个精确或通用的模型来描述微生物的细胞生长或产物形成过程是十分困难的(王晓玲等,2011)。本文之所以选择 Sigmoid 模型中 Logistic 函数和Boltzmann 函数而没有选择传统的底物消耗动力学方程Luedeking-Pire来进行厚垣普可尼亚菌发酵动力学模型的构建,主要是由于厚垣普可尼亚菌液体发酵同时存在碳源和氮源代谢,同时模型具有推导和参数估算比较简便的特点,且对本试验数据拟合效果较好。许多液体发酵动力学模型是基于发酵过程中的生物量和发酵产物来进行研究的(钟士清等,1995; 张昀羿等,2005; 徐鹏等,2008; 王晓玲等,2011),而厚垣普可尼亚菌在液体发酵的过程中,菌丝的生长和孢子的产生是不同步的,在发酵培养的初期有菌丝产生,但基本上是无孢子产生或仅产生少量孢子,随发酵时间的延长,大部分时间内菌体生长和产孢是同时进行的,既有菌丝生长,又有孢子产生,发酵后期当菌体不再继续生长时,孢子仍可大量产生,而发酵的结果是以孢子的含量进行评估的,因此该模型对孢子产量的监测具有极大的实用性,检测时间短且方便。Sigmoid 模型在厚垣普可尼亚菌液体发酵孢子生长和还原糖和氨基氮浓度的拟合方面有较好的适应性,为液体生产厚垣普可尼亚菌提供了理论依据。今后需要进一步通过厚垣普可尼亚菌的逐级放大发酵来验正该模型的实用性,并在应用过程中不断对其进行校正,为规模化的生产奠定基础。
| [1] |
冯冬梅.1989.莱氏野村菌生长和产孢条件的探索.西南农业学报,2(2): 57-62.( 1) 1)
|
| [2] |
林茂松,沈素文.1994.厚壁轮枝菌防治南方根结线虫研究初报.生物防治通报,10(1): 7-10.( 1) 1)
|
| [3] |
刘畅.2004.厚垣轮枝菌V10菌株对南方根结线虫的寄生和防治作用.广西农业科学,35(2): 135-137.( 1) 1)
|
| [4] |
刘春秀,汪来发,朴春根,等.2006.厚壁轮枝菌摇瓶发酵培养的研究.林业科学研究,19(2): 141-144.( 4) 4)
|
| [5] |
刘春秀.2006.厚壁轮枝菌和淡紫拟青霉发酵条件及代谢特性的研究.北京:中国林业科学研究院硕士学位论文.( 4) 4)
|
| [6] |
刘维志.2004.植物线虫志.北京:中国农业出版社,1-2.( 1) 1)
|
| [7] |
卢明科,潘沧桑,李舟.2004.厚垣轮枝孢菌(Verticillium chlamydosporium)防治植物线虫研究进展.西北农林科技大学学报,32(4): 103-107.( 1) 1)
|
| [8] |
宋健,林建群,金燕,等.2007.以比生长速率时间曲线为基础的生物群体生长数学模型.微生物学通报,34(5): 836-838.( 1) 1)
|
| [9] |
宋漳.2001.液体深层培养绿僵菌分生孢子的研究.林业科学,37(5): 134-139.( 1) 1)
|
| [10] |
汪来发,杨宝君.1999.根结线虫三种天敌真菌生物学特性的研究.安徽农业大学学报,26(2): 138-140.( 1) 1)
|
| [11] |
王乔,王海胜,农向群,等.2012.金龟子绿僵菌IMI330189液体发酵动力学研究.菌物学报,31(3): 398-404.( 1) 1)
|
| [12] |
王晓玲,赵艳,刘高强,等.2011.灵芝三萜酸分批发酵的非结构动力学模型.菌物学报,30(5): 767-773.( 2) 2)
|
| [13] |
徐鹏,钱竹,董亮,等.2008.灵芝深层发酵深层胞外多糖和灵芝酸的动力学分析.应用与环境生物学报,14(4): 562-565.( 1) 1)
|
| [14] |
殷华,李锋,蒋继宏.2004.蜡蚧轮枝菌液体发酵的代谢动力学.安徽农业大学学报,31(3): 340-343.( 1) 1)
|
| [15] |
张龙翔,张庭芳,李令媛.1997.生化实验方法和技术.2版.北京:高等教育出版社,1-260.( 1) 1)
|
| [16] |
张昀羿,李元广,金建,等.2005.SAM产生菌酿酒酵母HYS98发酵动力学及比生长速率控制策略.过程工程学报,5(3): 322-326.( 1) 1)
|
| [17] |
钟士清,胡文锋,罗国威,等.1995.冬虫夏草头孢菌菌丝体液体发酵条件研究.华南农业大学学报,16(3): 108-11.( 1) 1)
|
| [18] |
Chen S Y,Dickson D W,Mitchell D J,et al. 1996.Pathogenicity of fungi to eggs of Heterodera glycines. Journal of Nematology,28(2): 148-158.( 1) 1)
|
| [19] |
Gao L,Sun M H,Liu X Z,et al. 2007.Effects of carbon concentration and C/N ratio on the growth and sporulation of several biological control fungi.Mycology Research,111: 87-92.( 1) 1)
|
| [20] |
Kerry B R.1988.Fungal parasites of cyst nematodes.Agriculture Ecosystems and Environment,24: 293-305.( 1) 1)
|
| [21] |
Liu X Z,Chen S Y.2003.Nutritional requirements of Pochonia chlamydosporia and ARF18,fungal parasites of nematode eggs.Journal of Invertebrate Pathology,83: 10-15.( 1) 1)
|
| [22] |
Mo M H,Xu C K,Zhang K Q.2005.Effect of carbon and nitrogen sources,carbon-to-nitrogen ration,and initial pH on the growth of nematophagous fungus Pochonia chlamydosporia in liquid culture.Mycopathologia,159: 381-387.( 2) 2)
|
| [23] |
Papavizas G C,Dunn M T,Lewis J A,et al. 1984.Liquid fermentation technology for experimental production of biological fungi.Phytopathology,74: 1171-1175.( 1) 1)
|
| [24] |
Wang X Z,Wang L F,Piao C G,et al. 2013.Identification of the root-knot nematode species on Zanthoxylum bungeanum and management with combinations of different biocontrol agents.植物病理学报,43(增刊): 393.( 1) 1)
|
| [25] |
Willcox J,Tribe H T.1974.Fungal parasitism of cysts of Heterodera I.Preliminary investigations.Transactions British Mycological Society,62: 585-594.( 1) 1)
|
| [26] |
Zare R,Gams W,Evans H C.2001.A revision of Verticillium section Prostrata V.The genus Pochonia with notes on Rotiferophthora.Nova Hedwiga,73: 51-86.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

