文章信息
- 宋福强, 孔祥仕, 李季泽, 常伟
- Song Fuqiang, Kong Xiangshi, Li Jize, Chang Wei
- 基于抑制消减杂交技术筛选AM真菌与紫穗槐共生相关基因
- Screening the Related Genes in the AM Fungi and Amorpha fruticosa Symbiosis with the Suppression Subtractive Hybridization Technique
- 林业科学, 2014, 50(11): 64-74
- Scientia Silvae Sinicae, 2014, 50(11): 64-74.
- DOI: 10.11707/j.1001-7488.20141109
-
文章历史
- 收稿日期:2013-10-17
- 修回日期:2014-07-13
-
作者相关文章
丛枝菌根真菌(AMF)是一类广泛存在并与宿主植物互利共生的真菌,共生体双方双向转运营养成分,克服各种生物与非生物的胁迫。AMF共生对植物有正面或负面的生长效应(Smith et al.,2011)。对于同一种丛枝菌根(AM)植物,不同AMF定殖产生不同的生长效应(Klironomos,2003;Munkvold et al.,2004);而同一AMF在不同植物中产生的生长效应也不同。AM对植物的生长效应取决于植物基因组与AMF基因组之间相互关系以及环境条件,但是其中的控制机制仍然不明确。
菌根是一种很古老的共生体,在进化上比根瘤更古老(Sprent,2007)。植物与AMF共生专一性小,可以和不同种类AMF形成共生体。但是植物对AMF也有选择性,从而形成不同的侵染率,在有些情况下侵染率会非常低(Smith et al.,2009)。AMF与植物共生是一个精细的分子调控过程,从预共生时期的信号对话,到共生阶段的植物胁迫防御、细胞形态重塑,每一步都有大量生物分子参与。到目前为止,关于木本植物菌根形成的分子机制还鲜见报道。
抑制消减杂交技术(SSH)是由Diatchenko等(1996)在研究真核生物样本间mRNA水平基因表达差异的技术,可在一个差减杂交过程中将稀有基因序列富集上千倍,从而可以提高获得低丰度表达基因cDNA序列的概率(Rebrikov et al.,2004),结合Northern杂交筛选差异表达基因和对cDNA文库的EST序列进行生物信息学分析,能够筛选出大量的功能基因。可以快速完成设定条件下特异表达基因的筛选,在真菌(Danielle,2005; Margaret,2005)、植物(Xu et al.,2013)特异性基因的筛选挖掘研究中取得了理想的结果。
本研究选用紫穗槐(Amorpha fruticosa)作为AMF的宿主植物,采用抑制消减杂交技术,从转录水平筛选AMF与紫穗槐共生的相关基因,推测木本植物AM形成过程中可能的分子机制,旨在为木本植物AM形成机制研究提供一定的理论依据。
1 材料与方法 1.1 材料紫穗槐苗木种子由吉林省林业科学研究院提供。供试菌种AMF为摩西球囊霉(Glomus mosseae,GM),孢子含量约为25个孢子·g-1接种物,由黑龙江大学修复生态研究室保存。苗木培养基质按草炭土、蛭石、沙子5:3:2比例混合,然后灭菌(121 ℃,0.1 MPa,2 h)。将灭后菌的基质装入花盆(53 cm×17 cm×13 cm)。
1.2 试验方法 1.2.1 苗木培养紫穗槐种子于20~30 ℃温水中淘洗,搓洗2~3遍,然后用0.5%高锰酸钾溶液浸泡3~4 h,清水淘洗干净。将处理好的种子置于筛中,用几层湿润纱布覆盖,漂浮于水浴锅中,将水浴锅水温调制为35 ℃进行发芽。将萌发的种子播撒于每盆装有3.5 kg培养基质的花盆中,接种菌剂,盖薄层土。对照组: 灭活的AMF+紫穗槐; 处理组: AMF+紫穗槐。
1.2.2 紫穗槐苗木菌根侵染率测定采用Phillip等(1970)KOH脱色-酸性品红染色方法。
1.2.3 根系总RNA提取和mRNA 的纯化采用TRIzol方法提取根部总RNA,应用Oligotex® mRNA Mini Kit(Qiagen)分离纯化mRNA。
1.2.4 紫穗槐菌根相关基因的抑制消减杂交采用Clontech公司的PCR-SelectTM cDNA Subtraction Kit构建消减cDNA文库。以接种AMF的紫穗槐根系总mRNA合成的dsDNA作为测试组(Tester),接种灭活AMF的紫穗槐根系总mRNA合成的dsDNA作为驱动组(Driver),具体操作按照试剂盒使用说明进行。
1.2.5 消减杂交效率的检测通过PCR方法检测消减与未消减第2次PCR产物中紫穗槐内参与基因actin的表达丰度。PCR反应条件为: 75 ℃预变性5 min,然后94 ℃30 s,60 ℃30 s,72 ℃ 150 s扩增,并分别在第16,24,28和32循环处各取4 μL进行电泳,检测消减杂交效率。
1.2.6 cDNA消减文库的建立和鉴定对巢式PCR产物进行纯化后,直接连接到pGEM-T Easy Vectors进载体中,4 ℃连接过夜,然后再将连接产物转化至大肠埃希菌(E.coli)DH5α感受态细胞中,用含有X-Gal、IPTG和Amp的LB培养皿37 ℃倒置培养过夜,然后根据蓝白斑筛选阳性克隆。随机挑取阳性克隆,重新活化,提取质粒DNA。以质粒DNA为模板,利用载体两端的测序引物对插入片段进行PCR扩增鉴定。
1.2.7 差异基因的反向Northern blot杂交验证采用MBI公司的Biotin Chomogenic Detection Kit进行反向Northern blot杂交验证,探针的制备、膜固定、杂交和显色操作按说明书步骤操作。
1.2.8 SSH库的测序随机挑取阳性克隆到含氨苄青霉素的LB培养基中,37 ℃摇床中过夜摇菌,将含EST插入的阳性克隆菌液编号,由上海Invitrogen公司进行测序。
1.2.9 Unigenes序列的功能注释序列经去除载体序列和引物序列后,用NCBI的BLSATX功能进行序列相似性搜索,并初步推断差异表达片段的功能。在GenBank数据库中使用Blastx程序对测序结果进行功能注释,在去除内生菌根序列基础上,对紫穗槐相关功能基因进行分析,根据GO分类信息、Blast信息,查阅相关文献,对获得的unigenes进行基因功能分类。未知序列编码的肽段一级结构采用EMBL上的Transeq引擎进行预测(http://www.ebi.ac.uk/Tools/emboss/)。肽段的理化特性采用ProtParam工具进行分析(http://web.expasy.org/protparam/)。采用ProtScale对肽段的疏水性/亲水性进行分析(http://web.expasy.org/cgi-bin/protscale/protscale.pl); 采用sopma(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)对未知序列编码肽段的二级结构参数进行分析。
2 结果与分析 2.1 紫穗槐培养和侵染情况检测苗木培养第5天时菌根侵染率很低,只检测到个别根内有菌丝存在。此时根系小,大部分孢子处在萌发阶段。到第10天时,侵染率开始升高,并且接种和未接种之间的植株已经出现明显差异。在第15天时,侵染率迅速升高,此时根系和菌丝大量繁殖,随后一直升高。至30天时,侵染率接近90%,根内可见大量泡囊菌丝,到第40天时,有些根内可见少量孢子。
苗木培养至第15天时,接种GM和未接种之间紫穗槐生长差异非常显著,AMF的促生作用非常明显,这与之前的报道(孟剑侠,2009;赵晓娟,2010;宋鸽,2011)一致,其侵染率在50%左右(图 1)。本试验选取生长15天的紫穗槐根系,进行RNA提取和差异基因筛选工作。
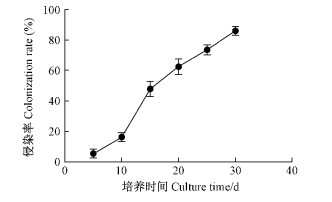 |
图 1 紫穗槐根部侵染率随时间的变化 Fig. 1 Changes of the colonization percentage of Amorpha fruticosa roots by AMF with time |
接种GM的紫穗槐根系(Tester)和空白对照组根系(Driver)的cDNA进行Rsa I酶切后,在1%琼脂糖上同时电泳,从图 2中可以发现,酶切后的cDNA片段明显小于酶切前的cDNA片段,分布在200~750 bp之间,说明酶切消化完全。
 |
图 2 Tester和Driver酶切前后cDNA变化 Fig. 2 The change of cDNA before and after digested by Rsa I 1和3为酶切前; 2和4为酶切后。Lane 1 and 3 represent cDNA prior to Rsa I digestion, and lane 2 and 4 after Rsa I digestion. |
消减产物经过1轮巢式PCR后,在1%琼脂糖上进行电泳(图 3)。PCR扩增片段主要分布在250~750 bp之间,呈比较均匀的弥散状,分辨不出明显的主带,较大的片段得到了明显的消减,与试剂盒所要求的预期大小符合,可进行后续基因产物克隆、抑制消减库的筛选、差异基因片段的测序以及差异基因的生物信息学分析。
 |
图 3 紫穗槐与AMF共生相关基因抑制消减杂交后2轮PCR扩增产物的比较 Fig. 3 The comparison of SSH products amplified by two run PCR about symbiotic genes between A. fruticosa and AMF 1.第1轮PCR扩增后的消减杂交产物Primary PCR of SSH products; 2.第2 轮PCR扩增后的消减杂交产物 Secondary PCR of SSH products. |
将抑制消减杂交cDNA的第2次扩增产物克隆到pGEM-T载体中,转化大肠埃希菌,菌液经37 ℃过夜培养后,长成蓝白菌落。构建包含146个与AM共生的紫穗槐根部SSH文库。
随机挑取部分文库中的克隆菌落,利用接头两端引物对重组质粒的插入片段进行PCR扩增鉴定,产物经1%琼脂糖凝胶电泳(图 4),插入片段呈现大小不一的带型,长度主要分布在250~750 bp之间,表明连接转化效果较好,消减后的cDNA片段具有多态性低和重复率低的特点,表明经过差减后高丰度基因的均一化效果较好,所构建的文库质量合乎要求,和理论预计的结果大致相符。
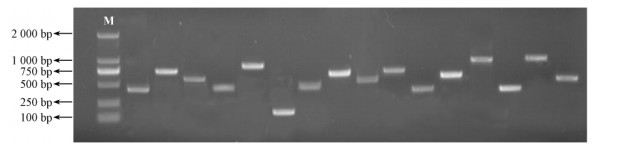 |
图 4 紫穗槐SSH文库插入片段的部分菌液PCR鉴定 Fig. 4 The identification of inserted cDNA fragments in SSH libraries of A. fruticosa with AMF by bacteria liquid PCR |
随机挑选阳性克隆库中的63个进行反Northern杂交验证,将Tester和Driver进行探针标记后,分别与点在尼龙膜上的cDNA文库阳性克隆的菌落PCR产物进行斑点杂交,杂交结果如图 5所示:大部分(49)出现阳性反应,14个阴性反应。阳性反应点在以Driver为探针的反Northern blot中均为阴性反应。因此,这些阳性反应的克隆均为紫穗槐与AMF共生相关的基因。
 |
图 5 斑点杂交筛选含有差异cDNA片段的克隆
Fig. 5 The screening of colonies with differential cDNA fragment from subtractive cDNA libraries by reverse northern blot analysis
每个克隆在2张杂交尼龙膜的相同位置,分别用Tester(左)和Driver(右)做探针进行杂交。 Each clone in the same position of the two hybrid nylon membrane, Tester (left) and Driver (right) respectively were used as probes for hybridization. |
将经过反Northern blot筛选并包含EST插入的高质量阳性克隆质粒进行测序。一共随机挑选600个阳性克隆,获得400个非冗余ESTs,经过组装拼接后获得47 个unigenes。在GenBank 数据库中使用 BLASTx程序对47个差异表达的unigenes序列进行注释,其中35个unigenes序列与已知序列显著性匹配,剩余12个unigenes序列在GenBank 数据库中没有获得显著性匹配(表 1)。
|
|
为了深入分析AMF在定植紫穗槐的过程中紫穗槐差异表达基因的生物学功能,利用GO分类信息、Blast注释信息和相关文献信息,对35个获得显著匹配的unigenes进行基因功能分类,结果表明:35个差异表达的unigenes可以被分为8类,分别是防御胁迫(24%)、物质代谢(17%)、能量代谢(14%)、蛋白合成(11%)、信号转导(11%)、细胞结构(11%)、转录(6%)、蛋白折叠和降解(6%)(表 1)。其中,胁迫防御相关基因和物质代谢相关基因所占比例最大,说明胁迫防御相关基因和物质代谢相关基因在AMF和紫穗槐共生互做过程中发挥着重要的作用。这些基因广泛参与生物体生命活动的各个过程,因此AMF与紫穗槐共生的过程是一个系统涉及各种生物过程的活动。
2.5 未知基因序列编码肽段的预测分析从表 2中可以看出这些未知基因编码的肽段,氨基酸长度大小不等,最少的65个氨基酸(AG10),最大的140个氨基酸(AG42),相对应的相对分子质量为6 903.8~16 553.8。总带正电残基(Asp+Glu)和总带负电残基(Asp+Glu)相互作用决定了预测肽段氨基酸的pI特性,两者持平的肽段显中性(pI=7左右,AG12),其他预测肽段pI偏酸或者偏碱,总体分布于5.87(AG24)与12.15(AG23)之间,pI偏碱的肽段占大部分。
|
|
对未知基因序列编码肽段进行二级结构预测,结果如表 3所示。各个片段编码的肽段均含有α螺旋、β折叠、转角和卷曲4种二级结构,含量不均一。
|
|
抑制消减杂交技术(SSH)由于假阳性率较低,灵敏性高,重复性强,通量大,因而能一次性分离上百个差异表达基因。已经广泛用于非靶向差异基因分离。Die等(2007)用SSH技术分离锯齿列当(Orabanche crenata)寄生诱导的紫花苜蓿(Medicago sativa)推防御基因表达。Klosterman等(2011)用SSH来发掘莴苣(Lactuca sativa)中衰老相关的蛋白酶与黄萎病(Orobanche cumana)之间的关系。Kuo等(2010)用SSH鉴定海葵(Sea anemone)与甲藻之间的共生和非共生相关基因。而有关AM方面的研究,SSH作为非靶向方法用于构建在菌根组织上调表达的基因库,并发现一些重要的AM诱导基因,也用SSH库来克隆AM发育早期和晚期诱导的特异表达基因(Kuo et al.,2010;Brechenmacher et al.,2004)。但是关于SSH方法用于紫穗槐与AMF共生相关基因的研究还没有报道。本研究采用这种非靶向的方法,全面系统地分析了紫穗槐与AMF共生之间的相关基因。经过序列分析,发现这些序列参与防御胁迫、物质代谢、能量代谢、蛋白合成、转录、信号转导、蛋白折叠和降解、细胞结构等生物体生命活动的各个过程,代表了共生过程中部分转录组。
3.2 AMF与紫穗槐共生相关基因 3.2.1 参与紫穗槐胁迫和防御的相关基因AMF与植物的互利共生关系表现为AMF可以诱导植物产生防御反应,激活植物防御分子,抵抗生物胁迫。在与AMF共生的紫穗槐根系内检测到病原相关蛋白(pathogenesis protein,PR)和防御素(Defensin)。PR蛋白与抗病性有关(Gianinazzi-Pearson et al.,1996),在丛枝形成前,AMF就可以激活PR编码基因。植物防御素是高等生物防御病源体入侵的重要防御物质(Takeuchi et al.,2012)。这些被AMF诱导的病原相关基因可增强菌根植物对生物胁迫的抵抗力,如对根腐病的抗性,但并不影响AMF在紫穗槐内定植。
除PR外,在紫穗槐菌根内还检测到Annexin,金属硫蛋白(metallothionein,MT)等金属相关蛋白以及环氧化物水解酶(Epoxide hydrolase)等。这些相关蛋白通常与抵抗氧化胁迫相关,通过与重金属结合可以有效地减轻重金属对机体的毒害,是体内清除自由基能力最强的一类蛋白质(Hu et al.,2013)。有研究用AM共生树种来治理重金属胁迫的土壤(Gaur et al.,2004;Hildebrandt et al.,2007),就是利用AMF隔离一些重金属从而避免其对植物的毒害作用。
3.2.2 参与紫穗槐物质代谢的相关基因酰基载体蛋白(acyl carrier protein,ACP)、乙酰辅酶A结合蛋白(acyl-CoA-binding protein,ACBP)、天冬酰胺合成酶(Asparagine synthatase)以及GDSL esterases/lipases等代谢相关基因在本研究的紫穗槐菌根根系内上调表达。植物中含有多种ACP异构体,表达具有组织特异性,中长链脂肪酸仅仅存在于储存三酰甘油的组织中,不存在于膜脂上(Schütt et al.,1998)。ACBP广泛存在于生物体中,在大分子合成转运乙酰基团中起重要作用,参与多种功能和调节过程(Kiruthika et al.,2013)。此外,ACBP可以增强ABA信号(Du et al.,2013)。ACBP缺失使植物外皮发育受损,同时影响由抗性蛋白介导的对病原细菌和真菌的基础性防御作用(Xia et al.,2012)。GDSL esterases/lipases主要参与调解植物发育、形态建成、次级代谢物的合成、防御反应(Chepyshko et al.,2012)。
天冬酰胺由于具有高的N/C比,是植物理想的氮储存和运输物质,可参与生物和非生物胁迫的氮循环、氮素从源组织到库组织的移动和运输过程的氮循环(Gaufichon et al.,2010)。此外,当处于胁迫环境如干旱、盐化、营养缺陷条件下,天冬酰胺会在共生植物的根瘤中大量富集,调节苜蓿等豆科植物(Sulieman et al.,2010)的固氮特性,因而可以在豆科植物紫穗槐的菌根根内检测到天冬酰胺合成酶的上调表达。AMF除了能为植物提供P营养外,还能提供一定量的N素营养,对N素有一定的吸收能力。
胡萝卜代谢相关的基因即类胡萝卜素裂解双加氧酶(carotenoid cleavage dioxygenase,CCDs)也在紫穗槐菌根根系内检测到。Lohse(2005)证实CCD在玉米(Zea mays)AM共生根系中具有较高的转录活性。CCD可切割类胡萝卜素特异双键,产生脱辅基类胡萝卜素,参与类胡萝卜素裂解。脱辅基类胡萝卜素能提高发枝菌根的共生效率,影响丛枝形成。在共生根系中AMF能够诱导类胡萝卜素生物合成及氧化裂解(Akiyama,2007),而AM根系中类胡萝卜素前体经过2个连续的裂解反应产生的脱辅基类胡萝卜素,反过来诱导AM菌丝分枝(Akiyama et al.,2005)。在小麦(Triticum aestivum)、玉米、大麦(Hordeum sp.)AM中,类胡萝卜素氧化裂解为C14的Mycorradicin和C13的环己烯酮衍生物,Mycorradicin在共生后期强烈影响功能丛枝,并能保护功能菌根,并具有缓解H2O2毒害的作用(Klingner et al.,1995)。环己烯酮衍生物无杀菌性,是一种土传植物病原菌的抑制剂,但能够控制发枝菌根与植物根系共生。
参与磷代谢的基因即磷酸肌醇转移蛋白(phosphatidylinositol transfer protein,PITP)基因在紫穗槐与AMF共生的根系中也发现上调表达。PITP参与信号传导、膜运输、脂代谢、细胞分裂等很多生物学过程,此外,PITP还是磷脂途径调节子(Cockcrof,2012)。AMF对植物最大的贡献是提供P,在丛枝膜上分布很多磷转运体,用于转运有机磷分子。PITP在紫穗槐菌根根系上发现上调表达,可能对紫穗槐根系的磷转运有促进作用。
3.2.3 参与紫穗槐能量代谢的相关基因果糖二磷酸醛缩酶(FDA)、NADH脱氢酶复合体(NADH)、甘油醛-3-磷酸脱氢酶(GAPDH)、乙醛脱氢酶(AD)、磷酸丙糖异构酶(TIM)等能量代谢相关基因均在紫穗槐菌根根系上调表达。FDA是糖酵解和糖异生过程中的一个关键酶,对细胞生命活动起到至关重要的作用(Yadav et al.,2013)。此外,FDA与植物体内多种植物激素有一定相关性(路玮,2011),而这些植物激素在AMF共生中起信号传导的作用,影响菌丝侵染和根内菌丝发育。NADH脱氢酶则起催化作用,将NADH上的氢原子传递给与其结合牢固的辅基FMN、铁-硫中心,再将氢从辅基上脱下转移给呼吸链中的下一个成员CoQ,参与能量代谢中的电子传递。这些酶在AMF共生的能量代谢中起重要作用。
3.2.4 参与紫穗槐蛋白合成的相关基因本试验结果显示参与蛋白合成的相关基因在AMF共生的紫穗槐根系中上调表达,如核糖体大亚基中的一个蛋白核糖体蛋白L18(Ribosomal protein L18),其用于稳定5S rRNA的4级结构,并介导其和大亚基其他部分的相互关系。此外还有参与植物蛋白质合成过程中的翻译起始因子(eIF1A)和延伸因子(EF1a)的合成,其中,eEFlA具有类似分子伴侣的活性,能够与新生的肽链结合,而且能够和在胞质中不能正确折叠的蛋白相互作用并加速这些蛋白的降解。有报道称EF1A和eEF1B是烟草花叶病毒入侵烟草所必须的,可以直接与病毒RNA依赖性RNA聚合酶的甲基化转移酶域相互作用(Hwang et al.,2013),可能在AMF定殖于紫穗槐的过程中起一定作用。这些蛋白合成相关的基因协同蛋白折叠降解基因,能保证紫穗槐根系内AM相关蛋白的快速准确合成。
3.2.5 参与蛋白折叠与降解的相关基因蛋白二硫键异构酶(protein disulfide-isomerase,PDI)在新生蛋白折叠和形成二硫键中起重要作用,并且参与新合成的分泌性蛋白质的修饰和折叠(Kim et al.,2012),以及逆境胁迫下受损蛋白的修复和重折叠等生理过程中起重要作用。此外,PDI还具有分子伴侣的部分功能,可通过ATP依赖等方式介导其他不同底物蛋白的多肽组装与异构、二硫键状态调控等过程,因此它与真核类生物中的糖转运及蛋白合成等代谢环节也可能存在较密切联系。
在AMF在与紫穗槐共生的过程中,宿主细胞中蛋白组分会发生剧烈变化,细胞骨架重排,新的蛋白合成或者有些蛋白上调表达,有些蛋白下调表达。为了确保这些蛋白的正确折叠,起分子开关作用的蛋白质二硫键、分子伴侣如PDI的上调表达必不可少。
3.2.6 参与紫穗槐细胞骨架构建的基因β-tubulin基因以及与细胞器移动有关的驱动蛋白Kinesin在形成共生结构过程中出现特异表达(Sasabe et al.,2011),在形成丛枝和泡囊的过程中,植物细胞 形态发生剧烈的变化,形成入侵栓,在丛枝发育的过程中必然会导致植物细胞骨架的改变以及细胞器的转移,以前也有 关于骨架相关蛋白变化的报道(Genre et al.,1998), 其中涉及ESTs编码的蛋白质,一些基因编码的蛋白质参与细胞壁修饰,如Extensins在细胞壁组装、细胞成型和大小、疾病抗性,以及生殖隔离和物种形成中起作用,有助于根毛扩增和延伸生长(Lamport et al.,2011)。
3.2.7 参与紫穗槐信号辅导的相关基因信号传导是AMF与植物共生的第1步,通过双方信号对话,植物打开防御大门,AMF则准备定殖。即便侵染后期丛枝形成后,因为营养关系,两者之间也进行即时动态信号对话。这个信号过程是从始至终的。本试验检测到一类蓝铜蛋白Stellacyanin,为原核生物和真核生物的电子传递体,除了有铜结合域,还有细胞壁结构的蛋白质结构域(Dennison et al.,2003)。有报道称,受到致病性、非致病性辣椒斑点病菌以及非病原性萤光假单孢菌(Pseudomonas fluorescens)侵染后,五彩椒(Capsicum annuum)叶子会富集stellacyanin cDNA clone(CASLP1),机械损伤诱导的CASLP1转录本局部性、系统性的积累呈现甲基化茉莉酸依赖性,当五彩椒暴露于脱落酸环境中时,盐和干旱胁迫也能诱导其表达(Kong et al.,2002)。AMF在定殖于紫穗槐根部的过程中,会压迫其根内皮层细胞,造成一定程度的机械损伤,从而诱导Stellacyanin的表达。
钙调素蛋白(CaM protein)是一类广泛存在的的蛋白,通过Ca2+依赖性与多种靶蛋白,如蛋白激酶、磷酸激酶、离子通道和细胞骨架等相互作用调节各种细胞功能(Kuttner et al.,2013)。在AMF共生中,钙调蛋白是核心蛋白之一,当菌根因子诱导核周质钙出现峰值后,释放到核周质的钙离子被钙调素识别并与之结合,同时与CCaMK结合解读内共生诱导的钙摆动模式,然后结合其他相关信号分子产生下游的共生级联反应。这种对钙摆动模式的识别可能是开启根瘤共生还是开启菌根共生的切换开关。
此外,在紫穗槐根部还检测到其他信号相关蛋白,如丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)和丝氨酸-苏氨酸蛋白磷酸酶(serine/threonine protein phosphatase,STK)。MAPK是细胞受激发后因发生磷酸化而被激活的一类丝氨酸苏氨酸蛋白激酶,可使某些关键性转录因子发生磷酸化而诱导新基因的表达(Sasabe et al.,2011)。MAPK信号级联是一类在进化上保守的基础信号传导途径。一个MAPK级联有几个不同的MAPKKK-MAPKK-MAPK,它们通过连续磷酸化和级联组分的活化来调节连接到各种上游受体和下游靶分子。这些级联相互合作,用于传递各种细胞外信号,控制细胞反应和过程,比如生长、分化、细胞死亡、转导激素信号和胁迫反应(Singh et al.,2013)。这种级联反应具有广泛性和古老性,在长期的进化历程中可能一直伴随AMF这种古老的真菌。蛋白磷酸化和去磷酸化在生物分子水平上起着分子开关的作用,控制着信号传导途径。相对于MAPK,STK则是一类蛋白磷酸酶,在转录、翻译、分化、细胞周期和信号传导中起多种作用。其成员之一蛋白磷酸酶2A(protein phosphatase 2A,PP2A)调节着植物形态建成、肌动蛋白分布以及细胞有丝分裂。有报道称PP2A可调节非病原性真菌粗糙链孢霉(Neurosporocrassa)(Yatzkan et al.,1998)菌丝的生长以及构巢曲霉(Aspergillus nidulans)菌丝形态建成(Kosmidou et al.,2001)。稻瘟病菌(Magnaporthe oryzae)入侵水稻叶的方式与AMF真菌定植植物根系极其相似,先形成附着泡,然后通过内部机械压力和分泌的酶破壁,再进行组织内菌丝生长,进行活体寄生,只是前者导致细胞死亡,而后者与细胞进行营养交换。PP2A的催化亚基突失活可导致稻瘟病菌营养菌丝生长缺陷,并且不能侵入到宿主植物细胞中(Du et al.,2012)。STK在与紫穗槐与AMF共生体系中高表达,表明其在调节AMF根内菌丝建成中可能起重要作用。由于PP2A可被ABA诱导,AMF可以增加植物中ABA的含量,因此可以推测紫穗槐中相应的基因不是直接被共生真菌诱导,而是间接通过增加植物激素的水平诱导的。
3.2.8 参与紫穗槐转录的相关基因转录的调节控制是基因表达调节控制中的一个重要环节,上承接信号对话过程,下参与基因的调控表达。本研究检测到紫穗槐菌根系中2个与大豆RNA结合的蛋白以及与苜蓿中RNA结合的蛋白同源性较高,因此,在AMF侵染紫穗槐的过程中,基因转录也受到调控。
3.2.9 对未知序列编码肽段的预测未知序列可能参与AMF与植物共生某一重要过程,也可能是紫穗槐在AMF特异诱导下产生的,因此可以对未知序列肽段的编码进行预测。本研究从序列编码肽段的一级结构进行预测,并对这些肽段的理化特性和二级结构进行预测。肽段的理化特性影响着未知基因编码肽段在细胞内的分布,而其二级结构则涉及这些肽段的高级折叠和跨膜特性。结果表明,这些未知基因编码的肽段都含有一定量的α螺旋、β折叠、转角和卷曲。α螺旋含量越高越有可能是跨膜片段,这样的蛋白可能作为信号或者营养转运体参与AM特异性活动;而β折叠、转角和卷曲含量高则水溶可能性更大,因而分布于胞质核质中作为调节分子。从理化特性上看,大部分序列编码的肽段偏碱性(pI>7),只有少数偏酸性。肽段稳定性和周转周期在一定程度上代表肽段是调节分子还是结构分子,调节分子稳定性较弱,周期较短,AG01、AG37、AG42和AG44比较稳定,可能是结构蛋白,其他为不稳定肽段,可能更多地参与到生物调节过程中。
| [1] |
路玮.2011.拟南芥果糖1,6-二磷酸醛缩酶家族分析.泰安:山东农业大学硕士学位论文.( 1) 1)
|
| [2] |
孟剑侠.2009.丛枝菌根真菌对紫穗槐固氮能力的影响.哈尔滨:黑龙江大学硕士学位论文.( 1) 1)
|
| [3] |
宋鸽.2011.AM真菌对紫穗槐防御性调控及共生相关蛋白的SDS-PAGE分析.哈尔滨:黑龙江大学硕士学位论文.( 1) 1)
|
| [4] |
赵晓娟.2010.AM真菌-紫穗槐共生体引起根瘤菌的趋化性及对结瘤因子诱导的研究.哈尔滨:黑龙江大学硕士学位论文.( 1) 1)
|
| [5] |
Akiyama K.2007.Chemical identification and functional analysis of apocarotenoids involved in the development of arbuscular mycorrhizal symbiosis.Bioscience,Biotechnology,and Biochemistry,71(6): 1405-1414.( 1) 1)
|
| [6] |
Akiyama K,Matsuzaki K,Hayashi H.2005.Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi.Nature,435(7043): 824-827.( 1) 1)
|
| [7] |
Brechenmacher L,Weidmann S,Van Tuinen D,et al. 2004.Expression profiling of up-regulated plant and fungal genes in early and late stages of Medicago truncatula-Glomus mosseae interactions.Mycorrhiza,14(4): 253-262.( 1) 1)
|
| [8] |
Chepyshko H,Lai C P,Huang L M,et al.2012.Multifunctionality and diversity of GDSL esterase/lipase gene family in rice(Oryza sativa L.japonica)genome: new insights from bioinformatics analysis.BMC Genomics,13(1): 309.( 1) 1)
|
| [9] |
Cockcroft S.2012.The diverse functions of phosphatidylinositol transfer proteins.Curr Top Microbiol Immunol,362:185-208.( 1) 1)
|
| [10] |
Danielle C.2008.Isolation of mycoparasitic-related transcripts by SSH during interaction of the mycoparasite Stachybotrys elegans with its host Rhizoctonia solani.Curr Genet,53:67-80.( 1) 1)
|
| [11] |
Dennison C,Harrison M D,Lawler A T.2003.Alkaline transition of phytocyanins: a comparison of stellacyanin and umecyanin.Biochemical Journal,371(Pt 2): 377.( 1) 1)
|
| [12] |
Diatchenko L,Lau Y F,Campbell A P,et al. 1996.Suppression subtractive hybridization: a method for generating differentially regulated or tissue-specific cDNA probes and libraries.Proc Natl Acad Sci USA,93:6025-6030( 1) 1)
|
| [13] |
Die J V,Dita M A,Krajinski F,et al. 2007.Identification by suppression subtractive hybridization and expression analysis of Medicago truncatula putative defence genes in response to Orobanche crenata parasitization.Physiological and Molecular Plant Pathology,70(1): 49-59.( 1) 1)
|
| [14] |
Du Z Y,Chen M X,Chen Q F,et al. 2013.Arabidopsis acyl-CoA-binding protein ACBP1 participates in the regulation of seed germination and seedling development.The Plant Journal,74(2):294-309.( 1) 1)
|
| [15] |
Du Y,Shi Y,Yang J,et al. 2012.A serine/threonine-protein phosphatase PP2A catalytic subunit is essential for asexual development and plant infection in Magnaporthe oryzae. Current Genetics,59: 1-9.( 1) 1)
|
| [16] |
Gaufichon L,Reisdorf-Cren M,Rothstein S J,et al.2010.Biological functions of asparagine synthetase in plants.Plant Science,179(3): 141-153.( 1) 1)
|
| [17] |
Gaur A,Adholeya A.2004.Prospects of arbuscular mycorrhizal fungi in phytoremediation of heavy metal contaminated soils.Current Science,86(4): 528-534.( 1) 1)
|
| [18] |
Genre A,Bonfante P.1998.Actin versus tubulin configuration in arbuscule-containing cells from mycorrhizal tobacco roots.New Phytologist,140(4): 745-752.( 1) 1)
|
| [19] |
Gianinazzi-Pearson V,Dumas-Gaudot E,Gollotte A,et al.1996.Cellular and molecular defence-related root responses to invasion by arbuscular mycorrhizal fungi.New Phytologist,133(1): 45-57.( 1) 1)
|
| [20] |
Hildebrandt U,Regvar M,Bothe H.2007.Arbuscular mycorrhiza and heavy metal tolerance.Phytochemistry,68(1): 139-146.( 1) 1)
|
| [21] |
Hu N,Han X,Lane E K,et al. 2013.Cardiac-specific overexpression of metallothionein rescues against cigarette smoking exposure-induced myocardial contractile and mitochondrial damage.PloS One,8(2): e57151.( 1) 1)
|
| [22] |
Hwang J,Oh C S,Kang B C.2013.Translation elongation factor 1B(eEF1B)is an essential host factor for tobacco mosaic virus infection in plants.Virology,439(2):105-114.( 1) 1)
|
| [23] |
Kim Y J,Yeu S Y,Park B S,et al. 2012.Protein disulfide isomerase-like protein 1-1 controls endosperm development through regulation of the amount and composition of seed proteins in rice.PLoS One,7(9):e44493.( 1) 1)
|
| [24] |
Kiruthika J,Rajesh S,Ponniah A G,et al. 2013.Molecular cloning and characterization of Acyl-CoA binding protein(ACBP)gene from shrimp Penaeus monodon exposed to salinity stress.Developmental & Comparative Immunology,40(1):78-82.( 1) 1)
|
| [25] |
Klingner A,Hundeshagen B,Kernebeck H,et al.1995.Localization of the yellow pigment formed in roots of gramineous plants colonized by arbuscular fungi.Protoplasma,185(1-2): 50-57.( 1) 1)
|
| [26] |
Klironomos J N.2003.Variation in plant response to native and exotic arbuscular mycorrhizal fungi.Ecology,84(9): 2292-2301.( 1) 1)
|
| [27] |
Klosterman S J,Anchieta A,Garcia-Pedrajas M D,et al.2011.SSH reveals a linkage between a senescence-associated protease and verticillium wilt symptom development in lettuce(Lactuca sativa).Physiological and Molecular Plant Pathology,76(1): 48-58.( 1) 1)
|
| [28] |
Kong H Y,Jung H W,Lee S C,et al.2002.A gene encoding stellacyanin is induced in Capsicum annuum by pathogens,methyl jasmonate,abscisic acid,wounding,drought and salt stress.Physiologia Plantarum,115(4): 550-562.( 1) 1)
|
| [29] |
Kosmidou E,Lunness P,Doonan J H.2001.A type 2A protein phosphatase gene from Aspergillus nidulans is involved in hyphal morphogenesis.Current Genetics,39(1): 25-34.( 1) 1)
|
| [30] |
Kuo J,Liang Z C,Lin C H.2010.Suppression subtractive hybridization identifies genes correlated to symbiotic and aposymbiotic sea anemone associated with dinoflagellate.Journal of Experimental Marine Biology and Ecology,388(1): 11-19.( 2) 2)
|
| [31] |
Kuttner Y Y,Nagar T,Engel S.2013.Surface dynamics in allosteric regulation of protein-protein interactions: modulation of calmodulin functions by Ca2+.PLoS Comput Biol,9(4):e1003028.( 1) 1)
|
| [32] |
Lamport D T A,Kieliszewski M J,Chen Y,et al.2011.Role of the extensin superfamily in primary cell wall architecture.Plant Physiol,156(1):11-19.( 1) 1)
|
| [33] |
Lohse S,Schliemann W,Ammer C,et al.2005.Organization and metabolism of plastids and mitochondria in arbuscular mycorrhizal roots of Medicago truncatula. Plant Physiology,139(1): 329-340.( 1) 1)
|
| [34] |
Margaret A.2005.Identification of novel Trichoderma hamatum genes expressed during mycoparasitism using subtractive hybridization,FEMS Microbiology Letters,251:105-112( 1) 1)
|
| [35] |
Munkvold L,Kjøller R,Vestberg M,et al.2004.High functional diversity within species of arbuscular mycorrhizal fungi.New Phytologist,164(2): 357-364.( 1) 1)
|
| [36] |
Phillips J M,Hayman D S.1970.Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection.Transactions of the British Mycological Society,55(1): 158-161.( 1) 1)
|
| [37] |
Rebrikov D V,Desai S M,Siebert P D,et al.2004.Suppression subtractive hybridization.Methods Mol Biol,258:107-134.( 1) 1)
|
| [38] |
Sasabe M,Boudolf V,De Veylder L, et al. 2011.Phosphorylation of a mitotic kinesin-like protein and a MAPKKK by cyclin-dependent kinases(CDKs)is involved in the transition to cytokinesis in plants.Proceedings of the National Academy of Sciences USA,108(43): 17844-17849.( 2) 2)
|
| [39] |
Schütt B S,Brummel M,Schuch R,et al.1998.The role of acyl carrier protein isoforms from Cuphea lanceolata seeds in the de-novo biosynthesis of medium-chain fatty acids.Planta,205(2): 263-268.( 1) 1)
|
| [40] |
Singh R,Jwa N S.2013.The rice MAPKK-MAPK interactome: the biological significance of MAPK components in hormone signal transduction.Plant Cell Reports,32(6): 1-9.( 1) 1)
|
| [41] |
Smith F A,Grace E J,Smith S E.2009.More than a carbon economy: nutrient trade and ecological sustainability in facultative arbuscular mycorrhizal symbioses.New Phytologist,182(2): 347-358.( 1) 1)
|
| [42] |
Smith S E,Jakobsen I,Grønlund M,et al.2011.Roles of arbuscular mycorrhizas in plant phosphorus nutrition: interactions between pathways of phosphorus uptake in arbuscular mycorrhizal roots have important implications for understanding and manipulating plant phosphorus acquisition.Plant Physiology,156(3): 1050-1057.( 1) 1)
|
| [43] |
Sprent J I.2007.Evolving ideas of legume evolution and diversity: a taxonomic perspective on the occurrence of nodulation.New Phytologist,174(1): 11-25.( 1) 1)
|
| [44] |
Sulieman S,Fischinger S A,Gresshoff P M,et al.2010.Asparagine as a major factor in the N-feedback regulation of N2 fixation in Medicago truncatula. Physiologia Plantarum,140(1): 21-31.( 1) 1)
|
| [45] |
Takeuchi H,Higashiyama T.2012.A species-specific cluster of defensin-like genes encodes diffusible pollen tube attractants in Arabidopsis. PLoS Biology,10(12): e1001449.( 1) 1)
|
| [46] |
Xia Y,Yu K,Gao Q,et al. 2012.Acyl CoA binding proteins are required for cuticle formation and plant responses to microbes.Frontiers in Plant Science,3:224.( 1) 1)
|
| [47] |
Xu,L,Liu Z Y,Zhang K,et al. 2013.Characterization of the Pinus massoniana transcriptional response to Bursaphelenchus xylophilus infection using suppression subtractive hybridization.Int J Mol Sci,14:11356-11375.( 1) 1)
|
| [48] |
Yadav P K,Singh G,Gautam B,et al. 2013.Molecular modeling,dynamics studies and virtual screening of Fructose 1,6 biphosphate aldolase-Ⅱ in community acquired-methicillin resistant Staphylococcus aureus(CA-MRSA).Bioinformation,9(3):158-164.( 1) 1)
|
| [49] |
Yatzkan E,Szöőr B,Feher Z,et al. 1998.Protein phosphatase 2A is involved in hyphal growth of Neurospora crassa. Molecular and General Genetics MGG,259(5): 523-531.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

