文章信息
- 孙敬爽, 李少峰, 董辰希, 孙长忠
- Sun Jingshuang, Li Shaofeng, Dong Chenxi, Sun Changzhong
- 嫁接植物体中RNA分子长距离传递研究进展
- Research Progress and Prospect of Long Distance Transmission of RNA Molecules in Grafted Plants
- 林业科学, 2014, 50(11): 158-165
- Scientia Silvae Sinicae, 2014, 50(11): 158-165.
- DOI: 10.11707/j.1001-7488.20141121
-
文章历史
- 收稿日期:2014-01-02
- 修回日期:2014-06-19
-
作者相关文章
嫁接作为重要的园艺技术手段,在我国已经有3 000多年的历史,目前嫁接已广泛应用于果树、蔬菜、花卉等快速繁育和良种保存等生产领域。
从理论上讲,嫁接作为一种无性繁殖方式,不会改变嫁接植物的遗传信息,然而大量的理论研究和生产实践证明,接穗和砧木嫁接后,可以提高植物的产量、抗逆性、改良植物的开花结果习性以及改良果实的品质等,使其表型、生理生化特性以及基因表达有所改变。早在明代《本草纲目》中有“李接桃而本强者其实毛,梅接杏而本强者其实甘”的记载,目前在黄瓜(Cucumis sativus)、番茄(Lycopersicon esculentum)、西瓜(Citrullus lanatus)、茄子(Solanum melongena)、苹果(Malus pumila)、梨(Pyrus spp.)、南瓜(Cucurbita moschata)等很多物种中发现,嫁接可以改变植物的遗传性状,如嫁接可以改善黄瓜对逆境的适应能力,耐低温弱光性(于贤昌等,1999; 胡春梅等,2006)和耐盐性(蔡雁萍等,2008),抗重金属毒害(张自坤等,2010)、抗虫害(李华等,2010)等。
随着RNA 分子在基因表达调控中的重要作用的发现,大量的研究表明,在植物中,RNA也可以作为活跃的信号分子在细胞间转移,并可以通过嫁接长距离传递至接穗的顶端分生组织。RNA的传递性为探索嫁接变异机制提供了新的思路,但RNA在砧木/接穗间传递的机制复杂,哪些RNA分子具有传递性,RNA传递对嫁接植物有何影响?本文就这些问题总结了具有长距离传递的RNA 种类及传递机制,并提出嫁接育种的策略及其可能性。
1 引起植物嫁接变异的遗传物质砧穗间遗传物质的水平转移是植物嫁接诱导变异产生的主要机制。究竟是何种遗传物质引起嫁接植物的变异?Zhang等(2006)发现,绿豆(Vigna radiata)的幼苗嫁接在番薯(Ipomoea batatas)的茎上,原绿豆和变异品系之间没有细胞质DNA的RFLP(限制性酶切片段多态性)差异,说明砧木与接穗间没有基因转移的迹象。在辣椒(Capsicum annuum)的嫁接试验中发现,以果实圆形的品种为砧木,以果实长形的品种作接穗,嫁接后接穗的果实形状改变,并且可以稳定遗传2代,但控制果实形状的CaOvate 基因没有变化(Aphrodite et al.,2013)。Stegemann等(2009)将2种转基因烟草(Nicotiana tabacum)品系进行嫁接,嫁接后通过抗性筛选和荧光信号发现,嫁接使2种不同标记的烟草细胞质体间发生了基因交流,认为细胞器的大片段DNA甚至整个细胞器能够在紧密相邻的细胞间转移,说明嫁接引起的信息交流发生在质体DNA上,但是发现基因转移只发生在嫁接部位,不会发生长距离运输。因此,引起嫁接植物变异的主要遗传物质不是DNA。
RNA分子作为遗传信息的重要载体,不仅在产生部位发挥作用,而且可以作为一个活跃的信号分子,从合成部位长距离运输到植物的不同组织,从而调控基因的表达和植物的发育(贺红霞等,2005)。在常规的砧穗嫁接植物体中,来源于不同谱系的植物细胞在嫁接部位通过胞间连丝彼此相邻连接,成为植物细胞间物质运输和信息传递的通道,据报道(Kim et al.,2009),一些与叶片发育、花期转变等相关的蛋白质和mRNA具有非自控性,能够作为胞间信号通过胞间连丝进行胞间传递; 另外,嫁接过程中砧穗愈伤组织在愈合过程中,砧穗之间产生了连通的维管束组织,很多研究者认为维管束内蛋白质和RNA可以随糖类物质共同运输,进行遗传物质的大量交流,一些RNA可以通过嫁接长距离传递至接穗的顶端分生组织(王燕等,2011)。因此,砧穗间遗传物质的水平运输主要发生在RNA和蛋白质等信号物质,即个体间的遗传物质通过无性方式传递,有别于世代繁衍过程中的有性传递方式。
2 嫁接植物中移动 RNA的形式及运输途径随着微嫁接技术的不断发展(Nayelli et al.,2013),嫁接已成为研究植物体内长距离信号传递的重要方法,利用突变体、转基因植株及野生型植株互为接穗和砧木进行嫁接,可以有目的地分析某个特定信号的长距离传递和作用规律。 大量的嫁接试验证实植物内源RNA分子确实存在于流动的韧皮部内,植物体内至少有3种类型的RNA分子可以通过胞间连丝进行长距离运输(Kehr et al.,2008): 1)致病性的病毒和类病毒RNA; 2)非编码的小RNA,包括siRNAs和miRNAs; 3)内源的遗传信息的mRNA。
植物中系统运输的3种RNA分子及其运输途径(图 1): 1)RNA病毒侵染寄主后,在RNA依赖性RNA聚合酶(RNA-dependent RNA polymerases,RdRP)作用和病毒移动蛋白(MP)及外壳蛋白(CP)协助下重新复制,病毒RNA经胞间连丝在细胞间扩散,完成系统感染; 2)内源非编码的小RNA(siRNA),引起系统性RNA沉默,与CmPSRP1(Pimpkine Phloem SMALL RNA BINDING PROTEIN1)蛋白结合后可在细胞间扩散(Aoki et al.,2005),再经维管组织长距离运输实现系统性RNA沉默; 3)特异内源mRNA(如PFP-LeT6和CmNACP mRNAs)在韧皮部产生,在细胞间扩散,而后局部或系统性运输,与蛋白CmmPP16、CmRBP50结合成核糖核蛋白复合体(Li et al.,2011b),调控RNA 进入特定靶位,直接控制基因表达或运输至目的组织。
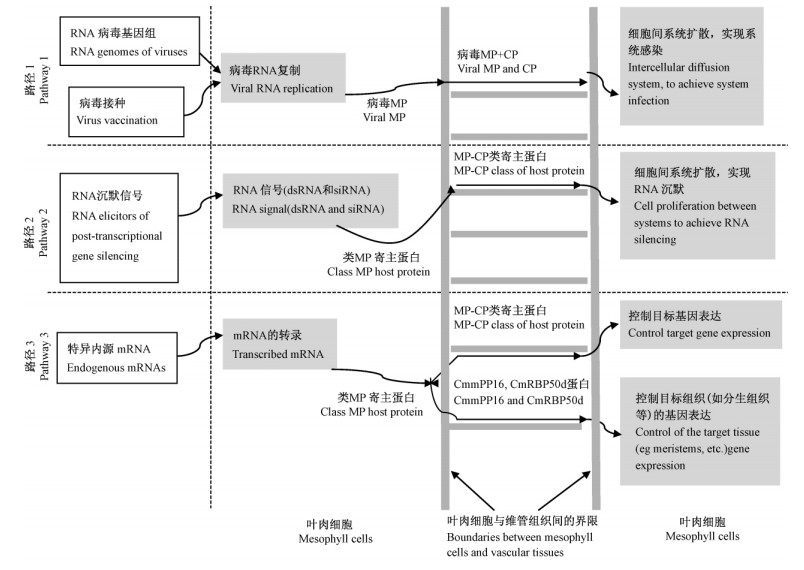 |
图 1 植物中系统运输的3种RNA分子及其运输途径 [参考贺红霞等(2005)] Fig. 1 Three major types of RNAs in plants and their transport pathways |
植物病毒侵入寄主细胞后,其局部侵染和系统侵染的形成涉及病毒在植物体内2种不同的传递机制: 1)胞间转运(cell to cell movement); 2)长距离转运(long-distance transport)。病毒RNA证实在植物韧皮部可进行长距离运输。在长距离运输的过程中,病毒能够从起初感染的叶肉细胞经维管束鞘细胞、韧皮部薄壁组织、伴胞等进入韧皮部中,在韧皮部快速地运输,最后在远处位点(如新生的幼叶)建立侵染位点(Carrington et al.,1996)。有研究表明,部分马铃薯Y病毒属(potyvirus)病毒粒子侵染的植物材料能够通过嫁接传染,能侵染茄科(Solanaceae)、藜科(Chenopodiaceae)、豆科(Leguminosae)和葫芦科(Cucurbitaceae)等多种植物(Shukla et al.,1994)。苹果茎痘病毒(apple stem pitting virus,ASPV)证明没有昆虫传播介体,主要通过嫁接传播。姚贵滨等(2010)通过对大豆(Glycine max)嫁接试验发现,大豆花叶病毒(soybean mosaic virus,SMV)侵入大豆叶片叶肉细胞后,通过叶肉细胞胞间连丝来实现胞间转运,并且经过植物维管系统的韧皮部筛管实现长距离运输。病毒运动蛋白(movement protein,MP)是由病毒编码的非结构蛋白,此类蛋白可与病毒RNA形成RNA-蛋白复合物进行细胞间的运输,并能增加胞间连丝的通透极限,协助RNA 病毒达到系统侵染(Ding,1992)。
类病毒(viroid)是迄今为止发现的最小病原物,是一类单链共价闭合环状的裸露 RNA 分子,不编码任何蛋白(Daròs et al.,2006)。类病毒是通过韧皮部完成长距离运输的,可被选择性地运送到植物不同部位。马铃薯纺锤块茎类病毒(potato spindle tuber viroid,PSTVd)的细胞间运动是通过胞间连丝实现的(Ding et al.,1997)。免疫沉淀试验证实,感病黄瓜中的啤酒花矮化类病毒与寄主因子黄瓜韧皮蛋白(CsPP2)相互作用,并且都能通过长距离运输从砧木进入异源接穗(Gomez et al.,2005)。
3.2 小RNA在嫁接植物中的传递近20年 来,小RNAs(small RNAs)分子因存在的广泛性和多样性及其在调控生理进程中的重要作用而受到广泛关注。植物中存在miRNA(microRNA)、siRNA(small interfering RNA)、ta-siRNA(trans-acting small interfering RNA)和nat-siRNA(natural antisense siRNA)等内源的小RNA 分子,由这些小RNA介导的通过核酸序列特异性相互作用抑制同源基因表达的现象,即RNA 沉默,或称为转录后基因沉默(post-transcriptional gene silencing,PTGS)。
近来的研究表明,植物RNA 沉默信号不仅可以在细胞质和细胞核之间通过胞间连丝进行短距离运输(Hamilton et al.,1999; Elbashir et al.,2001; Voinnet et al.,1998),而且可以通过韧皮部由诱导部位向更远的组织传播,进行长距离运输,这种现象称为系统性沉默(systemic acquired silencing,SAS)。嫁接、农杆菌注射和基因枪转化研究结果都显示,植物沉默信号的传递具有系统化的特点,在一个叶片上产生的沉默信号可在2~3天内传递到相邻的叶片中(Mlotshwa et al.,2002; Voinnet et al.,1998; Palauqui et al.,1999)。多数研究者证实,沉默信号在烟草嫁接体内可以双向传递,但2个方向的传递效率不同,从砧木向接穗方向传递的效率高于从接穗向砧木的传递(Voinnet et al.,1998; Sonoda et al.,2000)。李明等(2006)在拟南芥(Arabidopsis thaliana)的研究中也发现,用 RNAi型植株(目标基因的mRNA都发生降解的转基因植株)作为砧木或接穗,以KatB 和KatC 双基因转录后沉默的 DEX(dexamethazone)诱导性 RNAi 为载体,证实DEX诱导产生的基因沉默信号可以通过嫁接面在拟南芥体内双向传递。
3.2.1 miRNA的传递miRNA具有调控编码转录因子的作用。通过miRNA途径,生物体能动态地调节编码基因的表达水平,以适应不同生育时期和应对外界环境的需要。目前,Buhtz等(2008)在欧洲油菜(Brassica napus)韧皮部汁液中发现了30多种miRNA,并且发现韧皮液内miR395、miR398和miR399与营养胁迫相关,在植物分别受到硫(S)、铜(Cu)或无机磷(Pi)胁迫时升高。利用野生型拟南芥作接穗与miRNA合成突变体 hen-1作砧木的嫁接试验证实,miR395和miR399能够从接穗转移至砧木,并导致砧木相应靶基因转录物水平的降低(Buhtz et al.,2010)。在马铃薯(Solanum tuberosum)块茎形成机制的研究中,植物miR172通过嫁接进行长距离信号传递,诱导块茎的形成(Martin et al.,2009)。嫁接导致了柑橘(Citrus)接穗叶柄中miR156、miR157的大量减少,不同接穗品种miR397的表达存在差异,可能与嫁接砧穗组合中需要的铜和其他微量元素有关(Tzarfatil et al.,2013)。
3.2.2 siRNA的传递siRNA主要介导DNA甲基化(RNA-directed DNA methylation,RdDM)和转录后基因沉默,以靶标的mRNA的降解为特征。双链siRNA是RNA沉默的信号之一(Dunoyer et al.,2010),认为 21~23 nt的 siRNA 能够进行短距离的信号传导,而 24~26 nt的siRNA 很可能参与长距离干扰信号的传导(Himber et al.,2003)。Molnar等(2010)在拟南芥中发现,一种24 nt的内源siRNA可以通过嫁接结合处到达受体细胞,直接指导受体基因组进行甲基化修饰。异质嫁接试验结果表明,转外壳蛋白(CP)基因沉默的砧木中所产生的siRNA,在韧皮部中长距离运输引起接穗中CP基因的沉默(Lucas et al.,2001)。
3.3 内源mRNA在嫁接植物体中的传递近来研究者已获取了蓖麻(Ricinus communis)(Doering-Saad et al.,2006)、大麦(Hordeum vulgare)(Gaupels et al.,2008)、甜瓜(Cucumis melo)(Omid et al.,2007)、白羽扇豆(Lupinus albus)(Rodriguez-Medina et al.,2011)、拟南芥(Deeken et al.,2008)等植物韧皮液转录组信息,表明植物韧皮部汁液中存在超过1 000个mRNA,它们所编码的蛋白质功能广泛,涉及营养代谢、激素、信号传导、胁迫反应、DNA/RNA结合等。然而并非所有韧皮液中发现的RNA均能在嫁接植株进行长距离移动,目前已在嫁接植物体中共发现了17个可移动mRNA(表 1)。
|
|
Kim等(2001)等通过Southern 杂交发现,番茄嫁接体中显性鼠耳叶突变体(Mouse ear,Me)砧木特异表达的PFP-LeT6基因的mRNA转移到了带有半显性叶黄素突变基因(Xanthopphyllic,Xa)接穗中,并认为这是导致接穗叶形向Me突变体中鼠耳叶形变化的直接原因。GAI(GA INTENSIVE)基因的mRNA证明是另一个嫁接植株中与表型相关的移动RNA。目前在黄瓜、番茄和南瓜(Haywood et al.,2005; Ham et al.,2009)、苹果(Xu et al.,2010)、拟南芥(Huang et al.,2009)等多个物种的韧皮部内发现GAI mRNA能够进行长距离运输。以温室下生长的野生型番茄为接穗,嫁接在携带南瓜功能缺失突变基因Cmgaip或拟南芥突变基因ΔDELLA-gai的转基因番茄砧木上,野生型番茄的叶子形态特征发生了高度重复的变化(Haywood et al.,2005)。
3.3.2 mRNA传递对嫁接植株地下器官发育的调控mRNA的移动可以诱导地下块茎的形成。StBEL5 mRNA可以作为移动信号诱导地下块茎形成。以过度表达StBEL5的马铃薯转基因株系作为接穗或砧木(Banerjee et al.,2009),全长的转基因StBEL5 mRNA可以向上或向下移动,但是移动所需时间不同。在马铃薯发现的另一个移动mRNA,POTH1(potato Homeobox1)基因,利用POTH1过度表达的植株与野生植株嫁接,POTH1可以从转基因植株移至野生植株,且改变野生植株叶片形态,调节地下块茎形成(Mahajan et al.,2012)
植物根系的生长发育状况直接影响植物吸收环境中养分和水分。生长素是重要的植物激素,生长素信号转导和合成对调节侧根发育起重要作用(曾天赐等,2009)。Notaguchi等(2012)在拟南芥的异源嫁接试验发现,通过嫁接面的不是IAA蛋白,而是IAA基因的RNAs(IAA18和IAA28),这些RNAs在成熟叶片的维管束细胞中转录,并运输至根部从而抑制侧根的发生。SLR/IAA14基因是调节侧根形成的主要成员,在苹果(Malus×domestica)砧穗嫁接试验中发现SLR/IAA14 mRNA可以通过嫁接面,从而影响接穗的生长与结实(Kanehira et al.,2010)。
3.3.3 mRNA传递对嫁接植株开花信号的调控FT(FLOWERING LOCUST)mRNA在光周期诱导的叶片中转录翻译,并且可以从叶片向茎尖移动,调控光周期敏感植物开花(Turck et al.,2008)。以南瓜为砧木、短日照开花的葫芦(Lagenaria siceraria)为接穗的试验中发现,接穗韧皮部汁液中未发现FT mRNA,而是FT蛋白(Corbesier et al.,2007; Lin et al.,2007; Tamaki et al.,2007)。最近Li(2011a)和Lu等(2012)在拟南芥中发现,伴随FT蛋白,FT mRNA也可以从叶源通过韧皮部移至茎尖,控制光周期植物开花信号。Yang等(2010)从甘蓝(Brassica oleracea)的花序韧皮部的分泌物中发现了2种开花调控因子FVE、AGL24(AGAMOUS-LIKE 24),并且确认是mRNA。以转基因P35S-FVE和P35S-AGL24为砧木的拟南芥嫁接试验证明,FVE mRNA、AGL24 mRNA可以通过长距离运输至野生接穗,促进提前开花。
3.3.4 mRNA传递对嫁接植物逆境胁迫的调控转录因子与植物生长发育和形态建成、与植物抗逆及在高等植物改良上的应用均证明其在基因的表达调控以及高等植物的整个生命过程中都起着关键作用。NAC 结构域蛋白被证明参与植物非生物胁迫和防御反应(Tran et al.,2004)。从南瓜的韧皮部汁液中分离出来1个编码 NAC 的转录调控因子CmNACP的mRNA,表达分析和嫁接试验证明 CmNACP 基因的mRNA可以通过韧皮部进行长距离运输,并在营养器官、根和花分生组织中积累(Ruiz-Medrano et al.,1999)。宫磊等(2010)也成功地从‘鸭梨’(Pyrus bretschneideri ‘Yali’)和杜梨(Pyrus betulifolia)中克隆了全长的 NAC结构域蛋白基因 NACP,并进一步证明了梨内源性的 NACP 基因的 mRNA 可以通过韧皮部进行传递。
4 问题与展望 4.1 嫁接育种嫁接技术作为重要的园艺技术手段,在生产过程中已经广泛使用,而RNA 的传递性为植物嫁接育种提供了全新的思路。
通过筛选韧皮部内具有移动RNA的抗逆性优良的野生植物资源做砧木,利用异质嫁接技术,可以直接提高植物的抗病虫性、抗寒、抗旱和抗盐碱能力,而且能克服属间的有性杂交的不亲和性,培育远源嫁接杂种。另外,将编码小RNA(small RNA)或者能长距离运输的mRNA的基因导入砧木中,当非转基因的接穗嫁接到转基因砧木后,砧木表达的外源RNA分子可以运输到接穗,可以诱导接穗性状改变(Harada,2010)。一旦掌握了植物维管系统长距离运输的RNA信号调控,则可利用这种远程信号调控进行有目的嫁接,进行植物改造,从而改变接穗抗逆性、开花特性、改善植物品质等农艺性状,而且可以大大降低生产成本。
4.2 降低转基因风险转基因安全性问题是民众关心的一个话题,而通过嫁接提高果蔬品质则大大降低了转基因的风险。转基因技术是将人工分离和修饰过的基因导入到目的生物体的基因组中,从而达到改造生物的目的,而转基因同时也可通过花粉介导的基因漂移形式转移到非转基因作物及其野生近缘种,从而破坏生物的遗传多样性、生态系统等问题(卢宝荣等,2011)。在嫁接过程中,通过特定的砧木与接穗之间RNA的传递,使砧木和接穗表现出不同的性状,从而影响植物的抗性、树势、产量和果实品质等,并没有改变接穗的DNA序列,从而降低了转基因的风险。
4.3 RNA信号在嫁接植株中传递的局限性嫁接植物韧皮部内RNA分子长距离移动作为植物新的信号调控模式,已经成为植物界研究的新热点。然而,传统的劈接、靠接等方法诱导嫁接植株变异的频率较低。RNA在嫁接植株的传递性研究多以试管苗为试材(Turnbull et al.,2002)。有研究者推测,接穗幼嫩的植物组织处于感受态时,容易接受外源遗传信号物质的转化而发生变异,而接穗为非感受态的成年果树时,就不容易接受来自砧木的遗传物质,从而保持接穗的品种特性(刘用生等,2004)。Flachowsky等(2012)研究表明,以苹果植株中过表达gusA报告基因发卡结构的hpRNAi转基因为砧木,以过表达gusA报告基因的转基因株系T355为接穗,以试管苗为试材,gusA报告基因的表达减少,而在温室苗木嫁接研究中没有发现gusA基因沉默。苹果中内源基因Mdans(Malus domestica anthocyanidin synthase)的嫁接试验同样发现此现象,推测这可能与植物的木质化程度有关。因此,嫁接植株中RNA信号在田间植物中是否具有持续传递性,RNA最远移动距离有多长?是否可以利用一些可以持续长距离传递基因的mRNA为载体,携带一些不能传递的性状决定子基因进行长距离运输,达到改良砧木、有针对性地调控接穗性状的目的?这些问题均有待于进一步研究。
| [1] |
蔡雁平,袁祖华,孙小武.2008.盐胁迫下嫁接黄瓜和自根黄瓜幼苗的保护酶活性.湖南大学学报:自然科学版,34(5): 555-556.( 1) 1)
|
| [2] |
宫磊,张文娜,徐海燕,等.2010.梨NAC结构域蛋白基因克隆与mRNA嫁接传递性研究.中国农业科学,43(11): 2307-2314.( 1) 1)
|
| [3] |
贺红霞,麻鹏达,杨美英,等.2005.植物中RNA分子系统运输的研究进展.生物化学与生物物理进展,32(3): 204-209.( 2) 2)
|
| [4] |
胡春梅,朱月林,杨立飞.2006.低温条件下黄瓜嫁接株与自根株光合特性的比较.西北植物学报,26(2): 247-253.( 1) 1)
|
| [5] |
李华,贺洪军,高凤菊,等.2010.根结线虫对不同砧木黄瓜嫁接苗根系生理生化指标的影响.中国农学通报,26(11): 250-253.( 1) 1)
|
| [6] |
李明,姜世玲,王幼群,等.2006.基因转录后沉默信号可以在拟南芥嫁接体内快速双向传递.科学通报,51(2): 142-147.( 1) 1)
|
| [7] |
刘用生,李保印,李桂荣,等.2004.嫁接杂交与果树遗传的特殊性.遗传,26(5): 705-710.( 1) 1)
|
| [8] |
卢宝荣,夏辉.2011.转基因植物的环境生物安全:转基因逃逸及其潜在生态风险的研究和评价.生命科学,23(2): 186-194.( 1) 1)
|
| [9] |
王燕,谢辉,陈丽萍.2011.植物嫁接诱导的遗传变异机理的研究进展.遗传,33(6): 585-590.( 1) 1)
|
| [10] |
姚贵滨,李文龙,赵永山.2010.嫁接技术在大豆花叶病毒长距离运输机制研究上的应用.河北农业大学学报,33(6): 74-78.( 1) 1)
|
| [11] |
于贤昌,邢禹贤,马红,等.1999.低温胁迫下黄瓜嫁接苗和自根苗内源激素的变化.园艺学报,26(6): 406-407.( 1) 1)
|
| [12] |
曾天赐,吴爱萍,李忠锐,等.2009.大豆侧根发育相关基因GmSLR的克隆与功能研究.中国植物生理学会第十次会员代表大会暨全国学术年会.( 1) 1)
|
| [13] |
张自坤,张宇,黄志军,等.2010.嫁接对铜胁迫下黄瓜根际土壤微生物特性和酶活性的影响.应用生态学报,21(9): 2317-2322.( 1) 1)
|
| [14] |
Aphrodite T,Christos A,Konstantinos P,et al.2013.Molecular studies of inheritable grafting induced changes in pepper(Capsicum annuum)fruit shape.Scientia Horticulturae,149(4): 2-8.( 1) 1)
|
| [15] |
Aoki K,Suzui N,Fujimaki S,et al. 2005.Destination-selective long-distance movement of phloem proteins.Plant Cell,17:1801-1814.( 1) 1)
|
| [16] |
Banerjee A K,Lin T,Hannapel D J.2009.Untranslated regions of a mobile transcript mediate RNA metabolism.Plant Physiology,151(4): 1831-1843.( 2) 2)
|
| [17] |
Buhtz A,Springer F,Chappell L,et al. 2008.Identification and characterization of small RNAs from the phloem of Brassica napus. The Plant Journal,53(5): 739-749.( 1) 1)
|
| [18] |
Buhtz A,Pieritz J,Springer F,et al. 2010.Phloem small RNAs,nutrient stress responses,and systemic mobility.BMC Plant Biology,10: 64.( 1) 1)
|
| [19] |
Carrington J C,Kasschau K D,Mahajan S K,et al. 1996.Cell-to-cell and long-distance transport of viruses in plants.The Plant Cell,8(10): 1669-1681.( 1) 1)
|
| [20] |
Corbesier L,Vincent C,Jang S,et al. 2007.FT protein movement contributes to long-distance signaling in floral induction of Arabidopsis. Science,316(5827): 1030-1033.( 1) 1)
|
| [21] |
Daròs J A,Elena S,Flores R.2006.Viroids: an Ariadne's thread into the RNA labyrinth.EMBO Reports,7(6): 593-598.( 1) 1)
|
| [22] |
Deeken R,Ache P,Kajahn I,et al. 2008.Identification of Arabidopsis thaliana phloem RNAs provides a search criterion for phloem-based transcripts hidden in complex datasets of microarray experiments.Plant Journal,55(5): 746-759.( 1) 1)
|
| [23] |
Ding B.1992.Secondary plasmodesmata are specific sites of localizacation of tabacoo mosaic virus movement protein in transgenic tabacoo plants.Plant Cell,4(8): 915-928.( 1) 1)
|
| [24] |
Ding B,Kwon M O,Hammond R,et al. 1997.Cell-to-cell movement of potato spindle tuber viroid.Plant Journal,12: 931-936.( 1) 1)
|
| [25] |
Doering-Saad C,Newbury H J,Couldrige C E,et al. 2006.A phloem-enriched cDNA library from Ricinus: Insights into phloem function.Journal of Experimental Botony,57(12): 3183-3193.( 1) 1)
|
| [26] |
Dunoyer P,Schott G,Himber C,et al. 2010.Small RNA duplexes function as mobile silencing RNAs in plants are mobile silencing signals between plant cells.Science,328(5980): 912-916.( 1) 1)
|
| [27] |
Elbashir S M,Lendeckel W,Tucshl T.2001.RNA interference is mediated by 21 and 22-nucleotide RNAs.Genes Development,15(2): 188-200.( 1) 1)
|
| [28] |
Flachowsky H,Tränkner C,Szankowski I,et al. 2012.RNA-mediated gene silencing signals are not graft-transmissible from the rootstock to the scion in green house-grown apple plant Malus sp.International Journal of Molecular Science,13(8): 9992-10009.( 1) 1)
|
| [29] |
Gaupels F,Buhz A,Knauer T,et al. 2008.Adaption of aphid stylectomy for analyses of proteins and mRNA in barley phloem sap.Journal of Experimental Botany,59(12): 3297-3306.( 1) 1)
|
| [30] |
Gomez G,Torres H.2005.Pallas V: Identification of translocatable RNA-binding phloem proteins from melon,potential components of the long-distance RNA transport system.Plant Journal,41: 107-116.( 1) 1)
|
| [31] |
Ham B K,Brandom J L,Xoconostle-Cazares B,et al. 2009.A polypyrimidine tract binding protein,pumpkin RBP50,forms the basis of phloem mobile ribonicleoprotein complex.Plant Cell,21(1): 197-215.( 4) 4)
|
| [32] |
Hamilton A J,Baulcombe D C.1999.A species of small RNA in posttranscriptional gene silencing in plants.Science,286(5541): 950-952.( 1) 1)
|
| [33] |
Harada T.2010.Grafting and RNA transport via phloem tissue in horticultural plants.Scientia Horticultural,125(4): 545-550.( 1) 1)
|
| [34] |
Haywood V,Yu T S,Huang N C,et al. 2005.Phloem long-distance trafficking of GIBBERELLIC ACID-INSENSITIVE RNA regulates leaf development.Plant Journal,42(1): 49-68.( 3) 3)
|
| [35] |
Himber C,Dunoyer P,Moissard G,et al. 2003.Transitivity-dependent and -independent cell-to-cell movement of RNA silencing.The EMBO Journal,22(17): 4523-4533.( 1) 1)
|
| [36] |
Huang N C,Yu T S.2009.The sequences of Arabidopsis GA-INSENSITIVE RNA constitute the motifs that are necessary and sufficient for RNA long-distance trafficking.Plant Journal,59(6): 921-929.( 1) 1)
|
| [37] |
Kanehira A,Yamada K,Zwaya T.2010.Apple phloem cell contains some mRNAs transported over long distances.Tree Genetics & Genomes,6(5): 635-645.( 2) 2)
|
| [38] |
Kehr J,Buhtz A.2008.Long distance transport and movement of RNA through the phloem.Journal of Experimental Botany,59(1): 85-92.( 1) 1)
|
| [39] |
Kim M,Canio W,Kessler S,et al. 2001.Developmental changes due to long-distance movement of a homeobox fusion transcript in tomato.Science,293(5528): 287-289.( 2) 2)
|
| [40] |
Kim I,Pai H S.2009.Mobile macromolecules in plant development.Journal of Plant Biology,52(3): 186-192.( 1) 1)
|
| [41] |
Li C,Gu M,Shi N,et al. 2011a.Mobile FT mRNA contributes to the systemic florigen signaling in floral introduction.Scientific Reports,1:73.( 2) 2)
|
| [42] |
Li P,Ham B K,Lucas W J.2011b.CmRBP50 protein phosphorylation is essential for aseembly of a stable phloem-mobile high-affinity ribonucleoprotein complex.Journal of Biological Chemistry,286:23142-23149.( 1) 1)
|
| [43] |
Lin M K,Belanger H,Lee Y J,et al. 2007.FLOWERING LOCUS T protein may act as the long-distance florigenic signal in the cucurbits.Plant Cell,19(5):1488-1506.( 1) 1)
|
| [44] |
Lu K J,Huang N C,Liu Y S, et al.2012.Long-distance movement of Arabidopsis FLOWERING LOCUS T RNA participates in systemic floral regulation.RNA Biology,9(5):653-662.( 1) 1)
|
| [45] |
Lucas W J,Yoo B C,Kragler F.2001.RNA as a long-distance information macromolecule in plants.Nature Review Molecular Cell Biology,2(11): 849-857.( 1) 1)
|
| [46] |
Mahajan A,Bhogale S,Kang I H,et al.2012.The mRNA of a Knotted 1-like transcription factor of potato is phloem mobile.Plant Molecular Biology,79(6): 595-608.( 2) 2)
|
| [47] | Matin A,Adam H,Díaz-Mendoza M,et al. 2009.Graft-transmissible induction of potato tuberization by the microRNA miR172.Development,136(17):2873-2881. |
| [48] |
Mlotshwa S,Voinnet O,Mette M F,et al. 2002.RNA silencing and the mobile silencing signal.Plant Cell,14(Suppl): s289-s301.( 1) 1)
|
| [49] |
Molnar A,Melnyk C W,Bassett A,et al. 2010.Small silencing RNAs in plants are mobile and direct epigenetic modification in recipient cells.Science,328(5980): 872-875.( 1) 1)
|
| [50] |
Nayelli M,John F,Karla L,et al. 2013.An efficient flat-surface collar-free grafting method for Arabidopsis thaliana seedlings.Plant Method,9(14): 4-9.( 1) 1)
|
| [51] |
Notaguchi M,Wolf S,Lucas W J.2012.Phloem-mobile Aux/IAA transcripts target to the root tip and modify root architecture.Journal of Integrative Plant Biology,54: 760-772.( 1) 1)
|
| [52] |
Omid A,Keilin T,Glass A,et al. 2007.Characterization of phloem-sap transcription profile in melon plants.Journal of Experimental Botony,58(13): 3645-3656.( 2) 2)
|
| [53] |
Palauqui J C,Balzergue S.1999.Activation of systemic acquired silencing by localised introduction of DNA.Current Biology,9(2): 59-66.( 1) 1)
|
| [54] |
Rodriguez-Medina C,Atkins C A,Mann A J,et al. 2011.Macromolecular composition of phloem exudate from white lupin(Lupinus albus L).BMC Plant Biology,11: 36.( 1) 1)
|
| [55] |
Ruiz-Medrano R,Xoconostle-Cazares B,Lucas W J.1999.Phloem long-distance transport of CmNACP mRNA: implications for supracellular regulation in plants.Development,126(20): 4405-4419.( 2) 2)
|
| [56] |
Shukla D D,Frenkel M J,McKern N M,et al. 1994.New developments in the detection and classification of potyviruses//Rishi N,Ahuja K L,Singh B P.Virology in the Tropics.Malhotra Publishing House,571-581.( 1) 1)
|
| [57] |
Sonoda S,Nishiguchi M.2000.Graft transmission of post-transcriptional gene silencing: Target specificity for RNA degradation is transmissible between silenced and non-silenced plants,but not between silenced plants.The Plant Journal,21(1): 1-8.( 1) 1)
|
| [58] |
Stegemann S,Bock R.2009.Exchanges of genetic material between cells in plant tissue grafts.Science,324(5927): 649-651.( 1) 1)
|
| [59] |
Tamaki S,Matsuo S,Wong H L,et al. 2007.Hd3a protein is a mobile flowering signal in rice.Science,316:1033-1036.( 1) 1)
|
| [60] |
Tran L S,Nakashima K,Sakuma Y,et al. 2004.Isolation and functional analysis of Arabidopsis stress-inducible NAC transcription factors that bind to a drought-responsive cis-Element in the early responsive to dehydration stress 1 promoter.The Plant Cell,16(9): 2481-2498.( 1) 1)
|
| [61] |
Turck F,Fornara F,Coupland G.2008.Regulation and identity of florigen: FLOWERING LOCUST moves center stage.Annual Reviews Plant Biology,59: 573-594.( 1) 1)
|
| [62] |
Turnbull C G N,Booker J P,Leyser H M O.2002.Micrografting techniques for testing long-distance signalling in Arabidopsis.Plant Journal,32(2): 255-262.( 1) 1)
|
| [63] |
Tzarfatil R,Ben-Dor S,Sela I,et al. 2013.Graft-induced changes in Micro RNA expression patterns in Citrus leaf petioles.The Open Science Journal,7(7): 17-23.( 1) 1)
|
| [64] |
Voinnet O,Vain P,Angell S,et al. 1998.Systemic spread of sequence-specific transgene RNA degradation in plants is initiated by localized introduction of ectopic promoterless DNA.Cell,95(2): 177-187.( 3) 3)
|
| [65] |
Xu H,Zhang W,Li M,et al. 2010.Gibberellic acid intensive mRNA transport in both directions between stock and scion in Malus. Tree Genet Genomes,6: 1013-1019.( 1) 1)
|
| [66] |
Yang H W,Yu T S.2010.Arabidopsis floral regulators FVE and AGL 24 are phloem-mobile RNAs.Botanical Studies,51: 17-26.( 2) 2)
|
| [67] |
Zhang D H,Meng Z H,Xiao W M.2006.Grafted-induced inheritable variation in Mungbean and its application in Mungbean breeding.Aata Botanica Sinica,44(7): 832-837.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

