文章信息
- 崔贝, 林若竹, 赵文霞, 兰宗科
- Cui Bei, Lin Ruozhu, Zhao Wenxia, Lan Zongke
- 秦岭南坡北桑寄生生态危害状况评价
- Ecological Damage Assessment of Loranthus tanakae (Loranthaceae) in the South Slopes of Qinling Mountain
- 林业科学, 2014, 50(10): 86-93
- Scientia Silvae Sinicae, 2014, 50(10): 86-93.
- DOI: 10.11707/j.1001-7488.20141012
-
文章历史
- 收稿日期:2013-06-18
- 修回日期:2013-12-10
-
作者相关文章
2. 陕西省宝鸡市凤县林业局 宝鸡 721000
2. Fengxian Forest Bureau of Baoji City, Shaanxi Province Baoji 721000
桑寄生科(Loranthaceae)植物为半寄生性灌木,常寄生于木本植物的茎或枝上。该科有 60~68属,700~950种,主要分布在热带和亚热带地区,我国产8属51种,包括18个特有种(Qiu et al., 2003)。
桑寄生科植物是所在森林生态系统的核心类群,具有重要的生态调节功能(Watson,2001);但由于其独特的生存方式,该类植物的大量繁殖往往会造成寄主树种的衰退甚至死亡。例如,桑寄生植物常具有较高的电解质浓度及较强的蒸腾作用,能大量汲取寄主枝干的水分,导致寄生部位末端因缺水而干枯死亡(Stewart et al., 1990; Tennakoon et al., 1996; Kolb,2002); 同时,还会汲取寄主植物中大量的矿物质和碳水化合物(Lamont,1983; Ehleringer et al., 1985),削弱寄主植物树势,造成寄主植物果实或蓄积量减产,从而影响寄主植物的经济及生态效益(肖云来等,1988; 周德群,1990; 黄恩平等,1997; Reid et al., 2000; Geils et al., 2002)。另外,由于寄主树势的减弱,其被病原微生物或植食性昆虫侵染的概率增大,造成一定程度的次生损害,从而增加寄主植株的死亡率(Gill et al., 1961; Knutson,1983; Kolb,2002)。因此,桑寄生科植物的大量繁殖会影响天然林、人工林、经济林和城市园林树木的生长,影响森林生态、经济和社会效益的发挥(Gill et al., 1961; Room,1973; Hawksworth,1983)。
不同种桑寄生科植物对其寄主选择差异较大,寄主种群年龄及分布密度直接影响桑寄生植物的分布及丰富度。如在其寄主分散分布的地区,桑寄生较为少见且不会有大量分布(Aukema,2004)。此外,种子植物的种子传播途径和范围会影响其种群的分布区域(Schupp et al., 1995; García et al., 2005)、植物种群的空间占有率(Freckleton et al., 2002; Purves et al., 2005)和某一物种的地理学等级(Nathan,2006)。由于桑寄生植物与其传播者的特定的共生关系(Snow et al., 1984; 1988; Reid,1991),在鸟类及其他能协助该类植物种子传播的物种丰富度较高的地区出现桑寄生植物的概率也会同时提高(Snow et al., 1988)。因此,在我国具有重要生态学和生物地理学地位的地区设立观测和调查样点,研究桑寄生科植物的分布范围和危害发展趋势具有重要意义。
秦岭是我国华北、华中、西南、蒙古高原和青藏高原植物区系的交汇地,被视为我国南北方的自然分水岭,而秦岭南坡是我国暖温带和亚热带的分界线,具有十分重要的生态学及生物地理学意义(康慕谊,1991)。栎类植物是秦岭林区重要的建群种和优势种之一(朱志成,1983; 曲式曾等,1990),保护和改善栎林资源,对维护秦岭的生态平衡、促进秦岭林区物种多样化、保存珍贵动植物和微生物资源具有关键作用。自2000年“天保工程”实施以来,秦岭地区天然次生林恢复较快,物种多样性明显增加(屈兴奎等,2008),与此同时,寄生性种子植物繁衍所需环境条件得到保障,种群数量不断增大,由此逐步危害到森林整体健康。
北桑寄生(Loranthus tanakae)隶属桑寄生科、桑寄生属(Loranthus),分布于我国西南至华中等地,是秦岭林区主要的桑寄生科植物之一,寄主主要为栎属(Quercus)、桦木属(Betula)、榆属(Ulmus)植物等,其中,锐齿栎(Quercus aliena var. acutiserrata)是北桑寄生的重要寄主。锐齿栎林是秦岭林区落叶阔叶林的代表类型之一,分布广泛(王建让,1989)。因此,笔者选取秦岭南坡凤县的锐齿栎林区作为观测点,对其进行全面踏查和典型样地调查,以期获得北桑寄生及其寄主分布和生长情况的详细资料,探明北桑寄生在天然次生栎林中的分布式样,以评估北桑寄生对秦岭南坡天然次生栎林的生态危害。本研究可为桑寄生植物对天然次生林的生态影响评价提供理论依据,为森林有害寄生植物的长期监测与生态防治提供理论基础和本底资料。
1 研究区概况与研究方法 1.1 研究区概况凤县位于陕西省西南部,秦岭南坡,陕、甘、川3省交界处,106°24′54″—107°7′30″E,33°34′57″—34°18′21″N,属暖温带山地气候。森林植被主要是暖温带喜温性树种组成的落叶阔叶林和针-阔(松-栎)混交林,林木主要分布于海拔1 400~2 000 m的中山腹地,主要阔叶树种为栎属植物,占全县树种75%以上。海拔1 400 m以下由于人为活动影响、自然环境与气候变化和重力地貌逐步形成等诸多原因,森林环境遭到破坏,仅存小块状的侧柏(Platycladus orientalis)、栓皮栎(Q. variabilis)林分,大多为灌木林地和荒山。近年来由于加大飞播造林和封山育林力度,再加上加强依法护林,森林生态环境正在逐步改善。
1.2 调查方法 1.2.1 踏查凤县辖双石铺镇、凤州镇、黄牛铺镇、红花铺镇、河口镇、唐藏镇、平木镇、坪坎镇、留凤关镇9镇,共150个行政村。经查阅凤县森林资源分布图,确定主要栎类分布区,通过联系与走访当地林业部门,挑选人为砍伐破坏较小的几大林区作为初步踏查对象。2012年4月,选定具有典型天然次生栎林群落特征的调查试点进行走访踏查,初步了解该地区栎类分布情况及桑寄生危害情况。根据初步踏查结果,按照北桑寄生的分布密集程度及不同的地理方位,最终选取河口镇(中部)、唐藏镇(西北)、黄牛铺镇(北)、平木镇(东)、坪坎镇(东南)、留凤关镇(西南)6镇进行深入调查,并于2012年4—12月分别在唐藏镇、坪坎镇、留凤关镇进行典型样地调查。
1.2.2 典型样地调查针对北桑寄生密集分布的区域设置典型样地。调查样地为该地区具有代表性的典型栎类群落,主要选取自“天保工程”以后不再被大面积人为砍伐的天然次生栎林区。调查共设置25 m×25 m的样地11块:唐藏镇倒回沟村五岭子沟4块、草滩沟村1块、倒回沟村大水河沟1块; 坪坎镇八方山银母寺村老工区1块、银母寺沟1块; 留凤关镇苇子坪村后沟1块、苇子坪镇樊家沟灵官寺1块、苇子坪村偏沟1块。记录样地经纬度、海拔、坡位、样地内胸径大于6 cm的乔木种类和数量及被北桑寄生侵染的寄主植株种类和数量,对胸径6 cm以上的栎类乔木用红色油漆标记并测量树高、胸径、年龄、一级分枝数量。对于被侵染的寄主个体,记录其被侵染的一级分枝数量、北桑寄生植株丛数、染病枝朝向(东西南北)及单丛寄生植株最大直径。其中,单丛寄生植株冠幅记作其直径,选取寄生植株最大冠幅记录为单株寄主上单丛寄生植株最大直径。寄生率(%)为所有样地内被侵染乔木数占样地内全部乔木(DBH >6 cm)数的百分率。
在相邻区域选取健康栎类群落作为对照组,分别选择与样地具有相同海拔、坡位、林分组成等条件但未被北桑寄生侵染的栎类群落,以及与样地具有不同海拔、坡位、林分组成等条件且同样未被北桑寄生侵染的栎类群落共5块。
1.2.3 单株调查针对零散分布于样地外的被侵染乔木进行调查,对于被侵染的寄主个体记录其年龄、一级分枝总数、被侵染的一级分枝数量及单丛寄生植株最大直径。
1.3 数据分析一级分枝平均寄生率(%)为样地内和零散分布的锐齿栎被侵染的一级分枝数占其一级分枝总数的百分率。单株寄主各个方位被侵染分枝数量间进行单因素方差分析,最小显著差异法(least-significant difference,LSD)法检验组间差异。对锐齿栎年龄与各年龄寄主上单丛寄生植株的平均最大直径之间通过回归方程表示其关系。所有统计分析使用SPSS 17.0软件完成。
2 结果与分析 2.1 总体分布情况 2.1.1 分布情况根据踏查、走访当地村民及林业工作者,确定海拔1 600~2 000 m区域主要栎林内均有北桑寄生分布。远山成熟栎林分布密集,受人为干扰较少,北桑寄生分布频率较大(表 1)。
|
|
北桑寄生多生长在空气及土壤相对湿度较大、生态条件较好的山坡及山脊处,少数见河边、村路旁,干燥且林下植被较少的阳坡未发现寄生植株(表 1)。北桑寄生密集分布的样地内优势树种有锐齿栎、黑杨(Populus nigra)、榆树(Ulmus pumila)、华山松(Pinus arm and ii)、槭树(Acer spp.)、椴树(Tilia tuan)。
2.2 寄主选择在已调查的119株被侵染寄主植株中,有锐齿栎105株、白桦(Betula platyphylla)7株、榆树6株、野樱桃(Cerasus sp.)1株。优势寄主锐齿栎树龄对北桑寄生的寄主选择和生长状况有显著影响。在调查中发现,105株被北桑寄生侵染的锐齿栎中,绝大部分寄主为40~50年生,其比例达到54.62%(图 1A); 各年龄段锐齿栎上单丛北桑寄生植株平均最大直径和锐齿栎年龄间呈显著线性正相关(P< 0.05)(图 1B)。
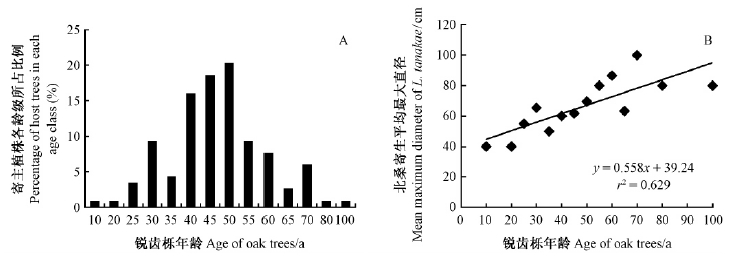 |
图 1 锐齿栎年龄与北桑寄生间的关系
Fig. 1 Relationships between age of oak trees and L. tanakae
A.各年龄被侵染的锐齿栎所占比例Proportion of infected hosts in each ages from the total infected oak trees; B.寄主年龄与单丛北桑寄生平均最大直径Regression analysis between the mean maximum diameter of L. tanakae and its host age. |
样地调查结果显示,被侵染的寄主植株在东南西北4个方位均有被侵染的枝条,4个方位单株寄主被侵染的一级分枝数量间无显著差异(df=3,296,F=1.68,P=0.17),但南向偏多,每株寄主位于南面的一级分枝被侵染数量平均为1.97枝(图 2A)。单株寄主垂直方向上被侵染的一级分枝数量间存在显著差异(df=2,222,F=26.67,P<0.05),其中树冠部被侵染的枝条数量最多,达到4.20枝,寄主植株下部未发现有被侵染枝条(图 2B)。
 |
图 2 单株寄主地理方位和垂直方向上平均被侵染一级分枝数量
Fig. 2 Number of the infected primary branches in geographic orientation and vertical position of a host
不同字母表示处理间差异显著(P<0.05,LSD检验)Different letters above the bars show significant difference among treatment(P<0.05,LSD test). |
在11块典型样地内(表 2),经统计被侵染植株共75株,其中69株为锐齿栎,6株为白桦。被侵染植株总数为样地内各树种总株数的29.03%; 被侵染的锐齿栎为样地内锐齿栎总数的36.90%(表 3)。调查中发现被侵染最严重的寄主个体上有35丛北桑寄生,平均每株锐齿栎上有5.55丛北桑寄生植株。
|
|
|
|
所有被侵染的锐齿栎个体一级分枝总数为1 163枝,被侵染的为576枝,受害植株一级分枝的平均寄生率为49.53%,即将近一半的一级分枝受到北桑寄生的威胁。受害植株寄生部位严重变形肿大,自寄生部位以上长势较弱,枝条明显变细,部分自寄生部位断裂脱落,末端死亡。受害最严重的分枝上发现10余丛寄生植株,寄主生长状况较差,被寄生枝干呈衰亡趋势。
3 结论与讨论由于北桑寄生分布范围较广,目前国内对其调查研究较少,未有较为全面的资源调查。曾有学者提出北桑寄生种群数量日益减少,已成为部分省区的濒危物种(王锡华等,2001; 司秉兴等,2008),亟需保护。秦岭作为我国物种极其丰富的地区之一,探明北桑寄生在秦岭的分布式样及影响有重要意义。本调查首次对秦岭凤县林区北桑寄生分布情况进行踏查及典型样地调查,初步了解了桑寄生科植物在天然次生锐齿栎林内的分布式样,并评估了其危害情况。
3.1 分布及其寄生情况 3.1.1 分布及其寄生环境本研究表明,北桑寄生在凤县的分布情况与其寄主分布情况有密切关系。北桑寄生在锐齿栎的主要密集分布区较容易发现,且在成熟林区域呈密集分布状,与国外学者研究结果一致(Aukema,2003; 2004)。
北桑寄生常生长于海拔950~2 000 m的阔叶林中(Qiu et al., 2003)。本研究表明,凤县北桑寄生的海拔分布更为严格,在海拔低于1 600 m、高于2 000 m的生境下均未发现其分布,并且其生存环境须同时满足生态条件较好、空气及土壤湿度较大、在山坡中上部及山脊处、有成片成过熟林等条件。如在留凤关镇瓦房坝村海拔1 700 m左右长势较好的成熟栎类林区并未发现北桑寄生,可能由于该区域地处南向阳坡,林下过于干旱。此外,北桑寄生海拔分布下缘也可能与当地人为采伐作业有关:海拔较低处的采伐力度较高海拔处大,因此海拔低处的寄生植株随寄主被一并采伐,留存较少。
3.1.2 寄生部位、寄主选择及分布式样北桑寄生的寄主选择及其寄生部位与其主要传播者鸟类有非常密切的关系。Aukema等(2002)发现,鸟类较喜好在成熟林的冠层位置栖息取食,导致种子不均衡传播,因此影响了寄生植物种子传播范围。本次调查发现,北桑寄生大多寄生于树干中上部,且南向居多,寄主主要为锐齿栎,多为成过熟林,偶见榆树、黑杨和白桦等。锐齿栎分布于陕西秦巴山区,常呈大面积纯林。而凤县地区的主要栎类树种为锐齿栎,为调查样地内的优势树种,大多长势优良,成熟林树高平均可达15 m,占据森林上层空间,因此成为北桑寄生主要寄主。此外,北桑寄生在冠层分布也可能与种间竞争有关,北桑寄生属半寄生植物,可进行光合作用,但其光合作用水平比一般植物低(Mathiasen et al., 2008; 盛晋华等,2006),因此林冠层及南向阳光充足的位置出现北桑寄生的概率较大。
本研究中,北桑寄生的寄主主要为40~50年生树木。其原因除了与鸟类栖息习性有关外,还可能由于北桑寄生的繁殖需要从寄主汲取水分、矿物质和碳水化合物,而只有年龄成熟、生长稳定的林分才能适合寄生植株的稳定生长,幼龄林不足以满足其生长需要。另外,人为干扰也可能对北桑寄生的寄主选择产生一定影响。目前所能观察到的寄生植株单丛直径为20~160 cm,根据其生长习性推断其为10~50年生,即初始寄生年代应早于20世纪末期的大规模砍伐。由此推测,现有寄主植株可能主要为当年采伐后剩余树木,并同时保存了寄生植株,后经人工抚育及自然更新,寄主种群扩大,森林生态环境逐步改善,北桑寄生繁殖、传播增强,出现在较为年幼的林分中。
北桑寄生在其密集分布区常呈中心辐射状分布。在分布区中心可发现数丛直径较大、长势最为旺盛的寄生植株,其周围尤其是稍低位置则出现大量较小寄生植株。其原因可能一是由于鸟类取食后就近活动,二是由于果实自然下落及近距离散播,附着在寄主植株自身下层枝干或周围植株上。
3.2 寄生率及危害状况本研究中,被侵染锐齿栎的一级分枝平均寄生率近50%,即将近一半的一级分枝都有可能在以后的生长过程中末端逐渐死亡脱落,造成寄主植株叶量减少,光合及蒸腾作用受到影响,最终可能导致寄主植株长势减弱,加速衰老死亡,造成林木蓄积量的减少。
到目前为止,凤县局部林区发现大量北桑寄生分布,导致部分寄主严重受害,但该寄生植物尚未对天然次生栎林造成广泛危害,主要原因推测如下:
1)我国20世纪80年代及更早的大规模采伐作业导致凤县林区现有森林主要优势树种树龄大多不超过40年,不满足北桑寄生大量生长繁殖需要的优异稳定的生态条件。调查区林木多为20世纪90年代中期人工作业砍伐、 1995年左右人工抚育的近-成熟林,寄主树种大多为当时采伐未涉及的植株,部分年龄可达40~60年,因此北桑寄生的寄主得以保存但又不足以造成该寄生植物广泛传播。
2)由于特殊的寄生习性,北桑寄生存在明显的分布界限,主要与环境及海拔密切相关,尤其是对寄生环境和寄主的选择有较严格的条件,在不符合其生长条件的情况下也无法满足其传播条件。
3)桑寄生科植物的繁殖和传播与取食的鸟类有密切关系。早期森林大面积砍伐导致生态环境遭到破坏,在一定时期内鸟类数量减少, 致使北桑寄生果实和种子的远距离散播受到限制。
虽然北桑寄生目前在秦岭凤县林区尚未造成严重危害,但由于近年来“天保工程”的实施,其主要寄主锐齿栎种群密度及种子传播者种群数量逐渐增加,不能忽视北桑寄生大量繁殖的潜在危害,亦不能排除其大面积暴发的可能性。一旦大面积暴发,将导致林木大量死亡,总蓄积量减少,势必造成严重的经济损失。
| [1] |
黄恩平, 姚忠庆. 1997. 板栗园桑寄生植物的生物学特性及危害的初步研究. 昆明师专学报:自然科学版, 12(1): 22-24.( 1) 1)
|
| [2] |
康慕谊. 1991. 秦岭地区森林植被研究的历史回顾. 陕西林业科技, (3): 19-24.( 1) 1)
|
| [3] |
曲式曾, 张文辉, 李景侠. 1990. 陕南栎类资源现状调查. 西北林学院学报, 5(1): 75-81.( 1) 1)
|
| [4] |
屈兴奎, 李道智, 徐振江. 2008. 浅谈秦岭林区新建自然保护区的管理与发展. 陕西林业, (4): 28-30( 1) 1)
|
| [5] |
盛晋华, 张雄杰, 刘宏义, 等. 2006. 寄生植物概述. 生物学通报, 41(3): 9-12.( 1) 1)
|
| [6] |
司秉兴, 白瑞兴, 韩艳杰, 等. 2008. 辽西地区寄生树种北桑寄生生存繁衍特性初探. 辽宁林业科技, (3): 31-43.( 1) 1)
|
| [7] |
王建让. 1989. 秦岭林区锐齿栎林群落类型的初步研究. 植物生态学与地植物学报, 13(3): 277-281.( 1) 1)
|
| [8] |
王锡华, 李京东. 2001. 仰天山北桑寄生研究初报. 山东科学, 14(2): 16-20.( 1) 1)
|
| [9] |
肖云来, 普正和. 1988. 西双版纳桑寄生植物的危害调查. 云南植物研究, 10(1): 423-432.( 1) 1)
|
| [10] |
周德群. 1990. 寄生性种子植物及其对林木的危害.云南林业科技, (2): 67-69.( 1) 1)
|
| [11] |
朱志成. 1983. 秦岭尖齿栎林的初步研究. 西北植物研究, 3(2): 122-132.( 1) 1)
|
| [12] |
Aukema J E. 2003. Vectors, viscin, and Viscaceae: mistletoes as parasites, mutualists, and resources. Frontiers in Ecology and the Environment, 1(4): 212-219.( 1) 1)
|
| [13] |
Aukema J E. 2004. Distribution and dispersal of desert mistletoe is scale-dependent, hierarchically nested. Ecography, 27(2): 137-144.( 1) 1)
|
| [14] |
Aukema J E, Martínez del Rio C. 2002. Where does a fruit-eating bird deposit mistletoe seeds? Seed deposition patterns and an experiment. Ecology, 83(12): 3489-3496.( 1) 1)
|
| [15] |
Ehleringer J R, Schulze E D. 1985. Mineral concentrations in an autoparasitic Phoradendron californicum growing on a parasitic P. californicum and its host, Cercidium floridum. American Journal of Botany, 72(4): 568-571.( 1) 1)
|
| [16] |
Freckleton R P, Watkinson A R. 2002. Large-scale spatial dynamics of plants: metapopulations, regional ensembles and patchy populations. Journal of Ecology, 90(3): 419-434.( 1) 1)
|
| [17] |
García D, Houle G. 2005. Fine-scale spatial patterns of recruitment in red oak (Quercus rubra): what matters most, abiotic or biotic factors? Ecoscience, 12(2): 223-235.( 1) 1)
|
| [18] |
Geils B W, Hawksworth F G. 2002. Damage, effects, and importance of dwarf mistletoes. Mistletoes of North American Conifers, Chapter 5, 57-65.( 1) 1)
|
| [19] |
Gill L S, Hawksworth F G. 1961. The mistletoes: A literature review (No. 1242). US Dept. of Agriculture.( 2) 2)
|
| [20] |
Hawksworth F G. 1983. Mistletoes as forest parasites. //Calder M, Bernhardt P. The Biology of MistletoesAcademic Press, San Diego, CA, 317-334.( 1) 1)
|
| [21] |
Knutson D M. 1983. Physiology of mistletoe parasitism and disease responses in the host//Calder M, Bernhardt P The Biology of Mistletoes. Academic Press, Sydney, 295-316.( 1) 1)
|
| [22] |
Kolb T E. 2002. Ecophysiology of parasitism in the plant kingdom//Lopezsaei J A, Rodnigu P C, Saez L. Plantas Parasitas de la Peninsula Iberica e Islas Baleares (Guide on Parasitic Plants of the Iberian Peninsula and the Balearic Islands). MundiPrensa, Madrid, 57-85.( 2) 2)
|
| [23] |
Lamont B. 1983. Mineral nutrition of mistletoes// Calder M, Bernhardt P. The Biology of Mistletoes. Academic Press, San Diego, CA, 185-201.( 1) 1)
|
| [24] |
Mathiasen R L, Nickrent D L, Shaw D C, et al. 2008. Mistletoes: pathology, systematics, ecology, and management. Plant Disease, 92(7): 988-1006.( 1) 1)
|
| [25] |
Nathan R. 2006. Long-distance dispersal of plants. Science, 313(5788): 786-788.( 1) 1)
|
| [26] |
Purves D W, Dushoff J. 2005. Directed seed dispersal and metapopulation response to habitat loss and disturbance: application to Eichhornia paniculata. Journal of Ecology, 93(4): 658-669.( 1) 1)
|
| [27] |
Qiu H X, Gilbert M G. 2003. Loranthaceae//Editorial Committee of Floraof China. Flora of China 5.Beijing:Science Press; St.Louis:Missouri Botanical Garden Press, 220-239.( 2) 2)
|
| [28] |
Reid N. 1991. Coevolution of mistletoes and frugivorous birds? Australian Journal of Ecology, 16(4): 457-469.( 1) 1)
|
| [29] |
Reid N, Smith M S. 2000. Population dynamics of an arid zone mistletoe (Amyema preissii, Loranthaceae) and its host Acacia victoriae (Mimosaceae). Australian Journal of Botany, 48(1): 45-58.( 1) 1)
|
| [30] |
Room P M. 1973. Ecology of the mistletoe Tapinanthus bangwensis growing on cocoa in Ghana. Journal of Ecology, 61(3): 729-742.( 1) 1)
|
| [31] |
Schupp E W, Fuentes M. 1995. Spatial patterns of seed dispersal and the unification of plant population ecology. Ecoscience, 2(3): 267-275.( 1) 1)
|
| [32] |
Snow B K, Snow D W. 1984. Long-term defence of fruit by mistle thrushes Turdus viscivorus. Ibis, 126(1): 39-49.( 1) 1)
|
| [33] |
Snow B K, Snow D W. 1988. Birds and Berries: A Study of an Ecological Interaction. Carolton, UK:T. & A. D.Poyser.( 2) 2)
|
| [34] |
Stewart G R, Press M C. 1990. The physiology and biochemistry of parasitic angiosperms. Annual Review of Plant Biology, 41(1): 127-151.( 1) 1)
|
| [35] |
Tennakoon K U, Pate J S. 1996. Effects of parasitism by a mistletoe on the structure and functioning of branches of its host. Plant, Cell & Environment, 19(5): 517-528.( 1) 1)
|
| [36] |
Watson D M. 2001. Mistletoe-a keystone resource in forests and woodlands worldwide. Annual Review of Ecology and Systematics, 32: 219-249.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

