文章信息
- 峥嵘, 王琚钢, 邰丽华, 白淑兰, 牛艳芳
- Zheng Rong, Wang Jugang, Tai Lihua, Bai Shulan, Niu Yanfang
- 浅黄根须腹菌γ-actin基因的克隆及表达分析
- Cloning and Expression Analysis of γ-actin Gene from Rhizopogon luteolus
- 林业科学, 2014, 50(10): 80-85
- Scientia Silvae Sinicae, 2014, 50(10): 80-85.
- DOI: 10.11707/j.1001-7488.20141011
-
文章历史
- 收稿日期:2013-06-17
- 修回日期:2014-04-29
-
作者相关文章
2. 内蒙古师范大学生命科学与技术学院 呼和浩特 010022
2. College of Life Sciences and Technology, Inner Mongolia Normal University Hohhot 010022
肌动蛋白(actin)是真核生物中广泛存在的一种重要蛋白质,是构成细胞骨架和肌肉肌小节的主要成分,执行着重要的生理功能,如细胞分裂、细胞运动、细胞形状变化、内吞作用、胞吐作用,以及多种细胞运动,如顶端生长、细胞器运动、胞质环流等(Doherty et al., 2008)。该蛋白主要包括α-actin,β-actin和γ-actin3种类型,其中,α-actin通常存在于平滑肌细胞中,而 β-actin和γ- actin则几乎在所有细胞中存在。目前在高等真核生物中已报道了多个不同的actin 基因,在真菌中报道较多的是γ- actin 基因(卓侃等,2010)。actin基因在各组织和细胞中的表达相对恒定,是高度保守的管家基因,因此,通常在实时定量PCR、Northern杂交和免疫蛋白印迹中作为内参基因(Lin et al., 2012)。此外,actin基因现已在植物界、动物界和真菌界作为分子系统学研究的重要基因之一(Kapoor et al., 2008; 方玲等,2013)。
浅黄根须腹菌(Rhizopogon luteolus)隶属于担子菌亚门(Basidiomycotina)、腹菌目(Gasteromycetes)、须腹菌科(Rhizopogonaceae)、根须腹菌属(Rhizopogon),主要分布于云南、福建、内蒙古等地(白淑兰,2011)。本研究所用菌株采集于内蒙古自治区呼和浩特市大青山喇嘛洞干旱阳坡油松(Pinus tabulaeformis)天然林中,通过子实体组织分离获得。在实验室通过盆栽试验证实菌株对油松的侵染率达80%,并对油松生长有显著的促进作用,同时能够显著提高油松的抗旱能力,是油松的优良外生菌根菌(Bai et al., 2009; 邵东华等,2013)。植物生理研究仅揭示菌根真菌影响植物抗逆性的一些现象,但本质上菌根真菌对于植物抗逆性的调节是基于对相关基因表达的调控,即通过上调或下调某些基因的表达以及诱导新的逆境基因表达来增强植物抗逆性(李涛等,2012)。油松为典型菌根依赖型树种(白淑兰,2011),耐干旱贫瘠,逆境中油松的菌根共生体可能通过调节一些抗逆相关基因的表达进而增强油松的抗逆性。形成菌根的植株有2条吸收磷的途径:一条是通过根系皮层细胞直接吸收;另一条是菌根途径(Smith et al., 2010)。在菌根途径中,菌根外延菌丝中大量表达的高亲和力磷酸盐转运蛋白发挥着重要作用,可以帮助宿主植物吸收贫磷区的磷(Bucher,2007)。另外,磷维持着植物根系的电导率和皮层细胞膜电位,其缺乏不利于植物对水分的吸收(王琚钢等,2012)。作为油松优良外生菌根真菌的浅黄根须腹菌可能通过菌根途径最大限度地提高了油松对环境中磷和水分的吸收。研究浅黄根须腹菌的磷酸盐转运蛋白基因在不同水分条件和不同胁迫处理条件下的变化规律,对于了解恶劣立地条件下外生菌根真菌提高油松生存的分子机制非常重要。作为前期研究,本研究以浅黄根须腹菌菌丝体培养物为材料,用简并PCR法和RACE技术克隆了浅黄根须腹菌γ-actin cDNA全长,并验证其作为内标基因的可靠性,为研究浅黄根须腹菌与油松菌根共生体的抗逆性相关基因表达和调控机制奠定基础。
1 材料与方法 1.1 材料与试剂浅黄根须腹菌通过子实体组织分离获得,现保存于内蒙古农业大学林学院微生物实验室。
主要试剂: EASY spin Plus植物RNA快速提取试剂盒(北京艾德莱生物科技有限公司); GoldScript cDNA合成试剂盒(invitrogen); Midi Purification Kit 离心柱型普通琼脂糖凝胶回收试剂盒(天根公司); 5′ RACE试剂盒(invitrogen); SMARTerTM RACE cDNA Amplification Kit试剂盒(Clontech); Taq DNA聚合酶(TAKARA); 克隆载体PMD19-T(TAKARA); 感受态大肠埃希菌(Escherichia coli)DH5α(TAKARA)。
1.2 引物根据已知大型真菌肌动蛋白基因序列,在其保守区域设计简并引物Rl-actF和Rl-actR,利用简并PCR扩增浅黄根须腹菌γ-actin cDNA核心片段; 根据分离得到的核心片段序列,设计该基因的特异性引物GSP-1,GSP-2,GSP-3和GSP-4,GSP-5,用于5′和3′-RACE-PCR。引物由上海生工生物技术公司合成(引物序列见表 1)。
|
|
采用RNA提取试剂盒提取浅黄根须腹菌总RNA,利用紫外分光光度计测定其纯度和浓度,通过琼脂糖凝胶电泳进行浓度和完整性检测。利用GoldScript cDNA合成试剂盒合成第一链cDNA,具体操作步骤参照试剂盒说明书。
1.4 浅黄根须腹菌γ-actin cDNA全长扩增及产物克隆、测序核心片段扩增,以cDNA为模板进行RT-PCR扩增。反应体系(总体积50 μL): 10×PCR缓冲液5 μL,2 mmol·L-1 dNTPs 3 μL,10 μmol·L-1的上游和下游引物各2 μL,cDNA(约30 ng)5 μL,5 U·μL-1 Taq酶 0.5 μL,去离子水32.5 μL。反应条件: 94 ℃预变性4 min; 94 ℃变性30 s,55 ℃ 退火30 s,72 ℃延伸 1 min,35个循环; 72 ℃延伸10 min,4 ℃保存。PCR 产物经1.0%的琼脂糖凝胶电泳分离,将目的DNA片段用琼脂糖凝胶回收试剂盒回收纯化。
5′ -RACE扩增基因末端,采用5′- RACE试剂盒克隆浅黄根须腹菌γ-actin基因的5′端序列。参照试剂盒说明,对总RNA进行目的基因第1链cDNA的合成,纯化后,对cDNA末端加上多聚C。用引物GSP-2和试剂盒内的桥连铆钉引物AAP对已经加dC尾的cDNA进行PCR第1轮扩增。PCR反应体系: 加dC尾的cDNA 5.0 μL,10×PCR buffer 5.0 μL,25 mmol·L-1 MgCl2 3 μL,10 mmol·L-1 dNTPs 1.0 μL,10 μmol·L-的引物GSP-2和桥连铆钉引物AAP 各2.0 μL,5 U·μL-1 Taq 酶 0.5 μL,无菌去离子水补至50 μL。反应程序: 94 ℃预变性2 min; 94 ℃ 变性30 s,55 ℃ 退火30 s,72 ℃延伸2 min,35个循环; 72 ℃延伸5 min,4 ℃保存。用引物GSP-3和试剂盒内的桥连通用扩增引物AUAP进行第2轮巢式PCR扩增。PCR反应体系: 第1轮PCR产物5.0 μL,10× PCR buffer 5.0 μL,25 mmol·L-1 MgCl2 3 μL,10 mmol·L-1 dNTPs 1.0 μL,10 μmol·L-1的引物GSP-3和引物AUAP各1.0 μL,5 U·μL-1 Taq 酶 0.5 μL,无菌去离子水补至50 μL。反应程序同上。将第2轮PCR产物进行电泳并对目的条带进行切胶回收纯化。
3′-RACE扩增基因末端,参照RACE试剂盒说明书,使用逆转录酶SMARTScribeTM Reverse Transcriptase和引物3′ CDS primer A 对总RNA进行逆转录合成cDNA。以上述合成的cDNA为模板,用引物GSP-4和UPM 进行第1轮PCR扩增。反应体系: cDNA 2.5 μL,引物各1 μL,Maser Mix 41.5 μL,无菌去离子水补至50 μL,降落PCR反应程序: 94 ℃ 30 s,72 ℃ 3 min,5个循环; 94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,5个循环; 94 ℃ 30 s,68 ℃ 30 s,72 ℃ 3 min,27个循环。将第1轮PCR扩增产物稀释50倍,用引物GSP-5和UPM进行第2轮PCR扩增,反应体系同上。反应程序: 94 ℃ 30 s,68 ℃ 30 s,72 ℃ 3 min,20个循环。将第2轮PCR产物进行电泳,并对目的条带进行切胶回收纯化。
将上述3个纯化后的PCR产物分别与pMD19-T连接,转化到感受态细胞大肠埃希菌DH5α,菌落PCR检测阳性克隆后送至上海生工生物技术有限公司进行测序。
1.5 浅黄根须腹菌γ-actin表达分析分别在不同碳源、磷水平条件下培养浅黄根须腹菌菌丝体,进行其γ-actin的表达特异性分析。PACH培养基中分别选用不同碳源(葡萄糖、麦芽糖、蔗糖、D-山梨醇、可溶性淀粉); 用0.025,0.05,0.1,0.2,0.4和0.8 mmol·L-1 6个水平磷(KH2PO4)浓度,28 ℃培养菌丝体20天后提取菌丝体总RNA。以等量的RNA反转录cDNA,取等量cDNA进行RT-PCR反应,再取等量的PCR产物进行琼脂糖凝胶电泳,经过3次重复,通过比较目的条带的灰度判定基因表达的强弱。
1.6 序列比较与系统进化树构建根据获得的mRNA拼接序列,网上Blast搜索同源性高的序列,进行同源性分析。利用NCBI的OFR Finder(http://www.ncbi.nlm. nih.gov/gorf/ gorf.html)识别OFR(open reading frame)序列并推定其所对应的氨基酸序列。使用ExPASy数据库的PortParam软件在线(http:// www.expasy.org/tools/protparam.html)分析推定蛋白质基本性质。在GenBank中,搜索不同真菌的肌动蛋白序列,与浅黄根须腹菌肌动蛋白序列进行Clustal W 多重序列比较,使用MEGA5软件邻接法(neighbor-joining,N-J法)运算1 000次构建系统进化树,用自展法(Bootstraping)对进化树进行评估。
2 结果与分析 2.1 总RNA的检测结果取10 μL RNA样液,稀释100倍,在核酸蛋白测定仪(Eppendrof BioPhotometer)中检测,OD260/OD280为1.94~1.96,OD260/OD230为2.45~2.60,说明RNA 纯度高,无蛋白质、酚污染,均一性很好。
电泳结果(图 1)表明,28S rRNA,18S rRNA与5S rRNA 带形整齐,无拖尾,说明RNA完整性很好,点样孔中及其附近也未发现有DNA的污染,证明提取的RNA质量较高,可以用于后续的RT-PCR。
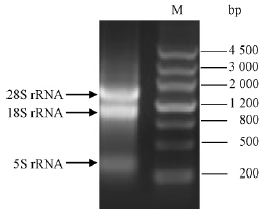 |
图 1 RNA电泳 Fig. 1 Agarose electrophoresis of RNA M: DNA MarkerⅢ. |
分别用简并PCR法和RACE技术扩增出浅黄根须腹菌肌动蛋白基因核心片段和5′端、3′端片段(图 2)。由图 2A可知,在标准分子质量1 kb处出现较亮的DNA条带,大小基本接近目的条带。但是在样品体系中出现了非特异性条带,因此进一步纯化回收了目的条带。由图 2B和图 2C可看出,分别在标准分子质量250 bp处出现了较亮的单一条带,表明得到的5′和3′末端片段大小为200~250 bp。阳性克隆子测序结果表明,浅黄根须腹菌肌动蛋白基因中心片段和5′端、3′端片段分别为1 100和242,254 bp。经过全长拼接,浅黄根须腹菌肌动蛋白基因的cDNA全长序列除1 128 bp的开放阅读框(ORF)外,还包含5′端95 bp的非编码片段和3′端116 bp的非编码片段,同时3′端有一个27个核苷酸的polyA尾,将其命名为Rl-act,cDNA全长序列提交GenBank,登录号为KC995171。
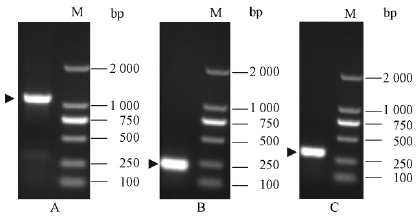 |
图 2 简并PCR及RACE-PCR产物凝胶电泳
Fig. 2 Product of degenerate-PCR and RACE-PCR
M: DL2000 Marker; A: 简并PCR结果Product of degenerate PCR; B: 5′RACE-PCR结果Product of 5′ RACE-PCR; C: 3′RACE-PCR结果Product of 3′ RACE-PCR. |
利用NCBI的ORF finder 进行开放阅读框识别后得知,Rl-act包含一个完整的开放阅读框,起始密码子为ATG,终止密码子为TAA,编码375个氨基酸。该推测蛋白质的理论分子质量大小为94.929 kD,理论等电点是5.01;其序列中 53YVGDEAQSKRG64, 357WCSKQEYDE365和 104LLTEAPLNPKANR116属于真菌actin蛋白的保守特征序列。
根据Rl-act氨基酸序列,Blast搜索出12种同源性高的序列,其中,Rl-act氨基酸序列与担子菌肌动蛋白序列有较高的相似性。该序列与Punctularia strigosozonata、 裂褶菌(Schizophyllum commune)、粗毛硬革菌(Stereum hirsutum)、 双色蜡蘑(Laccaria bicolor)4种真菌的肌动蛋白氨基酸序列(EIN04355,XP0030 26150,EIM-85406,XP001884444)相似性最高,达99%,其次与嗜蓝孢孔菌属的Fomitiporia mediterranea、双孢蘑菇(Agaricus bisporusva)、干朽菌(Serpula lacrymans)、毒蝇伞(Amanita muscaria)4种真菌的肌动蛋白氨基酸序列(EKM82128,EJD00785,ABQ17974,EGO04181)相似性达98%,与原毛平革菌属(Phanerochaete)的Phanerochaete carnosa、皱木耳(Auricularia delicate)、乳牛肝菌(Suillus bovinus)等真菌的肌动蛋白氨基酸序列(EKM59011,EJD35981,AF156258)相似性达97%。
2.4 不同碳源和磷水平培养条件下表达特性及稳定性分析半定量RT-PCR分析结果(图 3,4)显示,Rl-act基因在不同碳源及磷水平条件培养的菌丝体中均表达,且表达量基本一致,显示该基因的表达不受外界环境影响。
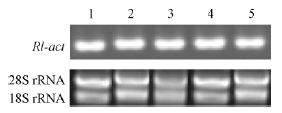 |
图 3 不同碳源培养条件下Rl-act的表达
Fig. 3 The expression level of Rl-act in different culture condition of carbon
1: 葡萄糖Glucose; 2: 麦芽糖Maltose; 3: 蔗糖Sucrose; 4: D-山梨醇D-sorbitol; 5: 可溶性淀粉Soluble starch. |
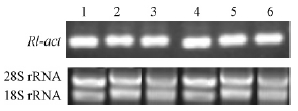 |
图 4 不同磷水平培养条件下Rl-act的表达
Fig. 4 The expression level of Rl-act in different culture condition of phosphorus levels
1: 0.025 mmol·L-1; 2: 0.05 mmol·L-1; 3: 0.1 mmol·L-1; 4: 0.2 mmol·L-1; 5: 0.4 mmol·L-1;6: 0.8 mmol·L-1. |
为进一步探讨浅黄根须腹菌肌动蛋白与其他担子菌(包括腐生型和外生菌根真菌)、丛枝菌根真菌(AMF)和子囊菌肌动蛋白在分子系统学上亲缘关系,根据Rl-act蛋白序列,在GenBank中搜索和参考文献报道(卓侃等,2010;Thorunn et al., 2003),获得了16种真菌的肌动蛋白序列(表 2)。利用MEGA5.0软件,通过N-J法运算1 000次,获得了浅黄根须腹菌与上述16种真菌的肌动蛋白系统进化树(图 5)。
|
|
从系统进化树可以看出,上述16种肌动蛋白序列聚类为担子菌、AMF和子囊菌3个分化群。本研究的浅黄根须腹菌肌动蛋白聚在担子菌分化群,亲缘关系依次与同为外生菌根真菌的双色蜡蘑、毒蝇伞和乳牛肝菌的肌动蛋白近,与腐生型担子菌灰拟鬼伞和黄孢原毛平革菌的肌动蛋白亲缘关系较远。这在一定程度上可以说明能够形成外生菌根的真菌肌动蛋白相似性较高,原因有待于进一步探讨。本系统进化树中的AMF真菌肌动蛋白由2个次级分化群组成,光壁无梗囊霉与Funneliformis caledonium聚为一支,珍珠巨孢囊霉与双紫盾巨孢囊霉聚为其姊妹支。子囊菌肌动蛋白由2个次级分化群组成。
3 讨论本研究通过简并PCR法和RACE技术首次克隆了浅黄根须腹菌γ-肌动蛋白的cDNA 全长序列。该全长序列为1 339 bp,包含一个1 128 bp的开放阅读框(ORF),编码375个氨基酸,具有actin 基因的保守特征序列,与前人报道的真菌γ-actin基因特征一致(Diez et al., 2001)。肌动蛋白最初是1941年在脊椎动物骨骼细胞中发现并命名的,在高等真核生物中,一般情况下肌动蛋白由家族基因编码,哺乳动物至少有10个由不同基因编码的肌动蛋白异型体。除了大多数酵母菌和丝状子囊菌只有1个单一的肌动蛋白基因外,其他真菌有少数肌动蛋白基因(朱雯雯等,2011)。从外生菌根真菌乳牛肝菌克隆得到2个肌动蛋白基因,并通过试验证实其肌动蛋白基因在营养菌丝及与宿主植物形成的菌根共生体中表达恒定(Tarkka et al., 2000),该基因可以作为功能基因研究的内标参照。本试验也得到相同结果,在不同碳源和磷水平培养条件下,Rl-act表达恒定。因此,本文Rl-act的获得可为将来浅黄根须腹菌-油松菌根共生体功能基因的研究奠定基础。
肌动蛋白基因高度保守,进化速率相对恒定,其氨基酸残基替换率约为每亿年1%(王丽等,2012),因此常被用作分子系统学研究的靶标基因。本研究构建的肌动蛋白系统进化树中16种不同真菌肌动蛋白聚为担子菌、AMF和子囊菌3个分化群,这一聚类结果与传统形态分类结果一致。另外,担子菌类中生活方式相同的真菌其肌动蛋白亲缘关系较近,即本研究中的浅黄根须腹菌肌动蛋白与另外3种外生菌根真菌肌动蛋白亲缘关系很近,而与另2种腐生型担子菌肌动蛋白亲缘关系较远,这一结果非常值得深入探究。
将浅黄根须腹菌Rl-act蛋白序列与Blast搜索出的高同源性序列进行比对分析发现,该序列与多种担子菌肌动蛋白氨基酸序列高度相似,其中包括双色蜡蘑、乳牛肝菌、毒蝇伞等外生菌根真菌。从它们的分类地位看,4种外生菌根真菌中浅黄根须腹菌属于担子菌亚门、须腹菌目,而其他3种属于伞菌目(Agaricales)。由聚类图可知,浅黄根须腹菌与双色蜡蘑亲缘关系最近,但这2种菌形态及分类地位差异较大。在肌动蛋白序列分析中不同目真菌聚为一类,一方面可能表明其肌动蛋白在进化上具有高度保守性,另一方面可能与外生菌根真菌本身的进化有关,这些疑问是今后关注的热点。
本聚类结果在肌动蛋白序列上初步分析了浅黄根须腹菌与其他16种真菌间的相互关系,但由于未搜索到更多真菌肌动蛋白基因方面的信息,不能在较低的分类阶元更好地反映浅黄根须腹菌的分类进化地位,因此浅黄根须腹菌与其他真菌间的亲缘关系有待于更进一步的研究。
| [1] |
白淑兰. 2011.菌根研究及内蒙古大青山外生菌根资源.呼和浩特: 内蒙古人民出版社,160-161.( 2) 2)
|
| [2] |
方玲, 刘歧莎,李 倩, 等.2013.肌动蛋白基因和β-微管蛋白基因用于真黏菌系统发育的可行性研究.菌物学报, 32(6): 1004-1011.( 1) 1)
|
| [3] |
李涛,陈保冬. 2012.丛枝菌根真菌通过上调根系及自身水孔蛋白基因表达提高玉米抗旱性.植物生态学报,36(9):973-981.( 1) 1)
|
| [4] |
邵东华,杨喜平,张晓东,等. 2013.浅黄根须腹菌侵染油松形成外生菌.生态学杂志,32(1): 80-83.( 1) 1)
|
| [5] |
王丽,黎妃凤,张文波,等.2012.西伯利亚白刺肌动蛋白基因的分离与特性分析.草业学报, 21(4):151-158.( 1) 1)
|
| [6] |
王琚钢,峥 嵘,白淑兰,等.2012. 外生菌根对干旱胁迫的响应.生态学杂志,31(6): 1571-1576.( 1) 1)
|
| [7] |
朱雯雯, 林晓飞,张文波,等.2011.兴安落叶松肌动蛋白基因的分离与序列分析.生物技术通报, (7):95-100.( 1) 1)
|
| [8] |
卓侃,罗 梅,廖金玲,等. 2010. 淡紫拟青霉γ-actin 基因cDNA全长的克隆与序列分析.植物保护,36(3): 78-81.( 2) 2)
|
| [9] |
Bai S L, Li G L, Liu Y, et al. 2009.Ostryopsis davidiana seedlings inoculated with ectomycorrhizal fungi facilitate formation of mycorrhizae on Pinus tabulaeformis seedlings. Mycorrhiza, 19(6): 425-434.( 1) 1)
|
| [10] |
Bucher M. 2007. Functional biology of plant phosphate uptake at root and mycorrhiza interfaces. New Phytologist, 173:11-26.( 1) 1)
|
| [11] |
Diez B, Marcos A T, Rodrguez M, et al. 2001. Structural and phylogenetic analysis of the γ-actin encoding gene from the penicillin-producing fungus Penicillium chrysogenus. Current Microbiology, 42(2): 117-121.( 1) 1)
|
| [12] |
Doherty G J, McMahon H T. 2008. Mediation, modulation, and consequences of membrane- cytoskeleton interactions. Annual Review Biophysics, 37: 65-95.( 1) 1)
|
| [13] |
Kapoor P, Sahasrabuddhe A A, Kumar A, et al. 2008. An unconventional form of actin in protozoan hemoflagellate, Leishmania. Journal of Biological Chemistry, 283(33): 22760-22773.( 1) 1)
|
| [14] |
Lin J, Redies C. 2012. Histological evidence: housekeeping genes beta-actin and GAPDH are of limited value for normalization of gene expression. Development Genes and Evolution, 222(6):369-376.( 1) 1)
|
| [15] |
Smith S E, Facelli E, Pope S, et al. 2010. Plant performance in stressful environments: interpreting new and established knowledge of the roles of arbuscular mycorrhizas. Plant and Soil, 326:3-20.( 1) 1)
|
| [16] |
Tarkka M T, Vasara R, Gorfer M, et al. 2000.Molecular characterization of actin genes from homobasidiomycetes:two different actin genes from Schizophyllum commune and Suillus bovines. Gene, 251(1): 27-35.( 1) 1)
|
| [17] |
Thorunn H, Irene J. 2003.Phylogeny of the glomerales and diversisporales (Fungi: Glomeromycota) from actin and elongation factor 1-alpha sequences. FEMS Microbiology Letters, 229(1): 127-132.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

