文章信息
- 郭志华, 张莉, 郭彦茹, 文菀玉, 曹萌, 郭菊兰, 李志勇
- Guo Zhihua, Zhang Li, Guo Yanru, Wen Wanyu, Cao Meng, Guo Julan, Li Zhiyong
- 海南清澜港红树林湿地土壤有机碳分布及其与pH的关系
- Soil Carbon Sequestration and Its Relationship with Soil pH in Qinglangang Mangrove Wetlands in Hainan Island
- 林业科学, 2014, 50(10): 8-15
- Scientia Silvae Sinicae, 2014, 50(10): 8-15.
- DOI: 10.11707/j.1001-7488.20141002
-
文章历史
- 收稿日期:2014-05-16
- 修回日期:2014-07-18
-
作者相关文章
2. 河南科技大学农学院 洛阳 471003
2. Henan University of Science and Technology Luoyang 471003
土壤是陆地生态系统中最大的有机碳库,全球土壤碳储量约2 500 Pg,占陆地生态系统总碳储量的2/3(Liski et al.,2002)。全球土壤碳库10%的碳波动相当于人类活动30年的碳排放,会引起大气二氧化碳的剧烈变化(Kirschbaum,2000)。以往对土壤有机碳的研究主要集中在森林、农田生态系统等(Noordwijk et al.,1997; Babu et al.,1999; Lal,2005; Wit et al.,2006; Jimenez et al.,2007)。湿地生态系统的土壤有机碳具有分解速率低、碳循环周期长、碳储量高等特点,近些年,仅占全球陆地面积6.4%的湿地在碳循环中的重要性逐渐得到重视,湿地土壤碳的研究也日益深入(Bridgham et al.,2006; Bernal et al.,2008; Donato et al.,2011; 张文娟等,2011; 刘刚等,2011; Sandilyan et al.,2012)。全球湿地土壤有机碳总储量约为550 Pg,占陆地土壤总储碳量的15%~30%(Bernal et al.,2008)。不同类型湿地土壤有机碳储量差异很大,滨海滩涂、河流、湖泊湿地土壤有机碳含量低、碳储量较少,泥炭湿地土壤有机碳含量高、碳储量丰富(Krogh et al.,2003; Bernal et al.,2008; Isla et al.,2002; 蔡倩倩等,2013)。这些湿地的有机碳多分布在土壤表层,且随土壤深度增加而降低。
红树林湿地是介于海洋和陆地之间的一类特殊的生态系统,是地球上生产力最高的生态系统之一,全球红树林每天平均生产力为2 500 mgC·m-2(Jennerjahn et al.,2002)。单位面积红树林地上部分固碳能力约为热带雨林的10倍(王文卿等,2007; Alongi et al. 2009; Donato et al.,2011),而整个红树林生态系统单位面积的固碳能力约为热带雨林的50倍(Sandilyan et al.,2012)。这反映了红树林土壤的固碳能力惊人,因为红树林土壤中发达的气生根和长期水淹生境有利于土壤有机碳的积累和储存(Cerón-Bretón et al.,2011; Donato et al.,2011)。有研究表明: 全球红树林土壤平均固碳速率为(210±20)g·m-2a-1(Alongi et al.,2008),而我国红树林土壤最高可达444.27 g·m-2·a-1(段晓男等,2008)。
国内外对红树林湿地碳储量的研究,过去多集中在地上部分(Twilley et al.,1992;王文卿等,2007; Proisy et al.,2007; Bouillon et al.,2008; Ray et al.,2011),对红树林土壤碳储量及其分布的研究多集中在热带地区,如密克罗尼西亚和印度的典型热带红树林(Bouillon et al.,2008; Kristensen et al.,2008; Kauffman et al.,2011; Ray et al.,2011),而对我国红树林湿地土壤有机碳分布规律的研究还不多见。
本研究以热带北缘地带的海南清澜港红树林湿地为研究区,研究该地区近文昌河河口与远离文昌河河口的红树林土壤有机碳含量及其分布特征,分析土壤有机碳含量与pH的关系,试图揭示我国热带北缘红树林土壤有机碳的分布规律特征,这对于正确认识我国红树林湿地在区域和全球尺度碳循环过程中的地位和作用具有重要意义。
1 研究区概况清澜港位于海南省文昌市境内(110°40′—110°48′E,19°22′—19°35′N),地处于热带北缘,兼具热带和亚热带气候特点。年均气温23.9 ℃,最冷月气温为18.3 ℃,年均降雨量1 974 mm。清澜港因其港湾深入内陆,又称八门湾。八门湾属于内海湾,最高潮位2.38 m,最低潮位0.01 m,最大潮差2.07 m。红树林主要生长在八门湾沿岸区域,湾内风平浪静且淤泥丰富,适合红树林生长发育(郑文教等,1995)。
清澜港水域宽阔,水域面积达64 km2,有文昌河、文教河两条河流汇入。清澜港沿岸的基岩属于变质岩,基岩上的土壤是河流、海潮搬运和暴雨从集水区范围冲刷带来的细粒物质,土壤大多偏酸、偏沙(郑文教等,1995)。
清澜港红树林保护区面积约1 223.3 hm2,有真红树24种,是我国红树种类天然分布最丰富的保护区(农寿千等,2011)。清澜港红树林的植物群系主要有海桑(Sonneratia caseolaris)群系、杯萼海桑(Sonneratia alba)群系、红树(Rhizophora apiculata)+海莲(Bruguiera sexangula)群系、角果木(Ceriops tagal)群系、榄李(Lumnitzera racemosa)群系、白骨壤(Avicennia marina)+杯萼海桑+榄李群系、海莲+木果楝(Xylocarpus granatum)群系、黄槿(Hibiscus tiliaceus)+海桑群系、水黄皮(Pongamia pinnata)+海漆(Excoecaria agallocha)群系等(农寿千等,2011)。在近河口(靠近文昌河入海口),植物种类丰富,乔木层主要树种有红树、海莲和桐花(Aegiceras corniculatum)等,灌木层主要有角果木和榄李等。由于土壤条件限制,远河口(远离文昌河入海口)生长的植物多为白骨壤和杯萼海桑等先锋红树树种,群落结构较简单。由于人类活动影响,清澜港红树林植物大多呈灌木状(郑文教等,1995; 廖宝文,2009)。
2 研究方法 2.1 样品采集与处理2011年12月中旬,在清澜港八门湾红树林保护区进行土壤实地取样。在靠近文昌河入海口(近河口)和远离文昌河入海口(远河口)各选取1条样线,两样线的直线距离约7 km。在每条样线上,按离海的远近分别选取近海、中间和近陆3块样地,相邻样地间的距离150~300 m,样地植被概况见表 1。
|
|
在每个所选样地,用高1.2 m、直径0.055 m的土壤调查专用采样器进行采样。每块样地取3次重复,2条样线共取土壤剖面18个。取样深度至基岩,最浅约60 cm,最深约90 cm。每个土壤剖面按5 cm一层的间隔分割,环刀法取土,5个环刀土壤混合成一个样品,然后将土壤样品装入袋中密封编号,并立即送回实验室处理。
实验室处理包括风干、过筛和测定。挑选出植物根系和碎石后,将土壤样品自然风干并过100目筛,装塑封袋保存备用。
2.2 样品测定采用重铬酸钾-硫酸外加热法测定土壤有机碳含量,用酸度计法测定土壤pH。
2.3 数据处理与分析采用每层土壤有机碳平均含量这一指标比较近海、中间和近陆区土壤有机碳含量的差异。近河口红树林土壤有机碳平均含量基于0~85 cm土壤深度的有机碳平均含量来计算,远河口则以0~60 cm土壤深度的有机碳平均含量来计算。
方差分析和相关性分析用SPSS 17.0软件完成,用Origin 8.6作图。
3 结果与分析 3.1 红树林土壤pH随土层深度的变化近河口与远河口红树林土壤pH差异显著(P<.05)。近河口红树林各样地土壤呈弱酸性,pH为4.9~6.2,且随土壤深度的增加先降低再升高,在50~70 cm土层最低(表 2)。远河口红树林各样地土壤为中性,pH为7.9~8.5,且随土壤深度的增加而略升高(表 2)。
|
|
近河口和远河口红树林土壤pH差异的原因是受河流淡水及地带性酸性土的影响,近河口红树林土壤呈现弱酸性,另外近河口土壤的可氧化硫含量偏高,是近河口红树林土壤呈弱酸性的另一原因(廖金凤,2004); 远河口红树林土壤主要受海水影响而呈中性。
3.2 近河口红树林土壤有机碳含量分布在近河口,红树林土壤有机碳含量的垂直分布如图 1所示。 近海和中间的红树林土壤有机碳含量变化趋势一致,均随土壤深度增加呈先增加后降低的趋势,在土层60~70 cm,有机碳含量最高(约66.2 g·kg-1),在底层90 cm深处,土壤有机碳含量仍高于20 g·kg-1;在近陆区域,红树林土壤有机碳含量随土壤深度增加呈先降低后升高再降低的变化趋势,在约30 cm深处土壤有机碳含量最低,在65 cm左右处土壤有机碳含量最高;近海区各层土壤有机碳含量为16.5~59.5 g·kg-1,中间为17.3~66.2 g·kg-1,近陆区为9.1~28.0 g·kg-1。
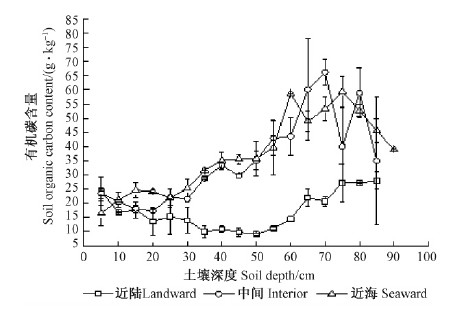 |
图 1 近河口红树林土壤有机碳的垂直分布 Fig. 1 Vertical distribution of soil organic carbon contents through the profiles of the different plots of the mangroves in estuary |
上述结果与密克罗尼西亚红树林土壤有机碳含量的垂直变化基本一致,密克罗尼西亚地区红树林土壤有机碳含量最大值出现在50~70 cm土层(Kauffman et al.,2011)。红树林湿地土壤有机碳的独特垂直分布特征与森林、农田土壤明显不同。森林、农田的土壤有机碳含量最高值多在表层0~20 cm处,且随土壤深度的增加而降低(Noordwijk et al.,1997; Babu et al.,1999; Isla et al.,2002; Jimenez et al.,2007; 程积民等,2012)。陆地土壤有机碳主要分布在土壤表层的原因是表层丰富的枯枝落叶为土壤提供了大量的有机质(王平等,2010)。近河口红树林土壤有机碳含量最高值在土层65 cm左右的原因可能是: 红树的细根多分布于土壤中间层,而细根周转能提供大量的有机物质; 近河口的涨潮流速往往小于退潮流速,红树林丰富的凋落物大部分被潮水带走,凋落物难以积累,且近河口土壤表层的红树根系远不及远河口发达,致使表层土壤缺乏草本层和枯枝落叶层(王文卿等,2007)。
与国内其他滨海湿地相比,清澜港红树林土壤有机碳含量高、分布深。杭州湾滨海湿地土壤有机碳含量最高值为6.45 g·kg-1(邵学新等,2011),仅是清澜港近河口红树林土壤最低有机碳含量的2/3。辽河口芦苇湿地在40~50 cm土层有机碳含量降低到0.3%(彭溶等,2012),而清澜港红树林在90 cm土层处的有机碳含量还高于20 g·kg-1。
然而,与密克罗尼西亚的典型热带红树林相比,清澜港红树林土壤有机碳含量较低、分布较浅,这可能与气候及人类活动影响有关。清澜港位于北纬20°附近,年均气温23.9 ℃; 而密克罗尼西亚位于北纬7°附近,年均气温27 ℃(Kauffman et al.,2011)。高温促进植物生长,密克罗尼西亚热带红树林生物量比清澜港红树林大得多,其对土壤有机碳的输入量也大得多; 同时,清澜港近河口红树林受人类活动影响较大,也不利于红树林土壤有机碳的积累。
在水平方向上,近河口红树林土壤有机碳平均含量表现为近海最高、近陆最低(图 2)。近海、中间和近陆依次为(36.76±3.04),(35.12±3.78)和(17.20±1.56)g·kg-1(图 2)。近陆与中间、近海均存在显著差异(P<0.05),中间与近海的有机碳含量差异不显著(P>0.05)。该结果与密克罗尼西亚红树林土壤有机碳含量水平变化趋势相似(Kauffman et al.,2011)。
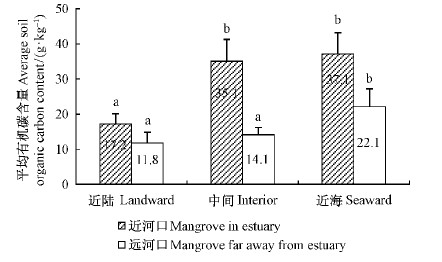 |
图 2 近河口和远河口红树林的土壤有机碳平均含量 Fig. 2 Average soil organic carbon content in the different plots of the mangroves in the estuary and far away from estuary |
清澜港红树林植物呈典型带状分布,近海区优势树种为榄李和角果木,树高约1.3 m,而且密度很高(150 000株·hm-2); 而近陆区的优势树种为海莲、红树和海莲,比近海区的红树植株高,平均高度为1.8 m,但密度很低(5 000株·hm-2)。近海区红树密度约为近陆的30倍,这是近海红树林土壤有机碳含量高于近陆的根本原因。近陆红树林土壤有机碳含量较低还可能与人类活动有关。
3.3 远河口红树林土壤有机碳分布远河口红树林的土壤厚度不及近河口,多不超过65 cm,且其有机碳含量也不及近河口(图 3)。远河口红树林近海、中间和近陆的土壤有机碳含量在垂直方向上的变化趋势一致,呈双峰递减型,表层有机碳含量最高,之后随土壤深度的增加而降低,在大约20 cm后有机碳含量又逐渐升高,直到40 cm处土壤有机碳含量出现第二个峰值,之后又逐渐降低,土壤最底层的有机碳含量最低(约8.35 g·kg-1);近海、中间和近陆等处的土壤有机碳含量分别为11.8~38.3,9.0~21.4和8.35~21.5 g·kg-1。
 |
图 3 远河口红树林土壤有机碳的垂直分布 Fig. 3 Vertical distribution of soil organic carbon contents through the profiles of the different plots in the mangroves far away from estuary |
远河口红树林各样地土壤有机碳含量呈双峰递减型的主要原因为: 海水对红树林土壤的影响大,而土壤性质又决定了植物分布,远河口的植物多为白骨壤、杯萼海桑等先锋种类植物,这些植物在土壤表层的大量气生根不仅是土壤有机质的重要来源,而且还能将较多的枯枝落叶截留在土壤表层,所以其表层土壤有机碳含量最高;红树根系分布深,在土层40 cm处是红树林根系分布的集中区(王文卿等,2007),因此,远河口红树林土壤有机碳含量在40 cm处有第二个高峰值,这主要是受红树根系分布的影响。
远河口红树林土壤有机碳含量较近河口低,可能原因为: 一是近河口与远河口的土壤酸碱度的差异;二是远河口植株密度较低,植物种类少,根系分布较浅(表 1)。
远河口红树林土壤有机碳含量也高于杰拉许海峡滨海湿地(其有机碳含量为4.5~14.5 g·kg-1)(Isla et al.,2012)。
在水平方向上,远河口红树林土壤有机碳平均含量(0~60 cm)的变化趋势与近河口一致,随离海距离的增加而降低(图 3),依次为: 近海(22.12±2.57)g·kg-1、中间(14.83±1.01)g·kg-1、近陆(13.18±1.20)g·kg-1。近海与近陆样地差异显著(P<0.05),而近陆和中间的有机碳平均含量差异不显著(P>0.05)。
在远河口,红树林优势植物为白骨壤和杯萼海桑,近海和近陆区的植株密度相近,但近海区红树林的平均株高明显高于近陆区(表 1),这可能是造成清澜港远河口红树林近海与近陆区土壤有机碳平均含量差异显著的主要原因。
3.4 土壤有机碳含量与土壤pH的关系在清澜港红树林分布区,无论是在近河口还是在远河口,其土壤有机碳含量与土壤pH均呈显著负相关(P<0.05),均随土壤pH升高而降低。近河口近陆、中间和近海处的红树林土壤有机碳含量与pH的相关系数分别为-0.885,-0.886和-0.725(图 4); 远河口近陆、中间和近海处红树林土壤有机碳含量与pH的相关系数分别为-0.798,-0.813和-0.916(图 5)。在闽江河口,空心莲子草(Alternanthera philoxeroides)湿地的土壤有机碳含量与其pH之间也有类似关系(张文娟等,2011)。土壤pH直接影响土壤微生物的种类、数量及活性(陆俊锟,2008; Lovelock,2008; Zhang et al.,2011)。清澜港红树林土壤有机碳含量与pH之间相关关系的机制还有待进一步深入研究。
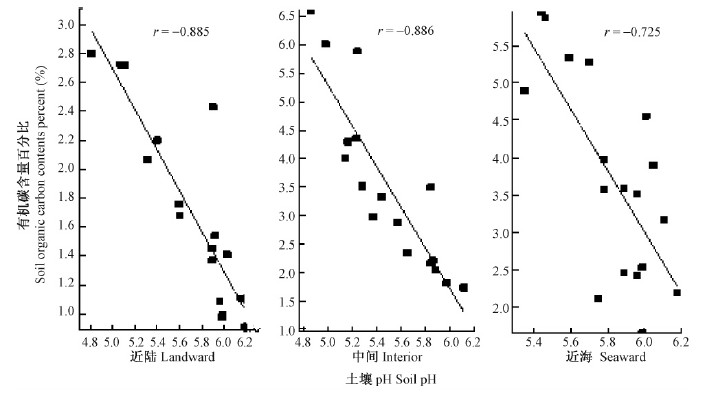 |
图 4 近河口红树林不同样地的土壤有机碳含量与其pH的相关关系 Fig. 4 Relationship between soil organic carbon content and soil pH of different sample plots in the estuary mangroves |
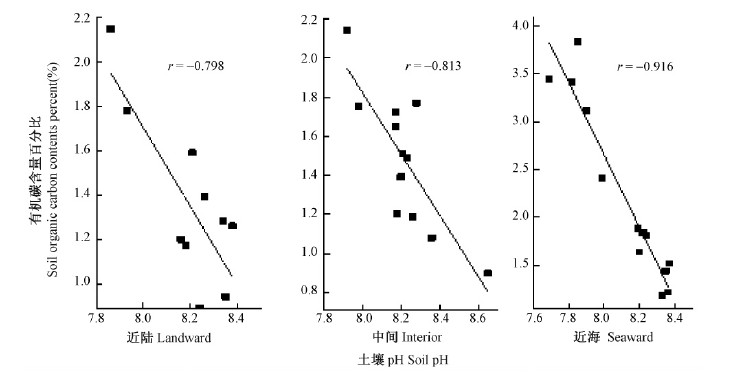 |
图 5 远河口红树林不同样地的土壤有机碳含量与其pH的相关关系 Fig. 5 Relationship between soil organic carbon content and soil pH of different sample plots in the mangroves far away from estuary |
清澜港红树林土壤有机碳含量高、分布深,远高于我国农田、其他森林及滨海湿地生态系统。清澜港红树林最高土壤有机碳含量约为陆地各类型土壤的5~10倍,且红树林土壤的底层有机碳含量仍很高。在近河口的近海区域,其90 cm深处的有机碳含量仍高达20 g·kg-1以上。红树林生态系统具有有机质沉积快、群落生产力高和土壤呼吸释放慢等特点,使红树林土壤有机碳的含量高且深。有研究表明,红树林湿地植物根系的生长与降解控制着有机质的沉积过程及其垂直分布(Poret et al.,2007)。
清澜港红树林土壤有机碳含量垂直分布与其他生态系统存在巨大差异,且红树林土壤有机碳含量的垂直分布与河口距离有关。近河口红树林土壤有机碳含量随深度增加先升高后降低,在60~70 cm深处有机碳含量达到最高; 远河口红树林土壤有机碳含量在表层最高,且随土壤深度的变化呈双峰递减趋势,土深40 cm处为另一个高峰值。有机质的沉积受到潮水强烈的平均化作用影响。红树林地理位置差异意味着在潮汐过程中所受潮水浸泡的时间和海水的冲击作用不同。近河口由于河水冲刷使得表层土壤有机质少且腐殖质不易沉积,所以导致土壤有机碳含量随深度增加先升高后降低。远河口无河水冲刷,主要受地形、潮汐、植被类型和生物过程等影响(Twilley et al.,1992; Nordhaus et al.,2006),因此,远河口土壤表层有机氮含量最高,并在40 cm深处土壤有机碳含量达到另一个峰值。红树林通过凋落物以及根系系统更新能够自身产生有机质(Jennerjahn et al.,2002),所以植物物种组成及其分布不同也会导致土壤碳含量的差异。
在水平方向上,近河口与远河口有机碳含量的空间变化趋势相同。在海南清澜港,离海距离不同,其红树植物的种类和密度差异显著,从而使近海处红树林的土壤有机碳平均含量显著高于近陆处的红树林。
清澜港红树林土壤有机碳含量与其土壤pH存在显著的负相关关系。土壤pH直接影响土壤微生物的种类、数量和活性,限制微生物的种类。较高的pH影响了微生物的生长,在酸性土壤中,微生物的种类因受到pH限制,而降低了有机质的分解速率(张文娟等,2011)。pH是影响土壤有机碳转化的重要因素之一,从而影响土壤有机碳的密度,因此,对清澜港红树林土壤pH与土壤有机碳含量关系的进一步研究,将有助于深入认识红树林土壤有机碳的循环机制。
| [1] |
蔡倩倩, 郭志华, 胡启鹏, 等. 2013. 若尔盖高寒嵩草草甸湿地不同水分条件下的土壤有机碳及碳储量分布. 林业科学, 49(3): 9-16.( 1) 1)
|
| [2] |
程积民, 程 杰, 杨晓梅, 等. 2012. 黄土高原草地植被碳密度的空间分布特征. 生态学报, 32(1): 226-237.( 1) 1)
|
| [3] |
段晓男, 王效科, 逯 非, 等. 2008. 中国湿地生态系统固碳现状和潜力. 生态学报, 28(2): 463-469.( 1) 1)
|
| [4] |
廖宝文. 2009. 海南东寨港红树林湿地生态系统研究. 青岛: 中国海洋大学出版社.( 1) 1)
|
| [5] |
廖金凤. 2004. 雷州半岛红树林盐土的某些理化性质. 土壤, 36 (5): 561-564.( 1) 1)
|
| [6] |
刘刚, 沈守云, 闫文德, 等. 2011. 洪湖湿地生态系统土壤有机碳及养分含量特征. 生态学报, 31(24): 7625-7631.( 1) 1)
|
| [7] |
陆俊锟, 康丽华, 陈 俊, 等. 2008. 华南三地红树林土壤微生物及其与土壤化学性质的相关性研究. 林业科学研究, 21(4): 523-527.( 1) 1)
|
| [8] |
农寿千, 杨小波, 李东海, 等. 2011. 清澜港保护区植物特点研究. 植物科学学报, 29(4): 459-466.( 2) 2)
|
| [9] |
彭溶, 邹 立, 万汉兴, 等. 2012. 辽河口芦苇湿地土壤有机碳的积累特征研究. 中国海洋大学学报: 自然科学版, 42(5): 28-34.( 1) 1)
|
| [10] |
邵学新, 杨文英, 吴 明, 等. 2011. 杭州湾滨海湿地土壤有机碳含量及其分布格局. 应用生态学报, 22(3): 658-664.( 1) 1)
|
| [11] |
王平, 盛连喜, 燕 红, 等. 2010. 植物功能性状与湿地生态系统土壤碳汇功能. 生态学报, 30(24): 6990-7000.( 1) 1)
|
| [12] |
王文卿, 王 瑁. 2007. 中国红树林. 北京: 科学出版社.( 4) 4)
|
| [13] |
张文娟, 曾路金, 王维奇, 等. 2011. 闽江河口空心莲子草土壤碳库研究. 湿地科学与管理, 7(1): 52-56.( 3) 3)
|
| [14] |
郑文教, 廖宝文, 郑松发, 等. 1995. 海南清澜港红树树种适应生境能力与水平分布. 林业科学研究, 8(1): 67-72.( 3) 3)
|
| [15] |
Alongi D M. 2008. Mangrove forests: resilience, protection from tsunamis, and responses to global climate change. Estuarine Coastal and Shelf Science, 76(1): 1-13.( 1) 1)
|
| [16] |
Alongi D M. 2009. The energetics of mangrove forest. Dordrecht: Springer Netherlands.( 1) 1)
|
| [17] |
Babu C P, Brumasack H J, Schnetger B. 1999. Distribution of organic carbon in surface sediments along the eastern Arabian Sea: a revisit. Marine Geology, 162(1): 91-103.( 2) 2)
|
| [18] |
Bernal B, Mitsch W J. 2008. A comparison of soil carbon pools and profiles in wetlands in Costa Rica and Ohio. Ecological Engineering, 34(4): 311-323.( 3) 3)
|
| [19] |
Bouillon S, Borges A V, Castaneda-Moya E, et al. 2008. Mangrove production and carbon sinks: a revision of global budget estimates. Global Biogeochemical Cycles, 22(2): 1-12.( 2) 2)
|
| [20] |
Bridgham S D, Megonigal J P, Keller J K, et al. 2006. The carbon balance of North America wetlands. Wetlands, 26(4): 889-916.( 1) 1)
|
| [21] |
Cerón-Bretón R M, Cerón-Bretón J G, Sánchez-Junco R C. 2011. Evaluation of carbon sequestration potential in mangrove forest at three estuarine sites in Campeche, Mexico. International Journal of Energy and Environment, 5(4): 487-494.( 1) 1)
|
| [22] |
Donato D C, Kauffman J B, Murdiyarso D, et al. 2011. Mangroves among the most carbon-rich forests in the tropics. Nature Geoscience, 4(5): 293-297.( 3) 3)
|
| [23] |
Isla E, Masque P, Palanques A, et al. 2002. Sediment accumulation rates and carbon burial in the bottom sediment in a high-productivity area: Gerlache Strait (Antarctica). Deep-Sea Reasearch, 49(2): 3275-3287.( 2) 2)
|
| [24] |
Jennerjahn T C, Ittekkot V. 2002. Relevance of mangroves for the production and deposition of organic matter along tropical continental margins. Naturwissenschaften, 89(1): 23-30.( 2) 2)
|
| [25] |
Jimenez J J, Lal R, Leblanc, et al. 2007. Soil organic carbon pool under native tree plantations in the Caribbean lowlands of Costa Rica. Forest Ecology and Management, 21(1/3): 134-144.( 2) 2)
|
| [26] |
Kauffman J B, Heider C, Cole T G, et al. 2011. Ecosystem carbon stocks of Micronesian mangrove forests. Wetlands, 31(2): 343-352.( 4) 4)
|
| [27] |
Kirschbaum M. 2000. Will changes in soil organic carbon act as a positive or negative feedback on global warming. Biogeochemistry, 48(1): 21-51.( 1) 1)
|
| [28] |
Kristensen E, Bouillon S, Dittmar T, et al. 2008. Organic carbon dynamics in mangrove ecosystems: a review. Aquatic Botany, 89(2): 201-219.( 1) 1)
|
| [29] |
Krogh L, Noergaard A,Hermansen M, et al. 2003. Preliminary estimates of contemporary soil organic carbon stocks in Denmark using multiple datasets and four scaling-up methods. Agriculture, Ecosystems and Environment, 96(1/3): 19-28.( 1) 1)
|
| [30] |
Lal R. 2005. Forest soils and carbon sequestration. Forest Ecology and Management, 220(1/3): 242-258.( 1) 1)
|
| [31] |
Liski J, Perruchoudc D, Karjalainena T. 2002.Increasing carbon stocks in the forest soils of western Europe. Forest Ecology and Management, 169(1/2): 159-175.( 1) 1)
|
| [32] |
Lovelock C E. 2008. Soil respiration and belowground carbon allocation in mangrove forests. Ecosystems, 11(2): 342-354.( 1) 1)
|
| [33] |
Noordwijk M V, Cerri C,Woomer P L, et al. 1997. Soil carbon dynamics in the humid tropical forest zone. Geoderma, 79(1/4): 187-225.( 1) 1)
|
| [34] |
Nordhaus I, Wolff M, Diele K. 2006. Litter processing and population food intake of the mangrove crab Ucides cordatus in a high intertidal forest in northern Brazil. Estuarine, Coastal and Shelf Science, 67: 239-250.( 1) 1)
|
| [35] |
Poret N,Twilley R R,Rivera-Monroy V H,et al.2007.Belowground decomposition of mangrove roots in Florida coastal everglades. Estuaries and Coasts,30(3):491-496.( 1) 1)
|
| [36] |
Proisy C, Couteron P, Fromard F. 2007. Predicting and mapping mangrove biomass from canopy grain analysis using Fourier-based textural ordination of IKONOS images. Remote Sensing of Environment, 109(3): 379-392.( 1) 1)
|
| [37] |
Ray R, Ganguly D, Chowdhury C, et al. 2011. Carbon sequestration and annual increase of carbon stock in a mangrove forest. Atmospheric Environment, 45(28): 5016-5024.( 2) 2)
|
| [38] |
Sandilyan S, Kathiresan K. 2012. Mangrove conservation: a global perspective. Biodiversity and Conservation, 21(14): 3523-3542.( 2) 2)
|
| [39] |
Twilley R R, Chen R H, Hargis T. 1992. Carbon sinks in mangrove forests and their implications to the carbon budget of tropical coastal ecosystems. Water Air Soil Pollute, 64(1/2): 265-288.( 2) 2)
|
| [40] |
Wit H A D, Palosuo T, Hylen G, et al. 2006. A carbon budget of forest biomass and soils in southeast Norway calculated using a widely applicable method. Forest Ecology and Management, 225(1/3): 15-26.( 1) 1)
|
| [41] |
Zhang S P, Wang L. 2011. Organic carbon accumulation capability of two typical tidal wetland soils in Chongming Dongtan, China. Journal of Environmental Sciences, 23(1): 87-94.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50
