文章信息
- 王大伟, 马良进, 周湘
- Wang Dawei, Ma Liangjin, Zhou Xiang
- 暗孢耳霉侵染竹梢凸唇斑蚜的生物学特征及毒力测定
- Infection Features and Bioassay of Aphid-Obligate Conidiobolus obscurus on the Bamboo Aphid Takecallis taiwanus
- 林业科学, 2014, 50(10): 74-79
- Scientia Silvae Sinicae, 2014, 50(10): 74-79.
- DOI: 10.11707/j.1001-7488.20141010
-
文章历史
- 收稿日期:2013-07-19
- 修回日期:2014-01-16
-
作者相关文章
竹子在传统上是食品和纤维制品的重要原料来源,近来研究发现其在森林碳汇和生物能源等方面也具有重要应用价值(Scurlock et al., 2000; Li et al., 2013)。竹梢凸唇斑蚜(Takecallis taiwanus)是危害竹子的主要蚜虫种类,由于其强劲的迁飞能力,广泛分布于亚洲、欧美和大洋洲等地区(Halbert et al., 2000; Qiao et al., 2004; 方燕等,2006)。该蚜生殖能力强,种群发展迅速,通过大量吸食汁液抑制植株正常生长,排泄出的蜜露往往引发煤污病,而且该蚜为植物病毒的主要传播媒介之一,对竹子资源造成严重的威胁(胡国良等,2001; 徐华潮等,2003)。
化学防治是森林虫害防治的主要手段之一,但化学防治对环境具有一定负面影响,而且长期使用化学药剂易引发抗药性等问题。因此,化学防治可作为虫害暴发时的应急措施,长期防控森林虫害还需走综合治理的途径。相对于种植周期短且精耕细作的农业生产系统,人为干扰较少的森林植被更适合采用生物防治方法控制害虫种群于成灾阈值之下。已有研究利用生物防治用菌球孢白僵菌(Beauveria bassiana)防治竹梢凸唇斑蚜,但该菌寄主范围广,对周边桑蚕养殖等构成潜在威胁(徐华潮等,2006; Jackson et al., 2010)。虫霉目(Entomophthorales)真菌寄主专化性高,常在野外诱发寄主流行病,是控制害虫种群的天然因子(冯明光,1997; 李增智,2000; Pell et al., 2001),如利用舞毒蛾噬虫霉(Entomophaga maimaiga)防治危害北美林区的舞毒蛾(Hajek et al., 1996)取得了很好的效果。
侵袭蚜虫的虫霉多达30余种,主要集中在新月霉科(Ancylistaceae)的耳霉属(Conidiobolus)6种、新接霉科(Neozygitaceae)的新接霉属(Neozygites)8种、虫霉科(Entomophthoracae)的虫疠霉属(P and ora)7种和虫瘟霉属(Zoophthora)7种(Barta et al., 2006)。其中,暗孢耳霉(Conidiobolus obscurus)这一蚜科专化菌广泛分布于亚非拉及欧美等地区,对环境适应性强,体外培养简便,可规模化发酵生产(李增智,2000; Zhang et al., 2007; Zhou et al., 2014)。该菌可通过主动弹射侵染性的分生孢子直接穿透寄主体壁侵入血腔内增殖,对防治蚜虫这类刺吸式口器害虫具有很大优势(Brey et al., 1986)。暗孢耳霉可感染众多经济作物上的蚜虫,如桃蚜(Myzus persicae)、甘蓝蚜(Brevicoryne brassicae)、棉蚜(Aphis gossypii)、麦蚜和豆蚜(Aphis craccivora)等,并可引发小范围的蚜病流行,导致区域内蚜虫种群显著下降(Barta et al., 2006; Zhang et al., 2007)。本研究通过扫描电镜观察暗孢耳霉侵染特性并生物测定其对竹梢凸唇斑蚜的毒力,评估将其开发为竹蚜生物防治用菌的可能性。
1 材料与方法 1.1 供试菌株和竹蚜饲养暗孢耳霉菌株购于美国昆虫病原真菌库(RW Holley Center for Agriculture and Health,Tower Road,Ithaca,NY,USA; 编号ARSEF 7217)。菌株置于萨氏培养基(W/V: 1%酵母粉、1%蛋白胨、4%葡萄糖、1.5%琼脂)斜面上,4 ℃冰箱储存,每半年转接1次。
供试竹梢凸唇斑蚜采自当年野外竹林。将健壮有翅成蚜移入盆栽方竹(Chimonobambusa quadrangularis)上在24 ℃(光周期14L∶10D)下饲养数周备用。
1.2 生物测定暗孢耳霉对竹梢凸唇斑蚜的毒力将暗孢耳霉菌株转接至加富营养的萨氏培养基平板(V/V: 80%萨氏培养基、11.5%蛋黄、8.5% 牛奶)上,24 ℃和12L∶12D条件下培养7天。将平板上的菌丝体接入装有50 mL 含0.1%(V/V)乳化芝麻油的萨氏培养液的锥形瓶中,在24 ℃下150 r·min-1摇荡培养4天。所获菌丝液倒入直径90 mm的水琼脂平板上,用滤纸吸去水分,使菌丝均匀铺满平板。24 ℃下放置过夜,平板上的菌丝进入弹孢高峰,用于接种蚜虫。
将20~30头3~4龄竹梢凸唇斑蚜若蚜置于每个饲虫平板上。饲虫平板的制作:剪取新鲜的方竹叶3片,背面朝上将边缘包埋入每个直径90 mm的水琼脂平板即可用于饲养竹蚜虫,其优点在于生物测定毒力期间无需转移蚜虫。将处于弹孢盛期的产孢平板倒扣在载有若蚜的饲虫平板上,使其暴露于暗孢耳霉分生孢子“淋浴”之中。为使孢子尽可能均匀地落到蚜虫体表,产孢平板每1/4接种时间顺时针旋转90°。接种时将一盖玻片置于蚜群旁收集沉降的孢子,在400倍下5点取样镜检(每视野0.159 mm2)并计数孢子,以确定实际接种浓度(孢子数·mm-2)。每个叶片上蚜群的接种时间从数分钟到数十分钟不等,从而产生4个不同接种孢子浓度梯度[均值±标准差:(15.6±4.3),(90.8±7.6),(149.4±15.2)和(192.6±20.3)个孢子·mm-2]。每个接种浓度包含3个蚜群(饲虫平板)作为重复。另外,准备3个未接种孢子的蚜群作为空白对照。逐日观察各饲虫平板上蚜虫的死亡情况,记录死亡率。在5天连续观察期内,将蚜尸置于24 ℃和100%相对湿度下过夜后,逐头棉兰染色压片镜检感病情况。
1.3 扫描电镜观察暗孢耳霉侵染特征高浓度“孢子浴”接种后的竹蚜和竹叶片,以及处于饱和湿度下0,6和24 h的感病蚜尸,分别置入2.5%戊二醛固定液中4 ℃过夜。接着,各样品用0.1 mol·L-1磷酸缓冲液冲洗3次,每次15 min。1%锇酸固定1.5 h后,再用0.1 mol·L-1磷酸缓冲液冲洗3次,每次15 min。随后,将样品依次浸没于梯度浓度(50%,70%,80%,90%,95%)的乙醇中,每个浓度各15 min,再用浓度100%的乙醇洗脱2次,每次20 min。用乙醇与醋酸异戊酯的混合液(V/V: 1/1)处理样品30 min,再用100%醋酸异戊酯处理样品2 h。最后临界点干燥,镀金,扫描电镜(Philips XL30-ESEM)观察。
1.4 数据分析各接种浓度下的累计死亡率数据经对照自然死亡率校正后,用时间-剂量-死亡率模型(TCM)进行模拟分析(Feng et al., 1996)。用拟合的剂量效应参数和时间效应参数计算随接种后时间而变化的半致死剂量(LC50)及其95%置信区间,并以此计算半致死时间(LT50)作为衡量暗孢耳霉对竹梢凸唇斑蚜毒力强弱的指标。所有模型模拟均采用DPS软件分析(唐启义等,2002)。
2 结果与分析 2.1 暗孢耳霉侵染竹梢凸唇斑蚜的特征刚接种后的竹梢凸唇斑蚜若蚜体壁完整(图 1a)。落入蚜虫体表的暗孢耳霉分生孢子可迅速萌发出芽管侵入寄主体内,在蚜虫体表上留下皱缩的孢子外壁(图 1b)。而未接触寄主体壁的暗孢耳霉孢子可弹射次一级的分生孢子来增加其“遭遇”寄主的概率,如落在竹叶表面的分生孢子向上产生萌发管,最后形成形态与之差不多的次级分生孢子(图 1c)。高剂量“孢子浴”接种后24 h内即有感病蚜尸出现。从扫描电镜观察结果看,刚感病死亡的虫体内已充满暗孢耳霉营养菌丝体(图 2a),虫尸体壁多皱褶,依稀可见体表下交织的菌丝体。在死后6 h内,菌丝即突破寄主体表(图 2b),24 h内整个虫体除头和足部区域外,其他都被暗孢耳霉菌丝和孢子所取代(图 2c)。最先突破体壁的菌丝体为细长的假囊状体(图 3a),其与短粗的分生孢子梗具有明显区别,其作用常指与真菌感知外部环境条件如湿度情况有关。但假囊状体在暗孢耳霉中出现概率较低,并不常见。分生孢子梗弹射的分生孢子近球形,具有明显的乳突结构(图 3b),与由营养菌丝形成的球形休眠孢子(图 3d)有所区别。休眠孢子无乳突,不具侵染性,但其厚壁的特点利于暗孢耳霉度过寄主匮乏等不利环境。
 |
图 1 暗孢耳霉分生孢子附着蚜虫和竹叶表面
Fig. 1 The Conidiobolus obscurus conidia adherent to the surfaces of aphid cuticle and bamboo leaf
a.经“孢子浴”后竹梢凸唇斑蚜若蚜体壁保持完整The intact cuticle of Takacallis taiwanus nymph after conidial shower; b.分生孢子产生芽管侵入虫体后在体表残留皱缩的外壁 A shrinking conidium on the cuticle after invading into the host body; c.落在方竹叶下表面的分生孢子可再萌发Conidia landing on the downside of bamboo leaf germinate to form secondary conidia. |
 |
图 2 感病死亡蚜尸的体表特征
Fig. 2 The surface features of mycosed aphid
a.刚死蚜尸内充满暗孢耳霉菌丝体C. obscurus mycelia filling up the fresh killed aphid; b.死后6 h内,菌丝突破体表The mycelia penetrated from the cuticle in 6 h after death; c.死后24 h后,虫体表面除了头足部位都被菌丝和孢子所取代The cadaver body replaced by mycelia and conidia in 24 h. |
 |
图 3 暗孢耳霉的生物学特征
Fig. 3 The characteristics of C. obscurus
a.最先突破体壁的假囊状体,如箭头所指,其尖细的顶端与周围头部膨大的分生孢子梗具有明显区别 The first emerging cystidia on the cuticle, the arrowed sharp tip distinguished with the surrounding conidiophores which had swollen tips; b.分生孢子梗顶端形成单个初级分生孢子,具明显的乳突(箭头标示)The primary conidium discharged from a conidiophore with an apparent papilla; c.初级分生孢子可再萌发形成次级分生孢子The primary conidium could germinate to form secondary conidium; d.暗孢耳霉在虫尸体内可由单个营养菌丝形成球形的休眠孢子Within cadaver body, a singular mycelium is forming a resting spore. |
竹蚜接种暗孢耳霉分生“孢子浴”后,对外界刺激反应逐渐变得迟缓,爬行速度明显下降,死后体色变为红褐色。竹梢凸唇斑蚜的感病死亡率经自然死亡率(1.3%±2.2%)校正后,如累计死亡率随接种浓度升高而升高,随观察天数增加而增加(图 4)。在接种浓度(192.6±20.3)个孢子·mm-2时第5天的累计死亡率高达92.8%。竹梢凸唇斑蚜感病死亡高峰出现在接种后前2天,如在最大接种浓度时第1天感病死亡的虫尸数占总虫尸数的56.4%,前2天总和占92.3%。生物测定数据很好地拟合了时间-剂量-死亡率模型,并通过异质性检验(Hosmer-Lemeshow: C=11.1,df=8,P=0.19)。模拟分析计算得到半致死浓度LC50及其95%置信区间,如图 5a所示,随观察天数增加显著降低,第5天的LC50低至51.6(37.9~70.2)个孢子·mm-2。由此计算所得的半致死时间也随接种浓度提高而显著下降,如图 5b所示,在100个孢子·mm-2接种浓度时,LT50值为2.3天。多剂量生物测定结果表明,暗孢耳霉对竹梢凸唇斑蚜具有较高的毒力,且致死迅速。
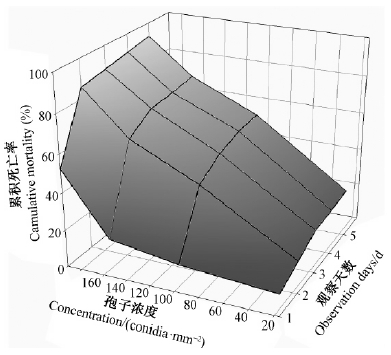 |
图 4 暗孢耳霉对竹梢凸唇斑蚜的累积死亡率随接种浓度和观察天数的变化 Fig. 4 The cumulative mortality of C. obscurus against T. taiwanus varying with the conidial concentration and observation days |
 |
图 5 竹梢凸唇斑蚜半致死浓度LC50(a)和半致死时间LT50(b) Fig. 5 The median lethal concentration (a) and the median lethal time (LT50) (b) 虚线为95%的置信区间95% confidence intervals (dotted lines). |
本研究初次报道了暗孢耳霉可感染竹梢凸唇斑蚜,并对其侵染特征进行了扫描电镜观察。首次观察到暗孢耳霉可产生假囊状体,该特化气生菌丝体对于暗孢耳霉侵染循环具有重要作用。虫霉通常在高湿度环境下产孢,侵染寄主,寄主死亡后随即产孢开启下一轮侵染,侵染循环的顺利进行对控制寄主种群尤为重要(Jackson et al., 2010)。其中,探知周围环境条件是否利于其感染寄主是关键的一步,假囊状体被报道具有吸收外界湿气帮助分生孢子形成的作用(李增智,2000)。同时,主动弹射的初级分生孢子如若未“遭遇”寄主,则可继续弹射次一级的分生孢子,增加其接触寄主的概率。遇到寄主匮乏或环境恶劣不适生存,暗孢耳霉又可在蚜尸体内形成休眠孢子在野外长期宿存(Pell et al., 2001)。这些生物学特征充分显示了该菌与寄主和环境之间高度的协调性,是长期演化的结果(Roy et al., 2006; 2010)。
暗孢耳霉对危害农业生产的蚜虫具有高毒力,但在林业上鲜有报道(Barta et al., 2006)。例如,暗孢耳霉对广食性害虫桃蚜毒力的生物测定结果显示,在10~28 ℃下最高感病致死率达到90%左右(Zhou et al., 2014)。本研究中生物测定结果显示,暗孢耳霉对竹梢凸唇斑蚜具有相当高的致死效果。由于生物测定毒力方法的不同,很难比较此次试验用菌和此前报道的其他生防菌在对竹蚜毒力方面的差异。徐华潮等(2006)报道了几株球孢白僵菌对竹梢凸唇斑蚜的毒力,所采用的浸渍法发现毒力最高的一株菌在第9天lg(LC50)值为4.054(相当于104个孢子·mL-1); 半致死时间在接种浓度106个孢子·mL-1下为3.6天。本试验采用的“孢子浴”法对接种浓度的衡量更为精准,近年来国外相关报道多采用此法。本研究结果显示暗孢耳霉所接种的蚜虫在第5天LC50值为51.6个孢子·mm-2,半致死时间在100个孢子·mm-2接种浓度时仅为2.3天。在同等温度条件下暗孢耳霉对桃蚜的LC50值及其95%置信区间为36.0(26.8~46.6)个孢子·mm-2,与本研究中该菌感染竹蚜的毒力测定结果无显著差异(二者的半致死剂量的95%置信区间相重叠)。
生防菌无法与化学农药相竞争的其中一个原因就是见效迟,使实际使用者怀疑其防治效果。本研究中竹梢凸唇斑蚜在“孢子浴”接种24 h后即有感病蚜尸出现,如此快速的致死效果将为今后暗孢耳霉防治竹蚜的实际应用提供动力。另外,国际上对田间施用生防用菌孢子浓度建议为每公顷1013个孢子(单乐天等,2006),相当于1 000个孢子·mm-2,而暗孢耳霉生物测定结果显示其所需的孢子浓度远低于该值,该菌优良的杀蚜性使其具有良好的应用前景。
| [1] |
方燕, 乔格侠, 张广学. 2006. 竹类植物叶片上八种蚜虫的形态变异分析. 昆虫学报, 49(6): 991-1001.( 1) 1)
|
| [2] |
冯明光. 1997. 虫霉流行病及其对害虫种群的自然控制与利用//樊美珍. 中国虫生真菌研究与应用. 第四卷. 北京: 中国农业科技出版社, 6-17.( 1) 1)
|
| [3] |
胡国良, 俞彩珠, 楼君芳, 等. 2001. 竹梢凸唇斑蚜生物学特性与防治. 浙江林学院学报, 18(3): 294-296.( 1) 1)
|
| [4] |
李增智. 2000. 中国真菌志.第13卷. 虫霉目. 北京: 科学出版社, 26-30.( 3) 3)
|
| [5] |
单乐天, 冯明光. 2006. 不同寄主及地理来源的16株绿僵菌对桃蚜的毒力比较. 微生物学报, 46(4): 602-607.( 1) 1)
|
| [6] |
唐启义, 冯明光. 2002. 实用统计分析及其DPS数据处理系统. 北京: 科学出版社.( 1) 1)
|
| [7] |
徐华潮, 施祖华. 2003. 温度对竹梢凸唇斑蚜种群增长的影响. 浙江大学学报:农业与生物科学版, 29(4): 439-443.( 1) 1)
|
| [8] |
徐华潮, 施祖华, 吴 鸿. 2006. 球孢白僵菌对竹梢凸唇斑蚜的毒力. 林业科学, 42(1): 85-89.( 2) 2)
|
| [9] |
Barta M, Cagáň L. 2006. Aphid-pathogenic entomophthorales (their taxonomy, biology and ecology). Biologia, 61(Suppl. 21): 543-616.( 3) 3)
|
| [10] |
Brey P T, Latge J P. 1986. Integumental penetration of the pea aphid Acyrthosiphon pisum, by Conidiobolus obscurus (Entomophthoraceae). J Invertebr Pathol, 48(1): 34-41.( 1) 1)
|
| [11] |
Feng M G, Tang Q Y, Hu G C, et al. 1996. Susceptibility of seven species of aphids to a Beauveria bassiana isolate: analysis of time-dose-mortality model. J Basic Sci Eng, 4(1): 22-33.( 1) 1)
|
| [12] |
Hajek A E, Elkinton J S, Witcosky J J. 1996. Introduction and spread of the fungal pathogen Entomophaga maimaiga (Zygomycetes, Entomophthorales) along the leading edge of gypsy moth (Lepidoptera, Lymantriidae) spread. Environ Entomol, 25(5): 1235-1247.( 1) 1)
|
| [13] |
Halbert S E, Remaudière G, Webb S E. 2000. Newly established and rarely collected aphids (Homoptera: Aphididae) in Florida and the southeastern United States. Florida Entomol, 83(1): 79-91.( 1) 1)
|
| [14] |
Jackson M A, Dunlap C A, Jaronski S T. 2010. Ecological considerations in producing and formulating fungal entomopathogens for use in insect biocontrol. BioControl, 55(1): 129-145.( 2) 2)
|
| [15] |
Li Y, Zhang J, Chang S X, et al. 2013. Long-term intensive management effects on soil organic carbon pools and chemical composition in moso bamboo (Phyllostachys pubescens) forests in subtropical China. Forest Ecol Manag, 303: 121-130.( 1) 1)
|
| [16] |
Pell J K, Eilenberg J, Hajek A E, et al. 2001. Biology, ecology and pest management potential of Entomophthorales //Butt T M, Jackson C, Magan N. Fungi as Biocontrol Agents. CABI Publishing, Wallingford, 71-153.( 2) 2)
|
| [17] |
Qiao G X, Zhang G X. 2004. Review of the genus Takecallis matsumura (Homoptera: Aphididae: Myzocallidinae) from China and description of one new species. Raff Bull Zool, 52(2): 373-378.( 1) 1)
|
| [18] |
Roy H E, Steinkraus D C, Eilenberg J, et al. 2006. Bizarre interactions and endgames: entomopathogenic fungi and their arthropod hosts. Ann Rev Entomol, 51: 331-357.( 1) 1)
|
| [19] |
Roy H E, Brodie E L, Chandler D, et al. 2010. Deep space and hidden depths: understanding the evolution and ecology of fungal entomopathogens. Biocontrol, 55(1): 1-6.( 1) 1)
|
| [20] |
Scurlock J M O, Dayton D C, Hames B. 2000. Bamboo: an overlooked biomass resource. Biomass Bioenerg, 19(4): 229-244.( 1) 1)
|
| [21] |
Zhang G Z, Feng M G, Chen C, et al. 2007. Opportunism of Conidiobolus obscurus stems from depression of infection in situ to progeny colonies of host alatae as disseminators of the aphid-pathogenic fungus. Environ Microbiol, 9(4): 1612-1621.( 2) 2)
|
| [22] |
Zhou X, Guo K, Mao S F, et al. 2014. Modeling analysis on sporulation capacity, storage and infectivity of the aphid-specific pathogen Conidiobolus obscurus (Entomophthoromycota: Entomophthorales). Mycoscience, 55(1): 21-26.)( 2) 2)
|
 2014, Vol. 50
2014, Vol. 50

