文章信息
- 谷加存, 赵妍丽, 王文娜, 王韶仲, 王政权
- Gu Jiacun, Zhao Yanli, Wang Wenna, Wang Shaozhong, Wang Zhengquan
- 皮层和中柱对水曲柳和落叶松吸收根直径变异的影响
- Effects of Cortical Thickness and Stele Diameter on Variations of Root Diameter in Fraxinus mandshurica and Larix gmelinii
- 林业科学, 2014, 50(10): 59-66
- Scientia Silvae Sinicae, 2014, 50(10): 59-66.
- DOI: 10.11707/j.1001-7488.20141008
-
文章历史
- 收稿日期:2014-01-16
- 修回日期:2014-05-04
-
作者相关文章
木本植物在进化过程中形成两大资源获取器官,即叶和根。不同树种叶形态变异主要表现在叶片形状、颜色和厚度等方面(Shipley et al.,2006),而根形态变异则主要表现在根直径大小和长短等(王向荣等,2005; 常文静等,2008; 师伟等,2008)。其中,叶片厚度和根直径是最重要的功能指标之一,前者深刻地影响叶片CO2同化能力,后者则在很大程度上决定了对养分和水分的吸收速率(Chapin et al.,2002)。以往研究发现,叶片厚度主要是由栅栏组织和海绵组织多少决定的(Esau,1977; Niinemets,1999; 2001),而根直径的粗细受哪些因子的影响到目前为止还不十分清楚。研究表明,环境因子如土壤水分、养分和温度对根直径有重要影响。例如,干旱或贫瘠土壤上生长的植物根通常较细,而湿润或肥沃土壤上生长的植物根通常较粗(Leppälammi-Kujansuu et al.,2013)。McMichael等(2002)研究发现,温度增加提高了棉花(Gossypium spp.)根直径; Zobel等(2007)研究表明,随着营养液浓度的变化,可可(Theobroma cacao)和小麦(Triticum aestivum)以及豇豆(Vigna unguiculata)根直径的变化趋势不同,与具体的种和养分浓度有关,同时指出根直径研究中应当充分考虑根系解剖构造的变化。然而,与叶片形态和解剖联系的广泛研究相比(Niinemets 1999; 2001; Shipley et al.,2006),人们对哪些解剖特征对根直径变异有重要影响的了解有限。
在吸收根(非木质化的根系统末端个体)(Guo et al.,2008)解剖构造中,主要存在皮层(cortex)和中柱(stele)2类组织,分别行使吸收和运输功能(Esau,1977)。这2类组织在根横截面中存在一定的比例关系,它们的变化影响根直径的粗细。但是,二者对直径的影响程度不同,例如,有的研究发现中柱对直径的影响更强(Guo et al.,2008),而有的研究表明皮层厚度是主要影响因子(Hummel et al.,2007; 许旸等,2011)。形成这种现象的原因:一方面受到根系取样的影响,因为有的研究仅仅考察了根尖(即1级根)(Hummel et al.,2007),而有的研究则包括了高等级根(Guo et al.,2008); 另一方面,则反映出根直径变异可能与树种生长特性(Comas et al.,2002;2004; Ugawa et al.,2010)、森林类型(常文静等,2008)、菌根侵染类型(师伟等,2008)等有关。因此,在根系取样基本一致的基础上(如区分根序,root order),对不同生长特性树种根系直径及其解剖特征进行研究,有助于了解木本植物吸收根直径变异的内在原因。由于皮层和中柱在吸收根中同时存在,有必要区分二者对根直径的直接和间接影响。为此,本研究以水曲柳(Fraxinus m and shurica)和落叶松(Larix gmelinii)人工林前2级根(主要的吸收根)(Guo et al.,2008)为材料,通过连续测定生长季中其形态(直径)和解剖特征(皮层厚度、中柱直径),采用通径分析(path analysis)方法研究: 1)2个树种根直径和解剖特征的变异及其与季节和根序的关系;2)皮层和中柱对根直径变异的直接和间接影响。这2个树种一个为阔叶树(水曲柳),一个为针叶树(落叶松),且分别是内生和外生菌根侵染类型,因此研究结果具有代表性。
1 研究地概况与研究方法 1.1 研究地概况研究地位于黑龙江省尚志市东北林业大学帽儿山实验林场尖砬沟森林培育实验站(127°30′—127°34′ E,45°21′—45°25′ N)。该地区属于温带大陆性季风气候,年均气温 2.8 ℃,1月平均气温-19.6℃,极端最低气温-44 ℃; 7月平均气温20.9 ℃,极端最高气温34.8 ℃。年平均降水量 723 mm,年平均蒸发量1 094 mm,无霜期120 ~ 140天,≥10 ℃积温2 526 ℃。林下土壤为典型暗棕壤,土壤厚度40~50 cm。研究林分为1986年营造的水曲柳和落叶松人工纯林,株行距1.5 m × 2.0 m。2002年分别在每个林分中设置3块(20 m × 30 m)固定标准地,立地条件相对一致。其他相关林分信息详见文献(王向荣等,2005)。
1.2 根系取样2009年,分别于5月中旬、7月中旬和10月上旬在每块标准地内随机选取3~4个样点(面积20 cm × 20 cm),采用平板利铲获取表层(0~10 cm)土块。小心除去根系上的浮土,直到露出整个根系为止,然后用剪刀剪下含有前5级根的根系样品。在纯林条件下,依据本研究中2个树种根系的分支特性和颜色特征,可以准确地将其与草本(少量)和灌木(极少量)根系区分开来。获得的根系样品用清水洗去杂质后装入盛满卡诺固定液(无水乙醇、冰醋酸按3∶1混合)的塑料瓶中进行固定,贴上标签并编号,放入冷藏箱(2~3 ℃)4 h后,转入70%酒精溶液中,放回冷藏柜(2~3 ℃)保存18 h以上,备用。
1.3 样品处理和分析在实验室,将解剖分析样品的根段放在直径为15 cm、装有70%酒精的培养皿中进行根系分级,方法与Pregitzer等(2002)相同,即根系统末端未分支的个体根定义为1级根,解剖研究主要分析前2级根。每个树种,对每个取样点获取的根系样品随机切取1级根15个、2级根15个,放入装有70%酒精的玻璃小瓶中,贴好标签,进行编号。采用石蜡切片技术制作细根横切片(卫星等,2008)。根样品经酒精系列脱水后透明,浸蜡包埋切片(8 mm)。采用番红-固绿片染色,加拿大树胶封片。切片用OLYMPUS BX-51生物显微镜(Olympus Electronics Inc.,Tsukuba,Japan)观察,用Motic 3000 CCD数码成像系统拍照成像,用对应的Motic软件测量皮层厚度、中柱(维管束)直径和根直径,计算维管束与根直径比值等参数。
1.4 数据分析对每个树种根系形态的测定数据分别按季节计算前2级根的平均直径、平均皮层厚度、平均中柱直径以及对应的标准误差、最大值和最小值。采用双因素方差分析(Two-way ANOVA)方法检验季节、根序以及它们之间的交互作用对根直径、皮层厚度和中柱直径的影响(α=0.05)。根据本地区气候因子特点,5,7和10月可分别被认为是典型的春季、夏季和秋季时段。采用线性回归分析方法研究解剖结构(皮层厚度和中柱直径)与直径变异的关系,确定这2个解剖特征对根直径变异影响的程度。由于皮层和中柱对直径的变异都有影响,故采用通径分析方法分析它们的直接和间接影响(陈强,1996)。所有数据分析均采用SPSS 13.0 for Windows 软件(SPSS公司,美国)完成。
2 结果与分析 2.1 直径、皮层和中柱的季节变异水曲柳和落叶松吸收根主要是前2级根,其中水曲柳和落叶松1级根平均直径分别为(291.38±4.73)mm和(310.38±4.92)mm,2级根平均直径分别为(319.62±4.96)mm和(362.73±5.24)mm,而且均从春季到秋季增加(图 1)。季节和根序对2个树种根直径均有显著影响,但是它们的交互作用仅对落叶松有影响(表 1)。
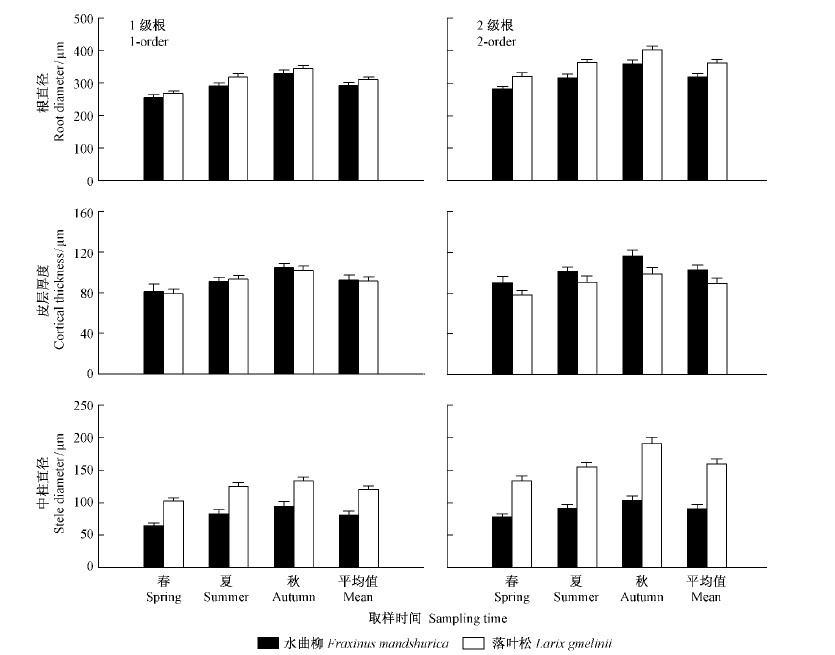 |
图 1 水曲柳和落叶松前2级根直径、皮层厚度和中柱直径季节变化 Fig. 1 Seasonal variations of root diameter, cortical thickness and stele diameter of the first two orders in F. mandshurica and L. gmelinii |
and order in F. mandshurica and L.gmelinii
|
|
皮层和中柱季节变化规律与直径相同(图 1),水曲柳和落叶松1级根平均皮层厚度分别为(104.69±1.06)mm和(102.36±1.18)mm,2级根平均皮层厚度分别为(116.36±4.96)mm和(98.91±1.61)mm; 水曲柳和落叶松1级根平均中柱直径分别为(94.03±1.97)mm和(133.29±1.60)mm,2级根平均中柱直径分别为(103.27±1.91)mm和(191.14±2.40)mm。在2个树种中,季节和根序对皮层厚度和中柱直径都有显著影响,但是它们的交互作用仅对落叶松中柱直径有显著影响(表 1)。
2.2 皮层和中柱对直径变异的影响水曲柳和落叶松吸收根直径在同一根序内和同一生长季内具有较大的变异,最小直径和最大直径之间相差10%左右(表 2)。这种差异既表现在根序之间,也表现在季节之间。简单相关分析表明,皮层厚度和中柱直径均与根直径之间存在显著正相关关系。水曲柳和落叶松在1级根中,皮层厚度分别可以解释直径变异的94%和95%,中柱直径可以解释92%和97%(图 2,3); 水曲柳和落叶松在2级根中,皮层厚度的影响分别为94%和85%,中柱直径的影响为93%和96%(图 2,3)。二元回归分析结果显示,皮层和中柱共同解释了水曲柳1级根直径96%和2级根直径95%的变异,落叶松为98%(1级根)和97%(2级根),显示皮层和中柱对直径变异均有重要的影响。
|
|
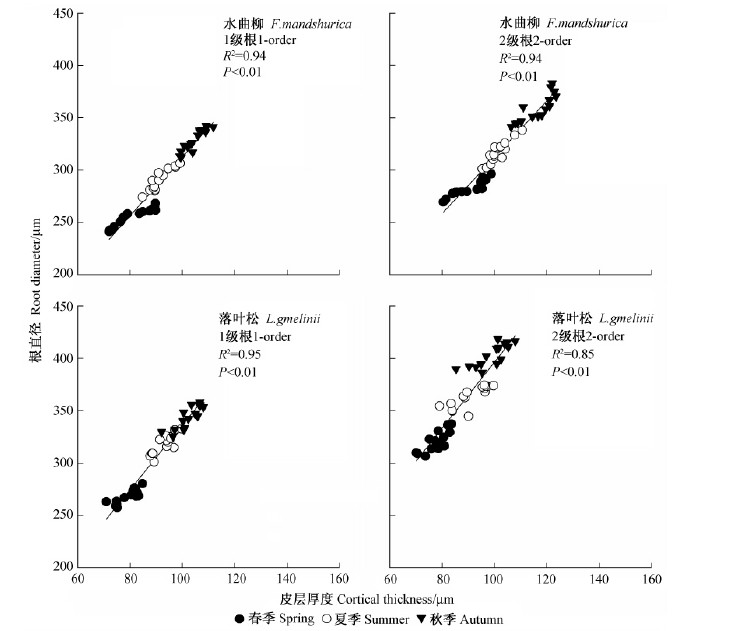 |
图 2 水曲柳和落叶松前2级根皮层厚度与直径相关性 Fig. 2 Correlation between root diameter and cortical thickness in the first two orders in F. mandshurica and L. gmelinii |
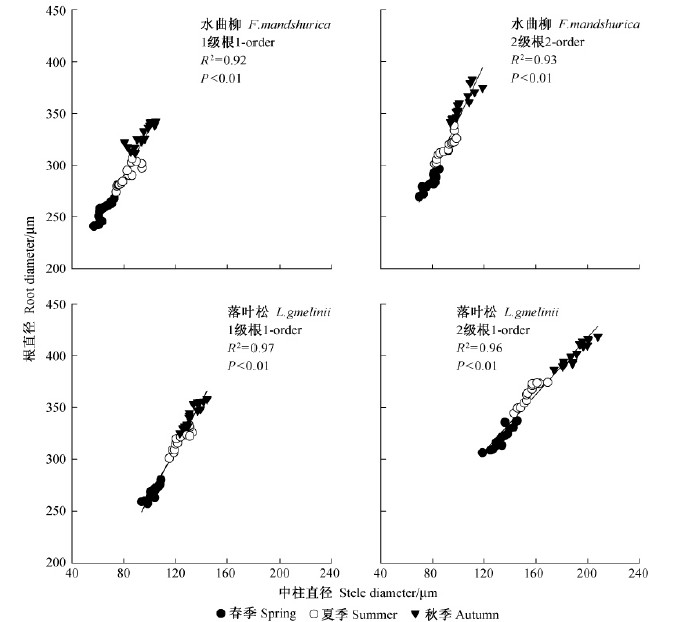 |
图 3 水曲柳和落叶松前2级根中柱直径与直径相关性 Fig. 3 Correlation between root diameter and stele diameter in the first two orders in F. mandshurica and L. gmelinii |
通径分析(表 3)显示,总体上,在水曲柳1,2级根中,皮层厚度对直径大小的直接影响较大(年平均通径系数0.53~0.56),间接影响较小(0.40~0.42); 而中柱直径直接影响小(0.43~0.45),间接影响大(0.51~0.52)(表 3)。落叶松正好相反,皮层厚度的直接影响小(0.27~0.42),间接影响大(0.55~0.64); 而中柱直径的直接影响大(0.59~0.73),间接影响小(0.39~0.24)。此外,解剖特征对直径大小的直接或间接影响随着季节发生改变。水曲柳1级根皮层厚度的直接影响春季为0.95,到秋季下降到0.65; 落叶松1级根皮层厚度的直接影响从春季0.54降到秋季0.35; 水曲柳1级根皮层厚度间接影响从春季0.41降到秋季0.23,落叶松则从春季0.40增加到秋季0.45。
|
|
树木根系直径具有重要的生理学和生态学意义,直径的粗细在很大程度上影响根系菌根真菌的侵染(Brundrett,2002)、养分和水分的吸收(Dunbabin et al.,2004)、寿命长短(Baddeley et al.,2005)和分解速率(Fahey et al.,1994; 张秀娟等,2006)。树木根系直径的变异不仅在种间差异很大(常文静等,2008; 师伟等,2008),而且在种内也存在较大变异(王向荣等,2005)。研究表明许多环境因素影响根系直径的粗细,如土壤温度、水分和养分等(McMichael et al.,2002; Glass,2002; Sperry et al.,2002)。但是,这些研究并没有很好地揭示根直径为何会表现出这样的改变。通过对水曲柳和落叶松吸收根的解剖研究发现,随着皮层厚度或者中柱直径的增加,根直径增粗(图 2,3),两因子可以解释1级根直径变异的92%~97%,解释2级根直径变异的85%~96%。这些结果一方面说明皮层厚度和中柱直径是影响根直径大小的主要因子,另一方面也表明环境因子很可能通过改变根系的解剖构造对直径大小产生影响。在本研究中,季节对2个树种根解剖特征均有显著的影响(表 1),也侧面证实环境因子(如土壤水分、温度和养分有效性)的季节动态对吸收根解剖构造的影响。但是,究竟是哪些环境因子起主导作用,仍需要进一步的试验来检验。
皮层和中柱构成了吸收根组织的主要部分,但是二者的功能不同。皮层是薄壁组织,主要功能是吸收和同化养分,为土壤真菌菌丝提供侵染场所; 中柱是输导组织,主要功能是运输养分和水分(Esau,1977; Peterson et al.,1999)。二者的大小和相对比例,对吸收根直径产生直接或间接影响。通径分析表明:在整个生长季中,2个树种的皮层厚度和中柱直径对吸收根直径变异的直接影响和间接影响存在明显不同。在水曲柳中,皮层厚度主要是直接影响,中柱主要是间接影响; 在落叶松中,皮层厚度主要是间接影响,中柱直径主要是直接影响(表 3)。产生这种差异可能与2个树种菌根真菌侵染的类型有关,水曲柳是内生菌根树种,而落叶松则是外生菌根树种。中柱处在根结构的内部,而皮层分布在中柱的外面。落叶松根因外生菌根真菌而形成菌丝鞘(hyphal sheath),很大程度上限制了皮层的发育(Smith et al.,2008),可能导致中柱对根直径的直接影响较大(Rousseau et al.,1994; Sun et al.,2010); 相比较,水曲柳的皮层无菌丝鞘包裹,发育上可能不受限制,因此,导致了水曲柳皮层对根直径产生较大影响。许旸等(2011)对海南岛尖峰岭4个热带内生菌根树种研究显示,皮层厚度可以解释种间直径变异的97%,而中柱直径则可以解释71%,显示了内生菌根树种中皮层厚度对根直径变异的重要性。
本研究还发现,皮层厚度和中柱直径的直接和间接影响存在明显的季节差异(表 3),这可能与根直径的季节变异和生理功能的转变有关。春季水曲柳和落叶松根直径是最小的(图 1)。春季是树木开始生长的季节,需要大量养分和水分,但此时土壤养分和水分的有效性偏低,根系可通过改变形态(如降低直径)来适应环境(Fitter,2002),因为较细的根和较薄的皮层通常具有较高的吸收效率(Eissenstat et al.,1997;Rieger et al.,1990); 尤其是2个树种1级根皮层厚度对直径的直接影响在春季均是最大的(表 3),这反映出此时根系主要通过调节皮层厚度来提高根系的吸收效率。在秋季,2个树种根平均直径均是最大的,可能有2个原因:首先,直径增粗是根系越冬存活的一种适应策略,较粗的根能更好地抵御冬季的低温胁迫,维持较长的寿命(Wells et al.,2002; Baddeley et al.,2005); 其次,秋季形成较粗的根中可能储存大量的非结构性碳水化合物(如淀粉),以便为翌年春季新根生长提供能量(Bai et al.,2008)。秋季水曲柳1级根中皮层厚度和中柱直径对直径的直接影响均低于春季,这种一致的下降趋势暗示此时根增粗很大程度上是二者共同作用的结果; 相反,落叶松1级根皮层厚度直接作用下降,而中柱直径作用增加,表明中柱直径对此时根系增粗的贡献可能更大。与此类似,2级根中皮层厚度和中柱直径直接作用大小的季节变化,也有助于理解其直径变异的潜在机制。因此,树木根系在解剖构造上的改变,直观地表现为其形态上的变化,但更重要的是意味着根系生理功能的内在转变,而这是以往研究中所没有足够重视的。此外,本研究主要关注了2个温带树种吸收根直径内在变异的潜在机制,而对种间细根直径的巨大变异,则需在更多的树种和更广泛的立地条件下开展有针对性的研究。
4 结 论本研究通过解剖学方法证实,水曲柳和落叶松前2级根直径与皮层厚度和中柱直径存在着相同的季节变化规律。皮层厚度可以解释直径变异的85%~95%,中柱直径可以解释92%~97%,表明皮层厚度和中柱直径均对直径变异有重要的影响。通径分析显示,水曲柳直径变异和季节变化主要是皮层厚度起直接作用,中柱直径仅起间接作用; 而落叶松则是皮层厚度起间接作用,中柱直径起直接作用。直径大小的季节动态与皮层厚度和中柱直径直接作用的相对强弱有关,而且这种联系存在种间差异。这些研究结果对认识树木种内吸收根直径变异的机制提供了重要基础。
| [1] |
常文静, 郭大立. 2008.中国温带、亚热带和热带森林45个常见树种细根直径变异. 植物生态学报, 32(6): 1248-1257.( 3) 3)
|
| [2] |
陈强. 1996. 通径分析及其在林业试验统计分析中的应用. 云南林业科技, (1): 54-61.( 1) 1)
|
| [3] |
师伟, 王政权, 刘金梁, 等. 2008.帽儿山天然次生林20个阔叶树种细根形态. 植物生态学报, 32(6): 1217-1226.( 3) 3)
|
| [4] |
王向荣, 王政权, 韩有志, 等. 2005.水曲柳和落叶松不同根序之间细根直径的变异研究. 植物生态学报, 29(6): 871-877.( 3) 3)
|
| [5] |
卫星, 刘 颖, 陈海波. 2008.黄波罗不同根序的解剖结构及其功能异质性. 植物生态学报, 32(6): 1238-1247.( 1) 1)
|
| [6] |
许旸, 谷加存, 董雪云, 等. 2011.海南岛4个热带阔叶树种前5级细根的形态、解剖结构和组织碳氮含量. 植物生态学报, 35(9): 955-964.( 2) 2)
|
| [7] |
张秀娟, 吴 楚, 梅 莉, 等. 2006.水曲柳和落叶松人工林根系分解与养分释放. 应用生态学报, 17(8): 1370-1376.( 1) 1)
|
| [8] |
Baddeley J, Watson C. 2005. Influences of root diameter, tree age, soil depth and season on fine root survivorship in Prunus avium. Plant and Soil, 276(1/2): 15-22.( 2) 2)
|
| [9] |
Bai W M, Wang Z W, Chen Q S, et al. 2008. Spatial and temporal effects of nitrogen addition on root life span of Leymus chinensis in a typical steppe of Inner Mongolia. Functional Ecology, 22(4): 583-591.( 1) 1)
|
| [10] |
Brundrett M C. 2002. Coevolution of roots and mycorrhizas of land plants. New Phytologist, 154(2): 275-304.( 1) 1)
|
| [11] |
Chapin III F S, Matson P, Mooney H A. 2002. Principles of Terrestrial Ecosystem Ecology. New York: Springer-Verlag, 97-119.( 1) 1)
|
| [12] |
Comas L H, Bouma T J, Eissenstat D M. 2002. Linking root traits to potential growth rate in six temperate tree species. Oecologia,132(1): 34-43.( 1) 1)
|
| [13] |
Comas L H, Eissenstat D M. 2004. Linking fine root traits to maximum potential growth rate among 11 mature temperate tree species. Functional Ecology, 18(3): 388-397.( 1) 1)
|
| [14] |
Dunbabin V M, Rengel Z, Diggle A J. 2004. Simulating form and function of root systems: efficiency of nitrate uptake is dependent on root system architecture and the spatial and temporal variability of nitrate supply. Functional Ecology, 18(2): 204-211.( 1) 1)
|
| [15] |
Eissenstat D M, Yanai R D. 1997. The ecology of root lifespan. Advances in Ecological Research, 27: 1-60.( 1) 1)
|
| [16] |
Esau K. 1977. Anatomy of Seed Plants. 2nd ed. New York: Wiley, 351-372.( 3) 3)
|
| [17] |
Fahey T J, Hughes J W. 1994. Fine root dynamics in a northern hardwood forest ecosystem, Hubbard Brook Experimental Forest, NH. Journal of Ecology, 82(3): 533-548.( 1) 1)
|
| [18] |
Fitter A H. 2002. Characteristics and functions of root systems// Waisel Y, Eshel E, Kafkafi U. Plant Roots: the Hidden Half. 3rd ed. New York, USA: Dekker Press, 15-32.( 1) 1)
|
| [19] |
Glass A D M. 2002. Nutrient absorption by plant roots: regulation of uptake to match plant demand// Waisel Y, Eshel E, Kafkafi U. Plant Roots: the Hidden Half. 3rd edn. New York, USA: Dekker Press, 571-587.( 1) 1)
|
| [20] |
Guo D L, Xia M X, Wei X, et al. 2008. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species. New Phytologist, 180(3): 673-683.( 4) 4)
|
| [21] |
Hummel I, Vile D, Violle C, et al. 2007. Relating root structure and anatomy to whole-plant functioning in 14 herbaceous Mediterranean species. New Phytologist, 173(2): 313 -321.( 1) 1)
|
| [22] |
Leppälammi-Kujansuu J, Ostonen I, Strmgren M, et al. 2013. Effects of long-term temperature and nutrient manipulation on Norway spruce fine roots and mycelia production. Plant and Soil, 366(1/2): 287-303.( 1) 1)
|
| [23] |
McMichael B L, Burke J J. 2002. Temperature effects on root growth// Waisel Y, Eshel E, Kafkafi U. Plant Roots: the Hidden Half 3rd edn. New York, USA: Dekker Press, 717-728.( 2) 2)
|
| [24] |
Niinemets V. 1999. Research review: components of leaf dry mass per area-thickness and density-alter leaf photosynthetic capacity in reverse directions in woody plants. New Phytologist, 144(1): 35-47.( 1) 1)
|
| [25] |
Niinemets V. 2001. Global-scale climatic controls of leaf dry mass per area density, and thickness in trees and shrubs. Ecology, 82(2): 453-469.( 1) 1)
|
| [26] |
Peterson C A, Enstone D E, Taylor J H.1999.Pine root structure and its potential significance for root function. Plant and Soil, 217(1/2): 205-213.( 1) 1)
|
| [27] |
Pregitzer K S, DeForest J L, Burton A J, et al. 2002. Fine root architecture of nine North American trees. Ecological Monographs, 72(2): 293-309.( 1) 1)
|
| [28] | Rieger M, Litvin P. 1999. Root system hydraulic conductivity in species with contrasting root anatomy. Journal of Experimental Botany, 50(331): 201-209. |
| [29] |
Rousseau J V D, Sylvia D M, Fox A J. 1994. Contribution of ecto-mycorrhiza to the potential nutrient-absorbing surface of pine. New Phytologist, 128(4): 639-644.( 1) 1)
|
| [30] |
Shipley B, Lechowicz M J, Wright I, et al. 2006. Fundamental trade-offs generating the worldwide leaf economics spectrum. Ecology, 87(3): 535-541.( 2) 2)
|
| [31] |
Smith S E, Read D J. 2008. Mycorrhizal symbiosis. 3rd ed.London: Academic Press, 191-269.( 1) 1)
|
| [32] |
Sperry J S, Stiller V, Hacke U G. 2002. Soil water uptake and water transport through root systems// Waisel Y, Eshel E, Kafkafi U. Plant Roots: the Hidden Half. 3rd edn. New York, USA: Dekker Press, 663-682.( 1) 1)
|
| [33] |
Sun Y, Gu J C, Zhuang H F et al. 2010. Effects of ectomycorrhizal colonization and nitrogen fertilization on morphology of root tips in a Larix gmelinii plantation. Ecological Research, 25(2): 295-302.( 1) 1)
|
| [34] |
Ugawa S, Iwamoto K, Matsuura Y, et al. 2010. Root-tip diameters of woody species in subalpine Abies forest. Plant and Soil, 326(1/2): 303-310.( 1) 1)
|
| [35] |
Wells C E, Glenn D M, Eissenstat D M. 2002. Changes in the risk of fine-root mortality with age: a case study in peach, Prunus persica (Rosaceae). American Journal of Botany, 89(1): 79-87.( 1) 1)
|
| [36] |
Zobel R W, Kinraide T B, Baligar V C. 2007. Fine root diameters can change in response to changes in nutrient concentrations. Plant and Soil, 297(1/2): 243-254.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

