文章信息
- 张雄帅, 周国娜, 高宝嘉
- Zhang Xiongshuai, Zhou Guona, Gao Baojia
- 油松毛虫体内酶系对油松诱导抗性的响应机制
- Response Mechanisms of Pine Caterpillar Enzymatic System to Pine Induced Resistance
- 林业科学, 2014, 50(10): 181-187
- Scientia Silvae Sinicae, 2014, 50(10): 181-187.
- DOI: 10.11707/j.1001-7488.20141025
-
文章历史
- 收稿日期:2013-04-23
- 修回日期:2014-03-27
-
作者相关文章
植物与植食性昆虫在长期的协同进化过程中形成既复杂又微妙的关系。以往关于植物对昆虫的防御反应及机制的研究较为深入,但关于昆虫对植物抗性的反防御反应近年来才受到关注,尤其是昆虫对植物诱导抗性反应的研究已有明显进展(Mainguet et al.,2008; Zeng et al.,2008)。当植物产生防御物质时昆虫能利用自身代谢系统对食物中的有害物质进行解毒和排毒,大大削弱了植物的诱导抗性在害虫防治过程中的作用强度(王琛柱等,2007),所以,在研究植物与昆虫之间的作用关系时,对昆虫本身防御机制的研究是必不可少的。昆虫对植物的反防御反应可使昆虫减少植物诱导抗性的影响(董向丽等,1998; 宋月琴等,2009),已有研究发现,寄主植物所含的次生物质和防御蛋白对植食性昆虫体内解毒酶系、保护酶系和消化酶系具有诱导效应(李镇宇等,1998; 张常忠等,2001; 彭梅等,2005; 冯春富等,2011)。Philippe等(2010)、Inis等(2011)、Noah等(2011)从昆虫对植物的反适应角度,分析研究了蚜虫如何操控植物反应、昆虫对植物芥子油甙-黑芥子酶系统的反适应机制、昆虫胰凝乳蛋白酶对马铃薯蛋白酶抑制剂抗性机制等,发现昆虫对植物抗性反防御的生化和分子机制主要来自于消化蛋白酶和解毒酶系的变化以及相关基因的调控(彭露等,2010)。Zhu-Salzman等(2005)发现昆虫可在植物蛋白酶抑制剂胁迫下产生过量的消化蛋白酶或对蛋白酶抑制剂不敏感的新的蛋白酶,并通过DNA微序列分析证明昆虫确实存在能够控制消化系统克服植物蛋白酶抑制剂的转录调控机制;Will等(2007;2008)研究发现昆虫唾液中的葡萄糖氧化酶可通过抑制植物中茉莉酸和水杨酸的产生而抵御植物的防御化合物。同时,还有研究发现对植物的不同取食刺激程度可诱导植物不同的防御反应以及昆虫自身体内主要防御物质的变化(戈峰等,1997; Haruta et al,2001; 徐伟等,2006)。已有研究表明,油松(Pinus tabulaeformis)受环境条件影响和取食刺激程度越强,其针叶表现出来对油松毛虫(Dendronlinus tabulaeformis)的抗性越明显,油松毛虫取食不同处理的油松针叶后,其生长发育指标(单宁、粗脂肪、总酚、还原糖、蛋白质)差异显著(陈晨等,2012a; 2012b)。这些研究揭示了昆虫对植物抗性的反防御反应规律,而深入分析昆虫对植物不同诱导抗性的反防御机制,对于探究昆虫与植物的相互适应和协同进化具有十分重要的意义。为此,本研究以自然状态下的油松和油松毛虫为材料,对在不同诱导抗性油松的胁迫下油松毛虫体内酶系活性进行研究,探讨不同取食刺激下油松是否影响油松毛虫解毒酶、保护酶、消化酶的活力水平。
1 研究区概况与研究方法 1.1 研究区概况试验地位于河北省承德市平泉县油松林区(118°21′03″—119°15′34″E,40°24′0″—40°40′17″E),环境条件适宜油松毛虫生存,并有周期性的暴发。选择立地条件优良的油松-山杏(Armeniaca sibirica)混交林作为样地,每块样地大小为30 m×30 m。随机选择健康、树龄相近、长势均匀且12~15 年生、平均树高6~7 m、胸径8~9 cm、无松毛虫危害的油松作为试验样株。
1.2 研究方法1)油松的处理选取生长状况基本一致的油松43株作为试验样株,分别接入2龄幼虫,设置5头18株、15头10株、30头5株、0头(对照)10株的油松毛虫取食处理,于4月中下旬套笼放养虫源一致的2龄油松毛虫幼虫,连续取食,并定期更换套笼的油松枝条(对照所用的油松毛虫放入笼中饲养,并置于树干上,每隔2天从对照油松上采取2年生松枝饲养)。4龄时从一部分试验样株取样(取过样的试验样株不再使用),6龄时从未取样的试验样株取样(4龄幼虫6月7日取样,6龄幼虫7月5日取样),每个龄期不同处理设置3次重复,每次重复取3头幼虫,饥饿处理24 h后,放入-80 ℃冰箱保存待测。
2)解毒酶活性的测定 酶液的制备: 取出-80 ℃冰箱保存的油松毛虫幼虫,取各组虫中肠,称重,置于玻璃匀浆器中,加入9倍缓冲液,在冰浴中进行组织匀浆。之后4 ℃ 10 000 r·min-1离心15 min,取上清液做酶源。
3种原液提取的缓冲液: 羧酸酯酶提取缓冲液为0.04 mol·L-1 pH7.0 PBS缓冲液; 谷胱甘肽S-转移酶提取液为0.06 mol·L-1 pH7.0 PBS缓冲液; 乙酰胆碱酯酶提取液为0.1 mol·L-1 pH7.6 PBS缓冲液。
羧酸酯酶活性测定: 参考Van Asperen(1962)和高希武(1992)的方法并略加改进,将原酶液稀释20倍用于试验,10 000 r·min-1离心10 min,冰浴待测。以α-NA为底物,经酯酶水解后生成α-萘酚,与显色剂(5%SDS∶1%固蓝B盐=2∶5)作用呈现深蓝色,于600 nm处测OD值,重复3次。
乙酰胆碱酯酶活性测定: 活性测定按乙酰胆碱酯酶试剂盒(南京建成生物工程研究所)说明书进行,以每毫克组织蛋白在37 ℃保温6 min、水解反应体系中生成1 μmol基质为1个活力单位(U),于412 nm处测OD值,重复3次。
谷胱甘肽S-转移酶活性测定: 活性测定按谷胱甘肽S-转移酶试剂盒(南京建成生物工程研究所)说明书进行,以每毫克组织蛋白在37 ℃反应1 min扣除非酶促反应,使反应体系中谷胱甘肽浓度降低1 μmo·L-1为1个活力单位(U),于412 nm处测OD值,重复3次。
3)保护酶活性测定 酶液制备参照李周直等(1994)的方法。取各组虫中肠,称重,置于玻璃匀浆器中,用pH7.0的0.05 mol·L-1 PBS缓冲液冰浴匀浆,然后4 ℃、12 000 r·min-1离心15 min,取上清液作酶源。
超氧化物歧化酶活性测定参照李周直等(1994)的方法并略加改进。取3 mL反应介质(0.05 mol·L-1 pH7.8的PBS,其中含0.1 mL 40 mmol·L-1核黄素、2.7 mL 15 mmol·L-1 Met、0.1 mL 2 mol·L-1 NBT、0.1 mL 0.1 mmol·L-1 EDTA),置于4 000 lx光照条件下进行光化学反应20 min,然后用黑暗终止反应立即在560 nm处比色,测定OD值,重复3次,1个酶活力单位定义为将NBT的还原抑制到对照的50%时所需的酶量。
过氧化物酶活性测定按照过氧化物酶试剂盒(南京建成生物工程研究所)说明书进行,以每毫克组织蛋白每分钟催化产生1 μg底物的酶量定义为1个酶活力单位(U),于420 nm处测定OD值,重复3次。过氧化氢酶活性测定参照彭志英等(1995)的方法并略加改进,采用紫外速率直接法,原理是CAT可催化H2O2,使H2O2在230 nm处的紫外吸收随时间的增加而减少,通过测定反应体系中的H2O2分解速率即可计算出CAT酶的活力,重复3次。
4)消化酶活性测定 酶液的提取: 取出-80 ℃冰箱保存的油松毛虫幼虫,称重,用75%乙醇表面消毒处理,双蒸水冲洗多次,然后将油松毛虫加入9倍的生理盐水中冰浴匀浆,10 000 r·min-1、4 ℃离心30 min,取上清液4 ℃保存备用,24 h内测定完毕。
蛋白酶活性测定: 采用福林酚试剂法(郭勇等,1996),在pH7.5、酪蛋白浓度为1.0 mg·mL-1 条件下37 ℃水浴 15 min,以酶液1 min水解的酪蛋白产生1 μg酪氨酸作为1个酶活单位,于680 nm处测定OD值,重复3次。
脂肪酶活性测定: 活性测定按脂肪酶试剂盒(南京建成生物工程研究所)说明书进行,活性单位定义为在 37 ℃条件下,每克组织蛋白在反应体系中与底物反应1 min,每消耗1 μmol底物作为1个酶活力单位,于420 nm处测定OD值,重复3次。
淀粉酶活性测定: 活性测定按淀粉酶试剂盒(南京建成生物工程研究所)说明书进行,活性单位定义为组织中每毫克蛋白在37 ℃与底物作用30 min,水解10 mg的淀粉作为1个淀粉酶活力单位,于660 nm处测定OD值,重复3次。
1.3 数据统计分析采用DPS 7.0.5软件进行方差分析,采用Duncan(新复极差法)分别在0.05和0.01水平下检验各处理间的差异显著性。
2 结果与分析 2.1 不同处理油松对油松毛虫体内解毒酶活性的影响1)羧酸酯酶活性变化 如图 1所示,油松毛虫幼虫中肠羧酸酯酶活性在2个龄期都高于对照,说明各处理的油松对油松毛虫体内的羧酸酯酶活性均有一定的诱导作用,在4龄期酶活性表现为随油松针叶受油松毛虫取食程度的增强而增高(T30>T15>T5>CK),但4种处理之间无显著差异(P>0.05); 6龄期羧酸酯酶活性亦表现出相同规律,而且T30处理与其他3种处理有极显著差异(P<0.01),说明不同处理对油松的诱导抗性作用在6龄期显著增强,而且对油松的取食刺激程度越大,油松所诱导的油松毛虫体内羧酸酯酶活性越高,羧酸酯酶在油松毛虫对油松诱导抗性的反防御反应中起到防御植物次生物质危害的作用。
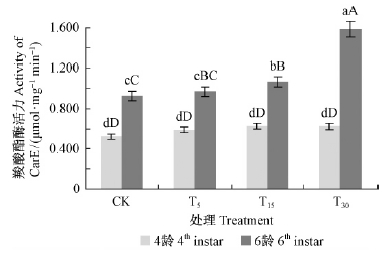 |
图 1 不同处理油松对油松毛虫体内羧酸酯酶活性的影响 Fig. 1 Impact of CarE activity of D.tabulaeformis induced by different treatments CK,T5,T15,T30处理对应的松毛虫、油松数量分别是0,10;5,18;15,10;30,50。Number of pine catepillars,Chinese pine for CK,T5,T15,T30 are 0,10; 5,18; 15,10; 30,5; respectively.下同The same below. |
2)乙酰胆碱酯酶活性变化 如图 2所示,2个龄期不同处理间油松毛虫幼虫体内的乙酰胆碱酯酶并无显著变化(P>0.05),说明油松抗性没有对油松毛虫体内的乙酰胆碱酯酶产生诱导作用。
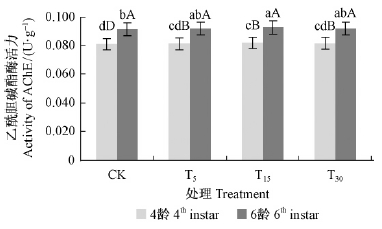 |
图 2 不同处理油松对油松毛虫体内乙酰胆碱酯酶活性的影响 Fig. 2 Impact of AChE activity of D. tabulaeformis induced by different treatments |
3)谷胱甘肽S-转移酶活性变化 如图 3所示,油松毛虫幼虫取食不同处理的油松针叶后,谷胱甘肽S-转移酶的活性在2个龄期的处理之间都有变化,4龄幼虫酶活性表现为随油松针叶受油松毛虫取食程度的增强而增高(T30>T15>T5>CK),6龄幼虫酶活性表现出与之相近的规律(T30>T15>CK>T5)。方差分析结果表明,在4龄期对油松T30处理幼虫的酶活性与其他3种处理均表现为差异极显著(P<0.01),T15处理与CK和T5处理之间差异极显著(P<0.01); 6龄时幼虫的酶活性,油松T15处理与CK表现为极显著差异(P<0.01),T30处理与其他3种处理表现为极显著差异(P<0.01)。说明谷胱甘肽S-转移酶是油松毛虫对油松抗性的重要适应性酶类。
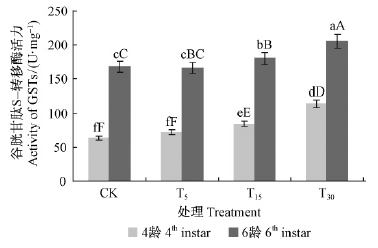 |
图 3 不同处理油松对油松毛虫体内谷胱甘肽S-转移酶活性的影响 Fig. 3 Impact of GSTs activity of D.tabulaeformis induced by different treatments |
1)超氧化物歧化酶活性变化 如图 4所示,4龄幼虫酶活力表现为对油松取食刺激处理T30>T5>T15>CK,6龄幼虫酶活力则表现为随油松针叶受油松毛虫取食程度的增强而增高(T30>T15>T5>CK)。方差分析结果表明,4龄时除了T30与CK表现为显著差异(P<0.05)外,其他各处理之间均差异不显著(P>0.05),说明对于4龄幼虫来说,总体上表现为随着刺激程度增加,油松所诱导的超氧化物歧化酶的活性增大;对6龄幼虫酶活性的方差分析结果表明,T15处理与CK之间、T30处理与T5处理和CK之间均表现为极显著差异(P<0.01),其他处理之间表现为显著差异(P<0.05),说明油松毛虫体内超氧化物歧化酶的活性对油松的不同抗性更加敏感,而且随着作用(取食)时间的增加,这种敏感性也增强。
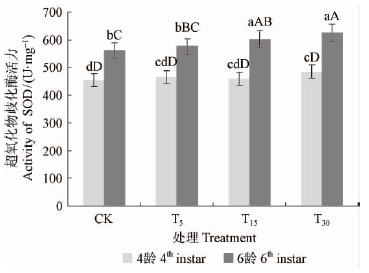 |
图 4 不同处理油松对油松毛虫体内超氧化物歧化酶活性的影响 Fig. 4 Impact of SOD activity of D.tabulaeformis induced by different treatments |
2)过氧化物酶活性变化 如图 5所示,幼虫4龄时,酶活力表现为对油松取食刺激处理T15>CK>T5>T30,方差分析结果表明,T30与其他处理均表现为极显著差异(P<0.01),T15与T5表现为极显著差异(P<0.01),T15与CK无显著差异(P>0.05);幼虫6龄时,酶活力表现为对油松取食刺激处理T5>CK>T30>T15,T5与CK之间没有显著差异(P>0.05),其他各处理之间均表现为极显著差异。说明油松毛虫体内过氧化物酶活性随着对油松取食刺激程度的增加而受到抑制,但在此范围内没有表现出线性变化规律。
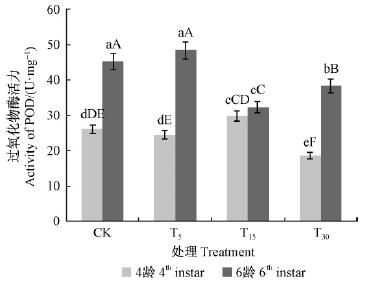 |
图 5 不同处理油松对油松毛虫体内过氧化物酶活性的影响 Fig. 5 Impact of POD activity of D.tabulaeformis induced by different treatment |
3)过氧化氢酶活性变化 如图 6所示,幼虫4龄时,酶活力表现为对油松取食刺激处理T30>T15>CK>T5,方差分析结果表明,T30与其他处理之间表现为极显著差异(P<0.01),CK,T5与T15之间无显著差异(P>0.05)。6龄幼虫酶活力表现为随油松针叶受松毛虫取食程度的增强而增高(T30>T15>T5>CK),方差分析结果表明,T5处理与CK之间显著差异(P<0.05),T15处理与CK,T5处理之间表现为极显著差异(P<0.01),T30处理与各处理之间表现为显著差异(P<0.05)。 说明油松毛虫体内的过氧化氢酶活性随油松抗性的增高而显著增强,而且这种变化随着幼虫取食时间的增加而更加明显。
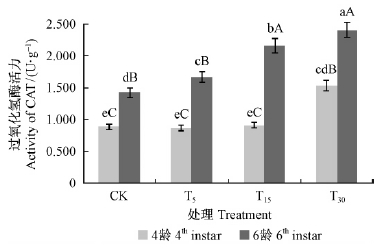 |
图 6 不同处理油松对油松毛虫体内过氧化氢酶活性的影响 Fig. 6 Impact of CAT activity of D.tabulaeformis induced by different treatments |
1)蛋白酶活性的变化 如图 7所示,在2个龄期,酶活力表现为随油松受取食刺激程度的增加而增高(T30>T15>T5>CK);方差分析结果表明,T30处理与CK之间表现为极显著差异(P<0.01),4龄时,各处理之间无显著差异(P>0.05),但各处理分别与对照之间表现为极显著差异(P<0.01)。说明油松毛虫体内的蛋白酶是油松抗性变化的重要响应因素。
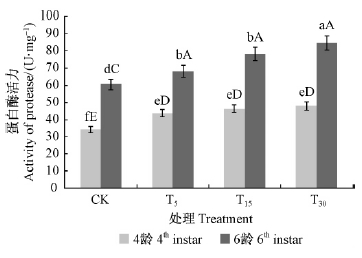 |
图 7 不同处理油松对油松毛虫体内蛋白酶活性的影响 Fig. 7 Impact of protease activity of D.tabulaeformis induced by different treatments |
2)脂肪酶活性的变化 如图 8所示,2个龄期酶活性总体上呈随着油松诱导抗性增加而增高的趋势;方差分析结果表明,幼虫体内脂肪酶活性在4龄时各个处理之间无显著差异(P>0.05)。6龄时,T30处理与CK之间表现为显著差异(P<0.05),但没有表现出显著的线性变化关系。说明油松毛虫体内的脂肪酶也参与了对油松抗性的反适应。
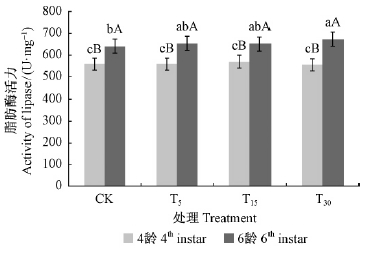 |
图 8 不同处理油松对油松毛虫体内脂肪酶活性的影响 Fig. 8 Impact of lipase activity of D.tabulaeformis induced by different treatments |
3)淀粉酶活性的变化 如图 9所示,酶活性在2个龄期均表现为随油松受取食刺激程度的增强而增高的趋势(T30>T15>T5>CK),但方差分析结果表明,2个龄期油松毛虫体内的淀粉酶活性在各处理之间均差异不显著(P>0.05)。说明油松毛虫体内的淀粉酶部分参与了对油松抗性的反适应。
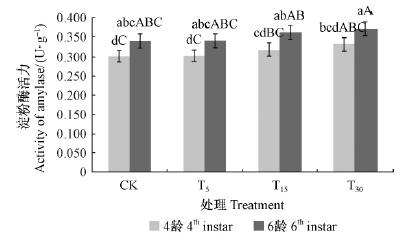 |
图 9 不同处理油松对油松毛虫体内淀粉酶活性的影响 Fig. 9 Impact of amylase activity of D.tabulaeformis induced by different treatments |
对不同的油松诱导抗性胁迫下油松毛虫体内解毒酶、保护酶和消化酶的测定结果表明:1)油松的诱导抗性胁迫可以导致油松毛虫体内羧酸酯酶、谷胱甘肽S-转移酶、超氧化物歧化酶、过氧化氢酶、蛋白酶的活性显著增加,可以影响油松毛虫体内过氧化物酶、脂肪酶和淀粉酶活性的变化;2)油松毛虫体内羧酸酯酶、谷胱甘肽S-转移酶、超氧化物歧化酶、过氧化氢酶、蛋白酶是油松毛虫对油松诱导抗性反防御反应的重要酶类; 3)在一定范围内,随着油松防御产物作用强度和时间的增加,油松毛虫体内适应性酶类的活性增强。
4 讨论羧酸酯酶是一类多聚蛋白,具有广泛的底物专一性,能催化水解脂肪族羧酸酯等多种化合物,是昆虫体内重要的解毒酶,在昆虫的生理代谢过程中有重要作用(冯春富等,2011)。谷胱甘肽S-转移酶是昆虫在解毒代谢过程中有多种功能的活性蛋白质,是昆虫体内重要的解毒酶系(周先碗,1999; 罗万春等,2003),是具有多种解毒功能的同工酶。Masttsten等(1987)认为,寄主植物中某些营养物质和次生物质的质与量的变化对害虫代谢有很大的影响,本试验结果初步证明了这一点。徐伟等(2006)通过对兴安落叶松(Larix gmelinii)的不同剪叶和取食刺激处理,研究落叶松毛虫(Dendrolimus superans)体内解毒酶活性的变化,发现不同剪叶处理、取食刺激处理对松毛虫体内解毒酶活性有显著影响,且随着剪叶和刺激程度的增加解毒酶活性显著升高。 与上述研究比较,本文得到了相似的结果,这可能是由于不同取食刺激可以诱导油松产生不同量的次生物质,进而诱导油松毛虫取食后产生较多的羧酸酯酶和谷胱甘肽S-转移酶,以抵御油松次生性化学物质的不良影响,这2种解毒酶可能是油松毛虫反防御反应重要的抗性指标。
在生物的进化过程中,细胞内逐渐形成了防御活性氧危害的保护机制,即过氧化氢酶、过氧化物酶、超氧化物歧化酶等保护酶类,是抵抗活性氧伤害的重要保护酶,在清除自由基、过氧化氢、过氧化物等方面起着重要作用(李明等,2002)。这3种酶通常协调一致,形成一种动态平衡,当这种平衡遭到破坏时,就可能产生伤害。戈峰等(1997)研究不同剪叶处理的松树对马尾松毛虫(D.punctatus)体内过氧化氢酶活性的影响发现,随着剪叶处理的增加,马尾松毛虫体内过氧化氢酶的活性显著增加; 陈尚文(2001)研究发现过氧化氢酶活性与昆虫的虫龄呈负相关。本研究结果表明,过氧化氢酶活性和超氧化物歧化酶活性与油松毛虫虫龄呈正相关,并随着对油松取食刺激程度的增加,这种规律表明超氧化物歧化酶和过氧化氢酶可能在油松毛虫的反防御机制中有重要的作用。过氧化物酶活性随着油松抗性的增加而呈现降低趋势,但没有表现出线性规律,这可能是由于对油松较低的取食刺激程度而产生的防御产物不足以引起油松毛虫过氧化物酶的活性变化。
当昆虫遇到植物蛋白酶抑制剂的影响时,昆虫不只是被动地适应植物的诱导防御,相反能够主动适应这些挑战(Zhu-Salzman et al.,2005)。植食性昆虫能通过产生对蛋白酶抑制剂不敏感的消化酶类来应对植物的防御(Cloutier et al.,2000; Mazumdar et al.,2001),以适应植物的诱导抗性。已有研究发现,松毛虫取食能够显著诱导蛋白酶抑制剂的活性,且在相同损伤程度下,虫害诱导的蛋白酶抑制剂活性大于剪叶损伤诱导,这可能与昆虫的取食方式和唾液成分在植物诱导反应中的作用有关(殷海娣等,2006),类似的结果在许多植物中都有证实(Haruta et al.,2001; Lawrence et al.,2004),落叶松毛虫取食以昆虫取食和剪叶处理的落叶松后,其中肠总消化酶活性无显著变化(徐伟等,2006)。本研究结果表明,蛋白酶与脂肪酶在植物诱导抗性作用下,表现出明显的活性变化,而淀粉酶活性的变化不明显,这可能是由于取食刺激诱导油松较多的产生与蛋白和脂类代谢有关的防御机制,进而诱导油松毛虫相应酶的活性发生变化。
乙酰胆碱酯酶是一种催化并水解乙酰胆碱的酶,乙酰胆碱存在于突触间隙,可以被乙酰胆碱酶分解,从而终止神经兴奋的传导,一旦该酶被抑制,昆虫就会过度兴奋而死亡。乙酰胆碱酶的是氨基甲酸酯和有机磷类杀虫剂最重要的靶标(宗静等,2000),同时也是生物神经传导中的一种重要酶。李云寿等(1996)研究了不同寄主植物对小菜蛾(Plutella xylostella)体内乙酰胆碱酯酶活性的变化情况,发现寄主植物对小菜蛾的乙酰胆碱酯酶活性没有影响。本研究表明,不同取食程度的油松针叶对油松毛虫体内乙酰胆碱酯酶的活性无明显影响。一般认为乙酰胆碱酯酶并非解毒酶,乙酰胆碱酯酶作为解毒酶尚存争议,自然环境下不同取食诱导下的油松针叶对油松毛虫乙酰胆碱酯酶的诱导作用有待进一步研究。
本研究表明,在油松不同的诱导抗性胁迫下,油松毛虫体内的解毒酶、保护酶和消化酶在反防御反应中表现出明显的线性变化规律,表明油松毛虫对植物诱导抗性产生了反适应机制。可以推断,油松毛虫在油松的诱导抗性胁迫下所表现出的反防御反应,主要受到油松防御机制的影响,油松在不同取食刺激诱导下所产生的防御蛋白(蛋白酶抑制剂、氨基酸脱氨酶等)、次生物质(含氮化合物、萜类化合物、酚类化合物等)等防御产物(秦秋菊等,2005),可对昆虫的取食及生长发育形成防御机制,昆虫则对于油松不同的防御机制产生反防御反应,并形成不同的反适应机制。物种之间的这种相互适应机制的形成及其影响因素仍需要进一步探索。
| [1] |
陈 晨. 2012a. 林分类型对油松诱导抗虫性的影响. 保定:河北农业大学硕士学位论文.( 1) 1)
|
| [2] |
陈 晨, 周国娜, 刘巧红, 等. 2012b. 不同林分类型的油松针叶对两种色型油松毛虫生长发育的影响.生态学杂志,31(10): 2573-2578.( 1) 1)
|
| [3] |
陈尚文. 2001.马尾松毛虫过氧化氢酶及过氧化物酶与耐药性的关系. 昆虫学报,44(1): 9-14.( 1) 1)
|
| [4] |
董向丽,高希武,郑炳宗.1998. 植物次生物质诱导作用对杀虫药剂毒力影响研究. 昆虫学报,41(1): 111-116.( 1) 1)
|
| [5] |
冯春富,严善春,鲁艺芳,等.2011. 兴安落叶松诱导抗性对舞毒蛾幼虫解毒酶活性的影响. 林业科学,47(8): 102-107.( 2) 2)
|
| [6] |
戈 峰, 李典谟, 邱业先,等. 1997. 松树受害后一些化学物质含量的变化及其对马尾松毛虫种群参数的影响. 昆虫学报, 40(4): 337-342.( 2) 2)
|
| [7] |
郭 勇,郑穗平.1996.酶在食品工业中的应用. 北京: 中国轻工业出版社,64-65.( 1) 1)
|
| [8] |
李 明,王根轩.2002.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响. 生态学报,22(4): 503-507.( 1) 1)
|
| [9] |
李云寿,罗万春,慕立义,等.1996. 不同寄主植物对小菜蛾艾氏剂环氧化酶和乙酰胆碱酯酶活性的影响.植物保护学报,23(2): 181-184.( 1) 1)
|
| [10] |
李镇宇,陈华盛,袁小环,等.1998.油松对赤松毛虫的诱导化学防御.林业科学,34(2): 43-50.( 1) 1)
|
| [11] |
李周直,沈惠娟,蒋巧根,等.1994.几种昆虫体内保护酶系统活力的研究.昆虫学报,37(4): 399-403.( 2) 2)
|
| [12] |
罗万春,张 强. 2003. 苦豆子生物碱对小菜蛾体内部分杀虫剂代谢酶活性的影响. 昆虫学报,46(1): 122-125.( 1) 1)
|
| [13] |
彭 露,严 盈,刘万学,等.2010.植食性昆虫对植物的反防御机制.昆虫学报, 53(5): 572-580.( 1) 1)
|
| [14] |
彭 梅,邓新平.2005.甜菜夜蛾不同龄期幼虫药剂敏感性及酶活性差异.西北农业大学学报,27(2): 173-183.( 1) 1)
|
| [15] |
彭志英,蒋 黎.1995.紫外速率直接法测定过氧化氢酶活性.华西医学,10(1): 4-7.( 1) 1)
|
| [16] |
秦秋菊,高希武.2005.昆虫取食诱导的植物防御反应.昆虫学报, 48(1): 125-134.( 1) 1)
|
| [17] |
宋月琴,孙会忠,李 涛,等.2009.不同寄主植物对小菜蛾羧酸酯酶活性的影响.中国农学通报,25(19): 203-205.( 1) 1)
|
| [18] |
王琛柱,钦俊德.2007.昆虫与植物的协同进化: 几株植物-铃夜蛾-寄主蜂相互作用.昆虫知识,44(3): 311-319.( 1) 1)
|
| [19] |
徐 伟,王志英,严善春.2006.兴安落叶松诱导抗虫性的研究.哈尔滨:东北林业大学硕士学位论文.( 3) 3)
|
| [20] |
殷海娣,黄翠红,王戎疆,等.2006.昆虫唾液成分在昆虫与植物关系中的作用.昆虫学报,49(5): 843-849.( 1) 1)
|
| [21] |
张常忠,高希武,郑炳宗. 2001. 棉铃虫谷胱甘肽S-转移酶的活性分布和发育期变化及植物次生物质的诱导作用.农药学报, 9(1): 30-35.( 1) 1)
|
| [22] |
周先碗.1999.昆虫谷胱甘肽S-转移酶分离纯化的新方法.中国生物化学与分子生物学报,15(2): 269-273.( 1) 1)
|
| [23] |
宗 静,张 凡,孙光芝,等.2000.繁殖寄主对赤眼蜂羧酸酯酶和乙酰胆碱酯酶的影响.昆虫学报,43(1): 70-76.( 1) 1)
|
| [24] |
Cloutier C,Jean C,Fournier M,et al. 2000. Adult Colorado potato beetles,Leptinotarsa decemlineata compensate for nutritional stress on oryzacystatin I-transgenic potato plants by hypertrophic behavior and over-production of insensitive proteases. Archives of Insect Biochemistry and Physiology,44: 69-81.( 1) 1)
|
| [25] |
Haruta M,Major I T,Christopher M E,et al. 2001. A Kunitz trypsin inhibitor gene family from trembling aspen: Cloning,functional expression,and induction by wounding and herbivory. Plant Mol Biol, 46: 347-359.( 2) 2)
|
| [26] |
Inis W,Ute W.2011. Insect herbivore counteradaptations to the plant glucosinolate-myrosinase system. Phytochemistry,(72): 1566-1575.( 1) 1)
|
| [27] |
Lawrence S D,Novak N G. 2004.Maize genes induced by herbivory and volicitinm.J Chem Ecol,30(12): 2543-2557.( 1) 1)
|
| [28] |
Mainguet A M,Louveaux A, Rollin P,et al.2008.Ability of a generalist insect, Schistocerca gregaria,to overcome thioglucoside defense in desert plants: tolerance or adaptation.Entomologia Experimentalis et Applicata,94(3): 309-317.( 1) 1)
|
| [29] |
Masttsten W J,Sciber J M.1987.Nutritional ecology of insect folivores of woody plants: nitrogen,water,fiter,and mineral considerations//Slansky J F,Rodriguez J G. Nutritional Ecology of Insects.Miters and Spiders.New York: Wiley Press,105-146.( 1) 1)
|
| [30] |
Mazumdar S,Broadway R M.2001.Transcriptional induction of diverse midgut trypsins in larval Agrotis ipsilon and Helicoverpa zea feeding on the soybean trypsin inhibitor. Insect Biochemistry and Molecular Biology,31: 645-657.( 1) 1)
|
| [31] |
Noah K W,Georg J.2011. Genome-enabled research on the ecology of plant-insect interaction. Plant Physiology,(154): 475-478.( 1) 1)
|
| [32] |
Van Asperen K. 1962. A study of Housefly esterases by means of a sensitive colorimetric method.J Ins Physiol,(8): 401-416.( 1) 1)
|
| [33] |
Philippe G,Laurence B,Christine R.2010.Compatible plant-aphid interactions: how aphids manipulate plant responses. C R Biologies, 333(6/7): 516-523.( 1) 1)
|
| [34] |
Will T,Tjalingii W F.2007. Molecular sabotage of plant defence by aphid saliva.Proceedings of the National Academy of Science of United States of America,104: 10536-10541.( 1) 1)
|
| [35] |
Will T,van Bel A J E.2008.Induction as well as suppression: how aphid saliva may exert opposite effects on plant defencse. Plant Signaling and Behavior,3(6): 427-430.( 1) 1)
|
| [36] |
Zeng R S,Su Y J,Ye M,et al. 2008. Plant induced defense and biochemical mechanisms.Journal of South China Agricultural University,29(2): 1-6.( 1) 1)
|
| [37] |
Zhu-Salzman K,Bi J L,Liu T X.2005. Molecular strategies of plant defense and insect counter-defense.Insect Science, 12(1): 3-15.( 2) 2)
|
 2014, Vol. 50
2014, Vol. 50

