文章信息
- 唐辉, 李婷婷, 沈朝华, 胡渊渊, 吴家胜
- Tang Hui, Li Tingting, Shen Chaohua, Hu Yuanyuan, Wu Jiasheng
- 氮素形态对香榧苗期光合作用、主要元素吸收及氮代谢的影响
- Effects of Nitrogen Forms on Foliar Photosynthesis, Nutrient Status and Nitrogen Metabolism of Torreya grandis Seedlings
- 林业科学, 2014, 50(10): 158-163
- Scientia Silvae Sinicae, 2014, 50(10): 158-163.
- DOI: 10.11707/j.1001-7488.20141022
-
文章历史
- 收稿日期:2014-02-27
- 修回日期:2014-04-25
-
作者相关文章
植物生长需要多种营养元素,以氮素最为重要。氮素既是蛋白质、核酸、磷脂的主要成分,又是原生质、细胞核和生物膜的重要组成部分,在生命活动中有特殊作用,被称为生命元素(邹文桐等,2011)。植物对氮素的吸收利用不仅取决于植物自身代谢的特点,而且取决于生长环境中的各种氮源。植物能吸收并利用的无机态氮主要是铵态氮(NH4+-N)和硝态氮(NO3--N)(von Wirén et al.,1997; Miller et al.,2005; 李霞等,2006; 晏枫霞等,2009)。
不同的植物对NH4+-N和NO3--N的吸收、利用有所偏好。在同时供应NH4+-N和NO3--N的条件下,欧洲赤松(Pinus sylvestris)和欧洲落叶松(Larix decidua)、挪威云杉(Picea abies)、白云杉(Picea glauca)、花旗松(Pseudotsuga menziesii)和异叶铁杉(Tsuga heterophylla)等针叶树对NH4+-N的吸收速率明显高于NO3--N,具有优先吸收NH4+-N的特性(张彦东等,2003; 樊卫国等,2013)。Yao等(2011)在研究高山松(Pinus densata)、油松(Pinus tabulaeformis)和云南松(Pinus yunnanensis)的氮源偏好特性时,发现高山松和油松具有偏好NO3--N的特性。这种差异是植物对NH4+或NO3-的相对吸收能力、由NO3-向NH4+的还原能力、对NH4+的同化能力以及与氮源形态有关的碳、氮整体代谢过程所决定的,是植物营养特性的反映(Abuzinadah et al.,1989)。在阔叶树种中,黄檗(Phellodendron amurense)幼苗喜硝特性明显,硝态氮比例较高(高NO3--N)的营养供给比铵态氮比例较高(高NH4+-N)的营养供给更有利于黄檗幼苗的生长,并在NH4+-N/NO3--N为25/75时具有最大生物量。喜树(Camptotheca acuminata)对NH4+-N也表现出明显的偏好,NH4+-N既能促进树体生长,又能促进养分吸收和光合作用(李金玲,2006)。
与NH4+-N相比,NO3--N是一种较耗能的无机氮源(Jampeetong et al.,2009; Konnerup et al.,2010),过多的施加NO3--N容易造成溶液pH升高,影响铁(Fe)和其他微量元素的吸收及叶绿素的合成,也容易造成氮肥的流失及植物体内硝酸盐的积累,而过量施用NH4+-N铵态氮则有可能抑制植物对钾离子(K+)与钙离子(Ca2+)的吸收,引起植物体内多方面代谢失调,致使植物铵中毒(李霞等,2006; 王康才等,2009; Jampeetong et al.,2012)。植物吸收利用环境中的NO3-需经过2个同化反应步骤: 首先由硝酸还原酶(NR)的NO3-还原为亚硝态氮(NO2-),然后再由亚硝酸还原酶把NO2-还原为NH4+,才能进一步掺入氨基酸及蛋白质的合成(Piwpuan et al., 2013)。
香榧(Torreya gr and is)为红豆杉科(Tanceae)、榧属(Torreya)常绿乔木,中国原产树种,是世界上稀有的经济树种,现已被列为国家Ⅱ级重点保护野生植物。香榧是实生榧树中优良变异类型或优株经人工嫁接繁殖而成,其栽培遍及浙江会稽山区及安徽山区,栽培历史已有1 000多年(黎章矩等,2004; 2005; 程晓建等,2007)。研究表明,生长于酸性土壤环境的树种通常喜铵,pH较高土壤环境中的树种则有喜硝的倾向(张福锁等,1995)。香榧一般栽培于pH 5.2~7.5的土壤上生长良好(黎章矩等,2007),香榧是喜铵植物还是喜硝植物?迄今为止,有关香榧的氮素营养特性研究还不够深入,不同氮素形态对香榧苗期光合作用、主要元素以及氮代谢相关酶类的影响尚不明确。本研究以香榧幼苗为材料,研究NH4+-N和NO3--N 2种形态氮素混合配比对香榧苗期光合作用、主要元素吸收和氮代谢的影响,旨在为香榧育苗和幼树氮肥管理提供科学依据。
1 材料与方法 1.1 试验材料试验材料为2年生香榧嫁接苗,来自浙江省杭州市淳安县文昌镇。
1.2 试验设计本试验在浙江农林大学智能温室进行(30°23′ N,119°72′ E),采用水培试验法。2012年5月末选择地径、苗高一致(苗高平均为32.06 cm,地径平均为6.24 mm)的香榧苗,从营养钵中将苗木取出,在不破坏苗木根系的前提下用自来水将根系泥土洗净,移入装有营养液带盖的塑料桶中培养,每桶培育3株。先用完全营养液培养10天,继之用不同氮素形态营养液处理,不同氮素形态营养液按不同的NH4+-N/NO3--N比例分为5组(即0/100,25/75,50/50,75/25和100/0,分别标记为T1,T2,T3,T4和T5),总氮浓度均为16 mmol·L-1适宜香榧幼苗生长。完全营养液中大量元素按照Utriainen等(2001)和孙世芹等(2008)的方法配制,略有改动,处理用营养液以完全营养液为基础,其中NO3--N使用Ca(NO3)2·4H2O和KNO3,NH4+-N使用(NH4)2SO4,用K2SO4和MgSO4·7H2O分别代替KCl和MgCl(表 1)。微量元素参照Arnon(1938)的方法配制。每个处理设置5次重复,每次重复3株,共15株。营养液每7天更换1次,隔天用1 mol·L-1 HCl 或1 mol·L-1 NaOH调pH,确保pH为6.0±0.5。全天用森森ACO-007电磁式空气泵连续通气,并相应地补充损失的水分。
|
|
试验处理75天后,选取香榧苗木中部当年生叶片,进行气体交换和各项生理生化指标的测定。采用美国Licor公司生产的Li-6400XT便携式光合测定系统测定香榧叶片的光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等气体交换参数。测定时采用6400-05簇状叶室,光源为自然光(光合有效辐射为1 237~1 652 μmol·m-2s-1),并保持CO2浓度(Ca)和流速为400 μmol·mol-1和500 μmol·s-1,测定温度为(29±1)℃。所有的气体交换试验均在9:00—10:30内完成。
NO3--N含量测定参照现代植物生理学试验指南(中国科学院上海植物生理研究院等,1999)方法,硝酸还原酶(nitrate reductase,NR)的测定采用体内法(孙世芹等,2004),用Shimadzu UV-2550紫外可见光分光光度计(日本东京)测定吸光值。所得数据SAS 9.0进行统计分析,用Duncan新复极差法进行差异显著性检验。
2 结果与分析 2.1 氮素形态对香榧苗期光合参数的影响从表 2可以看出,供应NH4+-N/NO3--N混合营养的叶片光合速率(Pn)、气孔导度(Gs)和蒸腾作用(Tr)均高于供应单一NH4+-N或NO3--N营养的叶片,其中混合营养处理(T2和T3)叶片的Pn,Gs和Tr显著高于供应单一NH4+-N或NO3--N营养处理的叶片。与供应单一NO3--N营养(T1)处理的叶片相比,T2和T3混合营养处理的叶片Pn和Gs分别增加了69%和200%。与供应单一NH4+-N营养(T1)处理的叶片相比,T2和T3混合营养处理的叶片Pn和Gs分别增加了270%和250%。T2和T3混合营养处理的叶片Tr显著高于供应单一NH4+-N或NO3--N营养处理的叶片。各不同氮素形态处理之间的Ci不存在显著性差异。
|
|
由图 1可知,随着NH4+浓度的增加,香榧叶片P,K含量呈先升高后降低的趋势。叶片含P量在施用纯NO3--N(T1)处理下时最小,但在NH4+-N/NO3--N=50/50(T3)时叶片P含量增加了34.1%,达到最大值,约为3.75 mg·g-1 DW。NH4+-N/NO3--N混合营养的叶片含K量显著高于单一供应NO3--N或NH4+-N的叶片。叶片含钾量在纯NH4+-N(T5)处理时约为纯NO3--N(T1)处理时的1.04倍。
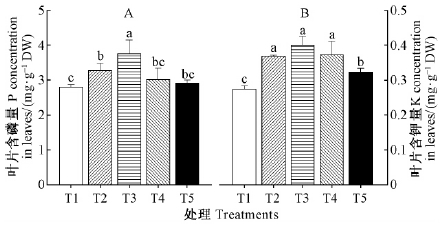 |
图 1 氮素形态对香榧苗期叶片磷和钾含量的影响 Fig. 1 Effects of nitrogen forms on the phosphorus and potassium concentrations in leaves of T.grandis seedlings |
由图 2可知,纯NH4+-N(T5)处理时叶片的NO3--N含量显著低于其他氮素处理。随着NO3-浓度的增加,香榧叶片的NR活性呈先上升后降低的趋势,其中NH4+-N/NO3--N=50/50(T3)处理的叶片NR达到最高,纯NO3--N处理的叶片NR最低。纯NH4+-N(T5)处理时叶片的NR活性与NH4+-N/NO3--N混合营养处理时叶片之间不存在显著性差异,但纯NH4+-N(T5)处理时NR活性显著高于纯NO3--N(T1)。
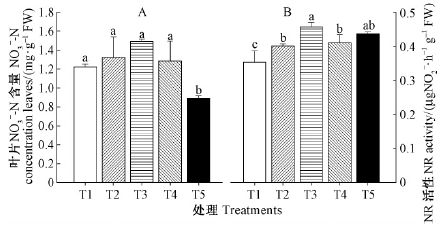 |
图 2 氮素形态对香榧苗期叶片中硝态氮(NO3--N)含量和硝酸还原酶(NR)活性的影响 Fig. 2 Effects of nitrogen forms on the nitrate nitrogen concentration in leaves and NR activities of T. grandis seedlings |
由图 3可知, 随着NO3-浓度的增加,香榧叶片N含量呈先升高后降低的趋势,其中纯NH4+-N供应的叶片N含量最低。NH4+-N/NO3--N混合营养供应叶片N含量均高于纯NH4+-N或NO3--N供应的叶片,其中T3和T4处理叶片N含量分别为纯NO3--N和NH4+-N的1.3和1.1倍。
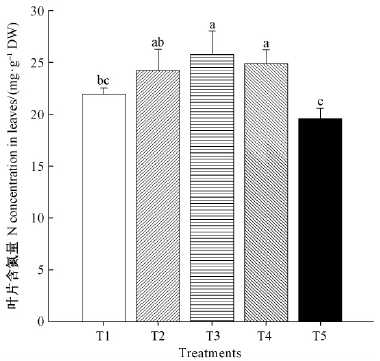 |
图 3 氮素形态对香榧苗期叶片中氮含量的影响 Fig. 3 Effects of nitrogen forms on the nitrogen concentration in leaves of T. grandis seedlings |
光合作用是果树生长发育的基础,果树干物质的90%~95%来源于光合作用,光合能力的高低可以反映出果树生长发育水平的高低(李天忠等,2008)。氮素形态对植物的光合作用有很大的影响。肖凯等(2000)对小麦(Triticum aestirum)的研究发现,氮素形态对净光合速率的影响由大到小依次为NH4+-N/NO3--N混合营养>单一供NO3--N营养>单一供NH4+-N营养。本研究结果表明,NH4+-N/NO3--N混合营养提高了香榧叶片的光合能力。供应单一NH4+-N或NO3--N营养叶片的Pn,Gs均低于供应NH4+-N/NO3--N混合营养的叶片,但不同氮素形态处理之间的Ci却未发生显著性变化(表 2),这说明单一供应NH4+-N/NO3--N的香榧叶片光合速下降并非完全由气孔因素造成。有研究发现,当NH4+-N供应水平过高时,NH4+会对植物产生铵毒作用(Britto et al., 2002),使光合速率下降,从而影响植物的生长(Gerendās et al., 1997)。本研究发现随NH4+-N比例增大或单纯供应NH4+-N香榧叶片光合能力减弱,这一现象可能与氨中毒有关。有研究表明,NO3--N为氮素供源时,即使植物吸收NO3-量超过其本身的利用能力,多余的NO3-可以储存在细胞的液泡中,而不影响植物的其他代谢过程,从而不会对植物造成毒害作用(Marschner,1995)。这从一定程度上也解释了本研究中供应纯NO3--N的香榧叶片光合速率高于供应纯NH4+-N的叶片的原因。从氮素形态对光合性能影响的结果来看,可以初步判断香榧不属于喜硝或喜铵的树种,对NH4+-N或NO3--N没有明显的偏好。
不同氮素形态会影响植物对矿质元素的吸收,尤其是阳离子的吸收,一般来说,单一供应NH4+的植物中K含量较少(Engels et al., 1993; Jampeetong et al., 2009)。本研究结果表明,单一NH4+-N供应(T5)的叶片中K含量显著高于单一供应NO3--N的叶片(图 1A)。这可能是由于高浓度NH4+-N抑制了K+的吸收,使香榧幼苗发生了生理性缺K,所以K从老叶向新叶运输。张振贤等(1995)研究发现,叶片中K含量随着叶龄的增加而降低。所以要证实这一假说,需要进一步研究不同氮素形态处理下不同叶龄叶片K元素的变化。另外,与K元素不同,NH4+会促进P的吸收(Smith et al., 1998; 张彦东等,2000),但是当NH4+过量时,也会抑制植物对P的吸收(Rayar et al., 1977)。本研究结果显示,随着NH4+浓度的增加,叶片的P含量呈先增加后降低的趋势,这表明少量的NH4+会增加香榧对P的吸收,但超过8 mmol·L-1 NH4+的供给会抑制香榧对P的吸收。
NH4+-N和NO3--N除影响其他养分元素的吸收外,它们之间也相互作用,并影响树木对N的吸收。植物吸收NO3-后,经硝酸还原酶(NR)将NO3-还原为NH4+才能进入氮代谢被植物加以利用。NR是植物NO3--N同化体系中的第一个酶,也是NO3--N吸收利用的一个限速酶。NR大量的存在于植物茎叶和根系中,均能进行NO3-的同化作用(Andrews,1986; Munzarova et al., 2006)。本研究表明,NH4+-N/NO3--N混合营养供应下叶片的NO3-和NR均显著高于单一供应NH4+-N或NO3--N营养的叶片,这表明NH4+-N/NO3--N混合营养能促进香榧叶片对NO3-的吸收及对氮的同化能力。通常认为增加营养液中NO3--N浓度时,植物体内的NO3-的积累量上升,NR活性提高(汪建飞等,2007)。许长蔼等(1991)在小麦上的研究表明当增加营养液中NO3-的浓度时,植物体内NO3-的积累量上升,NR活性提高,但当营养液中NO3-浓度升高到一定程度时,细胞质中NO3-含量不再增加,此时NR活性趋于稳定,继续吸收的NO3-则累积于液泡内。胡龙娇等(2013)研究表明,叶片NR活性很大程度上取决于木质部运送至叶片的NO3-的流量,而与叶片中原有的NO3--N含量关系不密切。本研究结果表明,随着NO3--N比例的减少,香榧叶片NR活性呈先升后降趋势,这表明单纯供应NO3--N时,高浓度NO3-抑制根中NO3-向叶片运输的速率,而适度的NO3-(NH4+-N/NO3--N=50:50)促进根中NO3-向叶片运输。单一供应NH4+-N营养的叶片中NR活性则显著高于单一供应NO3--N的叶片(图 2A,B),这可能是由于过量NH4+会引发铵毒,影响香榧对NH4+的吸收,为优先将氮元素供应给叶片,植物会促使根中的NO3-通过木质部运输到叶片中,从而诱导叶片的NR活性增强。这可以从2个方面证实其合理性,首先,与NO3-不同,NH4+对植物有毒害作用,所以根中NH4+需以氨基酸、蛋白质等其他有机氮的形态运输到叶片,因此在木质部中未发现游离的NH4+(People et al., 1997);其次,与NH4+相比,同化NO3-更加耗能,而叶片光合机构能提供大量的还原剂(ATP),因此叶片被认为是同化NO3-的主要器官(Gojon et al., 1994)。由此笔者推测单一供应NH4+-N营养时,香榧叶片所吸收的NH4+不能直接运输到叶片,促使根中的NO3-可以优先运输到叶片,所以诱导叶片中的NR活性增强(图 2B)。
NH4+-N/NO3--N混合营养供应香榧叶片中的N含量显著高于单一供应NH4+-N或NO3--N营养的叶片(图 3),这表明NH4+-N/NO3--N配施更有利于香榧对氮元素的吸收和同化。还原NO3-转变成NH4+,所需的能量可以由呼吸作用/光合作用提供(即NAD(P)H),另外碳水化合物的供应是其还原的另一个限制因子(Miller et al., 2005)。因此,笔者认为单一供应NH4+-N或NO3--N显著降低了香榧叶片的光合能力可能也是影响香榧叶片同化N元素的原因之一。
综上所述,NH4+-N/NO3--N混合营养供应促进香榧叶片光合能力的提高,从苗期看香榧不属于喜硝或喜铵的树种,对NH4+-N或NO3--N没有明显的偏好; 不同氮素形态可明显影响香榧对P和K元素的吸收。不同氮素形态通过影响香榧叶片NR活性,使得其对氮元素的同化能力不同,从而最终影响到叶片的氮含量。
| [1] |
程晓建, 黎章矩, 喻卫武, 等. 2007. 榧树的资源分布与生态习性. 浙江林学院学报, 24(4): 383-388.( 1) 1)
|
| [2] |
樊卫国, 葛慧敏, 吴素芳, 等. 2013. 氮素形态及配比对铁核桃苗生长及营养吸收的影响. 林业科学, 49(5):77-84.( 1) 1)
|
| [3] |
胡龙娇, 王康才, 李灿雯. 2013. 氮素形态对半夏植株氮代谢及主要化学成分的影响. 中国中药杂志, 38(13): 2073-2077.( 1) 1)
|
| [4] |
黎章矩, 程晓建, 戴文圣, 等. 2005. 香榧品种起源考证. 浙江林学院学报, 22(4): 443-448.( 1) 1)
|
| [5] |
黎章矩, 程晓建, 戴文圣, 等. 2004. 浙江香榧生产历史、现状与发展. 浙江林学院学报, 21(4): 471-474.( 1) 1)
|
| [6] |
黎章矩, 戴文圣. 2007. 中国香榧. 北京: 科学出版社, 21.( 1) 1)
|
| [7] |
李金玲. 2006.喜树的部分重要营养特性研究. 贵阳:贵州大学硕士学位论文.( 1) 1)
|
| [8] |
李天忠, 张志宏. 2008. 现代果树生物学. 北京: 科学出版社.( 1) 1)
|
| [9] |
李 霞, 阎秀峰, 刘剑锋. 2006. 氮素形态对黄檗幼苗生长及氮代谢相关酶类的影响. 植物学通报, 23(3): 255-261.( 2) 2)
|
| [10] |
孙世芹, 阎秀峰. 2008. 氮素形态对喜树幼苗喜树碱含量及喜树碱代谢相关酶类的影响. 中国中药杂志, 33(13): 1519-1523.( 1) 1)
|
| [11] |
孙世芹, 阎秀峰. 2004. 喜树叶片硝酸还原酶活性的测定方法. 东北林业大学学报, 32(3): 83-84.( 1) 1)
|
| [12] |
汪建飞, 董彩霞, 沈其荣. 2007. 氨素不同形态配比对菠菜体内游离氨基酸含和相关酶活性的影响. 植物营养与肥料学报, 13(4): 664-670.( 1) 1)
|
| [13] |
王康才, 罗庆云. 2009. 氮素形态对菘蓝氮代谢, 光合作用及生长的影响. 34(16): 2039-2042.( 1) 1)
|
| [14] |
肖 凯, 邹定辉. 2000.不同形态氮素营养对小麦光合特性的影响. 作物学报, 2000, 26(1): 53-58.( 1) 1)
|
| [15] |
许长蔼.1991.植物体内NO3-可给性对硝酸还原酶活性的调节.植物生理学通讯,27:173-177.( 1) 1)
|
| [16] |
晏枫霞, 王康才, 罗庆云, 等. 2009. 氮素形态对菘蓝氮代谢, 光合作用及生长的影响. 中国中药杂志, 34(16): 2039-2042.( 1) 1)
|
| [17] |
张福锁, 樊小林, 李晓林. 1995. 土壤与植物营养研究新动态.2卷. 北京: 中国农业出版社, 42-69.( 1) 1)
|
| [18] |
张彦东, 白尚斌. 2003. 氮素形态对树木养分吸收和生长的影响. 应用生态学报, 14(11): 2044-2048.( 1) 1)
|
| [19] |
张彦东, 范志强, 王庆成, 等. 2000. 不同形态 N 素对水曲柳幼苗生长的影响 应用生态学报, 11(5): 665-667.( 1) 1)
|
| [20] | 张振贤, 赵德婉, 梁书华. 1993. 大白菜矿质营养吸收与分配规律研究. 园艺学报, 20(2): 150-154. |
| [21] | 中国科学院上海生命科学研究院, 上海市植物生理学会. 1999. 现代植物生理学试验指南 (1版). 北京:科学出版社, 138-140,156-158. |
| [22] |
邹文桐, 李海珍, 林文娇, 等. 2011. 氮素水平对宽杆芥菜幼苗生长及酶活性的影响. 安徽农业大学学报, 38(6): 952-956.( 1) 1)
|
| [23] |
Abuzinadah R A,Read D J. 1989. The role of proteins in the nitrogen nutrition of Ectomycorrhizal Plants IV.The utilization of peptides by birch (Betula pendula L.) infected with different mycorrhizal fungi.New Phytol, 112: 55-60.( 1) 1)
|
| [24] |
Andrews M. 1986. The partitioning of nitrate assimilation between root and shoot of higher plants. Plant, Cell & Environment, 9(7): 511-519.( 1) 1)
|
| [25] |
Arnon D I. 1938. Microelements in culture-solution experiments with higher plants. American Journal of Botany, 322-325.( 1) 1)
|
| [26] | Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72(1): 248-254. |
| [27] |
Britto D T, Kronzucker H J. 2002. NH4+ toxicity in higher plants: a critical review. Journal of Plant Physiology, 159(6): 567-584.( 1) 1)
|
| [28] |
Engels C, Marschner H. 1993. Influence of the form of nitrogen supply on root uptake and translocation of cations in the xylem exudate of maize (Zea mays L). Journal of Experimental Botany, 44(11): 1695-1701.( 1) 1)
|
| [29] | Gerendás J, Zhu Z, Bendixen R, et al. 1997. Physiological and biochemical processes related to ammonium toxicity in higher plants. Zeitschrift für Pflanzenernährung und Bodenkunde, 160(2): 239-251. |
| [30] |
Gojon A, Plassard C, Bussi C. 1994. Root/Shoot distribution of NO3- assimilation in herbaceous and woody species.//Roy J, Garnier E.A whole plant perspective on carbon-nitrogen interactions. SPB Academic Publishing, 131-147.( 1) 1)
|
| [31] |
Jampeetong A, Brix H. 2009. Nitrogen nutrition of Salvinia natans: Effects of inorganic nitrogen form on growth, morphology, nitrate reductase activity and uptake kinetics of ammonium and nitrate. Aquatic Botany, 90(1): 67-73.( 2) 2)
|
| [32] |
Jampeetong A, Brix H, Kantawanichkul S. 2012. Effects of inorganic nitrogen forms on growth, morphology, nitrogen uptake capacity and nutrient allocation of four tropical aquatic macrophytes (Salvinia cucullata, Lpomoea aqnatica, Cyperns involucratus and Vetiveria Zizanioides).Aquatic Botany,97(1):10-16.( 1) 1)
|
| [33] |
Konnerup D, Brix H. 2010. Nitrogen nutrition of Canna indica: Effects of ammonium versus nitrate on growth, biomass allocation, photosynthesis, nitrate reductase activity and N uptake rates. Aquatic Botany, 92(2): 142-148.( 1) 1)
|
| [34] | Marschner H. Functions of mineral nutrients: macronutrients. Mineral Nutrition of Higher Plants, 2: 379-396. |
| [35] |
Miller A J, Cramer M D. 2005. Root nitrogen acquisition and assimilation. Root physiology: from gene to function. Springer Netherlands, 1-36.( 2) 2)
|
| [36] |
Munzarova E, Lorenzen B, Brix H, et al. 2006. Effect of NH4+/NO3- availability on nitrate reductase activity and nitrogen accumulation in wetland helophytes Phragmites australisand Glyceria maxima. Environmental and Experimental Botany, 55(1/2): 49-60.( 1) 1)
|
| [37] |
People M, Gifford R M. 1997.Regulation of the transport of nitrogen and carbonin higher plants//Dennis D T, Turpin D H, Lefebvre D D, et al. (Eds.), Plant Metabolism. Longman Singapore Publishers (Pte) Ltd., London,UK, 525-537.( 1) 1)
|
| [38] |
Piwpuan N, Zhai X, Brix H. 2013. Nitrogen nutrition of Cyperus laevigatus and Phormium tenax: Effects of ammonium versus nitrate on growth, nitrate reductase activity and N uptake kinetics. Aquatic Botany, 106: 42-51.( 1) 1)
|
| [39] |
Rayar, A J, Hai T. 1977. Effect of ammonium on uptake of phosphorus, potassium, calcium and magnesium by intact soybean plants. Plant Soil, 48: 81-87.( 1) 1)
|
| [40] |
Smith W F, Jackson W A, 1998. Nitrogen enhancement of phosphate transport in root of Zea mays L. I.Effect of ammonium and nitrate pretreatment Plant Physiol, 84:1314-1318.( 1) 1)
|
| [41] |
Utriainen J, Holopainen T. 2001. Nitrogen availability modifies the ozone responses of Scots pine seedlings exposed in an open-field system. Tree physiology, 21(16): 1205-1213.( 1) 1)
|
| [42] |
von Wirén N, Gazzarrini S, Frommer W B. 1997. Regulation of mineral nitrogen uptake in plants. Plant and Soil, 196(2): 191-199.( 1) 1)
|
| [43] |
Yao B, Cao J, Zhao C, et al. 2011. Influence of ammonium and nitrate supply on growth, nitrate reductase activity and N-use efficiency in a natural hybrid pine and its parents. Journal of Plant Ecology, 4(4): 275-282.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

