文章信息
- 张超男, 赵西平, 梁芳, 刘高均, 吴珍, 李伟丽
- Zhang Chaonan, Zhao Xiping, Liang Fang, Liu Gaojun, Wu Zhen, Li Weili
- 蒙古栎树冠不同部位树枝的导管特征的变化
- Variations of Vessel Characteristics of Branches in Quercus mongolica Canopy
- 林业科学, 2014, 50(10): 152-157
- Scientia Silvae Sinicae, 2014, 50(10): 152-157.
- DOI: 10.11707/j.1001-7488.20141021
-
文章历史
- 收稿日期:2013-12-10
- 修回日期:2014-04-08
-
作者相关文章
导管是植物体内运输水分的主要管道分子,其尺寸和数量直接影响水分运输的效率和栓塞脆弱性。一般认为,导管直径随年轮年龄的增加呈增加的趋势(石雷等,2008; 黄荣凤等,2005; Lintunen et al.,2010),沿着水分运输路径导管直径逐渐细化(方群等,2013; 范泽鑫等,2005)。导管直径越大,其比导率越大,且在树冠基部往上呈显著降低(范泽鑫等,2005)。多数研究表明,栓塞脆弱性与导管直径呈正相关(Zimmermann,1983; Hacke et al.,2006),也有研究表明栓塞脆弱性与导管直径呈反比(Hacke et al.,2009a; 2009b)。Shinozaki等(1964)提出的管道模型理论认为,树干和树枝具有水分传输的作用。随着树高的增加和年龄的增大,水分传输路径增加,水分运输过程中水力阻力也不断增大(Schulze et al.,1985)。与树干相比,树枝要承受较大的水柱张力以满足枝叶对水分的需求,因此研究树枝内导管特征的变异更有意义。
蒙古栎(Quercus mongolica)为壳斗科(Fagaceae)栎属(Quercus)落叶乔木,广泛分布于寒温带、温带和暖温带,是东北天然次生林的主要组成树种,也是我国主要的用材树种之一。蒙古栎对环境适应能力强,耐贫瘠且具有很强的抗旱性,在全球气候变暖等因素的影响下,蒙古栎地理分布范围有扩大趋势(殷晓洁等,2013; 延晓冬等,2000)。目前,对于蒙古栎木质部的解剖与水分运输机制的关系研究很少(彭海源等,1988)。本文通过对蒙古栎树枝内不同冠层及枝级别间的枝条进行解剖研究,以期探明树冠内导管特征的变异规律,为研究水分在植物体内的运输提供解剖学理论基础。
1 材料与方法 1.1 试验材料于2010年8月,在东北林业大学帽儿山森林生态系统定位研究站选择生长良好、树干通直、枝叶茂盛的7株蒙古栎优势木作为试验材料。试验地地处127°30′—127°34′E,45°20′—45°25′N,海拔300 m; 气候属温带大陆性季风气候,年均温21.6 ℃,年均降水量723 mm,且集中在7—8月,无霜期120~140天,土壤为暗棕壤。
1.2 试验方法每株样木采伐前,在地面测量树冠8个水平方向的投影半径,并计算出平均半径,即冠幅。样木伐倒后,测定并记录胸径、全树高及枝下高(表 1)。将树冠划分冠上、冠中和冠下3层,每层分别选取1个一级枝,在选取的一级枝上再选取1个二级枝,在选取的二级枝上再选取1个三级枝。测量所有样枝的长度和直径,然后将枝和叶分开。从各级样枝上垂直枝干截取2 cm厚圆盘,截取位置以避开节点为原则。
|
|
将圆盘剥去树皮,记录年轮数量。观察导管特征时,由髓心到树皮,取宽1.5 cm、高2 cm的木条,用5%的乙二胺室温软化,莱卡切片机(德国Leica HUTT-SM2010)切片,切片厚度为15 μm(于海鹏等,2008); 以Mshot(MD50)数字成像系统逐年轮拍照,木材解剖测量系统(TDY-5.2)测定导管直径、导管分布密度、导管比量及导管圆度。理论比导率(Ks)(James et al.,2003)及脆性指数(VI)(Carlquist,1977)以导管直径和导管分布密度计算。
$$ {K_s} = \frac{{\pi \rho }}{{128\eta A}}\sum\limits_{i = 1}^n {d_i^4} , $$ 式中: ρ为27 ℃时水密度;η为水黏度;A为视野面积(m2);di为第i个导管的直径(m);n为单位视野内导管总数;Ks为理论比导率(kg·m-1MPa-1s-1)。VI=VAT/FRE,
式中: VAT为导管直径;FRE为导管频率。蒙古栎为典型的环孔材,且早晚材区分明显,文中所测导管各个指标值均为早材导管的数据,导管直径为径、弦向直径的算术平均值。数据采用SPSS13.0进行统计分析,用邓肯氏新复极差检验法比较树枝级别间、冠层间导管解剖特征的差异。导管特征的径向变异采用指数和线性拟合变化趋势。
2 结果与分析 2.1 树枝导管特征随年龄的变化随着树枝年龄的增加,导管直径呈迅速增加的趋势,25年后增加缓慢(图 1j,k,l); 分布密度的变化趋势与导管直径相反,呈降低的趋势,一级、二级枝0~15年迅速减少,之后呈平稳状态(图 1g,h,i); 组织比量先增加,达到一定程度趋于平稳(图 1d,e,f); 圆度在0~10年迅速降低,之后降低缓慢(图 1a,b,c); 脆性指数和理论比导率也增加,20年后上下波动较大(图 1m-r)。除一级枝组织比量外,其余各个级别枝的导管特征与年轮年龄均存在显著的指数函数关系(表 2)。
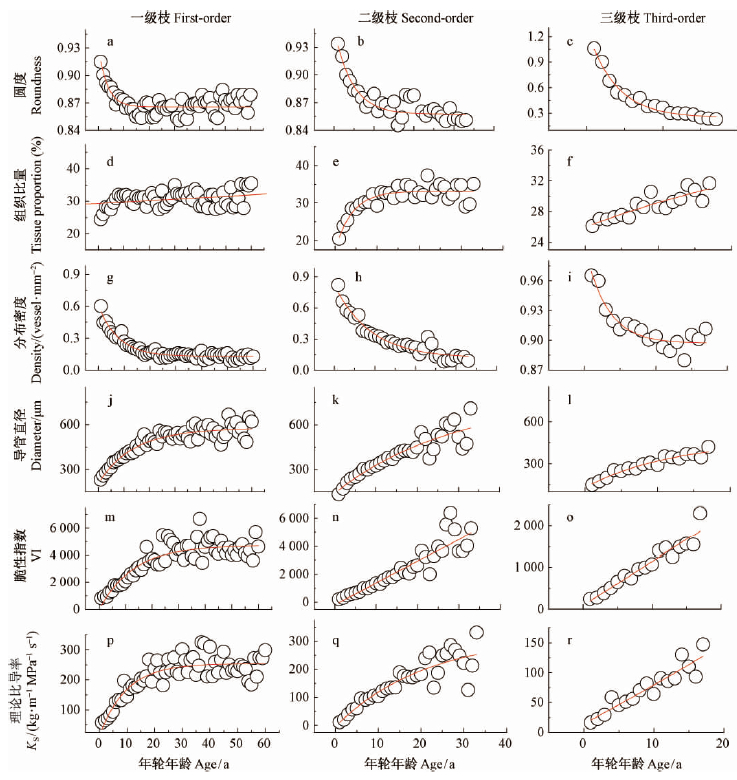 |
图 1 树枝导管特征随年轮年龄的变化 Fig. 1 Variation of vessel in branches with ring age |
|
|
一级、二级枝的导管直径在冠层间的比较为冠下>冠中>冠上,分布密度为冠上>冠中>冠下(图 2),并且,一级枝冠下、冠中和冠上导管直径差异显著,组织比量、圆度的变化趋势同导管直径的变化一致。三级枝的导管直径是冠中>冠下>冠上,分布密度、圆度是冠上>冠下>冠中,导管比量是冠上>冠下>冠中(图 2)。即随着水分运输距离的增加,导管直径减小,分布密度增大,组织比量减少,同时导管的形态越来越偏离圆形。不同枝级别间的导管直径是一级枝显著大于二级、三级枝。分布密度的变化与直径相反。冠下不同枝级别间的组织比量是一级枝>二级枝>三级枝,三级枝与一级枝、二级枝差异显著; 冠中是二级枝>一级枝>三级枝,三级枝与一级枝、二级枝差异显著,冠上的枝级别间差异不显著。导管圆度在冠中、冠上为三级枝>二级枝>一级枝(图 2)。即随着枝级别的增加,导管直径减小,密度增加,导管形态越来越趋于圆形。沿树冠向上,树枝的理论比导率与脆性指数减小。随着枝级别的增加,树木的理论比导率与脆性指数也减小(图 2)。
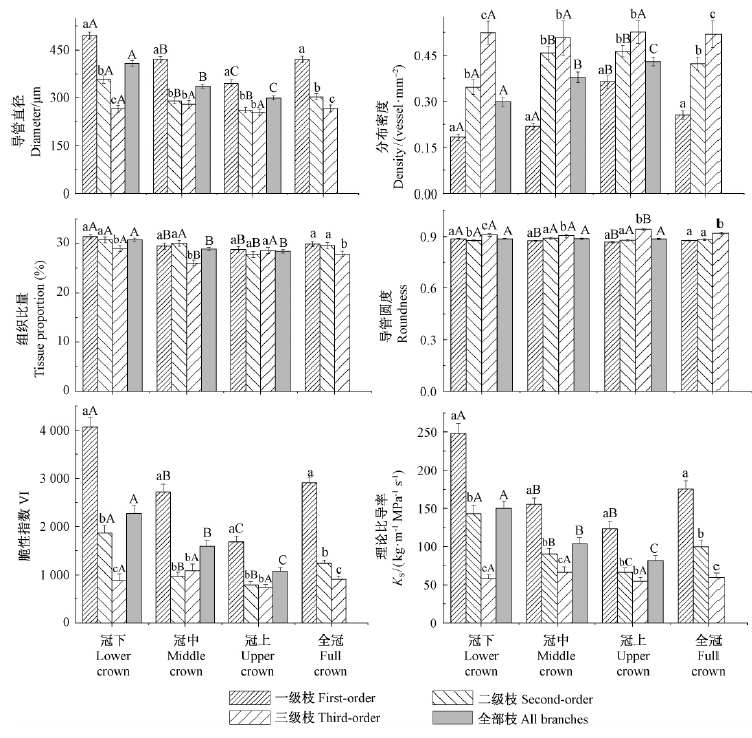 |
图 2 导管特征(y)与年轮年龄(x)的回归分析 Fig. 2 Regression analysis between characteristic parameters of vessel (y) and ring age (x) 多重比较结果用字母表示,字母相同表示在0.05水平上差异不显著。小写字母表示树枝级别间的多重比较结果,大写字母表示冠层之间的多重比较结果。The multiple comparison results represent with letters. The same letters mean no significant difference at 0.05 level. The lowercase letters mean multiple comparison results between branch orders and the capital letters mean multiple comparison results between the canopy layers. |
导管直径与理论比导率、脆性指数具有明显的相关性,随着导管直径增大,理论比导率、脆性指数都增大(图 3),理论比导率和脆性指数呈线性相关关系。
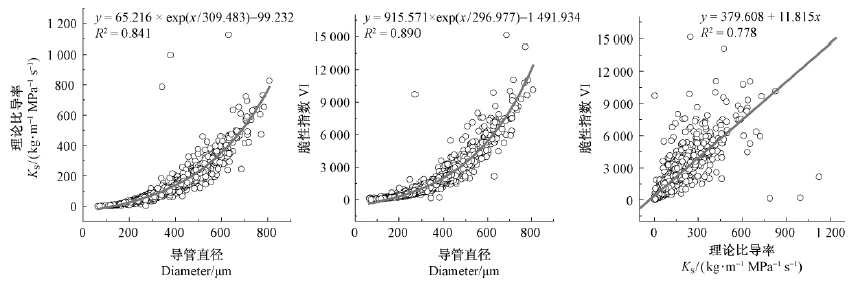 |
图 3 导管直径、脆性指数、理论比导率之间的关系 Fig. 3 The relationship among vessel diameter, theoretical specific hydraulic conductivity (Ks) and vulnerability index (VI) |
随着年轮年龄的增加,蒙古栎树枝的导管直径增大,组织比量增加,分布密度减小,这与前人在其他树种的研究结果(Peterson et al.,2007; 佟达等,2012; 赵西平等,2013)相似。Plomion等(2001)认为导管的尺寸由形成层原始细胞的尺寸决定,随着年轮年龄的增加,形成层变得越来越成熟,形成层原始细胞的尺寸也发生变化。Aloni(2001)认为导管尺寸和数量随年龄的变化与生长素的浓度变化有关,生长素的浓度决定了形成层细胞分化速度的快慢。随着年龄的增加,形成层的生长素浓度降低,分化减慢,产生大而少的导管(Spicer et al.,2001)。
沿树冠向下或者随树枝级别的增加,水分运输的距离增加,导管直径减小,分布密度增大,组织比量略有增加。这是因为从冠上到冠下,距生长素来源(顶端嫩叶或芽)的距离增加,生长素浓度降低,所以形成的导管较大,但数量较少。此外,受光照、风向等微环境的影响,树枝之间存在激烈的生长竞争(Mäkinen et al.,2006)。尽管研究选择的解析木为优势木,但相比较而言,树冠上层的树枝生长空间最充分,而树冠下层的枝叶受上层的遮挡,能接受到的资源和能源有限。在光照不足的情况下,树冠下层的枝叶会生长不良,甚至死亡脱落(赵西平等,2013)。枝、叶的生长情况必将影响导管的形成,进而影响到树枝水分和营养的运输(张显川等,2005)。
导管圆度反映了管孔形成与圆形的偏离程度(于海鹏等,2008)。本文的研究结果显示: 从髓心到树皮,随着导管直径的增加,导管形态越来越偏离圆形,与Sarén等(2001)和Peura等(2008)的研究结果一致。冠层间比较,冠上的导管更趋向于圆形;不同枝级别间,三级枝的导管更趋向于圆形。根据流体力学理论,管孔越趋向于圆形,水分运输效率越高(许荫椿等,2009); 随着水分运输路径的增加,导管直径减小,增加圆度来降低水分运输过程中的阻力可能是树木调节自身结构以适合生长环境的重要措施之一。
年轮年龄和冠层对理论比导率和脆性指数的影响显著,而且理论比导率和脆性指数随年轮年龄或冠层的变化趋势与导管直径相似。随着导管直径的增加,单位面积水分的运输量增加(Lambs et al.,2002),同时也增加了发生栓塞的可能性(Spicer et al.,2001)。
4 结论蒙古栎树枝导管特征在年龄间、冠层间和树枝级别间存在差异,这是内在因素(例如生长素浓度等)和外界环境因素(如日照条件等)共同作用的结果。处于树冠下层的一级老龄枝,导管直径较大,数量较少,水分传导率较高,安全性较低。树枝导管特征在树冠内的空间变异体现了水分传导效率和安全性之间的一种平衡。
| [1] |
范泽鑫,曹坤芬,邹寿青.2005.云南哀牢山6 种常绿阔叶树木质部解剖特征的轴向和径向变化.植物生态学报, 29(6): 968-975.( 1) 1)
|
| [2] |
方 群,章永江,曹坤方.2013.不同冠高腾冲栲叶片结构及其影响因子. 云南大学学报,35(1): 114-120.( 1) 1)
|
| [3] |
黄荣凤,鲍甫成,张冬梅.2005.杨树材性成熟龄模型的建立及树体内幼龄材的分布.林业科学,41(3): 103-109.( 1) 1)
|
| [4] |
彭海源, 陈伯林, 李 坚, 等. 1988.东北重要阔叶树环孔材超微结构研究. 东北林业大学学报, 16(4): 41-54.( 1) 1)
|
| [5] |
石 雷,孙庆丰,邓 疆.2008.引进树种印度黄檀解剖构造变异性质及其化学性质的研究.林业科学研究, 21(2): 212-216.( 1) 1)
|
| [6] |
佟 达,张 燕,宋魁彦.2012.天然林五角枫木材材质径向变异规律初探. 森林工程,28(1): 36-38.( 1) 1)
|
| [7] |
许荫椿, 薛朝阳, 胡德保.2009.水力学: 工程流体力学. 南京: 河海大学出版社,( 1) 1)
|
| [8] |
延晓冬,赵士洞,于振良.2000.中国东北森林生长演替模拟模型及其在全球变化研究中的应用.植物生态学报,24(1): 1-8.( 1) 1)
|
| [9] |
殷晓洁,周广胜,隋兴华,等.2013.蒙古栎地理分布的主导气候因子及其阈值. 生态学报,33(1): 103-109.( 1) 1)
|
| [10] |
于海鹏,刘一星,崔永志,等.2008.基于二值形态学的木材横切面显微构造特征测量.材料科学与工艺, 16(1): 107-111.( 2) 2)
|
| [11] |
张显川,高照全,舒先迂,等. 2005. 苹果开心形树冠不同部位光合与蒸腾能力的研究. 园艺学报,32(6): 975-979.( 1) 1)
|
| [12] |
赵西平,郭平平,张全智. 2013. 白桦枝叶的空间分布及导管特征. 林业科学,49(7): 69-74.( 2) 2)
|
| [13] |
Aloni R.2001.Foliar and axial aspects of vascular differentiation: hypotheses and evidence. Journal of Plant Growth Regulation, 20(1): 22-34.( 1) 1)
|
| [14] |
Carlquist S.1977.Ecological factors in wood evolution: a floristic approach. American Journal of Botany, 64(7): 887-896.( 1) 1)
|
| [15] |
Hacke U G, Jacobsen A L, Pratt R B.2009a.Xylem function of arid-land shrubs from California, USA: an ecological and evolutionary analysis. Plant, Cell & Environment, 32(10): 1324-1333.( 1) 1)
|
| [16] |
Hacke U G, Jansen S.2009b.Embolism resistance of three boreal conifer species varies with pit structure. New Phytologist, 182(3): 675-686.( 1) 1)
|
| [17] |
Hacke U G, Sperry J S, Wheeler J K, et al.2006.Scaling of angiosperm xylem structure with safety and efficiency. Tree Physiology, 26(6): 689-701.( 1) 1)
|
| [18] |
James S A, Meinzer F C, Goldstein G, et al.2003.Axial and radial water transport and internal water storage in tropical forest canopy tree. Oecologia, 134(1): 37-45.( 1) 1)
|
| [19] |
Lambs L, Muller .2002.Sap flow and water transfer in the Garonne River riparian woodland, France: first results on poplar and willow. Annals of Forest Science, 59(3): 301-315.( 1) 1)
|
| [20] |
Lintunen A, Kalliokoski T.2010.The effect of tree architecture on conduit diameter and frequency from small distal roots to branch tips in Betula pendula, Picea abies and Pinus sylvestris. Tree Physiology, 30(11): 1433-1447.( 1) 1)
|
| [21] |
Mäkinen H,Hein S. 2006. Effect of wide spacing on increment and branch properties of young Norway spruce. European Journal of Forest Research, 125(3): 239-248( 1) 1)
|
| [22] |
Peterson M G, Dietterich H R, Lachenbruch B.2007.Do Douglas-fir branches and roots have juvenile wood?. Wood and Fiber Science, 39(4): 651-660.( 1) 1)
|
| [23] |
Peura M, Sarén M P,Laukkanen J, et al.2008.The elemental composition,the microfibril angle distribution and the shape of the cell cross-section in Norway spruce xylem.Trees, 22(4):499-510.( 1) 1)
|
| [24] |
Plomion C, Leprovost G, Stokes A. 2001. Wood formation in trees. Plant Physiology, 127(4): 1513-1523.( 1) 1)
|
| [25] |
Sarén M P, Serimaa R, Andersson S, et al.2001.Structural variation of tracheids in Norway spruce(Picea abies Karst.). J Struct Biol, 136(2):101-109.( 1) 1)
|
| [26] |
Schulze E D, Čermák J, Matyssek R, et al.1985.Canopy transpiration and water fluxes in the xylem of the trunk of Larix and Picea trees: A comparison of xylem flow, porometer and cuvette measurements. Oecologia, 66(4): 475-483.( 1) 1)
|
| [27] |
Shinozaki K, Yoda K, Hozumi K, et al.1964.A quantitative analysis of plant form-the pipe model theory: I. Basic Analyses. 日本生態学会誌, 14(3): 97-105.( 1) 1)
|
| [28] |
Spicer R, Gartner B L.2001.The effects of cambial age and position within the stem on specific conductivity in Douglas-fir (Pseudotsuga menziesii) sapwood. Trees, 15(4): 222-229.( 2) 2)
|
| [29] |
Zimmermann M H. 1983. Xylem structure and the ascent of sap. Berlin: Springer-Verlag.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

