文章信息
- 王进, 安锋, 蔡秀清, 邹智, 张薇, 林位夫
- Wang Jin, An Feng, Cai Xiuqing, Zou Zhi, Zhang Wei, Lin Weifu
- 橡胶树水通道蛋白基因HbPIP1和HbPIP2的功能鉴定及其表达分析
- Functional Characterization and Expression Analysis of Aquaporin Genes (HbPIP1and HbPIP2) in Hevea brasiliensis
- 林业科学, 2014, 50(1): 69-75
- Scientia Silvae Sinicae, 2014, 50(1): 69-75.
- DOI: 10.11707/j.1001-7488.20140111
-
文章历史
- 收稿日期:2013-03-27
- 修回日期:2013-05-22
-
作者相关文章
2. 中国热带农业科学院橡胶研究所 农业部儋州热带作物科学观测试验站 儋州 571737;
3. 澳大利亚迪肯大学先进材料研究院维多利亚 吉朗 3216
2. Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences Danzhou Investigation & Experiment Station of Tropical Crops of Ministry of Agriculture Danzhou 571737;
3. Institute for Frontier Materials, Deakin University Geelong, Victoria, 3216, Australia
乙烯利刺激使橡胶树(Hevea brasiliensis)胶乳稀释可能与橡胶树的水通道蛋白基因表达的变化有关。研究表明,作为液泡膜和质膜上高效、专一的水分跨膜运输通道,植物水通道蛋白在调节植物水分平衡中具有重要作用且其表达和活性受乙烯的调节(Shapiguzov,2004;Jones et al.,2006;Lecourieux et al.,2006;李红梅等,2010;阮想梅等,2009)。因此,乙烯利可能是通过对橡胶树体内水通道蛋白的调节来改变橡胶树体内的水分平衡关系,促进水分等向乳管细胞的运输,促进橡胶树增产。但这方面仅有Tungngoen等(2009)分析了乙烯利刺激后橡胶树PB217水通道蛋白HbTIP1;1和HbPIP2;1的表达量变化,研究结果仅局限于未开割树和部分水通道蛋白,对水通道蛋白与橡胶树乳管膨压、排胶速度、排胶面积、排胶时间等之间的关系仅是一种推测,而且关于水通道蛋白的表达量是否在不同橡胶树品种上具有差异等也尚未涉及。有鉴于此,本研究对本小组前期从橡胶树上克隆的2个水通道蛋白基因HbPIP1和HbPIP2(庄海燕等,2010)进行功能鉴定,选择对乙烯利刺激较为敏感的橡胶树品种PR107为研究对象,对乙烯利刺激后这2个基因的表达进行分析,同时观测乙烯利刺激后排胶体积、排胶时间、干含和总固形物变化,从水通道蛋白表达对韧皮部水分转运角度进一步分析了乙烯利刺激对胶乳的稀释作用,以完善乙烯利刺激割胶理论及技术。
1 材料与方法 1.1 研究材料水通道蛋白基因的组织特异性表达研究以橡胶树PR107组培幼苗为对象(由本所国家橡胶育种中心提供)。于清晨采集,采集时先用灭菌水清洗材料,再用RNase-free ddH2O洗净的刀片切下相应组织,-80 ℃保存备用,提取RNA并进行水通道蛋白基因的表达量检测。
乙烯利刺激对水通道蛋白基因表达量的影响研究以对乙烯利刺激敏感的PR107为对象。材料种植在中国热带农业科学院实验农场三队,为已开割4割龄未刺激的橡胶树,割制为S1/2 d3,所选树木生长势、树围和产量相近。采样前分别于割胶前3,6,16,24,40 h在割线上方5 cm割面上涂1 g左右的2.5%乙烯利(稀释于1%的羧甲基纤维素钠),对照(CK)则是在割胶24 h前用与涂抹乙烯利相同的方法涂抹1 g左右的1%羧甲基纤维素钠,每个处理4株树,处理后由同一胶工割胶,弃前5滴胶乳,利用液氮保存割下的树皮和前40 min胶乳,供水通道蛋白的表达分析。另外,在第1次处理割胶的2个月后用同样方法对同一胶树进行处理并割胶,测定胶乳干含、排胶量等相关指标。
1.2 方法 1.2.1 水通道蛋白基因的功能鉴定参照黄昊等(1998)和Tungngoen等(2009)的方法,分别利用引物上游5’-GTACAGATCTATGGAGGGCAAGGAAGAGGA-3’、下游5’-GTACAGATCTTTAGGCCCTGGCCTTGAAA- 3’(HbPIP1)和上游5’-GTACAGATCTATGGCTAAGGAAGTGAGTGAAGAA-3’、下游5’-GTACAGATCTTTAGTTGGTGGGGTTGCTGC-3’(HbPIP2)扩增HbPIP1和HbPIP2编码区全长并在其两端加入BglⅡ酶切位点。在回收并测序验证后将其连接到以相同酶酶切回收的非洲爪蟾(Xenopus laevis)卵母细胞表达载体pXβG-ev1(Tungngoen et al.,2009;Horie et al.,2011)(由Tomoaki Horie博士惠赠)上,提取质粒并进行线性化。然后,利用mMESSEGEmMACHINE T3体外转录试剂盒(Ambion)进行体外转录得到加帽的cRNA。
用微量注射法分别向非洲爪蟾卵母细胞中注射50 ng的cRNA或RNase-free ddH2O溶液。20 ℃下在Barth溶液中保育24 h后,将卵母细胞转入1/5的Barth溶液,在倒置显微镜下按照20 s的间隔观测记录细胞体积的变化4 min或直至细胞胀裂。试验以注射HbPIP2;1 cRNA为阳性对照,以注射RNase-free ddH2O为阴性对照。同时,在测定水导度(Pf)前将拟测定的卵母细胞在含有0.3mmol·L-1 HgCl2的Barth溶液中浸泡处理10 min,观测HgCl2是否对橡胶树水通道蛋白活性具有抑制作用。注射相应水通道蛋白的卵母细胞的水导度Pf的计算公式: Pf=V0×[d(V/V0)/dt]/[S×Vw×(OSMin-OSMout)],式中,V0是细胞初始体积,V为细胞膨胀后的体积,t为时间,S为细胞初始表面积,Vw是水的摩尔体积,OSMout和OSMin分别是细胞外渗透势(约400 mOsmol·kg-1)和细胞内渗透势(约200mOsmol·kg-1)。相对体积通过V/V0=(a×b)3/2/(a0×b0)3/2计算,式中,a,a0和b,b0分别为特定时间和初始时卵母细胞动植物极间的直径(a)和动植物极界线处的直径(b)。
1.2.2 RT-qPCR分析胶乳RNA的提取参照Tang等(2007)的方法,RNA经过DNA酶处理纯化后,检测OD260/280在1.8~2.0之间后,用以下体系进行逆转录反应: 4 μL 5×PrimeScript Buffer,1 μLOligo dT Primer(50 μmol·L-1),1 μL R and om 6 mers(50 μmol·L-1),1 μL PrimeScript RT Enzyme Mix,1 μg总RNA,加RNase-free ddH2O至20 μL,37 ℃反应15 min后,85 ℃加热5 s,得到cDNA。然后利用荧光定量PCR仪(Real-time Thermal Cycler 5100,Thermo Fisher Scientific)分析水通道蛋白基因在转录水平的差异。荧光定量PCR的反应体系如下: 5 μLSYBR Premix Ex Taq II(2×),0.15 μL Primer F(10 μmol·L-1),0.15 μL Primer R(10 μmol·L-1),1 μL cDNA和3.7 μL RNase-free ddH2O。反应条件: 95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环。引物由Takara公司负责合成,HbPIP1基因引物:上游5’-ATCAACCCAGCAGTGACCTTT-3’,下游5’-AACCTTTTACCACCCCAGCA-3’。另外,选择不受乙烯利调控的YLS8作为内参基因(Li et al.,2011),引物:上游5’-GGGCTCTCAAGGACAAGCAA-3’,下游5’-GGAGCAATAACCAAACCACGA-3’。
1.2.3 Western blot分析参照传统的TCA-丙酮沉淀法(Damerval et al.,1986),并参考徐智娟等(2010)改进的适合胶乳全蛋白提取的方法提取胶乳总蛋白。不同浓度的标准牛血清蛋白溶液和所提取的蛋白溶液分别取100 μL加入10 mL离心管中,每个离心管中加入5 mL Dye reagent 1×quick startBradford,待Bradford与蛋白液充分反应后,测定其在595 nm波长下OD值,绘制标准曲线,计算蛋白浓度;制备12%分离胶及5%浓缩胶(郑亚军等,2008),根据所测得的蛋白浓度,将所有提取的蛋白稀释成相同的浓度,吸取适量的体积与相同体积的2×凝胶加样缓冲液混均,100 ℃加热10 min,点样,以恒流20 mA进行电泳。电泳结束后1块胶R-250染色,脱色,拍照;另1块胶通过半干转膜仪,将SDS-PAGE电泳的蛋白质转至PVDF膜上。将封闭后的PVDF膜与一抗(1 : 200)4 ℃过夜孵育,洗涤;与二抗(1: 2 000)常温下孵育1 h,洗涤,用HRP-DAB试剂盒在室温下染色,显色后拍照。一抗是羊抗兔HbPIP1和HbPIP2水通道蛋白多克隆抗体(HbPIP1:QPIGTSAQTDKDYKC;HbPIP2:CATDPKRSARD SHVP。由北京金斯瑞生物技术有限公司合成)和REF多克隆抗体(由王旭初博士惠赠);二抗为辣根过氧化物酶标记羊抗兔抗体(Pierce,Thermo Scientific,USA)。
1.2.4 干含和总固形物的测定胶乳干含和总固形物的测定参照杨华庚(2010)的方法测定。
2 结果与分析 2.1 HbPIP1和HbPIP2的功能鉴定由图 1和图 2可以看出,注入阳性对照HbPIP2;1 cRNA后非洲爪蟾卵母细胞的水导度(Pf)为2.206×10-2 cm·s-1,极显著高于注射RNase-free ddH2O的阴性对照,是其近5倍;卵母细胞在含0.3 mmol·L-1 HgCl2的Barth溶液中处理10min后其水导度(Pf)为0.448×10-2 cm·s-1,极显著低于未用HgCl2处理的卵母细胞,且与阴性对照不存在显著性差异;阴性对照的卵母细胞其水导度没有明显变化。
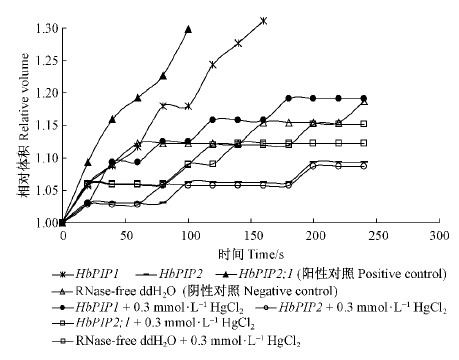 |
图 1 非洲爪蟾卵母细胞表达HbPIP1和HbPIP2后细胞体积的变化
Fig. 1 Change in cell volume of X. laevis oocytes
expressing HbPIP1 and HbPIP2 cRNA
|
 |
图 2 水导度(Pf)的差异显著性分析
Fig. 2 Analysis of significant difference of water permeability(Pf)
“Normal”表示普通测定组的非洲爪蟾卵母细胞Pf,“HgCl2”表示0.3 mmol·L-1 HgCl2 处理组非洲爪蟾卵母细胞的Pf。小写字母显示各个处理在5% 水平上的差异,大写字母表示各个处理在1% 水平上的差异。下同。“Normal”represents the X. laevis
oocyte Pf was measured directly, while “HgCl2 ”indicates the X. laevis oocytes were treated in the Barth solution containing
0. 3 mmol·L-1 HgCl2 for 10 min before the Pf measurements. The little case and capital case letters signify the ANOVA comparison
results at 5% and 1% level,respectively. The same below. |
注射HbPIP1 cRNA后非洲爪蟾卵母细胞水导度(Pf)为1.343×10-2 cm·s-1,极显著高于阴性对照,是其3倍多,稍低于阳性对照;然而,注射HbPIP1 cRNA的非洲爪蟾卵母细胞在含0.3mmol·L-1 HgCl2的Barth溶液中处理10 min后其水导度(Pf)为0.526×10-2 cm·s-1,极显著低于未处理细胞且与注射RNase-free ddH2O的阴性对照水导度相似。说明HbPIP1具有促进细胞水分传输的功能而且其活性可以被HgCl2抑制。
注射HbPIP2 cRNA的非洲爪蟾卵母细胞水导度(Pf)为0.291×10-2 cm·s-1,无论测定前是否用0.3 mmol·L-1 HgCl2处理,其水导度均与阴性对照不存在显著性差异且显著低于阳性对照,说明HbPIP2不具有促进水分运输的功能。
2.2 HbPIP1在橡胶树不同组织中的表达分析HbPIP1在不同组织中的表达量差异如表 1。从表 1可以看出,HbPIP1在胶乳、树皮和次生木质部的表达要高于各个时期的叶柄和叶片。
|
|
在乙烯利刺激后,PR107胶乳HbPIP1基因表达量随刺激时间的延后呈先升后降,但明显高于对照。其中3 h时表达量高达对照的7.59倍,之后略有下调,在6 h时还显著高于对照,但在16 h后,其表达量虽稍高于对照,但与对照差异不显著(表 2)。
|
|
乙烯利刺激后不同时间胶乳中HbPIP1蛋白的转膜结果、灰度值分析和全蛋白SDS-PAGE电泳结果分别如图 3、图 4和图 5。分析灰度值变化,橡胶树PR107在乙烯利刺激后6 h HbPIP1蛋白在胶乳中的表达有所上调,在16 h处略有降低后直至40 h一直处于上升趋势。与转录水平相比,翻译水平HbPIP1表达量上调时间滞后3 h;转录水平HbPIP1表达量一直高于对照,而翻译水平在3 h和16 h低于对照。
 |
图 3 乙烯利刺激后不同时间胶乳中HbPIP1的Western blot结果
Fig. 3 Western blotting of HbPIP1 in latex after
Ethrel stimulation
M: 蛋白预染marker Prestained protein marker; 1-6: CK,
3 h,6 h,16 h,24 h,40 h. |
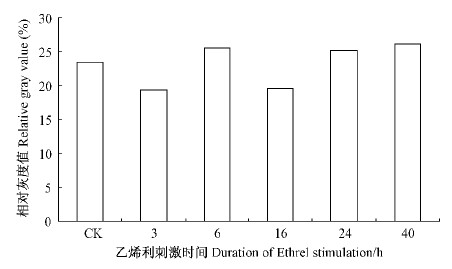 |
图 4 乙烯利刺激不同时间后胶乳中HbPIP1蛋白的Western blot 结果的相对灰度值变化
Fig. 4 The variation of HbPIP1 protein grey value in
latex after Ethrel stimulation
|
 |
图 5 胶乳全蛋白SDS-PAGE电泳
Fig. 5 SDS-PAGE electrophoresis of total protein of
latex of H. brasiliensis
M: 蛋白预染marker Prestained protein marker; 1-6: 0 h
( CK),3 h,6 h,16 h,24 h,40 h. |
由表 3可以看出,乙烯利刺激后,PR107树皮HbPIP1在转录水平的表达量出现波动变化。在24 h之前,树皮HbPIP1的表达一直低于对照,尤其在3 h和6 h树皮HbPIP1的表达量显著低于对照,但在40 h时出现跃升,显著高于对照。
|
|
乙烯利刺激后不同时间取样的树皮中HbPIP1蛋白的转膜结果和灰度值分析结果分别见图 6和图 7。从图 6和图 7中可以看出,在翻译水平,乙烯利刺激后6 h,树皮HbPIP1表达量开始下调,在6 h达到最低,之后逐渐上调,在24 h之后直至40 h都略微地高于对照。与转录水平相比,翻译水平树皮HbPIP1的表达量下调要滞后3 h,之后16~40 h树皮HbPIP1的表达量变化与转录水平相似,只是在24~40 h树皮HbPIP1的表达量上调的幅度要明显小于转录水平。
 |
图 6 乙烯利刺激后不同时间树皮中HbPIP1的Western blot结果
Fig. 6 Western blotting of HbPIP1 in bark
after Ethrel stimulation
|
 |
图 7 乙烯利刺激不同时间后树皮中HbPIP1蛋白的Western blot结果的相对灰度值变化
Fig. 7 The variation of HbPIP1 protein grey
value in bark after Ethrel stimulation
|
总固形物含量(TSC)是指鲜胶乳中所有固形物的质量与鲜胶乳质量的百分比。其中的干含(DRC)即胶乳中干胶的含量,一般占TSC的90%以上。乙烯利刺激后不同时间割胶的胶乳干含和总固形物含量(图 8)总体上呈下降趋势,在乙烯利刺激后24 h和40 h胶乳干含和总固形物显著低于对照。乙烯利刺激后不同时间割胶的排胶体积和排胶时间变化如图 9。从图 9中可以看出,在乙烯利刺激后,随着割胶时间的后延,排胶体积总体呈上升趋势,在刺激后3~6 h割胶的增幅较大,不同时段的排胶体积都明显大于对照,其中刺激后16~40 h割胶的排胶量显著地高于对照。乙烯利刺激后,随着割胶时间的后延,排胶时间呈增长趋势,刺激后40 h割胶的排胶时间长达299 min,显著高于对照。这表明,乙烯利刺激稀释了胶乳,延长了排胶时间。
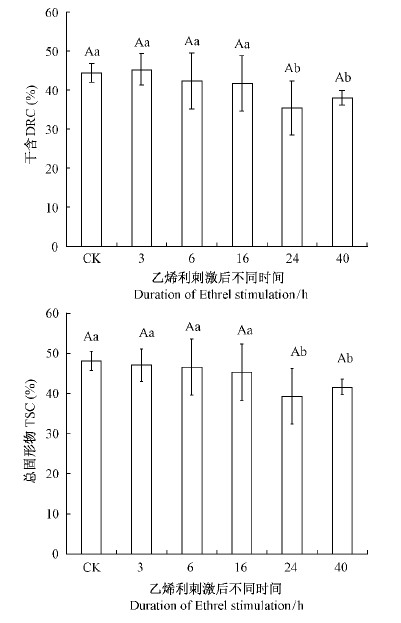 |
图 8 乙烯利刺激后不同时间割胶胶乳的干含和总固形物变化
Fig. 8 The change of dry rubber content (DRC) and total
solids content (TSC) of latex after Ethrel stimulation
|
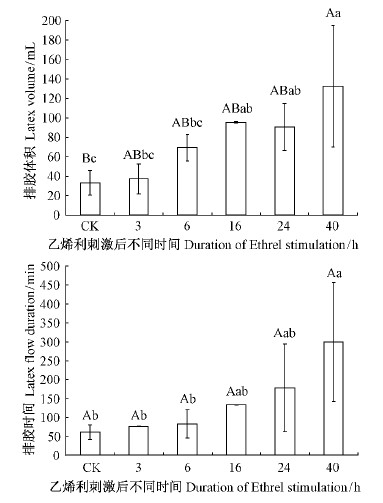 |
图 9 乙烯利刺激后不同时间橡胶树排胶时间和排胶体积的变化
Fig. 9 The change of latex flow duration and latex
volume after Ethrel stimulation
|
本研究发现HbPIP1具有水通道蛋白的活性,而HbPIP2不具备水通道蛋白的活性。研究认为PIP2s主要起到水分运输的作用,但也存在不具备水分运输功能的现象(Fetter et al.,2004;Maurel et al.,2008)。不具有水通道蛋白的活性并不代表HbPIP2对橡胶树韧皮部水分调节没有任何作用,Hill等(2004)认为许多水通道蛋白的功能是作为渗透或膨压传感器,这一说法可以解释许多水通道蛋白没有水分运输功能的原因。HbPIP1基因在橡胶树韧皮部和木质部中高度表达,说明其在韧皮部和木质部的水分调节中发挥着重要作用,而HbPIP2基因可能就是通过调节乳管的渗透和膨压来影响乳管乃至韧皮部的水分代谢,这有待于进一步的研究。
乙烯利刺激通过调控乳管中HbPIP1基因表达来促进胶乳稀释。关于乙烯利刺激能增加橡胶树的排胶时间和产量的原因,大多认为是乙烯利刺激降低胶乳黄色体破裂指数(Ribaillier,1968;Coupe et al.,1976;李明等,2010),降低二价金属阳离子浓度(Yip et al.,1977),降低树皮汁液凝絮活性(Gomez,1977),扩大胶树排胶影响面(肖再云等,2010)等。Tungngoen等(2009)在橡胶树PB217上克隆2个橡胶树水通道蛋白基因HbTIP1;1和HbPIP2;1,研究发现乳管和韧皮部HbPIP2;1受乙烯利刺激后上调,而且由于乙烯的作用,在乳管中上调的HbTIP1;1却在韧皮部中下调;据此,认为乙烯利促进橡胶树木质部和韧皮部的水分循环是因为橡胶树PB217树皮韧皮部HbPIP2;1的显著上调和HbTIP1;1的显著下调。本研究结果与Tungngoen等(2009)的结果相似,但发现橡胶树PR107在乙烯利刺激后3 h可观测到胶乳HbPIP1的表达大幅上调,而同时干含开始下降,之后HbPIP1表达量虽有所下降但至40 h内仍显著高于对照;在24~40 h干含显著下降,排胶体积也随着增加,在40 h排胶体积为对照的4倍,排胶时间为对照的5倍。因此乙烯利刺激不但稀释胶乳,而且延长排胶时间,从而增加了排胶总量。
综上所述,橡胶树HbPIP1具有水通道蛋白的活性,而HbPIP2不具备水通道蛋白的活性,但它可能通过调节乳管的渗透和膨压来影响乳管乃至韧皮部的水分代谢。HbPIP1基因在胶乳、树皮和次生木质部的表达高于各个时期的叶柄和叶片。乙烯利刺激后3 h可观测到胶乳HbPIP1的表达大幅上调,之后表达量下降但至40 h其表达量仍显著高于对照,说明乙烯利刺激可使水通道蛋白基因持续大量表达,从而持续降低干含,延长排胶时间。
| [1] |
黄昊,苏维埃.1998.植物水孔蛋白基因PIP1a在爪蟾卵母细胞中的表达和功能测定.植物生理学通讯,34(6):448-450.( 1) 1)
|
| [2] |
李红梅,万小荣,何生根.2010.植物水孔蛋白最新研究进展.生物化学与生物物理进展,37(1): 29-35.( 1) 1)
|
| [3] |
李明,罗世巧,刘实忠.2010.乙烯刺激橡胶树胶乳黄色体蛋白差异初析.热带作物学报,31(3):371-375.( 1) 1)
|
| [4] |
阮想梅,李登弟,李学宝.2009.植物水孔蛋白的功能和调控.植物生理学通讯,45(1):1-7.( 1) 1)
|
| [5] |
肖再云,刘实忠,校现周.2010.橡胶树PR107气刺微割排胶影响面胶乳生理分析.林业科学,46(9):65-72.( 1) 1)
|
| [6] |
徐智娟,袁坤,丁璇,等.2010.橡胶树胶乳全蛋白的提取及双向电泳分析.热带农业科学,30(4):1-4.( 1) 1)
|
| [7] |
杨华庚.2010.橡胶树割胶原理与技术.海口:海南出版社.( 1) 1)
|
| [8] |
郑亚军,李艳,李新菊,等.2008.不同SDS-PAGE分离胶浓度下椰子贮藏蛋白质亚基的分离效果.中国农学通报,24(9):452-456.( 1) 1)
|
| [9] |
庄海燕,安锋,何哲,等.2010.巴西橡胶树水通道蛋白基因cDNA的克隆及序列分析.西北植物学报,30(5):861-868.( 1) 1)
|
| [10] |
Coupe M,Lambert C,D'Auzac J.1976.Etude comparative des polyribosomes du latex d'Hevea sous l'action de l'ethrel et d'autres produits augmentant l'ecoulement du latex.Physiol Veg,(14):391-406.( 1) 1)
|
| [11] |
Damerval C,Dervienne D,Zivy M,et al.1986.Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat seedlings proteins.Electrophoresis,7(1):52-54.( 1) 1)
|
| [12] |
Fetter K,Van Wilder V,Moshelion M,et al.2004.Interactions between plasma membrane aquaporins modulate their water channel activity.The Plant Cell,(16):215-228.( 1) 1)
|
| [13] |
Gomez J B.1977.Demonstration of latex coagulants in bark extracts of Hevea and their possible role in latex flow.J Rubb Res Inst Malaysia,25(3):109-119.( 1) 1)
|
| [14] |
Hill A E,Shachar-Hill B,Shachar-Hill Y.2004.What are aquaporins for?.J Membr Biol,197(1): 1-32.( 1) 1)
|
| [15] |
Horie T,Kaneko T,Sugimoto G.2011.Mechanisms of water transport mediated by PIP aquaporins and their regulation via phosphorylation events under salinity stress in barley roots.Plant and Cell Physiology,52(4):663 -675.( 1) 1)
|
| [16] |
Jones J D,Dangl J L.2006.The plant immune system.Nature,444(7117): 323-329.( 1) 1)
|
| [17] |
Lecourieux D,Ranjeva R,Pugin A.2006.Calcium in plant defence-signalling pathways.New Phytologist,171(2): 249-269.( 1) 1)
|
| [18] |
Li H,Qin Y,Xiao X,et al.2011.Screening of valid reference genes for real-time RT-PCR data normalization in Hevea brasiliensis and expression validation of a sucrose transporter gene HbSUT 3.Plant Sci,181(2): 132-139.( 1) 1)
|
| [19] |
Maurel C,Verdoucq L,Luu D T,et al.2008.Plant aquaporins: membrane channels with multiple integrated functions.Annual Review of Plant Biology,(59): 595-624.( 1) 1)
|
| [20] |
Ribaillier D.1968.Action in vitro de certain ions mine raux et composes organiques surla stabilite des lutoids du latex d'Hevea.Rev Gen Caout Plast,45(12): 1395-1398.( 1) 1)
|
| [21] |
Shapiguzov A Y.2004.Aquaporins: structure,systematics,and regulatory features.Russian Journal of Plant Physiology,51(1):127-137.( 1) 1)
|
| [22] |
Tang C R,Qi J Y,Li H P,et al.2007.A convenient and efficient protocol for isolating high-quality RNA from latex of Hevea brasiliensis(para rubber tree).Journal of Biochemical and Biophysical Methods,70(5): 749-754.( 1) 1)
|
| [23] | Tungngoen K,Soulaiman S,Kongsawadworakul P,et al.2006.Aquaporin genes expression in the trunk phloem and in the laticifers of rubber tree.Ho Chi Minh City,Vietnam: IRRDB Annual Meeting and Conference. |
| [24] |
Tungngoen K,Kongsawadworakul P,Viboonjun U,et al.2009.Involvement of HbPIP2;1 and HbTIP1;1 aquaporins in ethylene stimulation of latex yield,through regulation of water exchanges between inner liber and latex cells in Hevea brasiliensis.Plant Physiology,151(2): 843-856.( 5) 5)
|
| [25] |
Yip E,Chin H C.1977.Latex flow studies: Distribution of metallic ions between phase of Hevea latex and effect of yield stimulation on the distribution.J Rubb Res lnst Malaysia,25(1):31-49.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

