文章信息
- 宰学明, 郝振萍, 赵辉, 钦佩
- Zai Xueming, Hao Zhenping, Zhao Hui, Qin Pei
- 丛枝菌根化滨梅苗的根际微生态环境
- Rhizospheric Niche of Beach Plum Seedlings Colonized by Arbuscular Mycorrhizal Fungi
- 林业科学, 2014, 50(1): 41-48
- Scientia Silvae Sinicae, 2014, 50(1): 41-48.
- DOI: 10.11707/j.1001-7488.20140107
-
文章历史
- 收稿日期:2013-05-20
- 修回日期:2013-10-09
-
作者相关文章
2. 南京大学生命科学学院 南京 210093
2. College of Life Science, Nanjing University Nanjing 210093
土壤微生物群落是土壤生物特性的重要组分,控制着土壤生态系统功能的关键过程,是土壤质量状况的重要而敏感的表征指标(郭欢等,2013)。丛枝菌根(arbuscular mycorrhizae,AM)真菌是一类能与地球上80%的陆生维管植物形成共生体的土壤真菌,与土壤中其他微生物类群及土壤的理化性质密切相关,是维持植物多样性和生态系统功能的一个重要因子(张涛等,2012;Saldajeno et al.,2012;Bainard et al.,2013)。植物根围AM真菌物种多样性丰富,具有明显空间异质性,并与土壤pH值、碳氮比及酶活性等土壤因子关系密切(贺学礼等,2012;王卫霞等,2013;Moe,2013)。AM菌根结构的形成有利于根际土壤磷酸酶、脲酶、蛋白酶活性的提高,各种土壤酶活性的增加幅度与宿主的菌根侵染率呈显著相关(袁丽环等,2010;Zhang et al.,2011)。但也有报道显示,AM真菌侵染对宿主根际土壤磷酸酶的活性无显著影响(Joner et al.,1995;高辉等,2007)。AM真菌与土壤微生态的关系及其对宿主植物的影响等问题日益受到菌根研究者的关注,如何正确认识和评价这三者的关系,特别是AM真菌对根际微生态的影响,进而对宿主植物产生作用的结果和机制,是近年来菌根研究的热点问题。
滨梅(Prunus maritima)系蔷薇科(Rosaceae)李属(Prunus)多年生特色林果,原产于美国东北部大西洋沿岸。滨梅集鲜果、医药和观赏价值于一身,具有耐盐、耐旱、耐贫瘠等多种特性,具有相当高的生产力和经济价值,适合大面积引种推广(Uva et al.,2007;Zai et al.,2009)。滨梅被引入我国后,主要用于干旱、盐碱等地区的生态修复,并作为该地区特色林果业开发的候选物种之一(Zai et al.,2009;王小敏等,2012)。但由于引种地瘠薄、盐碱含量高等土壤因子的制约,致使定植的滨梅幼苗生长缓慢,耐逆境胁迫的能力较弱,限制了其在我国的引种推广(Zai et al.,2009;2012)。研究表明:引种滨梅的根部能够与多种土著AM真菌形成共生体,接种适宜的AM真菌能显著提高滨梅幼苗的生长(Zai et al.,2009),但对于菌根促生的生态学机制尚不清楚。本文以滨梅为供试材料,通过盆栽接种试验,研究AM真菌对滨梅幼苗根际土壤微区的影响,揭示菌根促生的生态学机制,以期为滨梅在贫瘠、干旱、盐碱等地区的引种提供基础材料。
1 材料与方法 1.1 试验材料与试验设计使用的AM真菌的菌剂是:透光球囊霉(Glomus diaphanum,B)584个孢子/20 mL菌剂(编号BGC GZ01C),从贵州毕节槐树(Sophorajaponica)根际分离,用沸石加河沙扩繁,宿主高粱(Sorghum bicolor);幼套球囊霉(Glomus etunicatum,C)8 318个孢子/20mL菌剂(编号BGC SC01C),从四川奉节丝瓜(Luffa cylindrica)根际分离,用沸石加河沙扩繁,宿主高粱;摩西球囊霉(Glomus mosseae,A)1 285个孢子/20 mL菌剂(编号BGC JX01),从江西桂花树(Osmanthus fragrans)根际分离,用沸石加河沙扩繁,宿主高粱。上述菌剂购自北京市农林科学院植物营养与资源研究所。
供试滨梅的种子由美国特拉华大学友情赠送。按方逵等(2006)的方法培育出组培苗,盆土移栽15天后,筛选出生长状况一致的苗木进行AM菌剂接种处理。共设4种处理,每一处理重复30盆。4种处理为接种摩西球囊霉、透光球囊霉、幼套球囊霉以及未接种(对照,CK)。盆中填满生根介质,将菌剂于盆中介质表面下10 cm均匀撒成一薄层(每盆25 g菌剂)。CK组则加入相同质量经灭菌处理的接种剂(121 ℃,30 min;2次)和10 mL菌种滤液,以保证土壤微生物区系一致。组培苗置于介质中,每一组培苗的根部与接种物接触。盆中基质情况如下:取普通耕作土,添加5%(w/w,下同)草炭、1%河沙和0.5%过磷酸钙改良,拍碎、混匀、过筛、高压灭菌(121 ℃,2 h;2次)后作为栽培基质,含有机质1.35%、速效氮0.048‰(w/w,下同)、速效磷0.0248‰、速效钾0.148‰,pH值7.2。每盆装基质8.5kg(干质量6.45 kg)。盆为底部有排水孔的塑料盆,高25 cm,盆口直径30 cm,置于浅壁托盘上。试验温室条件如下:昼夜温度(28±3)℃/(15±2)℃,相对湿度70%~80%,自然采光;试验开始后每周喷洒Hoagl and 营养液500 mL(每盆),至试验结束。
1.2 试验方法 1.2.1 根际微区土样采集按照Riley等(1969;1970)的方法对处于生长旺盛期的滨梅苗取样。把植株从定植的营养钵中取出,将轻轻抖下的土壤置于已灭菌的培养皿中,该部分土样为非根际土壤;松散黏附在根系表面1~4 mm范围内不能轻轻抖下的土壤为根际土壤;紧密黏附在根系表面、距根面0~2 mm的土壤为根面土壤,用已灭菌的毛刷将其刷下。将以上已取过样的根系浸在纯净水中(换水3~4次),除去根上黏附的外来机械混入物,用无菌水冲洗根部。无菌吸水纸轻轻吸干根部,用已灭菌的剪刀将其剪成3 cm长的小段,置于灭过菌的培养皿中,称取小段根1.0 g,采集根系微生物样品。
1.2.2 生物量、菌根侵染率测定苗木生物量的测定采用烘干法,菌根侵染率的测定参照Phillips等(1970)的方法。2009年3月上旬开始试验,在滨梅30~180天生长期内,每隔10天取鲜根段,以FAA溶液固定,用KOH脱色-酸性品红染色法染色,玻片镜检观察其侵染过程。在滨梅生长180天时,选取10株标准苗木,烘干法测定苗木干质量(65 ℃,48 h),随机取鲜根段100~150条,镜检测定侵染的根段数,计算菌根侵染率:菌根侵染率=(菌根根段数/被检根段数)×100%。
1.2.3 根际、根面、根系微生物数量测定微生物数量的测定采用赵斌等(2002)的方法。真菌数量的测定采用改良PDA法;细菌数量的测定采用牛肉膏蛋白胨培养基法;放线菌数量的测定采用高氏合成一号琼脂培养基基法;固氮菌数量的测定采用根瘤菌琼脂培养基法。以上培养基先经121 ℃灭菌30 min,然后倒平板备用。平板接种后,真菌、放线菌置于25 ℃恒温培养箱中倒置培养,培养5天后统计数目;细菌、固氮菌置于30 ℃恒温培养箱中倒置培养,培养30 h后统计数目。
1.2.4 根际、非根际土壤pH值测定pH值的测定采用电位法,参照GB 7859—87。
1.2.5 根际、非根际土壤养分测定全磷含量的测定采用碱溶-钼锑抗比色法,参照GB 7852—87;有效磷含量的测定采用盐酸浸提-钼锑抗比色法,参照GB 7853—87;全氮含量的测定采用凯式定氮法,参照GB 7848—87;水解氮含量的测定采用碱解-扩散法,参照GB 7849—87。
1.2.6 根际土壤酶活性测定磷酸酶活性的测定参照赵兰坡等(1986)的方法,磷酸酶以每克土壤的酚毫克数表示。根际土壤脲酶活性的测定参照周礼恺(1987)的方法,以每克土壤在37 ℃培养24 h释放出NH3-N的毫克数表示酶活性。根际土壤蛋白酶活性的测定参照周礼恺(1987)的方法,以每克土壤中甘氨酸的毫克数表示NH2-N。
1.3 数据处理数据均采用Microsoft Excel 2003处理,采用SPSS 10.0软件对数据进行单因素方差分析和多重比较。
2 结果与分析 2.1 供试滨梅苗菌根侵染率与生物量由表 1可知,接种组的3种AM真菌都与滨梅苗形成了丛枝菌根结构,但侵染率却有较大差异,CK组未形成菌根结构。3种AM真菌接种处理中,摩西球囊霉组的菌根侵染率最高(45.4%),其次是幼套球囊霉组(41.3%),透光球囊霉组最低(18.6%)。
|
|
AM真菌接种组的生物量与CK组相比均有提高,其中摩西球囊霉组的生物量最大,是CK组的2.59倍(表 1)。3种AM真菌接种处理中,摩西球囊霉组与幼套球囊霉组的苗木生物量没有显著差异(P > 0.05),但它们与透光球囊霉组差异显著(P < 0.05)。滨梅苗生物量的累积与菌根侵染率呈显著正相关(r=0.908 7,P < 0.05)。
2.2 AM真菌对滨梅苗根际微生物的影响如图 1所示,各处理组根际细菌数量的分布有一定的规律性:根面>根系>根际。与CK组相比,AM真菌接种处理组的根际土壤细菌数量变动不大,没有表现出显著差异性(P > 0.05);而根面和根系上的细菌总数随着AM真菌接种处理的不同表现出较大的差异性。摩西球囊霉、幼套球囊霉组的根面、根系细菌数量与CK组差异均显著(P <0.05),而透光球囊霉组的根面、根系上的细菌数量与CK组差异不显著(P > 0.05)。摩西球囊霉组的根面、根系细菌数量最大,分别是CK组的1.91,1.37倍。
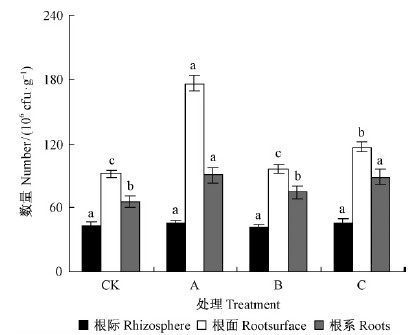 |
图 1 根部细菌数量
Fig. 1 Bacterial number of roots
|
各处理组根系上真菌数量明显比根际、根面真菌数量少(图 2)。AM真菌接种处理组的根际、根系或根面土壤真菌数量变动不大,与CK组无显著差异(P > 0.05),表明AM真菌与滨梅根部区域真菌之间没有相关性。
 |
图 2 根部真菌数量
Fig. 2 Fungi number of roots
|
根面的放线菌数量普遍高于根际和根系的放线菌数量(图 3)。摩西球囊霉、幼套球囊霉组的根面、根系放线菌数量与CK组差异显著(P < 0.05),而透光球囊霉组的与CK组无显著差异(P > 0.05)。摩西球囊霉、幼套球囊霉组的根际放线菌总数分别是CK组的1.98,1.30倍,且与菌根侵染率呈显著正相关(r=0.868 3,P < 0.05),表明AM真菌与滨梅根部区域放线菌之间有着密切的联系。
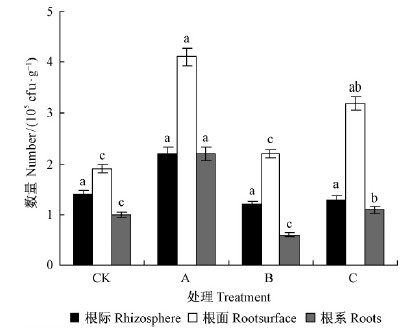 |
图 3 根部放线菌数量
Fig. 3 Actionmyces number of roots
|
如图 4所示,各接种处理组根部固氮菌数量的分布有一定规律性:根面>根际>根系。透光球囊霉组的根面固氮菌数量与CK组无显著差异,而摩西球囊霉、幼套球囊霉组的根面固氮菌数量与CK组差异显著(P < 0.05),摩西球囊霉、幼套球囊霉组的根面固氮菌数量分别是CK组的1.63,1.47倍。
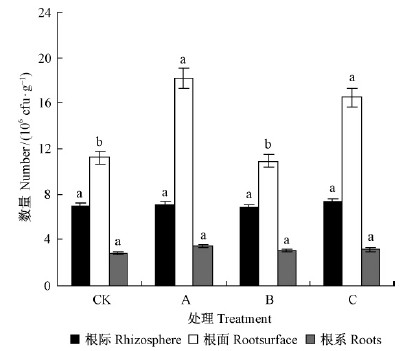 |
图 4 根部固氮菌数量
Fig. 4 Nitrogen-fixing bacteria number of roots
|
综上所述,AM真菌对滨梅苗木根系、根面上的细菌、放线菌、固氮菌类群数量影响较大,而对根际的影响较小。试验结果表明AM真菌接种滨梅的根面是微生物最为活跃的区域。进一步研究认为,接种AM真菌的滨梅根部微生物总量与菌根侵染率呈显著正相关(r=0.783 2,P <0.05)。
如图 5所示,不同接种处理滨梅的根际土壤pH值均比非根际低,其中摩西球囊霉组的根际土壤pH值降低最大(pH值下降0.7),CK组最小(pH值下降0.22);接种组苗木的根际和非根际土壤pH值都比CK组低。根际土壤pH值变化幅度较大,与CK组比,幼套球囊霉组的降低幅度最大(pH值下降0.9),而透光球囊霉组的降低幅度最小(pH值下降0.48);接种处理组的非根际土壤pH值与CK组差异不显著(P > 0.05)。试验结果表明AM真菌接种处理会使滨梅根际土壤的pH值降低,且降低的幅度与菌根侵染率呈显著正相关(r=0.792 4,P <0.05)。
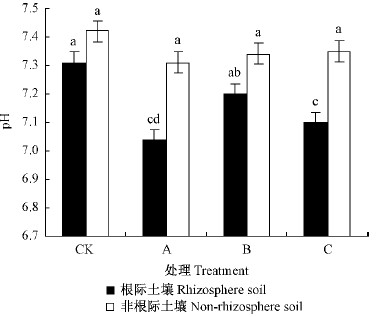 |
图 5 根部pH值
Fig. 5 pH of roots
|
由表 2可知,各接种处理组根际的磷酸酶活性有一定规律性:碱性磷酸酶活性>中性磷酸酶活性>酸性磷酸酶活性。与CK组相比,AM真菌接种组的酸性磷酸酶活性显著增加,而中性磷酸酶活性则无显著变化(P > 0.05);摩西球囊霉、幼套球囊霉组的碱性磷酸酶活性与CK组差异显著(P <0.05)。摩西球囊霉、幼套球囊霉、透光球囊霉组的根际土壤磷酸酶总量分别是CK组的1.36,1.29,1.15倍,土壤磷酸酶活性的增加与菌根侵染率呈极显著正相关(r=0.955,P < 0.01)。
|
|
由表 2可知,摩西球囊霉、幼套球囊霉、透光球囊霉组的根际蛋白酶总量分别是CK组的1.58,1.43,1.10倍,蛋白酶活性的增加与菌根侵染率呈极显著正相关(r=0.974,P < 0.01)。摩西球囊霉、幼套球囊霉、透光球囊霉组的根际脲酶总量分别是CK组的2.31,2.20,1.51倍,土壤脲酶活性的增加与菌根侵染率呈显著正相关(r=0.674,P < 0.05)。
2.5 AM真菌对根际土壤养分的影响如图 6所示,接种处理组的根际非根际土壤全磷量测定结果均比CK组有所降低,但差异不显著(P > 0.05)。接种处理组的根际土壤速效磷含量普遍高于CK组,且侵染率越高速效磷累积越丰富,非根际土壤速效磷含量均比CK组有所降低,其中摩西球囊霉、幼套球囊霉组的降低幅度较大(图 7)。各种处理组滨梅苗无论是全磷还是速效磷都表现出正根际效应。
 |
图 6 根部全磷含量
Fig. 6 Total P content of roots
|
 |
图 7 根部速效磷含量
Fig. 7 Available-P content of roots
|
接种处理组根际土壤全氮量略高于CK 组,但彼此之间差异不显著(P > 0.05); 接种处理组的非根际土壤全氮量略低于CK组,但彼此之间差异不显著(P > 0.05)(图 8)。接种处理组的土壤根际全氮含量的变化与菌根侵染率呈正相关关系(r=0.647,P < 0.05)。摩西球囊霉组和幼套球囊霉组的根际土壤水解氮是分别CK组的1.47,1.17倍,与CK组差异显著(P < 0.05),而透光球囊霉组与CK组差异不显著(P > 0.05)(图 9)。接种处理组的土壤根际水解氮含量与菌根侵染率呈显著正相关(r=0.831,P < 0.05)。各种处理组滨梅苗无论是全氮还是水解氮都表现出明显的正根际效应。
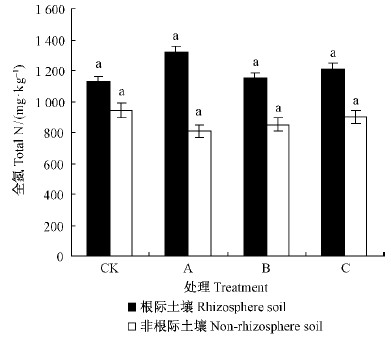 |
图 8 根部全氮含量
Fig. 8 Total N content of roots
|
 |
图 9 根部水解氮含量
Fig. 9 Hydrolysable N content of roots
|
AM真菌侵染能直接或间接影响根部的微生物群落。直接作用包括植物向其他微生物提供丰富的碳水化合物,这些物质通过真菌菌丝转运到微根际;真菌通过分泌抑制或刺激性的物质来调节其他微生物群落对营养的竞争(Manjula et al.,2005;李岩等,2010)。间接作用是通过菌根影响寄主植物的生长、根的分泌物和土壤结构(Manjula et al.,2005;李岩等,2010)。Meyer等(1986)证明了菌根化和非菌根化的玉米(Zea mays)苗的根际和根面存在细菌群落的差异;Secilia等(1987)认为被Glomusfasciculatum,Gigaspora margarita和Sclerocystis dussi侵染的几内亚草(Panicum maximum)根际中的总细菌群落数量比未被侵染的大得多。笔者认为生长于低磷土壤中的菌根植物的菌根可能通过增加氨基酸的分泌来刺激氨基酸依赖型的细菌生长和繁殖。Andrade等(1997)和Nuccio等(2013)认为AM真菌能够更改氮转化微生物的种群数量,且这些均可能影响土壤元素的利用率。Andrade等(1997)检查了与菌根际有联系的细菌和幼套球囊霉、G.intraradices及摩西球囊霉的菌丝际,观察到菌丝际细菌群落的变化本质上不是由AM菌的菌丝量决定,并且提示菌根真菌的种类对菌丝际细菌组成和增殖的作用比土壤中菌丝的数量对细菌群落的影响更为重要。Antunes等(2006)发现AM菌根形成后能在一定程度上强化放线菌与AM真菌生长发育的协同作用。潘超美等(2000)认为玉米菌根形成后,根际土壤中的细菌、放线菌、固氮菌数量显著增加,但真菌数量则略有下降。而本研究显示,接种处理组的根际微生物数量与CK组未产生显著变化,而根面、根系上微生物数量却表现出显著差异,菌根化滨梅苗的根面是微生物最为活跃的区域。这样的结果可能与试验选择的AM真菌种类、寄主植物以及微生物取样方法不同有关。
磷营养胁迫下,有些植物通过根分泌有机酸或微生物呼吸等途径使根际酸化,以降低根际pH值的方式来增加磷素的吸收(Petra et al.,2003;Zhang et al.,2011)。在本研究中,菌根化滨梅苗根际土壤磷素与CK组相比高度富集,而pH值却显著降低。酸化现象的产生不受磷营养胁迫的影响,也与供磷水平无关。笔者认为根际pH值的显著降低主要是AM真菌在促进滨梅苗生长的过程中,根系进行正常呼吸产生的CO2、根分泌的H+和有机酸引起的。
土壤中速效磷多以磷酸盐的状态存在,它们在土壤中的可移动性非常小。由于AM真菌能通过根外菌丝体将非根际土壤中的速效磷向根际运输和传递(Bücking et al.,2005;袁丽环等,2010),致使菌根化滨梅苗的非根际速效磷显著低于根际。土壤有机磷是土壤磷库的重要组分,它需在土壤磷酸酶的酶促作用下才能转化为植物可利用的形态(Tarafdar et al.,1994;Zhang et al.,2011)。本研究表明:菌根化滨梅苗根际土壤磷酸酶活性显著提高,说明AM真菌可能对根际的某个微区内土壤磷酸酶产生了刺激和分泌作用,进而加速了全磷向有机磷的转化,导致根际全磷量减少,速效磷富集,显著提高了植株的磷营养效率。同时,由于滨梅菌根的形成显著提高了各类微生物的数量,AM真菌和一些溶磷细菌的共同作用亦可能在一定程度上促进了植物对磷的吸收和利用(袁丽环等,2010;Nuccio et al.,2013)。
AM真菌根外菌丝体不仅对不同形态氮素(包括无机与有机氮类)的吸收具有较大的选择性,而且在吸收与同化机制或途径等方面也有着明显的差异(Fellbaum et al.,2012)。Manjula等(2005)的研究认为,AM真菌的菌丝能够在土壤有机物斑块中增殖,并将斑块内1/3的有机氮运输至宿主体内。Prikryl等(1980)研究显示,丛枝菌根促进植物的根在生长过程中分泌一些含氮化合物(如氨基酸等)进入土壤中,从而增加根际的含氮量。Azcon等(1982)认为丛枝菌根能促进植物的蒸腾作用,增加植物生长过程中对水分的需要,致使根际被动聚集了大量的离子态氮。本研究表明:滨梅苗菌根结构的形成可增加根际土壤脲酶和蛋白酶的活性,使根际有效态氮的含量提高;同时由于菌根化苗木土壤放线菌和固氮菌数量的增加,增强了苗木根系对空气和土壤中氮素吸收和固定能力,提高了滨梅的氮素营养利用率。
综上所述,AM菌根的形成无论是对滨梅的生长发育,还是对根区微生物的数量以及根区土壤氮、磷营养环境的改善作用都是明显的,不同的AM真菌与滨梅形成菌根所产生的根际效应有所不同。试验的3种AM真菌中,摩西球囊霉、幼套球囊霉根际效应较好。
| [1] |
方逵, 龚津平, 闫道良, 等. 2006. 耐盐果树滨梅微繁殖体系的建立. 南京大学学报:自然科学版, 40(5): 491-498.( 1) 1)
|
| [2] |
高辉, 顾泳洁, 蔡培乾, 等. 2007. 岛屿生境下苦槠丛枝菌根(AM)与根际土壤磷酸酶活性的相关性研究. 生态与农村环境学报, 23 (1): 24-27.( 1) 1)
|
| [3] |
郭欢, 曾广萍, 刘红玲, 等. 2013. 丛枝菌根真菌对红花根围微生物多样性特征的影响. 微生物学通报, 40(7): 1214-1224.( 1) 1)
|
| [4] |
贺学礼, 陈烝, 郭辉娟, 等. 2012. 荒漠柠条锦鸡儿AM真菌多样性. 生态学报, 32(10): 3041-3049.( 1) 1)
|
| [5] |
李岩, 焦惠, 徐丽娟, 等. 2010. AM真菌群落结构与功能研究进展. 生态学报, 30(4): 1089-1096.( 1) 1)
|
| [6] |
潘超美, 郭庆荣, 邱桥姐. 2000. VA 菌根真菌对玉米生长及根际土壤微生态环境的影响. 土壤与环境, 9(4): 304-306.( 1) 1)
|
| [7] |
王卫霞, 史作民, 罗达, 等. 2013. 南亚热带3种人工林土壤微生物生物量和微生物群落结构特征. 应用生态学报, 24(7): 1784-1792.( 1) 1)
|
| [8] |
王小敏, 张春红, 吴文龙, 等. 2012. 开发滨梅作为滩涂和荒地适种的多用途新经济植物. 林业调查规划, 37(2): 73-75.( 1) 1)
|
| [9] |
袁丽环, 闫桂琴. 2010. 丛枝菌根化翅果油树幼苗根际土壤微环境. 植物生态学报, 34(6): 678-686.( 3) 3)
|
| [10] |
张涛, 丁效东, 冯固. 2012. AM真菌对植物群落组成和物种多样性的调控机理. 生态环境学报, 21(12): 2024-2030.( 1) 1)
|
| [11] |
赵斌, 何绍江. 2002. 微生物实验. 北京: 科学出版社, 26-42.( 1) 1)
|
| [12] |
赵兰坡, 姜岩. 1986. 土壤磷酸酶活性测定方法的探讨. 土壤通报, 17(3): 138 -142.( 1) 1)
|
| [13] |
周礼恺. 1987. 土壤酶. 北京: 科学出版社, 11-99.( 1) 1)
|
| [14] |
Andrade G, Mihara K L, Linderman R G, et al. 1997. Bacteria from rhizosphere and hyphosphere soils of different arbuscular-mycorrhizal fungi. Plant and Soil, 192(1): 71-79.( 1) 1)
|
| [15] |
Antunes P M, Rajcan I, Goss M J. 2006. Specific flavonoids as interconnecting signals in the tripartite symbiosis formed by arbuscular mycorrhizal fungi, Bradyrhizobium japonicum (Kirchner) Jordan and soybean (Glycine max (L.) Merr.). Soil Biology and Biochemistry, 38(3): 533-543.( 1) 1)
|
| [16] |
Azcon R, Bone F, Barea J M. 1982. Exocellular phosphatase activity of lavender and wheat roots as affected by phytate and mycorrhiral inoculation//Gianinazzi S, Gianniazzi-Pearson V, Trouvelot A. Les Mycormzes: Biologie et Utilisation. Dijon:INRA, 83-85.( 1) 1)
|
| [17] |
Bainard L D, Koch A M, Gordon A M, et al. 2013. Growth response of crops to soil microbial communities from conventional monocropping and tree-based intercropping systems. Plant and Soil, 363(1/2): 345-356.( 1) 1)
|
| [18] |
Bücking H, Shachar-Hill Y. 2005. Phosphate uptake, transport and transfer by the arbuscular mycorrhizal fungus Glomus intraradices is stimulated by increased carbohydrate availability. New Phytologist, 165(3): 899-912.( 1) 1)
|
| [19] |
Fellbaum C R, Gachomo E W, Beesetty Y, et al. 2012. Carbon availability triggers fungal nitrogen uptake and transport in arbuscular mycorrhizal symbiosis. Proc Natl Acad Sci USA, 109(7): 2666-2671.( 1) 1)
|
| [20] |
Joner E J, Jakobsen I. 1995. Growth and extracellular phosphors activity of AM hyphaeas influenced by soil organic matter. Soil Boil Biochem, 27(9): 1153-1159.( 1) 1)
|
| [21] |
Manjula G, Philip E P, Jin H R, et al. 2005. Nitrogen transfer in the arbuscular mycorrhizal symbiosis. Nature, 435(7043): 819-823.( 2) 2)
|
| [22] |
Meyer J R, Linderman R G. 1986. Selective influence on populations of rhizosphere or rhizoplane bacteria and actinomy-cetes by mycorrhizas formed by Glomus fasciculatum. Soil Biology & Biochemistry, 18(2): 191-196.( 1) 1)
|
| [23] |
Moe L A. 2013. Amino acids in the rhizosphere: From plants to microbes. American Journal of Botany, 100(9): 1692-1705.( 1) 1)
|
| [24] |
Nuccio E E, Hodge A, Pett-Ridge J, et al. 2013. An arbuscular mycorrhizal fungus significantly modifies the soil bacterial community and nitrogen cycling during litter decomposition. Environmental Microbiology, 15(6): 1870-1881.( 2) 2)
|
| [25] |
Petra M, Karen B. 2003. Changes in bacterial community structure induced by mycorrhizal colonisation in split-root maize. Plant and Soil, 251(2): 279-289.( 1) 1)
|
| [26] |
Phillips J M, Haymen D S. 1970. Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid, assessment of infection. Transactions of the British Mycological Society, 55(1): 158-161.( 1) 1)
|
| [27] |
Prikryl Z. 1980. Root exudates of plant. Plant and Soil, 57(1): 69-83.( 1) 1)
|
| [28] |
Riley D, Barhr S A. 1969. Bicarbonate accumulation and pH changes at the soybean root-soil interface. Soil Science Society of America Proceedings, 33(6): 905-908.( 1) 1)
|
| [29] |
Riley D, Barhr S A. 1970. Salt accumulation at the soybean root-soil interface. Soil Science Society of America Proceedings, 34(1): 154-155.( 1) 1)
|
| [30] |
Saldajeno M G B, Ito M, Hyakumachi M. 2012. Interaction between the plant growth-promoting fungus Phoma sp. GS8-2 and the arbuscular mycorrhizal fungus Glomus mosseae: impact on bio-control of soil-borne diseases, microbial population, and plant growth. Aust Plant Pathol, 41(3): 271-281.( 1) 1)
|
| [31] |
Secilia J, Bagyaraj D J. 1987. Bacteria and actinomycetes associated with pot cultures of vesicular arbuscular mycorrhizas. Canadian Journal of Microbiology, 33(12): 1069-1073.( 1) 1)
|
| [32] |
Tarafdar J C, Marschner H. 1994. Phosphatase activity in the rhizosphere and hyphosphere of VA mycorrhizal wheat supplied with inorganic and organic phosphorus. Soil Biology and Biochemistry, 26(3): 387-395.( 1) 1)
|
| [33] |
Uva R H, Whitlow T H. 2007. Cultural methods for beach plum (Prunus maritima) fruit production. Journal-American Pomological Society, 61(1): 3-13.( 1) 1)
|
| [34] |
Zai X M, Qin P, Wan S W, et al. 2009. The application of beach plum (Prunus maritima) to wasteland vegetation recovery in Jiangsu Province, China: Seedling cloning and transplantation. Ecological Engineering, 35 (4): 591-596.( 3) 3)
|
| [35] |
Zai X M, Zhu S N, Qin P, et al. 2012. Effect of Glomus mosseae on chlorophyll content, chlorophyll fluorescence parameters, and chloroplast ultrastructure of beach plum (Prunus maritima) under NaCl stress. Photosynthetica, 50 (3): 323-328.( 1) 1)
|
| [36] |
Zhang H S, Wu X H, Li G, et al. 2011. Interactions between arbuscular mycorrhizal fungi and phosphate-solubilizing fungus (Mortierella sp.) and their effects on Kostelelzkya virginica growth and enzyme activities of rhizosphere and bulk soils at different salinities. Biol Fert Soils, 47(5): 543-554.( 3) 3)
|
 2014, Vol. 50
2014, Vol. 50

