文章信息
- 李如华, 严东辉, 冯小慧, 孙晓明
- Li Ruhua, Yan Donghui, Feng Xiaohui, Sun Xiaoming
- 基于分子可操作分类单元的北京地区杨树内生葡萄座腔菌属真菌多样性
- Diversity of Botryosphaeria spp., as Endophytes in Poplars in Beijing, Based on Molecular Operational Taxonomic Units
- 林业科学, 2014, 50(1): 109-115
- Scientia Silvae Sinicae, 2014, 50(1): 109-115.
- DOI: 10.11707/j.1001-7488.20140117
-
文章历史
- 收稿日期:2013-07-09
- 修回日期:2013-10-14
-
作者相关文章
真菌几乎参与了所有地球生态系统的作用过程,但对其多样性和生态功能的认识还极其缺乏。保守估计地球上真菌有100多万种,而目前命名和描述的只有10万多种(Hibbett et al.,2013 ; Cai et al.,2011 ; Schoch et al.,2012)。传统的分离培养真菌方法和依靠形态特征鉴定的技术方法已经不能适应当今人们对真菌生物多样性及其功能认识的要求,因而依靠分子标记序列建立的分子可操作分类单元对认识微生物多样性将发挥越来越重要的作用,如通过宏基因组学技术,地球上各类环境中的微生物的多样性得以发现和鉴定(Hibbett et al.,2013 ; Buée et al.,2009);但是分子可操作分类单元需要建立在国际公共核酸数据库(NCBI,EMBL,DDBJ)中参考序列的正确性和生物学及生态信息可靠性的基础上(Vrålstad et al.,2011 ; Begerow et al.,2010)。近年来发展起来的 DNA 条形码技术为更好地利用分子可操作分类单元提供了平台。 DNA 条形码旨在利用适用范围最广的共同引物,在环境组织材料靶标物种中全体核酸有效提取以及分子标记序列有效扩增和测序的基础上,利用统一的一段标准化(450 ~ 800 bp)长度的分子标记序列,借助具有明确定义的核酸数据库,对物种进行鉴别,因此,DNA 条形码体系是目前能较完善地识别物种种类多样性的分子可操作分类单元体系(Hibbett et al.,2013 ; Cai et al.,2011 ; Schoch et al.,2012)。
葡萄座腔菌属(Botryosphaeria)真菌的多个种可在包括杨(Populus)、柳(Salix)、榆(Ulmus)、槐(Sophora japonica)、桉(Eucalyptus)、苹果(Malus pumila)、梨(Amygdalus)、樱桃(Cerasuspseudocerasus)、桃(Amygdalus)等涉及20多科300多种树木上引起树木溃疡病(张星耀等,2003)。虽然该属内种间以及近缘属种的系统进化发育已有较为广泛的研究,但目前并未获得理想的种间关系归属,属内种几经调整和归类,仍然有待于对其系统进化进行再认识。引起我国杨树溃疡病的葡萄座腔菌属真菌种类归属名称就有葡萄座腔菌(B.dothidea)、茶藨子葡萄座腔菌(B. ribis)、贝伦格葡萄座腔菌(B. berengeriana)(张星耀等,2003 ; 王金利等,2007)。但 Slippers(2004)等利用形态特征结合 ITS、EF-1 α、β-tubulin等标记认为贝伦格葡萄座腔菌是葡萄座腔菌的同型,不建议使用贝伦格葡萄座腔菌这一名称。另外,该属作为内生菌在生态系统中占据重要位置,其多态性水平高,空间内横向传输广,寄主范围可塑性高,从专化性到广谱性都存在(Slippers et al.,2007)。而国内对其性质的认识还不足。另外,虽然功能基因如 COI、EF-1a和Tubulin等的序列在一些真菌种类鉴定中是更好的分子标记,但核糖体内部转录间隔子序列(ribosomal internal transcribed spacer,ITS)的进化速率在绝大多数真菌种类中表现的种间间隔距离,与当前分类和鉴定体系表现较为一致,并在新一代测序技术研究环境样本真菌多样性中得到应用(Buée et al.,2009)。因此,ITS 被国际真菌 DNA 条形码联盟推荐为真菌的通式性 DNA 条形码(Schoch et al.,2012)。现有的国际核酸数据库中,相关葡萄座腔菌属真菌 ITS 序列存在很多冗余的、过短的、归属错误的以及生态信息不可靠等问题。因此,笔者依据 DNA 条形码的标准,在分离培养内生菌以及建立葡萄座腔菌属可靠国际公共核酸数据库 ITS 序列数据库的基础上,对北京地区生长的杨树葡萄座腔菌属内生菌多样性进行研究,旨在利用宏基因组学知识和技术研究和揭示杨树寄主环境微生物群的生态作用,促进真菌与杨树寄主互作机制和杨树枝干病害如溃疡病的控制新策略的进一步研究。
1 材料与方法 1.1 材料及分离培养样本材料来自北京地区各区县分布生长的杨树皮层组织。每区县选样点2 ~ 3处,每处样树3 ~ 5 株。树龄10 ~ 30年,树林面积0.3 hm2以上,树高10 ~ 20 m。选取离地1.5 ~ 2.0 m 的高度,用小刀(每次取样前用70 % 酒精消毒)取健康树皮2 ~ 4 cm2,放入灭菌褐皮信封中,再放入自封袋中。取下材料在8 ~ 24 h 内,放入4 ℃冰箱中,并在10天之内用于分离培养。
将采集的杨树树皮用75%的酒精擦拭,进行表面消毒,用灭菌刀切成3 mm × 3 mm 小块,1.5 % 次氯酸钠浸泡1 min,无菌水冲洗3遍,然后放入 PDA培养基上。每一样本类型、每一皿中放入4块,27℃倒置培养3天。待组织切口部位有菌丝长出时,用接种针挑取边缘菌丝转接到 PDA 平板上继续培养,纯化2 ~ 3次后得到单一菌种。对于纯化菌株进行形态观察,包括菌落、菌丝特征等。
1.2 DNA 提取及 ITS-PCR 扩增固体培养基上生长旺盛的菌株直接刮取菌丝,收集放入1.5 mL 离心管中,用于 DNA 提取;或进行液体发酵培养获得菌丝体,将菌接入液体培养基,摇床培养4天后,过滤收集菌丝,蒸馏水冲洗,晾干,进行 DNA 提取。DNA 提取,采用试剂盒法(博迈德公司),取约0.05 g 菌丝,放入1.5 mL 离心管中,放入液氮中,用研磨杵进行研磨,然后按照试剂盒进行操作。DNA 样经0.8 % 琼脂糖凝胶(含 EB)电泳检测 DNA,和超微核酸蛋白测定仪(Nanodrop ND- 1000)测量 DNA 含量,- 20 ℃保存备用。
利用真菌通用引物 ITS1 / ITS4(White et al.,1990)扩增核糖体内部转录间隔区 ITS1 -5.8 S -ITS2序列。PCR 扩增体系为25 μL,包括12.5 μL 2 ×Taq plus MasterMix(博迈德公司)、引物(pm·μL - 1)各1 μL、DNA 模板1 μL、9.5 μL ddH2 O。反应程序为: 94 ℃预变性4 min,94 ℃变性30 s,55.6 ℃退火30 s,72 ℃延伸1 min,31个循环,最后72 ℃延伸4 min。取5 μL PCR 产物样品,加入2 μL 的6 × Loading Buffer,以 MarkerII 或 Marker D2000(天根公司)为分子量标准,在2.2 % 琼脂糖凝胶(含 EB)中120 V,电泳40 ~ 60 min,观察电泳结果。
将 PCR 扩增产物切胶回收、纯化,进行测序(三博远志公司),测序引物和扩增引物相同。
1.3 杨树皮层葡萄座腔菌属真菌的 DNA 条形码鉴定以 Botryosphaeria和ITS 为关键检索词,在 NCBI 非冗余公共核酸数据库中,利用 Blastn 工具搜索相似序列,并以 fasta 格式全部下载至本地。经 ITS 质量控制,剔除长度不足、含不确定碱基、镶嵌的序列,调整倒置序列;以 Botryosphaeria 属名、菌株来源为公共知名微生物菌库(ATCC、CBS),相关 DNA 条形码参考序列由 NCBI 下载后,只留下可靠的来自公共菌库(ATCC、CBS)和已在同行评审期刊发表的菌种。所测序列的可操作分子分类单元鉴定依 Blast,选取符合相似性大于97 % 、序列长度比对覆盖率大于75 % 及参考序列中分值最高者进行同源性比较,通过 Score和E-value 值进行判定相似性大小。
利用 MEGA version 5.21对 ITS 序列进行系统发育树构建,分析序列间的亲缘关系(无根),序列比对利用 MAFFT 在线工具进行。 3种建树方法(ML、NJ、MP)均分别用来建树,以互证亲缘关系的正确性。建树方法中的替代方法采用 Tamura-Nei 模型,Bootsrap1000,结合培养学、形态学特征对试验菌株进行系统发育分析。
2 结果与分析 2.1 北京地区杨树内生真菌多样性对北京地区13个区县进行抽样调查,从毛白杨(Populus tomentosa),北京杨(P.× beijingensis),银白杨(P. alba),美洲黑杨(P. deltoides),箭杆杨(P.nigra var. thevestina),加杨(P.× canadensis),青杨(P. cathayana)等上共采获359块树皮,经在 PDA培养基上分离培养,获真菌纯化菌株274株。菌株以 ITS 序列(GenBank accession: KF29370 - KF294012)在公共核酸数据库(NCBI)中 Blast,结果表明北京地区杨树干部皮层的主要内生真菌种类来自子囊菌的23个属和担子菌的3个属(裂褶菌属、肉片齿菌属、叉丝孔菌属)(图 1),其中,子囊菌中的葡萄座腔菌属和黑腐皮壳属为主要菌种,分别占43.3 %和17.6 %,其次是链格孢属、白座壳菌属、茎点霉属、白粉寄生孢属、枝孢属、毛二孢菌、新壳梭孢属等子囊菌属的种类占1.0 % ~ 8.0 % ; 担子菌中分离频次最高的种类是裂褶菌属的 Schizophyllum commune(1.7 %)。
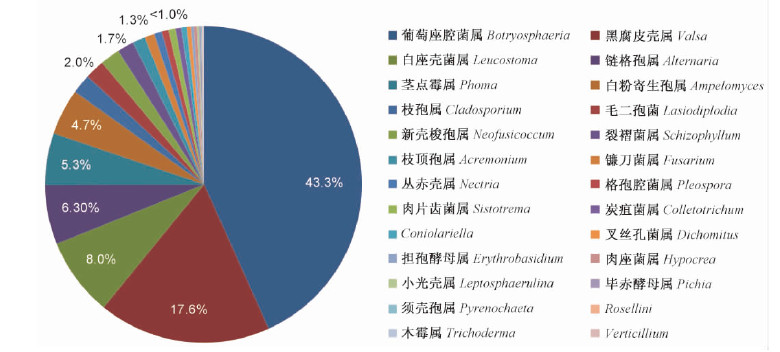 |
图 1 北京地区杨树内生真菌种类
Fig. 1 Diversity of fungal endophytes on poplars in Beijing area
|
截止到2013年6月30日,以 Botryosphaeria和Internal transcribed spacer 为关键词,从 NCBI 核酸数据库中下载2001条序列。对这些序列进行质量控制后,有653条满足作为 DNA 条形码要求的葡萄座腔菌属的序列,分属23个种(表 1)。这些序列均在同行评议的国际期刊中发表或来自国际菌库 CBA、ATCC 的菌株,序列长度大于450 bp,含 ITS1和ITS2全长序列,其中,序列号百条以上的有葡萄座腔菌(299个)和红葡萄座腔菌(101个),10条以上序列号的有茶藨子葡萄座腔菌、小葡萄座腔菌 B.australis、B. iberica、B. corticola、B. lutea、B. obtusa、B. stevensii,其余种的序列号的条数均小于10条,尤其是 B. laricina、B. mamane、B. populi、B.vaccinii,目前均只有1条。数据库目前由笔者本地保存。
|
|
在北京274个菌株中,通过 NCBI 初步的 Blast 比对,有118条归属在葡萄座腔菌属及其相关小穴壳属(Dothiorella)、新壳梭孢菌属、毛二孢菌属中,这118条序列经过与上述数据库比对,可以明确地分别归于葡萄座腔菌、小葡萄座腔菌、红葡萄座腔菌中(表 2),且绝大多数是葡萄座腔菌(占92.0 %),小葡萄座腔菌和红葡萄座腔菌分别有6,4个菌株,分别占5.0 %和3.0 % 。这些葡萄座腔菌属真菌菌株与数据库中这3种菌的相关参考序列的比对参数及参考序列信息(Accession ID和菌株)见 表 2 。这些序列符合 DNA 条形码种的确定标准,序列一致性 >98 %,序列比对覆盖度 > 75 % 。
|
|
为验证本结果,从分别归属在3个种的北京菌种样本序列组中,取菌株序列一致性差异最大(组中分值 Score 最大和最小)的2条(表 3),即葡萄座腔菌种组中的 BJ_H28 _ F11和BJ _8 _ F06 _18 Q 菌株系列、小葡萄座腔菌种组中的 BJ_4 _G09 _1 Q和BJ_4_X01菌株系列、红葡萄座腔菌种组中的 BJ_2 _G10 _ 13Q和BJ_1 _X03菌株系列,与所有参考序列即葡萄座腔菌属的7个序列、小葡萄座腔菌属的5个序列和红葡萄座腔菌属的3个序列(表 2)进行亲缘关系系统发育树的构建。
|
|
发育树构建结果如 图 2 所示:所有参考序列在3种建树方法中都显示独自的分支(方框、三角和菱形标记),各自的北京样本真菌序列也十分清晰地分列于各自的参考种序列分支中。
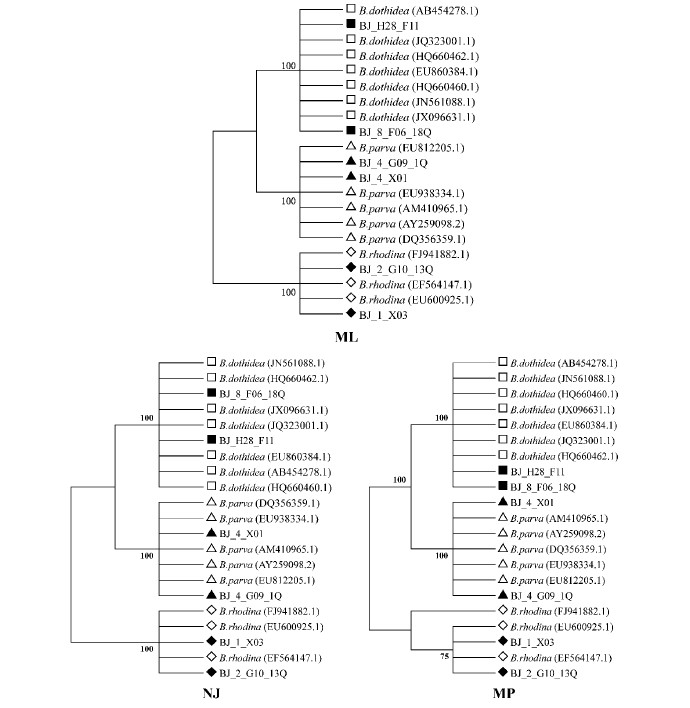 |
图 2 北京地区菌株与Botryosphaeria ITS 数据库参考菌株的亲缘关系
Fig. 2 Phylogenetical relationship for strains isolated from poplars in Beijing area and referred strains of Botryosphaeria spp. from INSD database based on ML、NJ,and MP trees
|
葡萄座腔菌属的真菌是树木常见的内生菌种群(Slippers et al.,2007),笔者以一个地区分布的杨树为采样范围,发现葡萄座腔菌属的真菌在杨树中也普遍以内生菌存在(图 1),且至少存在3个不同的种群: 葡萄座腔菌、小葡萄座腔菌和红葡萄座腔菌、(表 2),其中,葡萄座腔菌不仅在葡萄座腔菌属的内生菌中表现为优势种群,在杨树所有内生真菌种群中也是如此。在很多树木上,如桉树,葡萄座腔菌也被认为是最主要的优势内生真菌种群(Smith et al.,2007)。葡萄座腔菌的这种广布性,可能是其成为常发和常见树木溃疡病菌的基础(Slippers et al.,2007)。这种优势种群以无害生活方式存在于树木寄主中,最终转变为病原菌的机制非常的不清楚,但外部环境和发育阶段因素如光和衰老能诱发内生菌转变为病菌致害(Álvarez-Loayza et al.,2011)。杨树葡萄座腔菌溃疡病的发生与树木水分生理关系密切(张星耀、骆有庆,2003),树皮的水分因素应该参与或调节了该菌从内生无害状态转入寄生有害状态的转变过程。从北京地区生长的无症状杨树中,43.0 % 的葡萄座腔菌属真菌的分离频次(图 1)及属内92.0 % 的葡萄座腔菌的比例(表 2),说明引起我国杨树葡萄座腔菌属真菌性溃疡的主要病菌葡萄座腔菌常态下是内生真菌。
利用基于核酸序列的分子可操作分类单元进行分类能快速了解和掌握真菌多样性(Hibbett et al.,2013 ; Cai et al.,2011),ITS 被建议作为真菌 DNA条形码的标记序列(Schoch et al.,2012),并已经在多种环境的真菌研究中加以运用(Buée et al.,2009)。因为引起病害具有经济上的重要性,鉴定和鉴别葡萄座腔菌属及相近属种成为病害诊断和防治的关键,因此,对葡萄座腔菌属及其种之间的系统发育和分类地位,依据形态和分子标记都进行了较为广泛的研究(Slippers et al.,2007 ; Smith et al.,1996 ; Corus et al.,2006 ; Phillips et al.,2010)。28 SrDNA 亲缘关系揭示出过去葡萄座腔菌属能分化出10个分支,进而被建议拆分为10个属(Crous et al.,2006); 而多分子标记位点的谱系一致性亲缘种鉴别方法,对葡萄座腔菌属的种内修订起到了积极作用,之前形态特征和单分子标记区分的一些种类被合并为葡萄座腔菌(Slippers et al.,2004)。依据这些进展,葡萄座腔菌属实际上是含有3个较早种(葡萄座腔菌、B. corticis、B. mamane)以及近年(2009年以后、文献未列)发表的一些新种的属,而与北京杨树内生真菌 ITS 序列高度一致的小葡萄座腔菌和红葡萄座腔菌分别改为 Neofusicoccum parvum和Lasiodiplodia theobromae。虽然如此,从目前核酸数据库中既有形态特征描述鉴定又有基于 ITS 序列分子可操作分类单元的葡萄座腔菌属的种类来看,还有包括葡萄座腔菌、红葡萄座腔菌、小葡萄座腔菌等在内的23个种(或种名)仍在使用(表 1); 再者葡萄座腔菌属及相关属、种还在不断地调整以及该属新种不断地被发现。因此,笔者还是依据在 NCBI中具有详实 ITS 序列和相关生物特征分类信息背景的葡萄座腔菌属种名作为 ITS 分子可操作分类单元的参考数据库用于本研究。
据此,北京地区杨树内生菌中含有葡萄座腔菌属的3个种:葡萄座腔菌、红葡萄座腔菌、小葡萄座腔菌,且是种内有遗传分化的种群,并且葡萄座腔菌种群数量占据绝对的优势(表 2 、表 3 、图 2),这与我国杨树葡萄座腔菌属溃疡病的病菌主要是葡萄座腔菌(贝伦格葡萄座腔菌)的情况一致,但另一病菌茶藨子葡萄座腔菌(现名 Neofusicoccum ribis)(姜自如等,2012)在本研究中没有被发现。红葡萄座腔菌(现名 Lasiodiplodia theobromae)和小葡萄座腔菌(现名 N. parvum)都是重要的病原真菌(Alves et al.,2008 ; McDonald et al.,2011),二者在葡萄溃疡病中被检测到复合存在(Abreo et al.,2013)。而我国杨树上没有红葡萄座腔菌引起杨树溃疡病的记载,也少有小葡萄座腔菌在杨树上引起溃疡病的报道,二者与葡萄座腔菌一样以内生菌的方式存在于杨树中(表 3),是首次记录到有这2种病原以内生菌的形式在杨树上,而且也存在种群遗传分化(表 2)。二者是否参与或引起杨树溃疡病的发生,葡萄座腔菌内生菌种群是潜伏的致病种群还是分化有内生与致病类群以及作为内生菌转变为病原菌的诱发机制都有待进一步的研究。
| [1] |
姜自如, 张刚龙,曹支敏,等. 2012. 陕西省杨树溃疡病菌地理种群研究. 西北林学院学报,27(2) : 102 - 108.( 1) 1)
|
| [2] |
王金利, 贺 伟, 秦国夫, 等. 2007.树木溃疡病重要病原葡萄座腔菌属、种及其无性型研究. 林业科学研究, 20(1): 21-28.( 1) 1)
|
| [3] |
张星耀, 骆有庆.2003.中国森林重大生物灾害. 北京: 中国林业出版社.( 3) 3)
|
| [4] |
Abreo E, Martinez S, Bettucci L, et al. 2013.Characterization of Botryosphaeriaceae species associated with grapevines in Uruguay. Australasian Plant Pathol, 42(3): 241-249.( 1) 1)
|
| [5] |
Álvarez-Loayza P, White J J, Torres M, et al. 2011. Light converts endosymbiotic fungus to pathogen, influencing seedling survival and niche-space filling of a common tropical tree, Iriartea deltoidea. PLoS ONE, 6(1): e16386.( 1) 1)
|
| [6] |
Alves A, Crous P W, Correia A, et al.2008.Morphological and molecular data reveal cryptic speciation in Lasiodiplodia theobromae. Fungal Diversity, 28: 1-13.( 1) 1)
|
| [7] |
Buée M, Reich M, Murat C, et al.2009.454 pyrosequencing analyses of forest soils reveal an unexpectedly high fungal diversity. New Phytologist, 184(2): 449-456.( 3) 3)
|
| [8] |
Begerow D, Nilsson H, Unterseher M, et al.2010.Current state and perspectives of fungal DNA barcoding and rapid identification procedures. Appl Microbiol Biotechnol, 87(1): 99-108.( 1) 1)
|
| [9] |
Cai Lei, Giraud T, Zhang Ning, et al. 2011.The evolution of species concepts and species recognition criteria in plant pathogenic fungi. Fungal Diversity, 50: 121-133.( 3) 3)
|
| [10] |
Crous P W, Slippers B, Wingfield M J, et al.2006. Phylogenetic lineages in the Botryosphaeriaceae. Studies in Mycology, 55(1): 235-253.( 1) 1)
|
| [11] |
Hibbett D S, Taylor J W. 2013. Fungal systematic: is a new age of enlightenment at hand? Nature Reviews Microbiology, 11: 129-133.( 4) 4)
|
| [12] |
McDonald V, Eskalen A.2011.Botryosphaeriaceae species associated with avocado branch cankers in California. Plant Disease, 95(11): 1465-1473.( 1) 1)
|
| [13] |
Schoch C L, Seifert K A, Huhndorf S, et al.2012. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proc Natl Acad Sci USA, 109(16), 6241-6246.( 4) 4)
|
| [14] |
Slippers B, Crous P W, Denman S, et al. 2004.Combined multiple gene genealogies and phenotypic characters differentiate several species previously identified as Botryosphaeria dothidea. Mycologia, 96(1): 83-101.( 2) 2)
|
| [15] |
Slippers B, Wingfield J M.2007.Botryosphaeriaceae as endophytes and latent pathogens of woody plants: diversity, ecology and impact. Fungal Biology Reviews, 21(2-3): 90-106.( 4) 4)
|
| [16] |
Smith H, Wingfield M J, Petrini O. 1996.Botryosphaeria dothidea endophytic in Eucalyptus grandis and Eucalyptus nitens in South Africa. Forest Ecology and Management, 89(1-3): 189-195.( 1) 1)
|
| [17] |
Vrålstad T. 2011.ITS, OTUs and beyond—fungal hyperdiversity calls for supplementary solutions. Molecular Ecology, 20(14): 2873-2875.( 1) 1)
|
| [18] |
White T J, Bruns T, Lee S, et al. 1990.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics//PCR Protocols: A Guide to Methods and Applications. San Diego: Academic Press, 315-322.( 1) 1)
|
 2014, Vol. 50
2014, Vol. 50

