文章信息
- 王朝英, 李昌晓, 张晔
- Wang Chaoying, Li Changxiao, Zhang Ye
- 水淹-干旱胁迫对南川柳苗木生长及生理特性的影响
- Effects of Submergence-Drought Stresses on Growth and Physiological Characteristics of Salix rosthornii Seedlings
- 林业科学, 2013, 49(12): 164-170
- Scientia Silvae Sinicae, 2013, 49(12): 164-170.
- DOI: 10.11707/j.1001-7488.20131223
-
文章历史
- 收稿日期:2012-11-06
- 修回日期:2013-05-22
-
作者相关文章
三峡工程建设完工后在坝前高程上形成了垂直落差达30 m的消落带(罗芳丽等,2008)。库区水位大幅度涨落导致消落带内原有物种大部分因不能忍受其生境的剧烈变化而逐渐死亡,其“冬蓄夏排”的反季节水位调度管理方式进一步加剧消落带植被退化、水土流失、环境污染等现象,威胁库区的持久健康发展(王勇等,2005)。目前,筛选适宜的乡土树种重建库区植被是解决上述问题的科学方法。因此,开展三峡库区乡土树种对库区水文变化的生长及生理响应研究能够为三峡库区消落带人工植被构建实践提供技术支撑和理论指导。
南川柳(Salix rosthornii),杨柳科柳属植物,是原有长江库岸树种(刘维暐等,2011),具有生长快、适应性和耐水淹性强的特点,在堤岸防护中具有十分重要的作用(马跃等,2008;严惠珍等,2011)。目前,对于柳属植物的耐淹性有着较为普遍的认可,已有的研究主要集中在三峡库区现存柳属植物秋华柳(Salix variegata)(罗芳丽等,2008;李娅等,2008;陈芳清等,2008)以及在库区水文调度中的水淹部分,近年来也有部分学者开始注意到水淹后的恢复生长过程,但针对整个水文变化过程的研究尚未见报道。南川柳在库区水位涨落过程中先受到水位升高所带来的水淹胁迫,随着水位降落,胁迫程度逐渐降低,水位进一步下降之后土壤出露,南川柳也由水淹胁迫状态逐步恢复到正常生长状态。进入7月高温天气后,植株还将可能受到短时间的轻度干旱胁迫。随着高温天气雨水增多,干旱得到缓解。由此,南川柳的生理节律、生长及生理生化过程均有可能受到影响。因此,本研究模拟三峡库区水文动态变化,通过盆栽方法对南川柳的生理生态响应机制进行研究。笔者假设:在经过一个水文变化周期后,各处理组与对照组相比其生长和生理均无显著差异。
1 材料与方法 1.1 材料和试验地点所用材料为2年生南川柳苗木。采用盆栽法,2010年10月初挑选长势和大小基本一致的南川柳扦插苗160株,带土栽种于高24 cm、中央内径28 cm的塑料盆中,采用紫色土作为栽培基质,每盆1株。将所有植株置于西南大学三峡库区生态环境教育部重点实验室试验基地大棚(四周开敞,透明顶棚,海拔249 m)内培养,以使所有植株处于相同环境中。2011年1月25日正式开展试验,此时南川柳平均株高为143.2 cm,叶片已全部脱落。
1.2 试验方法本试验模拟三峡库区水位动态变化节律(图 1),设置水淹与干旱胁迫的水分处理梯度与时间跨度。由于库岸不同高程的植物受到水淹和干旱胁迫的程度不同,因此试验模拟165~180 m段水分环境状况将试验植株随机分成4组,即CK(对照处理)、T1(植株根淹动态变化处理)、T2(植株半淹动态变化处理)、T3(植株全淹动态变化处理),每组各40盆。CK在整个试验期间进行常规供水(表 1)。0~45天(2011-01-25—2011-03-10),T1,T2和T3组依次分别进行根淹、半淹和没顶全淹处理;46~65天(2011-03-11—2011-03-30),植物受到的水淹胁迫程度降低,T1,T2和T3组分别依次进行常规供水、根淹和半淹处理;66~155天(2011-03-31—2011-06-28),随着水分胁迫程度的进一步降低,T1,T2和T3组均进行常规供水处理;156~176天(2011-06-29—2011-07-19),高温导致土壤含水量进一步减少,T1,T2和T3组均进行轻度干旱胁迫处理;177~197天(2011-07-20—2011-08-09),夏季降雨缓解了土壤的干旱状况,T1,T2和T3组又均进行常规供水处理(表 1)。表 1中“常规供水”以60%~63%的田间持水量作为其土壤含水量,“轻度干旱”以40%~43%的田间持水量作为其土壤含水量(土壤含水量采用称量法确定)。“根淹”为水面超过植株根部土壤表面5 cm。“半淹”是将塑料盆放入专用试验水池中,水池长、宽、高各2.3 m,并向水池中注入自来水,水深保持在一半苗高(约70 cm)处。“全淹”是将苗盆放入上述试验水池中,并向水池中注满自来水,保持在2 m深度,此时没顶水淹约0.4 m。
 |
图 1 2009—2011年三峡水库月水位变化
Fig. 1 Monthly water levels in the Three Gorges Reservoir during 2009-2011
|
|
|
从试验处理之日算起,分别在试验处理45,65,155,176和197天测定生物量及生理指标。每次进行生理指标测定时,从每个处理中随机取3株,采样后放入冰盒,带回实验室,保存于-80 ℃冰箱中备用。生物量每个处理每次测定5株。
1.3 生理指标及生物量测定由于植物根部与土壤直接接触,其在应对水分逆境胁迫中具有十分重要作用,本试验中各项生理指标均取自根系样品。超氧化物歧化酶(superoxide dismutase,SOD)活性测定采用氮蓝四唑(NBT)比色法,以单位时间内抑制光化还原50%的氮蓝四唑为一个酶活力单位U(高俊凤,2006);过氧化物酶(peroxidase,POD)活性测定采用愈创木酚法,以每分钟内OD470变化0.01为1个酶活力单位U(高俊凤,2006);过氧化氢酶(catalase,CAT)活性测定采用过氧化氢氧化法,以每分钟内OD240变化0.01为1个酶活力单位U(张以顺等,2009);丙二醛(malondialdehyde,MDA)含量的测定采用硫代巴比妥酸(TBA)比色法(张志良等,2003);可溶性蛋白含量测定采用考马斯亮蓝G250显色法(李合生,2000),以牛血清蛋白为标准蛋白;脯氨酸含量测定采用磺基水杨酸法(李合生,2000)。
测定生物量时将植株各部分分开取样,放入80 ℃烘箱中烘干至恒质量,用分析天平分别称量。
1.4 数据分析采用Microsoft Excel 2003和SPSS(13.0版)对数据进行统计分析,差异显著性比较采用Tukey’s法,显著性水平均为0.05。
2 结果与分析 2.1 水分胁迫对南川柳苗木根系保护酶活性的影响从图 2可以看出,各处理不同阶段的土壤水分条件均对南川柳的SOD,POD和CAT活性产生了显著影响。处理45天,南川柳苗木各处理组SOD活性上升,T2和T3组显著高于CK组;处理65天,T1,T2和T3组SOD活性均上升,均显著大于CK组;处理155天,T1,T2和T3组SOD活性下降,T2,T3组与CK组无显著差异,而T1组显著小于CK组;处理176天,T1,T2和T3组SOD活性显著高于CK组。处理197天,4个处理组间无显著差异。
 |
图 2 不同水分处理对南川柳苗木根部SOD,POD 和CAT活性的影响
Fig. 2 Effects of different water treatments on the activities of SOD,POD and CAT in roots of S. rosthornii seedlings
|
处理45,65和176天,CAT活性的变化趋势与SOD活性的变化趋势相似。处理155和197天,4个处理组间无显著差异。
处理45天,南川柳苗木T2和T3组POD活性显著低于CK组,而T1组POD活性与CK组无显著差异;处理65天,T1,T2和T3组POD活性均显著大于CK组;处理155,176和197天,POD活性的变化趋势与CAT活性的变化趋势相似。
2.2 水分胁迫对南川柳苗木根系脂质过氧化作用的影响处理45天,T1,T2和T3组MDA含量均显著升高;处理65天,T1,T2和T3组MDA含量下降,但仍均显著高于CK组。紧接着的恢复处理阶段(155天),各处理组间MDA含量无显著差异;随后的轻度干旱胁迫阶段(176天),T1,T2和T3组的MDA含量显著高于CK组;处理197天,4个处理组间MDA含量没有显著差异(图 3)。
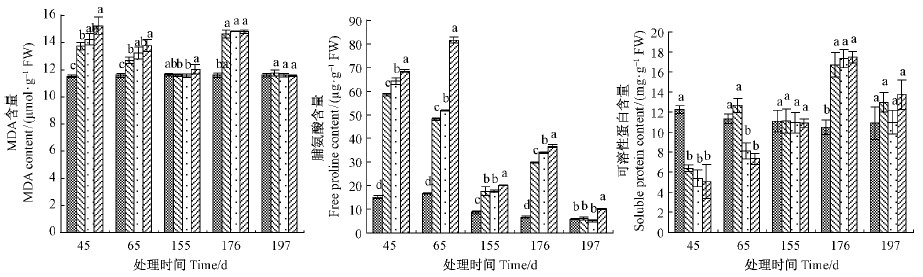 |
图 3 不同水分处理对南川柳苗木根部MDA、脯氨酸和可溶性蛋白含量的影响
Fig. 3 Effects of different water treatments on the contents of MDA,free proline and soluble protein in roots of S. rosthornii seedlings
|
水淹处理阶段(45,65天),T1,T2和T3组脯氨酸含量均显著高于CK组;常规供水阶段(155天),T1,T2和T3组脯氨酸含量有所下降,但仍都显著高于CK组;轻度干旱处理阶段(176天),T1,T2和T3组脯氨酸含量显著升高;处理197天,T1和T2组脯氨酸含量下降,与CK组无显著性差异,但T3组脯氨酸含量仍显著高于CK组(图 3)。
水淹处理阶段(45,65天),随着水淹胁迫的降低,南川柳苗木T1,T2和T3组可溶性蛋白质含量呈先下降后上升的变化趋势,至处理65天,T1组与对照组无显著差异,但T2和T3组仍然显著低于CK组;常规供水阶段(155天),T1,T2和T3组可溶性蛋白质含量恢复,与CK组无显著性差异;轻度干旱处理阶段(176天),T1,T2和T3组可溶性蛋白质含量均显著高于CK组;处理197天,各处理组可溶性蛋白质含量与CK组没有显著差异(图 3)。
2.4 不同水分处理对南川柳苗木生物量的影响在整个试验期间,所有供试苗木成活率均达到100%,但T3组叶片的萌发时间明显晚于CK,T1和T2组。各处理组的总生物量随着处理时间的延长不断增加(图 4)。但是,直至试验结束,T1,T2和T3组的根生物量分别比CK组低6.19%(P=0.603),8.25%(P=0.369)和13.57%(P=0.061),茎生物量分别比CK组低8.88%(P=0.037),8.4%(P=0.051)和24.8%(P=0.000),叶生物量分别比CK组低9.8%(P=0.002),24.69%(P=0.000)和43.06%(P=0.000),总生物量分别比CK组低7.95%(P=0.045),9.84%(P=0.011)和22.25%(P=0.000)(图 4)。
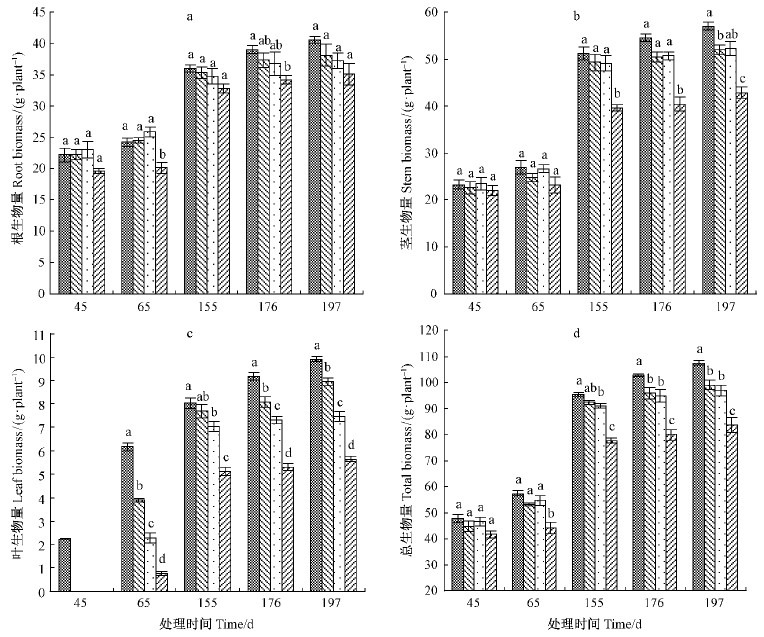 |
图 4 南川柳苗木在不同水分处理下生物量的变化
Fig. 4 Changes of the biomasses of S. rosthornii seedlings under different water treatments
|
水淹主要引起植物缺氧(Pezeshki,2001)。植物正常的呼吸作用在遭受长期缺氧后受到干扰,进而破坏根系内活性氧产生和代谢平衡(Mittler,2002;Blokhina et al.,2003;Panda et al.,2008),根系内产生和积累的大量活性氧。抗氧化防御系统是植物抵御活性氧自由基毒害作用的主要屏障,SOD,POD和CAT作为植物体内重要的抗氧化酶参与到活性氧代谢中(Lanceras et al.,2004),它们之间彼此协调的综合结果决定了保护酶防御能力的强弱(陈少裕,1991;蒋明义等,1996)。SOD是活性氧清除系统中的第一道防线,它将O2-歧化为H2O2,因此保持较高SOD活性对植物适应水分胁迫极为重要(徐勤松等,2009;Jin et al.,2006;Tang et al.,2010)。POD和CAT能够维持细胞内H2O2的正常水平,保护细胞膜结构(Kriwoken et al.,2000;Teisseire et al.,2000)。已有研究表明:三峡库区消落带耐淹物种狗牙根(Cynodon dactylon)SOD活性在水淹深度小于5 m之前随着水淹深度增加呈现上升趋势(谭淑端等,2009),其他耐淹性较强的植物在水淹胁迫下SOD活性也呈上升趋势(Caton et al.,1999;Kawano et al.,2002),本研究结果与之相似。水淹胁迫使南川柳苗木根系SOD和CAT活性增加,这可能是因为水淹导致南川柳苗木根部缺氧,破坏了根系的活性氧代谢平衡,诱导SOD和CAT活性升高。相反POD活性却显著降低,充分说明南川柳根部的SOD,POD和CAT对水淹胁迫的敏感程度不同。与水淹胁迫不同,在轻度干旱胁迫中,南川柳SOD,POD和CAT活性均高于对照组,而在水淹和干旱胁迫后的恢复处理中,SOD,POD活性又能恢复至对照水平,充分说明南川柳遭受胁迫时,将全面启动其防御机制,对胁迫造成的活性氧积累做出积极反应,以防止细胞受到氧化伤害,具有一定的耐淹耐旱性。笔者的假设部分得到证实。
随着植物根部活性氧进一步增加,植物体内生物大分子被破坏,酶活性丧失(Subbaiah et al.,2003;Tang et al.,2010)。过量的活性氧将引发膜脂过氧化作用,MDA是其产物之一(Drew,1997;Yin et al.,2010)。部分研究表明:植物体内膜脂过氧化作用的程度能够通过MDA积累量变化反映植物对水分胁迫的反应能力(贾恢先等,1994;孙存华等,2005;孙景宽等,2009;Menconi et al.,1995)。本研究中,南川柳苗木在水淹和轻度干旱胁迫下MDA积累量均增加,且其含量随着水淹深度增加呈现出上升趋势,由此表明南川柳苗木在水淹和轻度干旱胁迫均已发生膜脂过氧化作用。本研究还发现,南川柳苗木根部的MDA含量随着水淹深度的减小而出现下降,且在水淹和轻度干旱胁迫后的恢复处理中,MDA含量恢复至对照水平,这有可能是由于南川柳根系受到的水分胁迫程度降低,活性氧产生逐渐减少,细胞膜受到的伤害逐渐恢复,其产物MDA含量也相应随之减少。由此充分说明南川柳苗木对水淹和轻度干旱胁迫具有一定的耐受性,笔者的假设部分得到证实。
脯氨酸作为渗透调节物质之一,能够保护蛋白质分子和酶活性,还可用作活性氧清除剂和抗冷剂(许详明等,2000;彭志红等,2002;Morgan,1984),通常被认为是植物应对干旱胁迫的重要指标之一。本研究发现南川柳不仅在轻度干旱胁迫下根部的脯氨酸含量较CK组有显著增加,其在水淹条件下(0~65天)脯氨酸含量较CK组也显著增加,由此说明南川柳根部通过提高脯氨酸含量来降低细胞渗透势是其应对水淹与干旱胁迫的共同措施之一。Carpenter等(2008)发现黑柳(Salix nigra)在水淹胁迫条件下根、茎细胞存在明显的渗透调节现象。但是,也有学者认为脯氨酸的积累不能反映植物抗逆能力的提升(王邦锡等,1989)。鉴于干旱胁迫下MDA含量也同时升高,认为南川柳苗木适应干旱胁迫的能力是有限的。在处理前期,南川柳各处理组可溶性蛋白质含量随水淹深度增加而逐渐下降,这可能是由于水淹胁迫抑制了蛋白质的合成并诱导蛋白质降解,使南川柳体内的蛋白质含量降低(魏良民,1991)。但是,减弱水淹胁迫强度,可溶性蛋白质含量则逐渐上升,这与汤玉喜等(2008)对美洲黑杨(Populus deltoides)无性系的研究结果一致。本研究还发现,轻度干旱处理阶段,T1,T2和T3组可溶性蛋白质含量显著高于CK组,表明随着轻度干旱胁迫持续,南川柳根部的可溶蛋白质含量增加,以提高细胞保水力,恢复正常供水后,可溶性蛋白质含量能够恢复至正常水平。
3.2 不同水淹-干旱胁迫下南川柳苗木的生长响应植物的生长和生物量与其所处生长环境密切相关(靖元孝等,2001;Tang et al.,1983)。本试验发现,南川柳苗木在T1,T2和T3组的根、茎、叶和总生物量积累均显著低于CK组,并且随着初期水淹深度增加生物量减少幅度加大(图 4),说明笔者关于“在经过一个水位变化周期后,各处理组与对照组相比其生长无显著差异”的假设不成立。在试验处理65天后,各处理组均处于相同土壤水分条件下,但叶和总生物量仍显著低于CK组,由此表明前期(0~65天)的水淹对南川柳的后期生长具有持续性的负面影响。但是,水淹胁迫后,每一处理组的生物量较之前均呈现出增加趋势,与轻度干旱胁迫后生物量无显著增加形成鲜明对比(图 4),充分说明干旱胁迫对南川柳的持续负面影响要大于水淹胁迫。值得提出的是,南川柳苗木在T3组的全淹胁迫下,叶的生长有明显滞后现象(图 4),而这种滞后现象是否是因水淹胁迫影响其物候还有待于进一步研究。
通过本研究表明:南川柳苗木通过提高自身SOD等保护酶的活性,增加脯氨酸等渗透调节物质的含量来应对库区水文波动变化所产生的水淹与轻度干旱胁迫环境,具有一定的适应性,但对二者的适应性存在差异,南川柳苗木对水淹胁迫的适应能力大于轻度干旱胁迫。南川柳苗木对三峡库区消落带水位变化而形成的多种水分胁迫逆境具有一定的适应性,但在种植初期,特别是干旱条件下,应加强供水保障管理。
| [1] |
陈芳清, 郭成圆, 王传华, 等. 2008. 水淹对秋华柳幼苗生理生态特征的影响. 应用生态学报, 19(6): 1229-1233.( 1) 1)
|
| [2] |
陈少裕. 1991. 膜脂过氧化对植物细胞的伤害. 植物生理学通讯, 27(2): 84-90.( 1) 1)
|
| [3] |
高俊凤. 2006. 植物生理学试验指导. 北京: 高等教育出版社.( 1) 1)
|
| [4] |
贾恢先, 赵曼容, 马 莹. 1994. 典型盐地植物细胞脂质过氧化伤害与质膜超微结构变化的研究. 西北植物学报, 14(6): 1-5.( 1) 1)
|
| [5] |
蒋明义, 郭绍川. 1996. 水分亏缺诱导的氧化胁迫和植物的抗氧化作用. 植物生理学通讯, 32(2): 144-150.( 1) 1)
|
| [6] |
靖元孝, 程惠青, 彭建宗, 等. 2001. 水翁(Cleistocalyx operculatus)幼苗对淹水的反应初报. 生态学报, 21(5): 810-813. ( 1) 1)
|
| [7] |
李合生. 2000. 植物生理生化试验原理和技术. 北京: 高等教育出版社.( 1) 1)
|
| [8] |
李 娅, 曾 波, 叶小齐, 等. 2008. 水淹对三峡库区岸生植物秋华柳(Salix variegate Franch.) 存活和恢复生长的影响. 生态学报, 28(5): 1923-1930.( 1) 1)
|
| [9] |
刘维暐, 杨 帆, 王 杰, 等. 2011. 三峡水库干流和库湾消落区植被物种动态分布研究. 植物科学学报, 29(3): 296-306.( 1) 1)
|
| [10] |
罗芳丽, 曾 波, 叶小齐, 等. 2008. 水淹对三峡库区两种岸生植物秋华柳(Salix variegate Franch.)和野古草(Arundinella anomala Steud.)水下光合的影响. 生态学报, 28(5): 1964-1970.( 2) 2)
|
| [11] |
马 跃, 王正荣. 2008. 适宜三峡库区消落带的八种植物. 南方农业: 园林花卉版, 2(6): 42-46.( 1) 1)
|
| [12] |
彭志红, 彭克勤, 胡家金, 等. 2002. 渗透胁迫下植物脯氨酸积累的研究进展. 中国农学通报, 18(4): 80-83.( 1) 1)
|
| [13] |
孙存华, 李 扬, 贺鸿雁, 等. 2005. 藜对干旱胁迫的生理生化反应. 生态学报, 25(10): 2556-2561.( 1) 1)
|
| [14] |
孙景宽, 张文辉, 陆兆华, 等. 2009. 沙枣(Elaeagnus angustifolia)和孩儿拳头(Grewia biloba G. Don var. parviflora)幼苗气体交换特征与保护酶对干旱胁迫的响应. 生态学报, 29(3): 1330-1340.( 1) 1)
|
| [15] |
谭淑端, 朱明勇, 党海山, 等. 2009. 三峡库区狗牙根对深淹胁迫的生理响应. 生态学报, 29(7): 3685-3691.( 1) 1)
|
| [16] |
汤玉喜, 刘友全, 吴 敏, 等. 2008. 淹水胁迫下美洲黑杨无性系生理生化指标的变化. 中国农学通报, 24(8): 156-161.( 1) 1)
|
| [17] |
王邦锡, 黄久常, 王 辉. 1989. 不同植物在水分胁迫条件下脯氨酸的积累与抗旱性的关系. 植物生理学报, 15(1): 46-51.( 1) 1)
|
| [18] |
王 勇, 刘义飞, 刘松柏, 等. 2005. 三峡库区消涨带植被重建. 植物学通报, 22(5): 513-522.( 1) 1)
|
| [19] |
魏良民. 1991. 几种旱生植物碳水化合物和蛋白质变化的研究. 干旱区研究, 8(4): 38-41.( 1) 1)
|
| [20] |
徐勤松, 施国新, 计汪栋, 等. 2009. Zn对荇菜叶片保护酶活性、渗透调节物质含量和Ca2+定位分布的影响. 水生生物学报, 33(4): 613-619.( 1) 1)
|
| [21] |
许详明, 叶和春, 李国凤. 2000. 脯氨酸代谢与植物抗渗透胁迫的研究进展. 植物学通报, 17(6): 536-542.( 1) 1)
|
| [22] |
严惠珍, 丛 野. 2011. 河道生态护坡技术在宜春市城市防洪工程中的运用. 江西水利科技, 37(1): 48-52.( 1) 1)
|
| [23] |
张以顺, 黄 霞, 陈云凤. 2009. 植物生理学试验教程. 北京: 高等教育出版社.( 1) 1)
|
| [24] |
张志良, 瞿伟菁. 2003. 植物生理学试验指导. 北京: 高等教育出版社.( 1) 1)
|
| [25] |
Blokhina O, Virolainen E, Fagerstedt K V. 2003. Antioxidants, oxidative damage and oxygen deprivation stress: a review. Annals of Botany, 91(2): 179-194.( 1) 1)
|
| [26] |
Carpenter L T, Pezeshki S R, Shields F D. 2008. Responses of nonstructural carbohydrates to shoot removal and soil moisture treatments in Salix nigra. Trees, 22(5): 737-748.( 1) 1)
|
| [27] |
Caton B P, Foin T C, Hill J E. 1999. A plant growth model for integrated weed management in direct-seeded rice: Ⅱ. Validation testing of water-depth effects and monoculture growth. Field Crops Research, 62 (2/3): 145-155.( 1) 1)
|
| [28] |
Drew M C. 1997. Oxygen deciency and root metabolism: injury and acclimation under hypoxia and anoxia. Annual Review of Plant Molecular Biology, 48: 223-250.( 1) 1)
|
| [29] |
Jin J, Shan N, Ma N, et al. 2006. Regulation of ascorbate peroxidase at the transcript level is involved in tolerance to postharvest water decit stress in the cut rose (Rosa hybrida L.) cv. Samantha. Postharvest Biology and Technology, 40(3): 236-243.( 1) 1)
|
| [30] |
Kawano N, Ella E, Ito O, et al. 2002. Metabolic changes in rice seedlings with different submergence tolerance after desubmergence. Environmental and Experimental Botany, 47(3): 195-203.( 1) 1)
|
| [31] |
Kriwoken L K, Hedge P. 2000. Exotic species and estuaries: managing Spartina anglica in Tasmania, Australia. Ocean & Coastal Management, 43(7): 573-584.( 1) 1)
|
| [32] |
Lanceras J C, Pantuwan G, Jongdee B, et al. 2004. Quantitative trait loci associated with drought tolerance at reproductive stage in rice. Plant Physiology, 135(1): 384-399.( 1) 1)
|
| [33] |
Menconi M, Sgherri C L M, Pinzino C, et al. 1995. Activated oxygen production and detoxification in wheat plants subjected to a water deficit program. Journal of Experimental Botany, 46(9): 1123-1130.( 1) 1)
|
| [34] |
Mittler R. 2002. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, 7(9): 405-410.( 1) 1)
|
| [35] |
Morgan J M. 1984. Osmoregulation and water stress in higher plants. Annual Review of Plant Physiology, 35: 299-319.( 1) 1)
|
| [36] |
Panda D, Sharma S G, Sarkar R K. 2008. Chlorophyll fluorescence parameters, CO2 photosynthetic rate and regeneration capacity as a result of complete submergence and subsequent re-emergence in rice (Oryza sativa L.). Aquatic Botany, 88(2): 127-133.( 1) 1)
|
| [37] |
Pezeshki S R. 2001. Wetland plant responses to soil flooding. Environmental and Experimental Botany, 46(3): 299-312.( 1) 1)
|
| [38] |
Subbaiah C C, Sachs M M. 2003. Molecular and cellular adaptations of maize to flooding stress. Annals of Botany, 91(2): 119-127.( 1) 1)
|
| [39] |
Tang B, Xu S, Zou X, et al. 2010. Changes of antioxidative enzymes and lipid peroxidation in leaves and roots of waterlogging-tolerant and waterlogging-sensitive maize genotypes at seedling stage. Agricultural Sciences in China, 9(5): 651-661.( 2) 2)
|
| [40] |
Tang Z C, Kozlowski T T. 1983. Responses of Pinus banksiana and Pinus resinosa seedlings to flooding. Canadian Journal of Forest Research, 13(4): 633-639.( 1) 1)
|
| [41] |
Teisseire H, Guy V. 2000. Copper-induced changes in antioxidant enzymes activities in fronds of duckweed (Lemna minor). Plant Science, 153(1): 65-72.( 1) 1)
|
| [42] |
Yin D, Chen S, Chen F, et al. 2010. Morpho-anatomical and physiological responses of two Dendranthema species to waterlogging. Environmental and Experimental Botany, 68(2): 122-130.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

