文章信息
- 陆秀君, 张晓林, 刘广林, 李天来
- Lu Xiujun, Zhang Xiaolin, Liu Guanglin, Li Tianlai
- PEG分级沉淀法分析天女木兰种子的低丰度蛋白
- Polyethylene Glycol Fractionation Analysis of Low-Abundant Proteins in Magnolia sieboldii Seeds
- 林业科学, 2013, 49(11): 189-194
- Scientia Silvae Sinicae, 2013, 49(11): 189-194.
- DOI: 10.11707/j.1001-7488.20131127
-
文章历史
- 收稿日期:2012-11-16
- 修回日期:2013-04-07
-
作者相关文章
2. 沈阳农业大学园艺学院 沈阳 110866;
3. 沈阳农业大学设施园艺省部共建教育部重点实验室 沈阳 110866
2. College of Horticulture, Shenyang Agricultural University Shenyang 110866;
3. Key Laboratory of Protected Horticulture of Ministry of Education, Shenyang Agricultural University Shenyang 110866
蛋白质组学研究的瓶颈问题之一是低丰度蛋白的检测,这些低丰度蛋白往往发挥多种重要的生理功能,如细胞防御、基因表达调节、信号传导等,因此低丰度蛋白的检测尤为重要。在双向电泳试验时,有2个因素限制了低丰度蛋白的检测:第一,IPG胶条的上样量有限;第二,高丰度蛋白的位置效应(王旭,2007)。例如,植物叶片中高丰度蛋白Rubisco含量超过50%(Gutteridge et al.,1995),这些高丰度蛋白的存在影响低丰度蛋白的分析。应用PEG分级提取法对水稻(Oryza sativa)叶片蛋白提取发现,叶片中的Rubisco酶被有效富集在15% PEG组分中(Kim et al.,2001;2003;2004;Lee et al.,2007a;2007b;2011;Zhang et al.,2010)。目前PEG分级提取法主要应用在草本植物中,并且不同植物的蛋白提取采用不同的PEG浓度配置。例如,拟南芥(Arabidopsis thaliana)叶片蛋白提取采用16%的PEG浓度(Xi et al.,2006);Aryal等(2012)进一步证明在5%,10%,15% 3个PEG浓度都有Rubisco酶富集。目前在番茄(Lycopersicon esculentum)(Ahsan et al.,2007)、洋蓟(Cynara cardunculus var.scolymus)(Acquadro et al.,2009)、向日葵(Helianthus annuus)(Walliwalagedara et al.,2010)、水稻叶鞘(王莹等,2011)、黄瓜(Cucumis sativus)(任丽萍等,2011)、甜瓜(Cucumis melon)(钟俐等,2012)、大豆(Glycine max)、芒草(Miscanthussinensis)、卷心菜(Brassica oleracea var. capitata)、花生(Arachis hypogaea)(Alam et al.,2013)叶片蛋白提取中均有报道。木本植物中,目前只发现在野茶树(Camellia sinensis)叶片蛋白提取中应用PEG分级提取法,PEG浓度采用15%(Alam et al.,2013),而在其他木本植物研究中还鲜有报道。
在天女木兰(Magnolia sieboldii)种子蛋白双向电泳体系建立过程中发现,在电泳图谱的30 kDa和50 kDa附近有2条明显的高丰度蛋白条带,推测这2条高丰度蛋白条带为天女木兰种子储藏蛋白,在高丰度蛋白干扰下,使得对低丰度蛋白的检测以及深入分析研究变得非常困难。因此,本研究以天女木兰种子为材料,根据PEG分子与蛋白分子之间的空间排查作用,设置不同的PEG浓度梯度,对种子蛋白进行分级分离,将高丰度蛋白富集在单一组分中,提高对低丰度蛋白的检测,增加电泳图谱的分辨率,建立适用于天女木兰种子蛋白质高通量分析的提取方法。
1 材料与方法 1.1 材料供试天女木兰种子采摘于沈阳农业大学植物园。
1.2 主要仪器和试剂Manifold胶条槽、EttanIPGphorⅢ等点聚焦仪、SE 600 Ruby垂直电泳仪、Multi TempⅢ温度控制仪,均为GE Healthcare公司产品;UMAX Power look 2100XL扫描仪购自UMAX公司。
双向电泳常规试剂参照张晓林等(2012)方法,PEG分级主要试剂:聚乙二醇(PEG4000)、乙基苯基聚乙二醇(NP-40)。所有溶液均用超纯水配置。
1.3 样品制备1)TCA-丙酮法 参照Damerval等(1986)的方法并略有改进。取3 g天女木兰种子,去掉外种皮液氮冷冻研磨,加入30 mL预冷的丙酮溶液(含质量分数10%的三氯乙酸和体积分数0.07%的β-巯基乙醇),-20 ℃静置2 h或沉淀过夜,于4 ℃、15 000×g离心30 min,弃上清,沉淀用5倍体积预冷的体积分数80%丙酮(含体积分数0.07%的β-巯基乙醇)溶液清洗,于-20 ℃静置30 min,4 ℃、15 000×g离心30 min,弃上清,重复6次,最后沉淀即为全蛋白,冷冻干燥后放-70 ℃保存。
2)蛋白质PEG分级提取法 参照Kim等(2001)方法并略有改进。操作步骤如图 1,具体方法如下:取10 g天女木兰种子去掉外种皮,液氮冷冻研磨。加入4倍体积4 ℃预冷的Mg/NP-40蛋白提取液,充分混匀后4 ℃、13 000×g离心15 min,收集上清,沉淀用Mg/NP-40提取液洗涤1次,同样参数离心,上清液与前一步上清液混合,沉淀部分经检测蛋白含量很少,故舍弃;向上清液中加入50%PEG溶液,使其浓度达到8%,冰浴30 min。4 ℃、2 000×g离心10 min,所得沉淀部分为F1;上清液继续加入50% PEG溶液,使其浓度达到14%,冰浴30 min。4 ℃、13 000×g离心15 min,所得沉淀部分为F2;上清液继续加入50% PEG储备液,使其浓度达到20%,冰浴30 min。4 ℃、13 000×g离心15min,所得沉淀部分为F3;最后的上清液加入4倍体积预冷的丙酮溶液(含质量分数10%的三氯乙酸和体积分数0.07%的β-巯基乙醇),-20 ℃静置2 h或过夜,4 ℃、15 000×g离心15 min,得到的沉淀部分为F4;F1,F2,F3,F4分别加入5倍体积预冷的丙酮溶液(含质量分数10%的三氯乙酸和体积分数0.07%的β-巯基乙醇),-20 ℃静置2 h或过夜,4℃、15 000×g离心30 min,弃上清,加入5倍体积预冷的80%丙酮(含体积分数0.07%的β-巯基乙醇)清洗,-20 ℃静置30 min,4 ℃、15 000×g离心30 min,弃上清,重复6次;冷冻冻干后于-70 ℃保存。
 |
图 1 PEG分级法提取种子全蛋白质样品流程
Fig. 1 Flowchart of PEG classification method toextract the seed protein sample
|
采用垂直板SDS-PAGE分析各分级蛋白质组分,凝胶面积7 cm×7 cm,厚度1 mm,浓缩胶为3%,分离胶12.5%。样品上样量3 μg,电泳参数为60 V/胶30 min和130 V/胶1.5 h。
1.5 蛋白质裂解及定量分别称取5 mg蛋白干粉至500 μL裂解缓冲液(9 mol·L-1尿素,2 mol·L-1硫脲,质量分数0.001%溴酚蓝,体积分数2% IPGBuffer,质量分数4% CHAPS,体积分数1% TBP,质量分数1% DTT,体积分数1%鸡尾酒)中,30 ℃水浴裂解3 h,13 000×g常温离心10 min,弃沉淀,Bradford法测定蛋白浓度。
1.6 双向电泳本试验采用11 cm(pH值3~11NL)IPG胶条进行等电聚焦,上样量和上样体积分别为200 μg和200 μL,根据测定的裂解液中蛋白浓度,向胶条槽中加入含有200 μg蛋白样品的裂解液并用未溶解蛋白的裂解液补齐至200 μL。将胶条胶面朝下放入胶条槽中,水平置于Ettan IPGphorⅢ等点聚焦仪上,等电聚焦电泳参数: 50 V(12 h),100 V(3 h),250 V(3 h),500 V(3 h),1 000 V(1 h),6 000 V升压3 h,6 000V聚焦30 000 Vh,500 V(24 h)。
IPG胶条等电聚焦后,采用两步平衡法,在平衡液Ⅰ(6 mol·L-1尿素,质量分数2% SDS,体积分数20%甘油,0.05 mol·L-1 Tris-HCl pH值8.8,质量分数2%二硫苏糖醇)和平衡液Ⅱ(6 mol·L-1尿素,质量分数2% SDS,体积分数20%甘油,0.05 mol·L-1Tris-HCl pH值8.8,质量分数2.5%的碘乙酰胺)中各振荡平衡15 min。平衡后进行SDS-PAGE电泳,胶浓度T=12.5%,电泳参数为5 mA/胶30 min和25 mA/胶4 h。采用硝酸银染色法对凝胶进行染色。UMAX Power look 2100XL扫描仪采集凝胶图像,PDQuest7.3.1software软件对图像进行分析。
2 结果与分析 2.1 PEG分级法与全蛋白提取法比较为了检验分级效果,将4个分级组分(F1,F2,F3,F4)和全蛋白样品NF(TCA-丙酮提取法)进行垂直板SDSPAEG分析(图 2)。结果表明:不同组分间的蛋白质谱带存在明显差异,表明种子全蛋白经过PEG分级已经得到有效分离。NF全蛋白组分中有2条明显高丰度蛋白条带(33 kDa向上箭头和50 kDa向下箭头),而在F1,F3组分中各有一条高丰度蛋白条带,条带颜色较深,F1组分中在33 kDa附近有1条高丰度蛋白条带(向上箭头),F3组分在50 kDa附近有2条高丰度蛋白条带(向下箭头)。而F2和F4组分中条带分布比较均匀,在同一区域内条带较浅,并且F3组分中蛋白条带较少,表明全蛋白中的2种高丰度蛋白主要富集在F1和F3组分中。
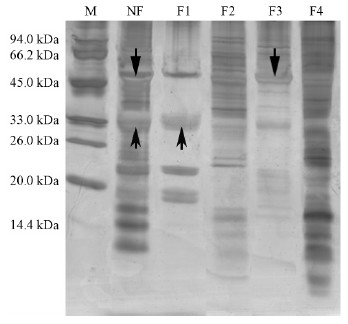 |
图 2 PEG分级各组分(F1-F4)和全蛋白(NF)的SDS-PAGE分析
Fig. 2 SDS-PAGE analysis of PEG classification of eachcomponent(F1-F4) and whole protein(NF)
M:标准蛋白St and ard protein. |
为了进一步检测蛋白质样品分级效果,对分级制备的蛋白质各组分与全蛋白进行双向电泳比较,见图 3。
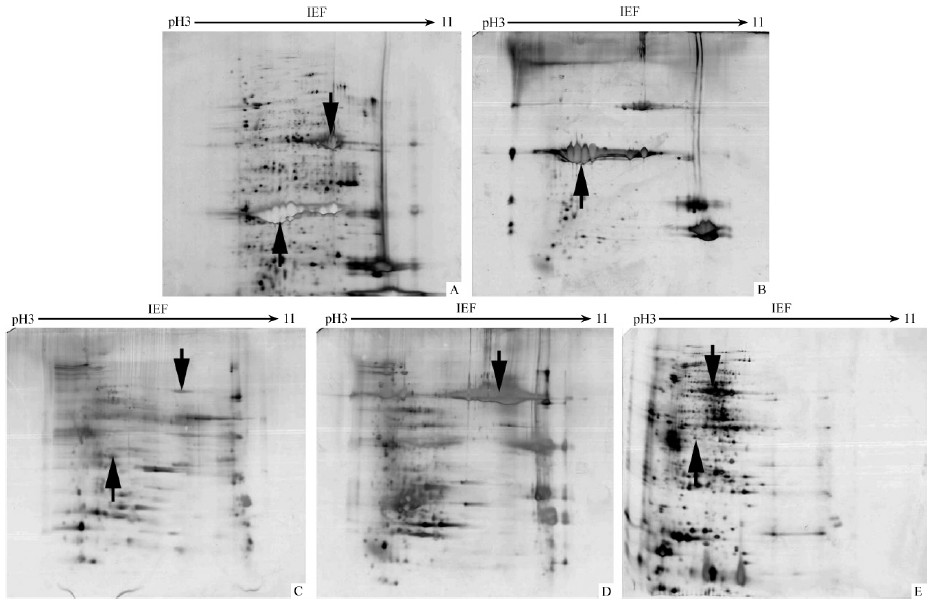 |
图 3 全蛋白(NF)和PEG分级组分的2-DE分析
Fig. 3 2-DE analysis of whole protein(NF) and PEG classification of components
2A: TCA-丙酮全蛋白提取法;B,C,D,E为分级组分F1,F2,F3,F4。A: TCA-acetone extraction method;B,C,D,E: PEG classification of components F1-F4. |
从图 3可以看出,在TCA-丙酮法制备的全蛋白质图谱(图 3A)中间区域有2个蛋白点(向下箭头和向上箭头)占整个图谱的面积比较大,独立蛋白点少,特别是向上箭头指示的高丰度蛋白对低丰度蛋白遮挡明显。而在PEG分级提取法蛋白图谱(图 3B~E)的2个高丰度蛋白分别存在于F1,F3组分中,在F2,F4组分中高丰度蛋白含量相对减少,从而使在上样量相同的情况下,F2,F4中的低丰度蛋白比例增加,提高了低丰度蛋白的检测率。
2.2 PEG分级组分与全蛋白(NF)均一性分析PEG分级4个组分电泳图谱上的蛋白点有一定的重叠,利用PDQuest软件对相邻组分图谱上的蛋白点进行匹配,计算出蛋白点重叠率,见表 1。不同组分蛋白点重叠率不同,且在F2和F3组分间蛋白点重叠率较高。
|
|
为了进一步评价分级组分和全蛋白质的均一性,利用软件对分级和全蛋白进行匹配,统计结果见表 2。由表 2可知,通过分级后蛋白点数量明显增多,增加了检测的低丰度蛋白点数。尽管相邻组间的蛋白点有一定重叠,但4个分级组分的蛋白点总数超过1 700个,而全蛋白提取法有900个左右,各分级组分总蛋白点中平均有800个点与全蛋白提取法重叠,匹配率达到了90%以上,表明全蛋白仍然分布在各分级组分中,说明分级后不仅保证了全蛋白的完整性,而且大大增加了凝胶蛋白点的检测数量,检测到的蛋白点数是未分级的2倍以上。因此,PEG浓度8%和20%有利于富集种子中的2种高丰度蛋白,PEG分级法可以作为天女木兰种子全蛋白一种有效的提取方法。
|
|
为了验证PEG分级法对高丰度蛋白的分离效果,对全蛋白和PEG分级组分的蛋白质双向电泳凝胶进行比较分析,并分别在全蛋白和F4凝胶图像中截取相同区域行进对比,如图 4,分级组分的蛋白点数明显提高,全蛋白和分级蛋白组分的蛋白点数分别为15和30,很多在全蛋白质图谱中检测不到的蛋白点经过分级后清晰可见,而且一些蛋白点的丰度也有很显著的变化。可见蛋白样品经过分级后,能明显提高蛋白点的检测数量和低丰度蛋白点的检测效果。
 |
图 4 凝胶局部区域PEG分级法与TCA-丙酮法提取蛋白点数目比较
Fig. 4 Number of protein spots of gel local area PEG grading and TCA-acetone extraction
A: TCA-丙酮全蛋白提取法TCA-acetone extraction method.B: PEG分级F4组分PEG classification of components F4. |
蛋白质样品的制备是蛋白质组学的关键步骤,而植物样品中不同蛋白质的数量差异很大,细胞内蛋白丰度的动态变化范围可达到6个数量级(Görg et al.,2004)。例如植物叶片中参与光合碳同化的关键酶Rubisco,在叶片中的含量超过50%;种子内储藏物质的重要组分———储藏蛋白,由于其含量大,也会遮挡低丰度蛋白的检测。因此,应根据样品和试验目的的不同,采取不同的和有针对性的样品制备方法。有研究发现,PEG浓度为15%时能有效富集水稻叶片中高丰度蛋白Rubisco和种子中的高丰度蛋白(Kim et al.,2001);PEG浓度为16%时能有效富集拟南芥中的高丰度蛋白Rubisco(Xi et al.,2006);20% PEG沉淀适用于灌浆期水稻叶鞘低丰度蛋白的检测(王莹等,2011);PEG浓度为15%时能富集甜瓜叶片中的大部分Rubisco酶(钟俐等,2012);PEG浓度为24%时能有效富集黄瓜叶片中的高丰度蛋白Rubisco(任丽萍等,2011)。大豆、芒草、卷心菜、花生、野茶树叶片中的Rubisco酶主要富集在15%的PEG组分中(Alam et al.,2013)。
本试验中利用PEG分级法将天女木兰种子蛋白样品分离成4个组分,能有效地把种子中的高丰度蛋白分别富集在单一组分内,提高了低丰度蛋白的检测率。利用这种方法,4个组分蛋白点总数超过1 770个,是未分级样品的2倍以上,发现许多在常规提取方法下无法检测到的低丰度蛋白点。本研究建立了适合天女木兰种子蛋白质样品分级沉淀的方法,有利于种子蛋白质组学的深入研究。但试验中PEG各分级组分与TCA-丙酮法约有10%的蛋白点不匹配,可能有以下3个方面原因: 1)蛋白点在多步骤分级提取过程中造成损失;2)PEG分级沉淀法与TCA-丙酮法在原理上有一定差异,三氯乙酸是一种表面活性剂,其沉淀原理是利用蛋白质、酶和核酸等生物大分子对某些物理或化学因素敏感性不同,有选择地使之变性沉淀,以达到分离提纯的目的。聚乙二醇是非离子多聚物,沉淀原理是使生物大分子在同一液相中,由于被排斥相互凝聚而沉淀析出(Atha et al.,1981);3)多个分级组分同时等电聚焦,相互干扰,造成聚焦不完全。样品中的杂质会影响蛋白的溶解和等电聚焦,其中盐含量对聚焦效果的影响最严重(Rabillod,1996),本试验是4个组分(F1-F4)同时聚焦,由于不同样品中的盐浓度不同,必然会影响等电聚焦效果,其中F4组分聚焦效果较差。通过后期大量试验发现,上清(F4)组分单独进行聚焦时,效果明显好于各组分同时聚焦,分级组分中上清(F4)对聚焦条件要求较高,因此认为,2种提取方法蛋白点不匹配,可能是由于样品中的盐含量高,同时等电聚焦相互干扰所致。
在试验中可根据需要调整PEG浓度和梯度,达到分离高丰度蛋白的效果。考虑到F2组分蛋白点较少,且F2和F3蛋白点的重叠率较高,故将F2,F3组分合并。在提取天女木兰种子蛋白样品时可选择PEG浓度在8%,20% 2个浓度梯度和上清液3个组分来进行蛋白样品沉淀。
后期经过质谱鉴定发现,本试验TCA-丙酮提取法电泳图谱中的高丰度蛋白为豆球蛋白,豆球蛋白是豆科和非豆科植物种子中主要的储藏蛋白。分级沉淀提取法有效去除了天女木兰种子中高丰度蛋白对低丰度蛋白的干扰。天女木兰种子萌发过程中差异蛋白点比较发现,经过PEG分级处理后,高丰度蛋白遮挡位置存在差异蛋白点,经质谱鉴定为丝氨酸羧肽酶和S-腺苷甲硫氨酸合成酶,这2种低丰度蛋白与种子萌发(Lehfeldt et al.,2000)和蛋白质合成(Tabor et al.,1985)合成代谢相关。试验结果表明低丰度蛋白很可能是与重要特征或生理功能相关的调控蛋白,从它们着手更容易找到植物生理调节机制的突破口,因此,低丰度蛋白的分离和鉴定尤为重要。
尽管本方法在分级后获得了更多的蛋白质点用于蛋白质组分析,但需根据试验需要,结合其他方法,以获得不同类型的蛋白质。
| [1] |
任丽萍, 范海延, 王珊珊,等. 2011.黄瓜叶片蛋白质双向电泳样品分级优化.西北植物学报, 31(8): 1706-1710.( 2) 2)
|
| [2] |
王 旭. 2007. PEG分级沉淀方法及其在拟南芥低温胁迫蛋白质组学研究中的应用. 长春: 吉林大学硕士学位论文.( 1) 1)
|
| [3] |
王 莹, 崔为同, 杨明峰,等. 2011.一种有效检测水稻叶鞘低丰度蛋白的方法.草业学报, 20(3): 192-197.( 2) 2)
|
| [4] |
张晓林, 陆秀君, 马蓓蓓,等. 2012.天女木兰种子蛋白双向电泳体系的建立.西北农林科技大学学报: 自然科学版, 40(8): 207-214.( 1) 1)
|
| [5] |
钟 俐, 马成梅, 梁永增,等. 2012.甜瓜叶片中 Rubisco 的去除及双向电泳体系的优化.植物生理学报, 48(3): 303-309.( 2) 2)
|
| [6] |
Acquadro A, Falvo S, Mila S, et al. 2009.Proteomics in globe artichoke: protein extraction and sample complexity reduction by PEG fractionation.Electrophoresis, 30(9): 1594-1602.( 1) 1)
|
| [7] |
Ahsan N, Lee D G, Lee S H, et al. 2007.A comparative proteomic analysis of tomato leaves in response to waterlogging stress.Physiologia Plantarum, 131(4): 555-570.( 1) 1)
|
| [8] |
Alam I, Sharmin S, Kim K, et al. 2013.An improved plant leaf protein extraction method for high resolution two-dimensional polyacrylamide gel electrophoresis and comparative proteomics.Biotechnic & Histochemistry, 88(2): 61-75.( 2) 2)
|
| [9] |
Aryal U K, Krochko J E, Ross A R. 2012.Identification of phosphoproteins in Arabidopsis thaliana leaves using polyethylene glycol fractionation, immobilized metal-ion affinity chromatography, two-dimensional gel electrophoresis and mass spectrometry.Journal of Proteome Research, 11(1): 425-437.( 1) 1)
|
| [10] |
Atha D H, Ingham K C. 1981.Mechanism of precipitation of proteins by polyethylene glycols. Analysis in terms of excluded volume. Journal of Biological Chemistry, 256(23):12108-12117.( 1) 1)
|
| [11] |
Damerval C, De Vienne D, Zivy M, et al. 1986.Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins.Electrophoresis, 7(1): 52-54.( 1) 1)
|
| [12] |
Görg A, Weiss W, Dunn M J. 2004.Current two-dimensional electrophoresis technology for proteomics.Proteomics, 4(12): 3665-3685.( 1) 1)
|
| [13] |
Gutteridge S, Gatenby A A. 1995.Rubisco synthesis, assembly, mechanism, and regulation. Plant Cell, 7(7): 809-819.( 1) 1)
|
| [14] |
Kim S T, Cho K S, Jang Y S, et al. 2001.Two-dimensional electrophoretic analysis of rice proteins by polyethylene glycol fractionation for protein arrays.Electrophoresis, 22(10): 2103-2109.( 3) 3)
|
| [15] |
Kim S T, Cho K S, Yu S, et al. 2003.Proteomic analysis of differentially expressed proteins induced by rice blast fungus and elicitor in suspension-cultured rice cells.Proteomics, 3(12): 2368-2378.( 1) 1)
|
| [16] |
Kim S T, Kim S G, Hwang D H, et al. 2004.Proteomic analysis of pathogen-responsive proteins from rice leaves induced by rice blast fungus, Magnaporthe grisea.Proteomics, 4(11): 3569-3578.( 1) 1)
|
| [17] |
Lee D G, Ahsan N, Lee S H, et al. 2007a.A proteomic approach in analyzing heat-responsive proteins in rice leaves.Proteomics, 7(18): 3369-3383.( 1) 1)
|
| [18] |
Lee D G, Ahsan N, Lee S H, et al. 2007b.An approach to identify cold-induced low-abundant proteins in rice leaf.Comptes Rendus Biologies, 330(3): 215-225.( 1) 1)
|
| [19] |
Lehfeldt C,Shirley A M,Meyer K, et al. 2000.Cloning of the SNG1 gene of Arabidopsis reveals a role for a serine carboxypeptidase-like protein as an acyltransferase in secondary metabolism. Plant Cell Online, 12(8): 1295-1306.( 1) 1)
|
| [20] |
Rabilloud T. 1996. Solubilization of proteins for electrophoretic analyses.Electrophoresis, 17(5):813-829.( 1) 1)
|
| [21] |
Tabor C W,Tabor H. 1985.Polyamines in microorganisms.Microbiological Reviews, 49(1): 81.( 1) 1)
|
| [22] |
Walliwalagedara C, van Keulen H, Cutright T, et al. 2010.Comparison of sample preparation methods for the resolution of metal-regulated proteins in helianthus annuus by 2-dimensional gel electrophoresis. Open Proteomics Journal, 3: 20-25.( 1) 1)
|
| [23] |
Xi J, Wang X, Li S, et al. 2006.Polyethylene glycol fractionation improved detection of low-abundant proteins by two-dimensional electrophoresis analysis of plant proteome.Phytochemistry, 67(21): 2341-2348.( 2) 2)
|
| [24] |
Zhang A, Lu Q, Yin Y, et al. 2010.Comparative proteomic analysis provides new insights into the regulation of carbon metabolism during leaf senescence of rice grown under field conditions.Journal of Plant Physiology, 167(16): 1380-1389.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49
