文章信息
- 陈大风, 李叶静, 孔祥波, 张真, 王鸿斌, 焦相杰, 段瑞龙, 陈洁, 李继峰
- Chen Dafeng, Li Yejing, Kong Xiangbo, Zhang Zhen, Wang Hongbin, Jiao Xiangjie, Duan Ruilong, Chen Jie, Li Jifeng
- 落叶松八齿小蠹对聚集信息素和寄主挥发性萜烯成分的电生理响应
- Olfactory Reception of Conspecific Aggregation Pheromone and Host Volatile Terpenes by Asian Larch Bark Beetle, Ips subelongatus
- 林业科学, 2013, 49(11): 89-97
- Scientia Silvae Sinicae, 2013, 49(11): 89-97.
- DOI: 10.11707/j.1001-7488.20131112
-
文章历史
- 收稿日期:2013-04-16
- 修回日期:2013-08-02
-
作者相关文章
2. 内蒙古自治区克什克腾旗广兴林场 克什克腾 025350;
3. 内蒙古自治区克什克腾旗大局子林场 克什克腾 025350
2. Guangxing Forest Farm of Keshiketeng Qi of Inner Mongolia Keshiketeng 025350;
3. Dajuzi Forest Farm of Keshiketeng Qi of Inner Mongolia Keshiketeng 025350
落叶松八齿小蠹(Ips subelongatus)属鞘翅目(Coleoptera)象甲科(Curculionidae)小蠹亚科(Scolytinae)齿小蠹属(Ips),是危害落叶松(Larix spp.)的重要蛀干害虫,主要危害衰弱木、风倒木和火烧木。该虫猖獗成灾时,也危害健康的活立木,可导致森林大面积死亡,对落叶松人工林或天然林造成巨大危害(于诚铭,1992 ; Zhang et al.,1992)。在我国东北地区,落叶松八齿小蠹寄主主要有兴安落叶松(L.gmelinii)、长白落叶松(L.olgensis)、华北落叶松(L.principis-rupprechtii)和日本落叶松(L.kaempferi)等(章士美等,1996)。虽然落叶松八齿小蠹与欧洲落叶松齿小蠹(I.cembrae)的寄主与地理分布不同,但由于外部形态非常相似,因而在2000年以前欧洲昆虫学家认为两者是同种异名。到2001年,Stauffer等(2001)通过线粒体 DNA 细胞色素氧化酶 I 基因(COI)标记分析,发现落叶松八齿小蠹欧洲种群和亚洲种群COI基因序列存在4.3%的差异,因此将亚洲种群定为不同于欧洲种群的一个独立物种,即I.subelongatus。
欧洲落叶松齿小蠹主要以(-)- 小蠹烯醇、(+)- 小蠹二烯醇和3-甲基-3-丁烯 -1-醇作为聚集信息素成分,实现种内信息交流(Stoakley et al.,1978 ; Francke et al.,1983); 但是成虫后肠微量成分单萜醇(amitinol)对3组分的聚集信息素有显著的增效作用(Kohnle et al.,1988),而低释放剂量的3-甲基-3-丁烯-1-醇也是提高诱捕量的关键因子(Zhang et al.,1995)。 Zhang等(2000)鉴定了落叶松八齿小蠹的聚集信息素成分,发现东北地区落叶松八齿小蠹后肠提取物中除了含有欧洲落叶松齿小蠹的3种主要聚集信息素成分外,还含有6种微量腺体成分(2-苯基乙醇、香叶醇、小蠹烯酮、小蠹二烯酮、桃金娘烯醇和马鞭草烯酮),腺体成分中不含有欧洲落叶松齿小蠹的微量有效成分 Amitinol。Zhang等(2007)进一步研究了落叶松八齿小蠹对来自寄主、非寄主和成虫释放的信息化学物质的电生理和行为活性。结果表明: 落叶松八齿小蠹对成虫腺体成分小蠹烯醇和小蠹二烯醇有 EAD 反应,对寄主成分α-蒎烯,β-蒎烯和对伞花烃有 EAD 反应; 对非寄主成分如正己醇、顺-3 -己烯-1-醇、反-3-己烯-1-醇、反-2-己烯-1-醇、1-辛烯-3-醇、3-辛醇、里哪醇、香叶基丙酮和苯乙醇有 EAD 反应; 内蒙古野外诱捕试验表明小蠹烯醇对落叶松八齿小蠹雌雄均有强烈的吸引力(Zhang et al.,2007)。Song等(2010)在我国东北吉林和内蒙古地区利用落叶松八齿小蠹的聚集信息素成分(小蠹烯醇、小蠹二烯醇和3-甲基-3-丁烯-1-醇)进行野外诱捕试验,发现3 -甲基-3-丁烯-1-醇无引诱效应,(-)-小蠹烯醇在内蒙古克什克腾旗及(-)- 小蠹烯醇和(+)- 小蠹二烯醇混合物在吉林省净月潭公园表现出强烈的引诱活性,说明落叶松八齿小蠹不同地理种群对聚集信息素的响应可能发生了分化。
寄主植物挥发物在小蠹虫寄主定位和产卵繁殖等行为中发挥了重要作用。利用健康木和衰弱木挥发性化学成分的差异,小蠹虫能从寄主树种中识别抗性较弱、易于攻击和定殖的衰弱木作为繁殖材料(Byers et al.,1987)。我国东北地区主要分布着兴安落叶松、长白落叶松和华北落叶松,为揭示落叶松八齿小蠹寻找寄主和聚集行为机制,笔者分析了3种落叶松单萜类挥发物的差异以及落叶松八齿小蠹对单萜类化合物和聚集信息素的电生理活性,进一步探索饵木引诱落叶松八齿小蠹的作用机制,为落叶松八齿小蠹的饵木防治技术提供科学指导。
1 材料与方法 1.1 落叶松八齿小蠹及落叶松挥发性萜烯成分的采集落叶松八齿小蠹寄主挥发性成分的采集地点、日期及寄主种类信息见表 1 。
|
|
利用大气采样仪(QC-1型,北京劳动保护研究所生产)和采样管(Chrompack,Φ 0.6 cm × 16 cm)对落叶松树干和针叶挥发性萜烯成分进行动态顶空采集。每根采样管填充150 mg 吸附剂 Porapak Q(50-80目,购自 CNW Techonologies),采样前采样管在200 ℃高温条件下氮气保护老化2 h,采样管两端用铝箔纸封口,装到保温桶中带到采样地点。落叶松树干和枝叶用聚乙烯袋包裹(Toppits ®,35 cm × 43 cm,klippan,Sweden),采样管通过特氟
龙管连接到大气采样仪的进气口,采样气流为0.5L·min -1,采集时间为1 h。每个采样地点选取6株胸径为20 cm左右的落叶松分别进行树干采样和针叶采样(n=3)。采集后的吸附管用铝箔纸封闭管的两端,放到冰盒中带回实验室。室内用色谱纯的正己烷洗脱,4 mL 洗脱液在微弱的氮气流下浓缩到1.5 mL,置于-20 ℃冰箱中备用。
落叶松八齿小蠹成虫采集于辽宁省抚顺市温道林场的风倒木或衰弱木上,放到储有少许树皮的离心管中带回实验室,保存在6 ℃冰箱内备用。
1.2 化学标准品本试验中所用的化学标准品来源及纯度见表 2 。其中,碳氢化合物标样是含有 C8-C40的混标(AccuStandard©,New Haven,CT),母液浓度500μg·mL-1,使用时稀释成10 ng·μL-1。
|
|
落叶松挥发性萜烯成分在7890 A 气相色谱仪(Agilent,Palo Alto,CA,USA)上分析。氮气作载气(柱头压10 psi),无分流进样(0.75 min 后开阀),检测器为火焰离子化检测器(FID)。色谱分析条件是: CycloSil-B 毛细管色谱柱(30 m ×0.25 mm i.d.× 0.25 μm film thickness,J & W Scientific,Folsom,CA,USA),60 ℃保持1 min,以4 ℃·min -1升温至200 ℃,在200 ℃保持5 min。进样口和检测器温度均为200 ℃。手动进样,从1.5 mL的洗脱液中取1 μL 稀释10倍后进样1 μL,Agilent GC Chemstation(Rev A.08.03)软件采集数据。
1.3.2 GC-MS 分析落叶松挥发性萜烯成分进一步在 Finnigan Trace DSQ 质谱仪上分析(EI源,70 eV,splitless mode)。质谱质量扫描范围是41~ 560 u,离子源温度是220 ℃,灯丝电流是150 μA。气相色谱装有 DB-5 MS 毛细管色谱柱(30 m ×0.25 mm i.d.× 0.25 μm film thickness,J & W Scientific,Folsom,CA,USA),升温程序是60 ℃保持1 min,6 ℃·min -1升温至220 ℃,保持20 min。氦气做载体(1.0 mL·min -1),进样器温度为220 ℃,传输线温度为250 ℃。
1.4 触角电位(EAG)和气相色谱-触角电位联用(GC-EAD)分析 1.4.1 落叶松八齿小蠹对挥发性萜烯成分和聚集信息素不同异构体的选择性触角的连接:用剃须刀片将落叶松八齿小蠹雄虫或雌虫触角从基部切下,直接使用导电胶(Spectra 360 electrode gel,Parker Laboratories Inc.,Orange,NJ,USA)将切下的触角连接到 EAG 的2个电极上(PRG-2,Syntech,Kirchzarten,Germany)。将接好触角的电极放置到“L”型玻璃管出口端内2 cm 处。 EAG 电极的外部放大系数为10 ×,刺激持续1 s。
萜烯混合物和信息素标准品进行 GC-EAD 分析时,1 μL 萜烯混合物(每个样品浓度是60 ng·μL-1)或小蠹烯醇和小蠹二烯醇混合物(每个异构体浓度是30 ng·μL-1)无分流进样到 HP6890 GC(Agilent Technologies,Palo Alto,CA,USA)。GC 分析色谱柱为 CycloSil-B 毛细管色谱柱(30 m ×0.25 mm × 0.25 μm,J & W Scientific,Folsom,California),样品在柱尾端经分流器(SGE,part # OSS-2)1 ∶ 1分流,分流组分一部分到 FID 检测器,另一部分到 EAD 检测器。 GC 分析条件: 起始温度50 ℃,保持1 min,以6 ℃·min -1的升温速率升到80 ℃,再以2 ℃·min -1的升温速率升到200 ℃,然后保持10 min; 进样口和检测器温度均为220 ℃ ;氮气做载气,柱头压为10 psi。EAD 分析条件: EAD出口以500 mL·min -1的湿润的空气流吹过触角;EAD 信号通过外部放大器放大10 ×后记录输出。
1.4.2 落叶松八齿小蠹对挥发性萜烯成分和聚集信息素的敏感性进行萜烯标准品和聚集信息素标准品剂量反应关系研究时,将测试化合物的正己烷溶液以0.01,0.1,1,10,100,1 000 μg的绝对量分别滴加到巴斯德管中的滤纸条上(0.5 cm × 5 cm),并以正己烷作对照。刺激时每种化合物随机选取,并由低浓度向高浓度的顺序依次刺激触角,刺激时间间隔是50~60 s,每测试3个浓度样品时就测试1次对照,且每根触角接受3种化合物的刺激后就更换新触角。每种萜烯化合物刺激落叶松八齿小蠹雌雄成虫各15头,每头试虫仅用其1根触角。进行触角电位分析时湿润的空气流速为900 mL·min -1 。
1.5 数据分析 1.5.1 色谱保留指数系列正烷烃以10 ng 的量加入到分析样品中,进行GC或GC-MS分析,记录各正烷烃的色谱保留时间,根据下面的公式计算标准品和分析样品的Kováts 指数值(Marques et al.,2000)。通过与标准品比对色谱保留时间和Kováts色谱保留指数鉴定寄主挥发物成分。
$ {\rm{KI = 100}}n{\rm{ + 100(}}N - n{\rm{)}} \times \frac{{{t_R}(unknown)- {t_R}(n)}}{{{t_R}(N)- {t_R}(n)}} $
式中:n和N 表示鉴定样品色谱峰前面和后面正烷烃色谱峰具有的碳原子数,tR(n)和tR(N)表示鉴定样品前面和后面相应碳原子数的正烷烃色谱峰的保留时间,tR(unknown)表示待鉴定样品色谱峰的保留时间。
1.5.2 寄主挥发性成分定量及统计分析采用内标法(庚酯10 ng·μL-1)对寄主挥发性萜烯成分进行定量,最终换算成每小时的释放量(μg·h-1)。寄主挥发性单萜成分经SPSS18.0(IBM,Chicago,IL,USA)软件进行方差分析,在α=0.05的水平下,通过LSD进行多重比较分析。
1.5.3 触角电位分析测试样品触角电位的测试值与对照平均值的差值作为测试样品触角电位的绝对值。萜烯标准品 EAG 测试绝对值利用 SPSS18.0(IBM,Chicago,IL,USA)软件进行方差分析,在α=0.05的水平下,通过 LSD 进行多重比较分析。落叶松八齿小蠹的检测阈值和饱和水平根据 Sant'ana等(1999)提供的方法进行比较。
2 结果与分析 2.1 落叶松八齿小蠹3种落叶松寄主单帖烯挥发物分析3种落叶松主要单帖烯挥发物手性色谱分析结果见表 3。在3种落叶松中,针叶和树干的挥发性单萜烯成分主要是 S -(-)- α-蒎烯,R -(+)- α -蒎烯,3-蒈烯,R -(+)- β-蒎烯,S -(-)-β-蒎烯。这5种成分占3种树种挥发性萜烯成分的80% 以上,且在3种落叶松针叶挥发物中差异不显著,而在3种落叶松树干挥发物中仅 R -(+)- β-蒎烯和S -(-)- β -蒎烯差异不显著。另外,大部分针叶挥发性萜烯成分释放量是树干释放量的2~5倍。
|
|
对于树干挥发性萜烯成分,兴安落叶松 S -(-)- α-蒎烯的释放量达到42.29 μg·h-1,与华北落叶松(14.19 μg·h-1)和长白落叶松( 10.50μg·h-1)的释放量相比差异显著(P=0.02); 而长白落叶松的3-蒈烯释放量(38.49 μg·h-1)与华北落叶松(2.72 μg·h-1)和兴安落叶松(7.58μg·h-1)的释放量相比差异显著(P=0.01)。另外,(-)- 莰烯在兴安落叶松针叶和树干中的释放量均显著高于华北落叶松和长白落叶松的释放量。香叶烯在长白落叶松针叶和树干中的释放量均显著高于华北落叶松和兴安落叶松的释放量。
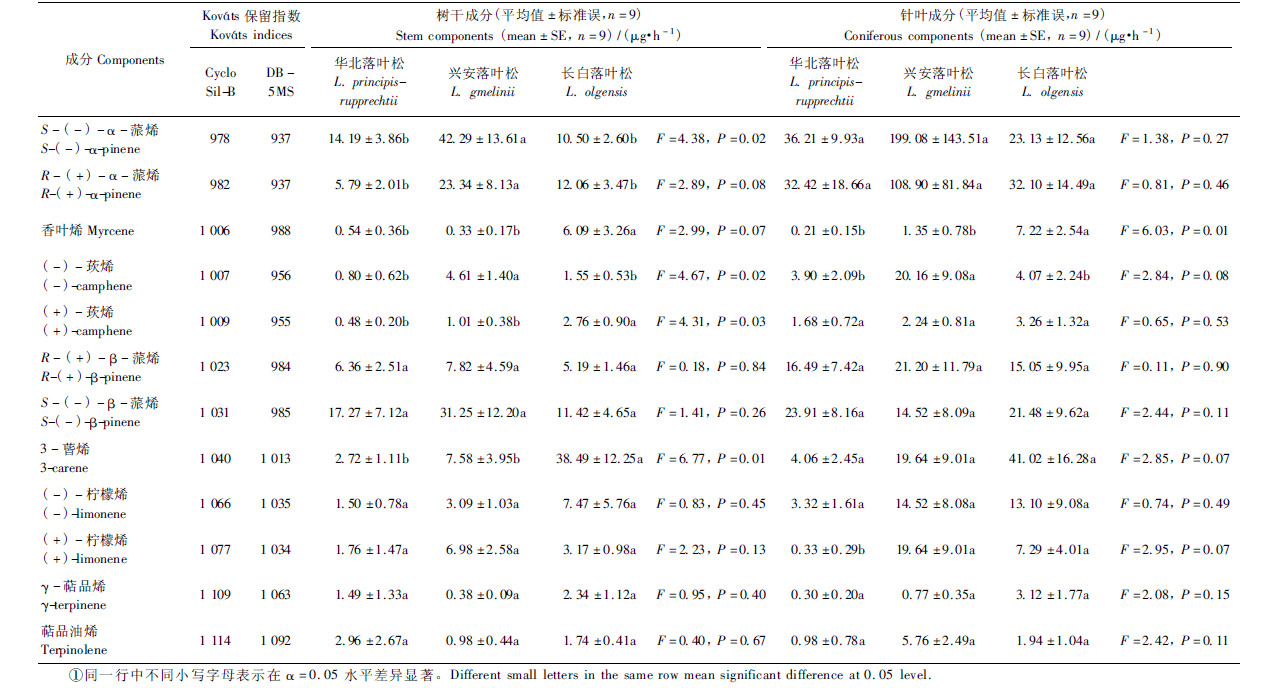
2.2 落叶松八齿小蠹触角对萜烯和聚集信息素成分手性异构体的选择性响应触角电位测试表明,在100 μg 刺激剂量下,落叶松八齿小蠹对香叶烯 [(1.15 ± 0.18)mV,n=20 ]、R -(+)- β-蒎烯 [(1.24 ± 0.16)mV,n=20 ]、3-蒈烯 [(1.06 ± 0.13)mV,n=20]和萜品油烯 [(1.39 ± 0.13)mV,n=20]的触角电位响应值都大于1 mV,且差异不显著(P<0.05); 对其他萜烯成分的触角电位响应值在0.32~0.96 mV 之间。在α=0.05的水平下,LSD 多重比较结果显示,(+)-和(-)- 莰烯的触角电位响应值显著低于其他萜烯物质(P<0.05),(+)- /(-)- 柠檬烯、(+)- /(-)- α-蒎烯及 S -(-)- β-蒎烯触角反应值居中,相互间差异不显著(图 1)。
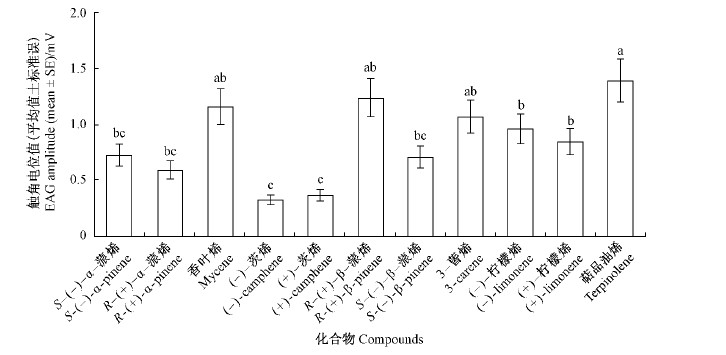 |
图 1 落叶松八齿小蠹(抚顺种群)对单萜烯类挥发物100μg刺激剂量的触角电位响应(n=20 ,α=0.05)
Fig. 1 The EAG responses of Ⅰ. subelongatus(Fushun population)to monoterpenes at the stimulus load of 100 μg(n=20 ,α=0.05)
|
GC-EAD 测试结果表明,落叶松八齿小蠹雌雄成虫对 S -(-)- α-蒎烯,3-蒈烯,对伞花烯和萜品油烯4种成分均表现出重复性的触角电位响应(图 2),反应顺序从强到弱依次是: 对伞花烯,3-蒈烯,S -(-)- α-蒎烯和萜品油烯。另外,雄虫触角对γ-萜品烯与雌虫触角对(+)- 柠檬烯有时也表现出弱的 EAD 响应。其他测试的单萜烯成分均没有 EAD 活性。
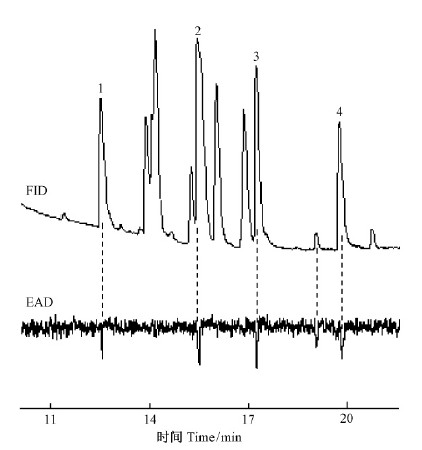 |
图 2 落叶松八齿小蠹(抚顺种群)对单萜烯标准品(50 ng)的 GC-EAD 反应
Fig. 2 The GC-EAD responses of Ⅰ. subelongatus (Fushun population)to monoterpenes
1.S -(-)-α -蒎烯 S-(-)-α-pinene; 2.3 -蒈烯3-carene;3.对伞花烃 p-cymene; 4.萜品油烯 Terpinolene. |
落叶松八齿小蠹聚集信息素成分小蠹烯醇和小蠹二烯醇的4个手性异构体 GC-EAD 测试结果表明,雌雄成虫对4个手性异构体的 EAD 响应表现出一定的差异(图 3)。雄虫对(-)- 小蠹烯醇有很强的 EAD 活性,对(-)- 小蠹二烯醇和(+)- 小蠹二烯醇也均表现出 EAD 活性。雌虫除了对(-)- 小蠹烯醇有很强的 EAD 活性外,仅对(-)- 小蠹二烯醇表现出较强的 EAD活性,而对(+)- 小蠹二烯醇基本没有 EAD 活性。雌雄成虫触角对(+)- 小蠹烯醇均没有 EAD活性。
 |
图 3 落叶松八齿小蠹(抚顺种群)雌雄成虫对聚集信息素成分手性异构体的触角电位响应
Fig. 3 Theolfactory discrimination of female and male Ⅰ. subelongatus(Fushun population)to chiral aggregation pheromones in the GC-EAD analysis
1.(-)-小蠹烯醇(-)-ipsenol; 2.(+)-小蠹烯醇(+)-ipsenol; 3.(-)-小蠹二烯醇(-)-ipsdienol;4.(+)-小蠹二烯醇(+)-ipsdienol. |
具有 EAD 活性的 S -(-)- α-蒎烯、3 -蒈烯、对伞花烃、γ- 萜品烯和萜品油烯的触角电位剂量-反应关系测试表明,这5种萜烯成分的触角电位响应值都是随着刺激浓度的增加而增强,且雌虫的敏感性高于雄虫(图 4)。落叶松八齿小蠹雌雄成虫对这5种单萜烯成分的检测阈值都是0.1 μg。雌雄成虫对γ- 萜品烯在100 μg刺激剂量下达到饱和水平[雌虫(1.33 ± 0.27)mV,雄虫(1.28 ± 0.23)mV],雄虫对对伞花烃在100 μg 刺激剂量下也达到饱和水平[(1.18 ± 0.23)mV ],而雌雄成虫对 S -(-)- α-蒎烯、3-蒈烯和萜品油烯在1 000 μg 的刺激剂量下也未达到饱和水平。
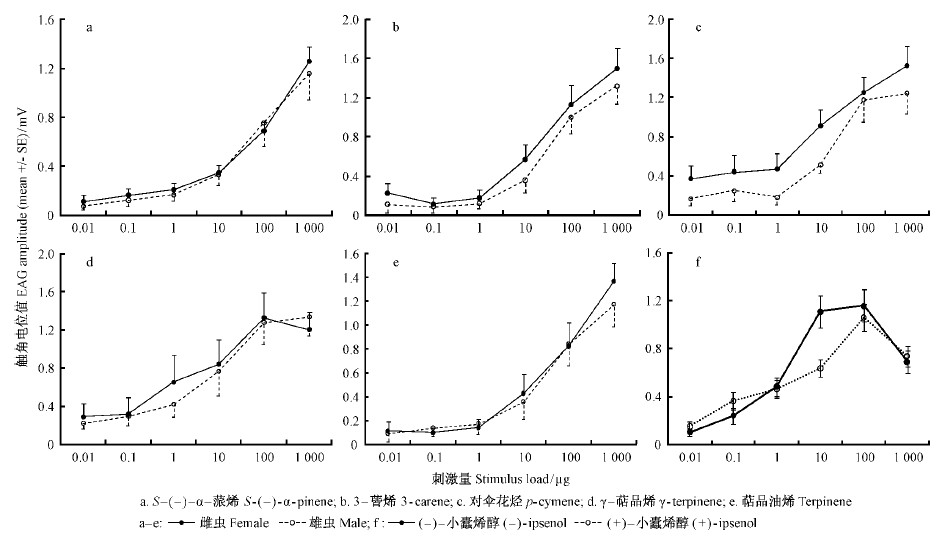 |
图 4 落叶松八齿小蠹(抚顺种群)对有 EAD 活性的寄主单萜烯成分(n=10)和聚集信息素成分(n=33)的触角电位剂量-反应曲线
Fig. 4 Dose-response curves constructed from mean EAGs of Ⅰ. subelongatus (Fushun population)to serial stimulus loads of EAD-activehost odorants(n=10)and aggregation pheromones(n=33)
|
落叶松八齿小蠹雌雄成虫对(-)- 小蠹烯醇和(+)- 小蠹二烯醇的触角电位剂量反应关系的研究表明,其对2种主要聚集信息素的检测阈值是0.1 μg,饱和水平是100 μg。落叶松八齿小蠹对低剂量(0.01~1 μg)的(+)- 小蠹二烯醇响应比对(-)- 小蠹烯醇敏感,而对高剂量(1~1 000μg)的(-)- 小蠹烯醇响应比对(+)-小蠹二烯醇敏感。
3 讨论不同落叶松树种单帖烯挥发物组成成分基本一致,主要成分是 S -(-)- α-蒎烯,R -(+)- α-蒎烯,3-蒈烯和S -(-)- β -蒎烯。但是兴安落叶松α-蒎烯的释放量占优势,长白落叶松3-蒈烯的释放量占优势,华北落叶松 S -(-)- β-蒎烯的释放量占优势。不同落叶松寄主在相同时间内萜烯挥发物的释放量除与树种本身的生理特性有关外,还与地理、气候以及采集时的天气状况密切相关。例如,针叶挥发量大于树干,说明针叶新陈代谢能力强于树干。据报道,落叶松八齿小蠹在落叶松树干上的垂直分布范围为0~12 m,且主要集中在0~7.5 m区段上(郭树平等,1992)。树干挥发性单萜烯主要成分是α-蒎烯、β-蒎烯和3-蒈烯,而萜品油烯的释放量较低。笔者的电生理测试表明,S -(-)- α-蒎烯、3-蒈烯和萜品油烯均有可重复性的 EAD 活性,而(+)- 柠檬烯和γ-萜品烯有时也表现出较弱的 EAD 活性。 Zhang等(2007)的研究表明落叶松八齿小蠹对α-蒎烯、β- 蒎烯和对伞花烃有 EAD 活性。本文首次确认了表现出 EAD 活性的α-蒎烯是 S -(-)- 构型,而 R -(+)- α-蒎烯没有 EAD 活性。另外,关键是笔者还发现了3-蒈烯和萜品油烯,甚至是(+)- 柠檬烯和γ- 萜品烯也均有 EAD 活性,这是 Zhang等(2007)没有报道过的。另外,有强烈 EAD 信号的对伞花烃在寄主挥发物色谱分析时未检测到。本文针对落叶松八齿小蠹对聚集信息素成分手性异构体识别的电生理测试(GC-EAD)表明: 1)雌雄成虫对(+)- 小蠹二烯醇和(-)- 小蠹二烯醇的选择性表现出差异; 2)雌雄成虫对(-)- 小蠹烯醇有很强的 EAD 活性,而对(+)- 小蠹烯醇没有 EAD 响应。据报道,α- 蒎烯,β-蒎烯和对伞花烃混合物对落叶松八齿小蠹没有吸引力,相反对含有小蠹烯醇和小蠹二烯醇的聚集信息素引诱剂有很强的抑制效应(Zhang et al.,2007)。同时α- 蒎烯和落叶松原木对 I.cembrae 聚集信息素也无增效作用(Stoakley et al.,1978 ; Zhang et al.,1995),这说明寄主挥发物对聚集性小蠹虫,特别是具有强烈聚集信息素的齿小蠹属昆虫没有引诱效果(Schlyter et al.,1999)。
然而,寄主单萜类挥发物的释放速率对小蠹虫聚集信息素的聚集作用是有影响的(Rudinsky et al.,1971 ; Erbilgin et al.,2000 ; Miller et al.,2000)。例如,Erbilgin等(2007)发现寄主萜烯挥发物影响云杉八齿小蠹对其聚集信息素的反应:云杉主要萜烯挥发物(-)- α-蒎烯在高释放速率的情况下对聚集信息素的引诱力有增效作用,而低释放剂量则无作用; 与之相反,针对 I.pini 低释放剂量的单萜类成分对聚集信息素有增效作用,而高释放比例则无作用(Erbilgin et al.,2003)。并且这种单萜类成分对 I.pini 聚集信息素的作用存在地理差异: 在英国哥伦比亚,I.pini 仅仅被α-水芹烯吸引(Miller et al.,1990),然而在英国大湖区,单独的寄主单萜类挥发物对 I.pini 并没有引诱力(Erbilgin et al.,2003),这也进一步证明小蠹虫对寄主萜烯挥发物具有的独特效应与寄主树的生理状态相关,同时也与地理环境和气候条件相关。
不同寄主背景下的落叶松八齿小蠹的触角电位响应表现出一定的差异,这可能与小蠹虫适应环境和寻找寄主机制相关,需要进一步研究寄主的差异是否会影响小蠹虫的取食及聚集行为。总之,为进一步了解落叶松八齿小蠹对寄主挥发性萜烯成分与聚集信息素的相互作用机制,需要根据落叶松八齿小蠹入侵的不同阶段对其寄主挥发物成分及聚集信息素含量的变化关系进行有针对性的分析。
| [1] |
郭树平,曹仁襄,邢念华,等.1992.落叶松八齿小蠹在林分中的垂直分布与水平蔓延范围.林业科技, 19(5): 24-26.( 1) 1)
|
| [2] |
于诚铭.1992.落叶松八齿小蠹 Ips subelongatus Motschulsky// 萧刚柔.中国森林昆虫.北京:中国林业出版社,626-628.( 1) 1)
|
| [3] |
章士美,赵泳祥.1996.中国农林昆虫地理分布.北京:中国林业出版社( 1) 1)
|
| [4] |
Byers J A, Lanne B S, Löfqvist J. 1987. Host tree unsuitability recognized by pine hoot beetles in flight. Experientia, 45(5): 489-492.( 1) 1)
|
| [5] |
Erbilgin N, Krokene P, Kvamme T, et al. 2007. A host monoterpene influences Ips typographus (Coleoptera: Curculionidae, Scolytinae) responses to its aggregation pheromone. Agricultural and Forest Entomology, 9(2): 135-140.( 1) 1)
|
| [6] |
Erbilgin N, Powell J S, Raffa K F. 2003. Effect of varying monoterpene concentrations on the response of Ips pini (Coleoptera:Scolytidae) to its aggregation pheromone: implications for pest management and ecology of bark beetles. Agricultural and Forest Entomology, 5(4): 269-274.( 2) 2)
|
| [7] |
Erbilgin N, Raffa K F. 2000. Opposing effects of host monoterpenes on responses by two sympatric species of bark beetles to their aggregation pheromones. Journal of Chemical Ecology, 26(11): 2527-2548.( 1) 1)
|
| [8] |
Francke W, Vité J P. 1983. Oxygenated terpenes in pheromone systems of bark beetles. Zeitschrift für Angewandte Entomologie, 96(1-5): 146-156. ( 1) 1)
|
| [9] |
Kohnle U, Vité J P, Erbacher C, et al. 1988. Aggregation response of European engraver beetles of the genus Ips mediated by terpenoid pheromone. Entomologia Experimentalis et Applicata, 49(1-2): 43-53.( 1) 1)
|
| [10] |
Marques F A, McElfresh J S, Millar J G. 2000. Kováts retention indexes of monounsaturated C12, C14, and C16 alcohols, acetates and aldehydes commonly found in Lepidopteran pheromone blends. Journal of the Brazilian Chemical Society, 11(6): 592-599.( 1) 1)
|
| [11] |
Miller D R, Borden J H. 1990. α-Phellandrene: Kairomone for pine engraver, Ips pini (Say) (Coleoptera: Scolytidae). Journal of Chemical Ecology, 16(4): 2519-2531. ( 1) 1)
|
| [12] |
Miller D R, Borden J H. 2000. Dose-dependent and species-specific responses of pine bark beetles (Coleoptera: Scolytidae) to monoterpenes in association with pheromones. The Canadian Entomologist, 132(2): 183-195.( 1) 1)
|
| [13] |
Rudinsky J A, Novák V, Švihra P. 1971. Pheromone and terpene attraction in the bark beetle Ips typographus L. Experientia, 27(2): 161-162.( 1) 1)
|
| [14] |
Sant'ana J, Silva R F P, Dickens J C. 1999. Olfactory reception of conspecific aggregation pheromone and plant odors by nymphs of the predator, Podisus maculiventris. Journal of Chemical Ecology, 25(8): 1813-1826.( 1) 1)
|
| [15] |
Schlyter F, Birgersson G. 1999. Forest beetles//Hardie J, Minks A K. Pheromones in Non-Lepidopteran Insects Associated with Agricultural Plants. CAB International, Oxford U K, 113-148.( 1) 1)
|
| [16] |
Song L W, Zhang Q H, Chen Y Q, et al. 2010. Field responses of the Asian larch bark beetle, Ips subelongatus, to potential aggregation pheromone components: disparity between two populations in northeastern China. Insect Science, 18(3): 311-319.( 1) 1)
|
| [17] |
Stauffer C, Kirisits T, Nussbaumer C, et al. 2001. Phylogenetic relationships between the European and Asian eight spined larch bark beetle populations (Coleoptera, Scolytidae) inferred from DNA sequences and fungal associates. European Journal of Entomology, 98(1): 99-105.( 1) 1)
|
| [18] |
Stoakley J T, Bakke A, Renwick J A A, et al. 1978. The aggregation pheromone system of the larch bark beetle Ips cembrae Heer. Zeitschrift für Angewandte Entomologie, 86(1-4): 174-177.( 2) 2)
|
| [19] |
Zhang Q H, Birgersson G, Schlyter F, et al. 2000. Pheromone components in the larch bark beetle, Ips cembrae, from China: Quantitative variation among attack phases and individuals. Journal of Chemical Ecology, 26(4): 841-858.( 1) 1)
|
| [20] |
Zhang Q H, Niemeyer H. 1992. Morphological characteristics for sexing living adults of Ips cembrae (Heer) (Col., Scolytidae). Journal of Applied Entomology, 114 (1-5): 403-409.( 1) 1)
|
| [21] |
Zhang Q H, Niemeyer H. 1995. Field response of the larch bark beetle, Ips cembrae, and its predators to different ratios of pheromone baits and addition of host logs//Hain F P, Salom S M, Ravlin W F. Behavior, Population Dynamics, and Control of Forest Insects. Proceedings of a Joint IUFRO Working Party Conference, Ohio State University. OARDC, Wooster, 19-28.( 2) 2)
|
| [22] |
Zhang Q H, Schlyter F, Chen G F, et al. 2007. Electrophysiological and behavioral responses of Ips subelongatus to semiochemicals from its hosts, non-hosts, and conspecifics in China. Journal of Chemical Ecology, 33(2): 391-404.( 5) 5)
|
 2013, Vol. 49
2013, Vol. 49