文章信息
- 牛庆霖, 王迎, 罗磊, 黄艳艳, 刘静, 冯殿齐, 曹帮华
- Niu Qinglin, Wang Ying, Luo Lei, Huang Yanyan, Liu Jing, Feng Dianqi, Cao Banghua
- 欧美杨107杨β-1,3-葡聚糖酶(BG2)基因遗传转化及对溃疡病的抗性分析
- Transformation of BG2 Gene into Populus×euramericana cv.‘Neva’and Resistance of the Transgenic Poplar to Canker Disease
- 林业科学, 2013, 49(11): 60-66
- Scientia Silvae Sinicae, 2013, 49(11): 60-66.
- DOI: 10.11707/j.1001-7488.20131108
-
文章历史
- 收稿日期:2013-06-06
- 修回日期:2013-08-08
-
作者相关文章
2. 泰安市泰山林业科学研究院 泰安 271000
2. Taishan Institute of Forestry Science Tai'an 271000
杨树在我国分布广泛且有大面积种植,人工林总面积超过700万hm2,天然林总面积超过300万hm2,中国现已成为全球杨树种植面积最大的国家。世界上天然杨树种类100多种,仅中国就有53种,其中欧美杨107杨(Populus × euramericana cv.‘Neva’)是中国林业科学研究院选育并重点推广的速生杨树优良品种,适合我国黄淮河流域及辽河以南流域广泛栽植,在新疆、内蒙古、陕西、宁夏、甘肃、重庆等地亦有引种。由于107杨具有速生、丰产的优点,现已在山东、河南、天津等地得到迅速推广。107杨不仅丰富了我国森林资源,为国家生态环境建设、国民经济创收做出了重要贡献,而且己经成为发展农村经济的一项支柱产业。
杨树溃疡病一直是杨树枝干上的重大病害,是影响杨树产业规模化发展的重要限制因素。2007年山东兖州和河南濮阳107杨遭受特大溃疡病病害,严重林地发病率在70%以上。随着107杨的大面积种植,由于树种结构的单一,杨树溃疡病越来越严重,解决107杨抗溃疡病的问题成了当务之急。传统育种和农药防治方法不能从根本上解决溃疡病对107杨的危害,相反在长时间的化学防治下,大大提高了病原菌对化学试剂的抗性,而且伴有大量的化学农药进入环境不断积累,危害人类生存环境(赵鑫等,2004)。利用转基因技术提高木本植物抗性(Song et al.,2013),是当前抗性育种研究的热点问题。由于107杨树具有易于无性繁殖、基因组小、转化率相比其他树种较高等特点,因此,利用抗病基因的遗传转化培育抗溃疡病杨树新品种是一种可行的选择。
β-1,3-葡聚糖酶是一种抗真菌蛋白,是植物受到病原菌侵染、细胞发生程序性死亡时自身释放出的一种有害物质(Josen et al.,1996),能催化真菌细胞壁中β-1,3-葡聚糖多聚体的水解,将其降解为葡萄糖,从而抑制真菌的生长及增殖。 Yoshikawa等(1997)将β-1,3-葡聚糖酶基因(BG2)导入烟草(Nicotiana tabacum)中,其β-1,3-葡聚糖酶活性高达非转基因烟草植株中的4倍,转基因烟草表现出对烟草黑胫病(Phytophthora parasitica)和烟草青枯病(Ralstonia solanacearum)的良好抗性; 蓝海燕等(2000)将BG2转入甘蓝型油菜(Brassica napus)中,获得的转基因甘蓝型油菜显示出较高的抗性。本研究的目的就是通过根癌农杆菌介导方法将 BG2基因导入欧美杨107杨,培育出抗溃疡病的107杨改良品系,为进一步的品种选育奠定基础。
1 材料与方法 1.1 试验材料表达载体 pATC940的5 ' 端经过 Xba Ⅰ酶切,测序正确的目的基因PCR产物5 ' 端经过 Spe Ⅰ酶切后,二者的酶切末端互为黏性末端。表达载体和目的基因3 '端均用 NotⅠ酶切,二者经过 T4 DNA 酶连接,形成表达载体 pATCBG2(图 1)。含植物抗病基因 BG2表达载体的根癌农杆菌(Agrobacterium tumefaciens)LBA4404由中国科学院遗传与发育生物学研究所王斌研究员提供; 遗传转化中所用植物材料欧美杨107杨组培苗为本实验室保存; 杨树溃疡病菌种(Dothichiza populea)由山东农业大学刘会香教授惠赠。
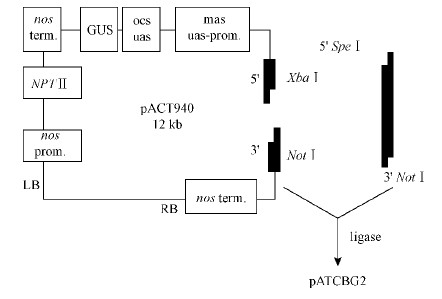 |
图 1 植物表达载体 pATCBG2的构建
Fig. 1 Construction of plantexpressionvectorof pATCBG2
|
用接种环挑取保存在YEP固体培养基上含有BG2基因的LBA4404单菌落,接种到YEP液体培养基中,28 ℃,150 r·min-1过夜振荡培养约12 h,待OD600值在0.6~0.7时,作为转化侵染时的菌液备用(刘静等,2011)。
1.2.2 农杆菌介导法转化分别取生长健壮的107杨组培苗的叶片、茎段和叶柄为试验材料,浸染一定时间(梯度为10,15,20 min),然后将材料取出,置于带无菌滤纸的培养皿上吸干多余菌液,接入培养基后和对照避光共培养2天(赵华燕等,2001)。之后,转入含有卡那霉素(50 mg·L-1)和头孢霉素(400 mg·L-1)的培养基上生长,用作分子检测和扩繁的材料。
1.2.3 转基因植株的PCR检测按 CTAB 法提取转化植株和未转化植株的基因组DNA,常规方法提取含 BG2基因的农杆菌质粒 DNA 作为阳性对照。 BG2特异引物序列如下,
引物1 : 5 '-TATGCTACGGGATGCTAGGC-3 ';
引物2 : 3 '-TCATACTAGACTGTCAGTC-5 '。
PCR 扩增的反应体系为25 μL: 2.5 μL 10 ×Buffer,0.4 mmol·L-1 dNTP,2 mmol·L-1 MgCl2,1 U Taq DNA polymerase,1 μL 引物1,1 μL 引物2,1 μL模板DNA,ddH2O 加至终体积25 μL。反应条件为: 94 ℃预变性4 min; 94 ℃变性45 s,55 ℃复性45 s,72 ℃延伸1 min,35个循环; 最后72 ℃延伸5 min。PCR 产物用1%琼脂糖胶电泳,EB 染色,紫外下观察扩增结果。
1.2.4 转基因植株的 Southern 检测对PCR检测结果阳性的转基因植株和未转基因的对照植株同时送到北京美莱博医学科技有限公司生物技术服务部采用PCR标记法进行Southern检测。具体方法: 用Not Ⅰ和Sac Ⅰ双酶切 pATCBG2质粒 DNA,DIG-dUTP 标记(地高辛杂交检测试剂盒),得到800 bp 的片段为标记探针;取10.0 mL Hyb 高效杂交液(Hyb-100),加入杂交管中,60 ℃杂交炉中预杂交2 h; 探针在PCR仪中100 ℃变性10 min,立即放冰水浴冷却5 min; 排尽预杂交液,在10.0 mL Hyb 高效杂交液(Hyb-100)加入4.0 μL 新变性好的探针,混匀,60 ℃杂交仪中杂交过夜; 使用美莱博 DIGD-110“地高辛杂交检测试剂盒Ⅱ(化学发光法)”(Sambrook et al.,1989)进行洗膜、信号检测。
1.2.5 转基因植株的离体抑菌试验按照王玲等(2000)方法有改进。选取生长状态一致的转基因107杨树(以下简称T-107杨)及未转基因的对照107杨树(以下简称 C-107杨),用 TES 缓冲液(100mmol · L-1 Tris-Cl,0.1 mmol · L-1 EDTA,30mmol·L-1 NaCl,pH 调至7.0)提取其细胞粗体液备用; 打孔器取6 mm 滤纸浸泡细胞粗提液20~40 min 后,平铺在接种了杨树溃疡病病菌的 PDA 培养基平板上,28 ℃继续培养2~4天后观察杨树溃疡病病菌的生长情况。
1.2.6 转基因植株组培苗感菌试验及 MDA 与 PAL 的变化测定将生长培养基感染杨树溃疡病病原真菌,选取长势一致的多代筛选后T-107杨及 C-107杨组培苗接种于上,光照培养观察。培养条件: 温度(25 ± 2)℃,光照强度约为2 000 lx,光周期为每天12 h。在培养2,4,6,8,10,12天时分别采T-107杨及 C-107杨组培苗叶片,进行生理试验测定,同时每隔3天调查感病情况。
MDA 的测定参照高俊凤(2000)的方法; 称取0.5 g(3个重复)鲜质量叶片,加入1 mL 磷酸缓冲液(pH 7.8,0.05 mol·L-1),冰浴研磨,研磨后再加入4 mL 磷酸缓冲液。将研磨液倒入离心管中,平衡。低温(0~4 ℃)离心20 min,离心后冷藏保存。取上清液1 mL(对照加1 mL 水),加2 mL TBA,封口沸水浴15 min,迅速冷却(用冷水冲泡),倒入离心管中,4 000 r·min-1下离心20 min,取上清液于600,532,450 nm 比色测定。 MDA(mmol·g-1 FW)=[6.452 ×(D532-D600)- 0.559 × D450 ]Vt / Vs·W,式中: D 为各个波长下吸光值,Vt 为提取液总体积(mL),Vs为测定所用提取液体积(mL),W为样品鲜质量(g)。
PAL 的测定参照胡景江等(1992)所述方法。取待测样品(3个重复)1 g 鲜质量,经-15 ℃冷冻固定后,加4倍质量预冷的0.2 mol·L-1硼酸缓冲液(pH 8.8,含8 mmol·L-1巯基乙醇)在冰浴中研磨匀浆,4 ℃下10 000 g 离心30 min,上清液用于酶活性的检测。酶检测反应液组成: 硼酸缓冲液(pH 8.8)3 mL,L-苯丙氨酸(80 mmol·L-1)1 mL,酶液1 mL。35 ℃下反应60 min,6 mol·L-1 HCl 终止酶活性。290 nm 处测 OD 值,以 OD 值变化0.01为1个酶活性单位。
2 结果与分析 2.1 转基因植株的PCR检测选取经50 mg·L-1 Kan 筛选出的T-107杨和未转基因的 C -107杨对照组培苗为材料,取2~3片幼嫩的新叶提取基因组 DNA,以T-107杨基因组 DNA、载体质粒 DNA 以及 C -107杨的基因组 DNA 为模板,用 BG2基因特异PCR引物进行PCR扩增。结果表明 : 检测过的8个转基因植株中有6个与载体质粒一样产生了1条800 bp 的明显的特异扩增片段,而对照植株未扩增出此特异条带(图 2)。
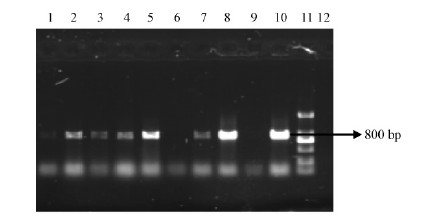 |
图 2 BG2转基因植株的PCR检测
Fig. 2 PCR identification of the transgenic plants
1-8 : T-107(转基因植株 Transgenic plants); 9 : C-107(未转基因植株 Untransformed plant); 10 : 阳性对照 ,质粒 DNA Positivecontrol,plasmid DNA; 11 : DNA marker DL2000 ; 12 : 水 Water(阴性对照 Negative control). |
将PCR扩增产物电泳后印迹于硝酸纤维素膜上,用 NotⅠ和SacⅠ双酶切阳性质粒得到800 bp 的片段,以其回收产物为模板合成探针,进行 Southern 杂交检测。结果表明: 这6个转基因植株中有4个显示出较强的杂交信号,而非转基因的 C-107杨(泳道7)无杂交信号(图 3)。
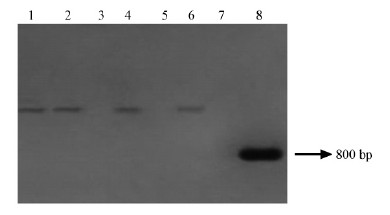 |
图 3 BG2转基因植株的 Southern 检测
Fig. 3 Southern assay of the transgenic plants
1-6 : T-107(转基因植株 Transgenic plants);7 : C-107(未转基因植株 Untransformed plant);8 :PCR对照PCRcontrol. |
为了验证转基因植株T-107杨是否对杨树溃疡病菌具有一定的抗性,将打孔器打取的6 mm 滤纸片在T-107杨的提取液中浸泡20~40 min 后,然后平铺在涂有杨树溃疡病菌液的 PDA 培养基上进行抑菌试验。结果发现: 经未转基因的C-107杨细胞粗提液和无菌水浸泡过的滤纸片对杨树溃疡病菌没有抑制作用,抑菌率为0,滤纸片被生长的菌丝覆盖; 而在T-107杨细胞粗提液浸泡过的滤纸片抑菌率达到45%,周围形成了明显的抑菌圈(图 4),滤纸片上没有长出菌丝。这说明转基因植株T-107杨的细胞粗提液对杨树溃疡病病原菌具有一定的抑制作用。
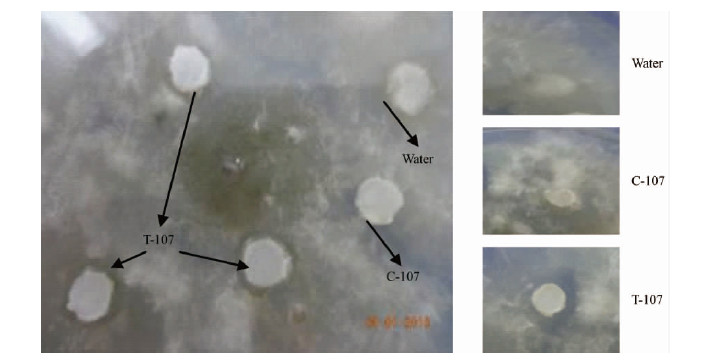 |
图 4 转基因植株提取液的体外抑菌分析
Fig. 4 Inhibition of fungal growth by the cell extracts from transgenic plants in vitro
|
将杨树组培苗生长培养基感染杨树溃疡病病原真菌,然后选取长势相近的转基因T-107杨与对照C-107杨的组培苗在上面培养,生长情况见表 1 、图 5 。在3~6天内,杨树溃疡病菌生长缓慢,杨树组培苗都能正常生长,C-107只有10%叶片出现病状 ; 6天后,杨树溃疡病菌丝开始迅速生长,C-107杨组培苗茎叶开始被大量菌丝包裹,叶片出现黄化现象,但T-107杨长势基本正常,叶片感病率仅为5%,显著低于对照C-107杨(30 %); 9天时 C-107杨叶片污染率达到60%; 12天时T-107杨叶片感病率为30%,但植株仍能生长,而 C-107杨叶片被大量菌丝覆盖,茎叶枯黄,感病率达到100%,逐渐死亡 ;15天时 C-107杨完全死亡,而T-107杨仍能生存。试验结果说明转BG2基因T-107杨组培苗能够抑制溃疡病菌丝的生长,对杨树溃疡病具有一定的抗性。
|
|
 |
图 5 转 BG2基因植株抗溃疡病分析
Fig. 5 Anti-fungal assay of transgenic plants
A,B,C,D:T-107与 C-107分别共培养3,6,9,12天 ; E:C-107培养15天 ; F:T-107培养15天。 A,B,C,D:T-107 and C-107 co-culture for 3,6,9,12 days,respectively;E:C-107 co-culture for 15 days;F:T-107 co-culture for 15 days. |
MDA是植物体细胞膜脂过氧化反应的主要产物之一,其含量的增加过程是细胞内有毒性物质的积累过程,因此 MDA 含量增加是植物细胞损伤的直接原因。从图 6 A 可以看出:T-107杨与C-107杨在感染杨树溃疡病病原真菌的生长培养基上培养,体内MDA含量始终在积累,T-107杨 MDA 总体含量明显低于 C-107杨; 在4~8天时 C-107杨 MDA 含量急剧增加1.07倍,说明这期间植物体细胞内有害物质迅速积累,细胞膜受到严重的损伤,这与组培苗抗菌试验第9天 C-107杨出现大量菌丝叶片枯黄相吻合(图 5 C); 而T-107细胞内的 MDA 缓慢积累,直至第10天才有显著增长趋势。
 |
图 6 转基因植株组培苗 MDA 与 PAL 的变化
Fig. 6 Changes of MDA and PAL contents of the transgenic plants
|
苯丙氨酸解氨酶(PAL)是苯丙烷类代谢途径的起始酶,研究认为它是植物的防御酶之一。从图 6 B 可以看出:在培养过程中T-107杨与 C-107杨的PAL 活性的变化趋势基本一致,均为单峰曲线,且在第8天时都达到峰值,但T-107杨的 PAL 活性始终强于C-107杨,其PAL 峰值比C-107杨高出59.7%。
3 结论与讨论杨树抗菌基因工程的研究早在1987就有报道(李少锋等,2011)。近年来,杨树真菌病害不断发生,人们在杨树抗真菌基因工程上展开不同方向的研究,其热点主要集中在几丁质酶基因、病原相关蛋白基因、多聚半乳糖醛酸抑制蛋白基因(Rose et al.,2002)。Doan等(1993)研究发现杨树在受到机械损伤后,产生了3种新的转录子 mRNA,其中2个转录物 Wni6和Wins 编码几丁质酶,而几丁质酶可以降解侵染杨树的真菌或细菌的细胞壁; Nieoleseu等(1996)将矮牵牛(Petunia hybrida)黄酮合成酶(CHSA)基因导入杨树,提高了杨树的抗病性;Liang等(2001)将小麦(Triticum aestivum)的草酸氧化酶基因导入杨树,提高了转基因植株的抗真菌能力; 樊军锋等(2002)将 MtlD/gutD 双价基因成功转化美洲黑杨(Populus deltoides)×青杨(Populus cathayana)并对转基因植株进行了检测; 孟亮等(2004)利用几丁质酶转化美洲黑杨成功; 邹维华等(2006)将反义磷脂酶 PLDγ基因与几丁质酶基因共同转化美洲黑杨并对其抗病性进行了研究; 贾之春等(2011)超量表达益母草(Leonurus japonicus)抗菌肽基因 LJAMP2能显著提高毛白杨(Populus tomentosa)对溃疡病的抗性。然而在植物的抗菌过程中,β-1,3-葡聚糖酶同样扮演着重要角色,对β-1,3-葡聚糖酶基因的转化研究报道较少(蔡应繁等,2001)。
Kim等(2000)研究证明,真菌细胞壁主要由几丁质和β-1,3-葡聚糖组成,几丁质在细胞壁的内部,而葡聚糖在细胞壁内部外部均有。而β-1,3-葡聚糖酶可以水解β-1,3 -葡聚糖破坏真菌细胞壁,因此对真菌病原的侵染有一定的防护作用。当植物体受到真菌病原菌的侵染后,植物体内β-1,3-葡聚糖酶对暴露在细胞壁最外层的多糖具有水解作用,使得菌丝体细胞壁变薄,菌内膨压和细胞伸缩张力不平衡,菌丝体顶端细胞最终破碎死亡。Klarzynski等(2000)研究发现,在此水解过程中产生的寡糖又作为植物超敏反应(Hypersensitive Response,HR)中的激发子,进一步诱导植物的防御反应。 韩琳娜等(2004)将 BG2转入到黑杨(Populus),并建立了黑杨的转化体系; 白靖(2008)将BG2转入到南瓜(Cucurbita)中。上述二者都得到了转基因植株,但并未对转基因植株的抗病性做进一步研究。
本研究通过根癌农杆菌介导法将 BG2基因导入107杨中,经过抗菌素筛选、PCR和Southern 检测,得到了4个阳性株系。对转基因植株的PCR和Southern 鉴定表明: BG2基因已经整合到受体植株基因组DNA 中。并进一步对转基因植株进行了离体抑菌试验和组培苗感病试验。感病试验采取培养基接种感病、与植物体共培养的方法,使转基因植物体与对照处在相同环境下,模拟大田感病过程,更有力地说明转基因植物的抗病能力。试验结果表明,转基因植株T-107杨的细胞粗提液能够抑制杨树溃疡病病原菌丝的生长(图 4),T-107杨组培苗对杨树溃疡病具有较强的抵抗能力,可在长有病原菌的培养基上生长15天以上(图 5)。
由于病原菌入侵使得细胞内的活性氧代谢平衡被破坏,有利于活性氧或超氧化物自由基的产生,使得植物细胞膜脂发生过氧化反应。 王玲平(2007)在黄瓜(Cucumis sativus)上接种枯萎病,试验发现抗病品种可以自身调节,维持 MDA 含量的相对平衡,减少对膜的损害; 毕咏梅等(1990)研究证明水稻(Oryza sativa)受到不同病原体感染后 PAL 活性均有升高的现象,因为 PAL 活性的升高往往与植保素、木质素等抗性物质的产生和积累呈正相关;刘学敏等(2003)将烟草感染赤星病菌(Alternaria alternata)后,抗病品种 CV87的 PAL 活性升高,感病品种 NC89的 PAL 活性降低,PAL 活性与烟草抗赤星病呈正相关。本研究选取 MDA 与 PAL 作为评价转基因植株T-107杨组培苗抗菌能力高低的重要指标,结果显示,在受到杨树溃疡病感染时T-107杨组培苗细胞内 MDA 含量缓慢升高,PAL 活性第4天后迅速增强,这可能是由于导入的 BG2基因的表达提高了植物体抗病能力,诱导调整体内代谢途径,阻止MDA 在体内的迅速积累降低细胞膜的损伤,同时提高 PAL 活性,产生大量防御酶,从而提高植物体对外界病原菌的抵抗能力。本研究仅对转基因植株T-107杨组培苗进行了分子检测和抗病试验研究,下一步将在大田试验中进一步筛选优良的抗病株系;此外BG2基因是否对107杨上其他真菌病害有抵抗作用,也将作更进一步的研究。
| [1] |
白靖.2008.农杆菌介导β-1,3-葡聚糖酶(BG2)基因转化南瓜的研究.哈尔滨: 东北农业大学硕士学位论文.( 1) 1)
|
| [2] |
毕咏梅,欧阳光察.1990.稻瘟病菌诱导物对水稻苯丙烷类途径酶系和绿原酸的诱导作用.植物生理学通讯,(3):18-20.( 1) 1)
|
| [3] |
蔡应繁,叶鹏盛, 张利,等.2001.β-1,3-葡聚糖酶及其在植物抗真菌病基因工程中的应用.西南农业学报, 14(2): 78-81.( 1) 1)
|
| [4] |
樊军锋,韩一凡,李玲,等.2002.MtlD/gutD 双价基因转化美洲黑杨×青杨的研究.林业科学,38(6): 30-35.( 1) 1)
|
| [5] |
高俊凤.2000.植物生理学实验技术.西安: 世界图书出版西安公司.( 1) 1)
|
| [6] |
韩琳娜,周春江,崔德才,等.2004.转BG2基因黑杨植株的获得.山东农业大学学报:自然科学版,35(3):375-378.( 1) 1)
|
| [7] |
胡景江,文建雷,景耀,等.1992. 杨树体内苯丙烷代谢与其对溃疡病抗性的关系. 植物病理学报, 22(2):185-188.( 1) 1)
|
| [8] |
贾之春,孙一铭,秦志超,等.2011.转抗菌肽基因毛白杨的培育及其对溃疡病的抗性.林业科学,47(7):123-127.( 1) 1)
|
| [9] |
蓝海燕,田颖川,王长海,等. 2000. 表达β-1,3-葡聚糖酶及几丁质酶基因的转基因烟草及其抗真菌病的研究. 遗传学报, 27(1): 70-77.( 1) 1)
|
| [10] |
李少锋,苏晓华,张冰玉.2011.林木基因克隆研究进展. 植物学报,46 (1): 99-107.( 1) 1)
|
| [11] |
刘静,黄艳艳,翁曼丽,等.2011. TCS基因转化泡桐的遗传表达及抗病能力研究.林业科学,47(5): 171-176.( 1) 1)
|
| [12] |
刘学敏,陈宇飞,董长军.2003. 烟草对赤星病的抗性与其防御酶系活性的关系.烟草科技, 186(1): 43-46.( 1) 1)
|
| [13] |
孟亮,崔德才.2004.转几丁质酶基因黑杨的获得.生物技术通报,(3):48-51.( 1) 1)
|
| [14] |
王玲平.2007.黄瓜感染枯萎病菌后生理生化变化及其与抗病性关系的研究.山西农业大学硕士学位论文.( 1) 1)
|
| [15] |
王玲,张富宝. 2000. 中药大黄提取色素的抑菌作用研究. 食品工业科技,(6): 27-28.( 1) 1)
|
| [16] |
赵华燕,卢善发,晁瑞堂.2001. 杨树的组织培养及其基因工程研究.植物学通报, 18(2): 169-176.( 1) 1)
|
| [17] |
赵鑫,詹立平,刘桂丰.2004. 杨树基因工程抗性育种研究进展.东北林业大学学报,32(6): 76-78.( 1) 1)
|
| [18] |
邹维华,赵强,崔德才.2006. 反义磷脂酶Dγ基因与几丁质酶基因转化美洲黑杨G2.林业科学,42(1): 37-42.( 1) 1)
|
| [19] |
Doan D N P, Høj P B, Collins A, et al.1993. Post-translational processing of barley β-glucan endohydrolases in the baculovirus-insect cell expression system.DNA and Cell Biology, 12(1): 97-105.( 1) 1)
|
| [20] |
Josen L G, Olsen O, Kops O, et al.1996. Transgenic barley expressing a protein-engineered thermostable(1,3-1,4)-beta-1,3-glucanase during germination.Proceedings of Nation Academy of Sciences of the United States of America,93(8): 3487-3491.( 1) 1)
|
| [21] |
Klarzynski O,Plesse B,Joubert J M,et al.2000. Linear β-1,3-glucans are elicitors of defense responses in tobacco.Plant Physiol, 12(4): 1027-1037.( 1) 1)
|
| [22] |
Kim Y J, Hwang B K. 2000. Isolation of a basic 34kiloDalton β-1,3-glucanase with inhibitory activity against Phytophthora capsici from pepper stems. Physiol Mol Plant Pathol,50(2):103-115.( 1) 1)
|
| [23] |
Liang Haiying, Maynard C A, Allen R D, et al. 2001. Increased Septoria musiva resistance in transgenic hybrid poplar leaves expressing a wheat oxalate oxidase gene. Plant Mol Biol, 45(6):619-629.( 1) 1)
|
| [24] |
Nieoleseu C,Snader C,Jounain L,et al.1996. Genetic engineering on phenolic metabolism in Populus deltoides with resistance against pathogens. Aeta Bot Galliea, 14(3):539-546.( 1) 1)
|
| [25] |
Rose J K C,Ham K,Darvil A G,et al.2002. Molecular cloning and characterization of glucanase inhibitor proteins.Plant Cell, 1(4): 1329-1345.( 1) 1)
|
| [26] |
Sambrook J, Fritsch E F, Maniatis T. 1989. Molecular Cloning, A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 19(2): 93-95.( 1) 1)
|
| [27] |
Song J, Liu J, Weng M L, et al.2013. Cloning of galactinol synthase gene from Ammopiptanthus mongolicus and its expression in transgenic Photinia serrulata plants.Gene,513(1): 118-127.( 1) 1)
|
| [28] |
Yoshikawa M,Dai Y,Shimada H T, et al.1997.Studies on the saponin constituents from the fruits of Chinese Kochia scoparia (Chenopodiaceae): chemical structures of kochiano-sides Ⅰ, Ⅱ, Ⅲ and Ⅳ.Chem Pharm Bullv,4(5): 1052-1055.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

