文章信息
- 付林江, 李厚华, 李玲, 于航, 王拉岐
- Fu Linjiang, Li Houhua, Li Ling, Yu Hang, Wang Laqi
- 金银花花色变化原因分析
- Reason of Flower Color Change in Lonicera japonica
- 林业科学, 2013, 49(10): 155-161
- Scientia Silvae Sinicae, 2013, 49(10): 155-161.
- DOI: 10.11707/j.1001-7488.20131024
-
文章历史
- 收稿日期:2012-10-01
- 修回日期:2013-01-04
-
作者相关文章
2. 杨凌金山农业科技有限责任公司 杨凌 712100
2. Agriculture Science and Technology Limited Liability Company of Yangling Jinshan Yangling 712100
花色作为观赏植物的主要性状之一,既是衡量观赏价值的重要指标,也是区别植物种类的重要依据(张超等,2012)。研究表明:影响花色的色素主要有叶绿素(chlororphyll)、类胡萝卜素(carotenoids)、类黄酮(flavonoids)与生物碱(alkaloid)(赵昶灵等,2003;Tanaka et al.,1998)。金银花(Lonicera japonica)为忍冬科(Caprifoliaceae)忍冬属藤本植物,1年内能够多次开花,花期很长,由最开始的绿色过渡到白色,最后变成黄色,而且其所含的绿原酸与木犀草苷等物质具有很高的药用价值(Shang et al.,2011),因而它集药用、观赏与绿化于一体,有很高的经济价值(方建新等,2006)。目前对金银花的研究主要集中在药用价值方面,其体内绿原酸、木犀草苷等多酚类物质含量的测定已经做过很多的研究(郑敏等,2009;孟晓岩等,2012;Seo et al.,2012)。本试验通过薄层层析、紫外可见分光光度法、高效液相色谱法对金银花花瓣不同花发育期相关花色色素及药用有效成分进行定性与定量分析,探讨其花色的变色原因及花色与药用有效成分间的关联性,为金银花新品种培育及根据颜色判断药材品质提供理论支持。
1 材料与方法 1.1 试验材料试验材料为金银花栽培品种‘金花三号’,采自陕西省杨凌金山农业科技有限责任公司苗圃基地。选取生长健壮、长势一致的植株,依次采集初蕾期、绿蕾期、小白期、大白期、银花期、金花期的花(图 1),在-20 ℃低温保存,备用。
 |
图 1 金银花不同花发育期的情况
Fig. 1 Variation of L. japonica during different flowering stages
1.初蕾期Primary green;2.绿蕾期Green bud;3.小白期Primary white;4.大白期White bud;5.银花期White flower;6.金花期Yellow flower. |
仪器 日立L-2000高效液相色谱仪,岛津-2450紫外可见分光光度计,三用紫外分析仪(上海嘉鹏科技有限公司),真空冷冻干燥机,旋转蒸发仪,超声清洗器。
试剂 甲醇、乙腈为色谱级购自Spectrum公司,标准品槲皮素、木犀草素购自天津金测分析技术有限公司,芦丁、绿原酸购自天津一方科技有限公司,山奈酚购自Sigma公司,乙醇、正丁醇、冰醋酸、石油醚、乙酸乙酯均为国产分析纯。
1.3 试验方法1)分析用萃取液的制备取保存在-20 ℃冰箱中的金银花,放置于-80 ℃冰箱中预冻24 h后,用真空冷冻干燥机处理72 h后研磨成粉末备用。
甲醇萃取液(类黄酮分析用)的制备:分别称取金银花6个花发育期冷冻干燥后的粉末0.3 g,用10 mL甲醇萃取,超声提取3次,合并萃取液,旋转蒸发后用甲醇定容至10 mL(Li et al.,2007),试验重复3次。
乙醇萃取液(叶绿体色素分析用)的制备:参考高俊凤(2000)的方法,分别称取金银花6个花发育期冷冻干燥后的粉末0.05 g,用5 mL 95%乙醇超声波萃取30 min,放入4 ℃冰箱中保存备用,试验重复3次。
水解萃取液(木犀草苷分析用)的制备:取400μL甲醇萃取液加入1.5 mL离心管中,添加600 μL2 mol·L-1的盐酸,在95 ℃条件下加热45 min。冷却后加入300 μL异戊醇萃取,并剧烈晃动,然后放入4 ℃冰箱中待其分层,上层液体含有木犀草苷水解后的木犀草素,收集上相液体置入新管中保存于4 ℃冰箱中待用(Li et al.,2007)。
2)薄层层析分析取甲醇萃取液和乙醇萃取液用玻璃毛细管分别点样于已经活化过的纤维素薄层板上,然后各自放置到装有流动相BAW和PAE(表 1)的层析缸中展开,测定各展开系统中显色斑点在薄层板上的Rf值(宋学英等,2002;Li et al.,2007)。对于肉眼很难看清的黄酮物质,在紫外光(254 nm)下和氨水烟熏薄层板后观察颜色变化。
|
|
3)紫外可见分光光度计测定金银花中叶绿素、类胡萝卜素的含量用岛津-2450紫外可见分光光度计在663,645和470 nm测定乙醇萃取液(叶绿体色素分析用)在各个吸收波长处的吸收值,并据此计算叶绿素和类胡萝卜素的含量(高俊凤,2000),计算公式如下:
$ {C_a} = 13.95{D_{663}} - 6.88{D_{645}}, $
$ {C_b} = 24.96{D_{645}} - 7.32{D_{663}}, $
$ {C_{a + b}} = {C_a} + {C_b} = 6.63{D_{663}} + 18.08{D_{645}}, $
$ {C_x} = \left( {1{\kern 1pt} {\kern 1pt} {\kern 1pt} {\kern 1pt} 000{D_{470}} - 2.05{C_a} - 114{C_b}} \right)/245, $
叶绿体色素含量(mg·g-1)=(C×V)/M。式中: D663,D645,D470分别为金银花乙醇萃取液在663,645和470 nm的吸光度;Ca,Cb,Ca+b,Cx分别为叶绿素a、叶绿素b、总叶绿素、类胡萝卜素的质量浓度(mg·L-1);C为叶绿体色素浓度;V为叶绿体色素萃取液定容体积(mL);M为金银花干质量(g)。
4)金银花中总黄酮含量的测定分别取浓度为2 mg·mL-1的芦丁标样0,0.2,0.4,0.6,0.8,1.0 mL放到10 mL的离心管中,加入0.2 mL 5%的NaNO2摇匀后静置6 min;加入0.2 mL 10%Al(NO3)3,摇匀后静置6 min;加入1 mL 4%NaOH,摇匀后室温静置15 min;加入60%乙醇溶液定容至10 mL,摇匀后在510 nm波长下测定吸光度值,根据刘飞等(2005)的方法绘制标准曲线。然后吸取0.1 mL金银花甲醇萃取液(类黄酮分析用)代替标准品进行测定,重复3次。金银花中总黄酮含量(mg·g-1)=10×C×V1/(M×0.1)。式中:C为测定样品液中总黄酮浓度(mg·mL-1);M为样品干质量(g);V1为样品最后定容体积(mL);0.1为测定时加入提取液量(mL);10为测定时提取液定容体积(mL)(李娟等,2007)。
5)高效液相色谱测定金银花中单体酚的含量用日立L-2000高效液相色谱仪检测金银花甲醇萃取液(类黄酮分析用)和不同浓度的单体酚标样。检测参数: C18柱(250 mm×4.6 mm,5 μm),柱温40 ℃,进样量为10 μL,流速0.5 mL·min-1。流动相参数: A为0.04%的甲酸水溶液,B为色谱级乙腈。采用梯度洗脱,洗脱程序为: 0~40 min,A 95%~0,B 5%~100%;40~60 min,A 0,B100%。检测波长为280 nm。根据标样浓度与标样出峰面积绘制标准曲线,进而计算各单体酚含量(Li et al.,2007)。
木犀草苷含量的测定用日立L-2000高效液相色谱仪检测水解萃取液(木犀草苷分析用)中木犀草素的含量,检测方法与单体酚相同。金银花不同花发育期体内木犀草苷的含量计算公式如下:
$ {m_1}\left( {mg \bullet {g^{ - 1}}} \right) = \left( {{m_2} - {m_3}} \right) \times \left( {{M_1}{M_2}} \right). $
式中: m1为木犀草苷的含量;m2为水解后木犀草素的含量;m3为水解前的木犀草素的含量;M1为木犀草苷的相对分子质量;M2木犀草素的相对分子质量。6)金银花细胞液的pH值测定参照唐前瑞(2001)的方法,分别称取2 g金银花不同花发育期的花,加入1 mL的双蒸水研磨成匀浆,然后用320-S的pH计测定匀浆的pH值,并以此来代表金银花细胞原液的酸碱度,试验重复3次。
2 结果与分析 2.1 金银花不同花发育期色素的薄层层析分析将金银花6个花发育期的乙醇萃取液在薄层板上点样后,放到流动相PAE中展开。如图 2所示,金银花6个花发育期在薄层层析板上的绿色斑点逐渐变淡,到金花期呈现出黄色,计算Rf值为0.90,这与类胡萝卜素在流动相PAE中的Rf值基本一致(宋学英等,2002),基本可以判定为类胡萝卜素,其含量从初蕾期到银花期都呈下降趋势,但到了金花期含量急剧增加。
 |
图 2 金银花乙醇萃取液在流动相PAE的薄层层析结果
Fig. 2 Result of ethanol extract's thin-layer chromatography of L. japonica in the mobile phase PAE
1,2,3,4,5,6分别为金银花的初蕾期、绿蕾期、小白期、大白期、银花期、金花期。1. Primary bud;2. Green bud;3. Primary white;4. White bud;5. White flower;6. Yellow flower.下同。The same below. |
将金银花不同花发育期的甲醇萃取液在薄层板上点样后,放到流动相BAW中展开4.5 h,然后用氨水烟熏处理(图 3A)后,斑点变得清晰,再放到紫外光下观察(图 3B)。并计算各个斑点的Rf值,得到图中下排斑点的Rf值为0.44,与木犀草素-7-葡萄糖苷在BAW流动相中的Rf值相同;上排斑点的Rf值为0.78,与木犀草素在BAW流动相中的Rf值相同。再根据黄酮物质经过氨水烟熏后在紫外光下的颜色特征(Li et al.,2007),可以初步判定下排的物质为木犀草素-7-葡萄糖苷,上排为木犀草素。木犀草素的含量呈降低趋势,木犀草苷含量呈先上升后下降的趋势。
 |
图 3 金银花甲醇萃取液在流动相BAW中的薄层层析结果
Fig. 3 Result of methanol extract's thin-layer chromatography of L. japonica in the mobile phase BAW
|
1)叶绿素与类胡萝卜素含量 如图 4所示,金银花花内的叶绿素的含量呈降低的趋势,从含量最高的初蕾期到最低的金花期,叶绿素的含量下降了近96.77%,并且叶绿素含量的下降速率也不相同,初蕾期到小白期下降较快,小白期到金花期逐渐趋于平缓(图 4A);而类胡萝卜素的含量变化则为从初蕾期到银花期的小幅下降,到金花期的急剧上升,高出银花期10倍以上(图 4B);且到金花期,类胡萝卜素与叶绿素的含量比值达到了10.3(图 4C)。
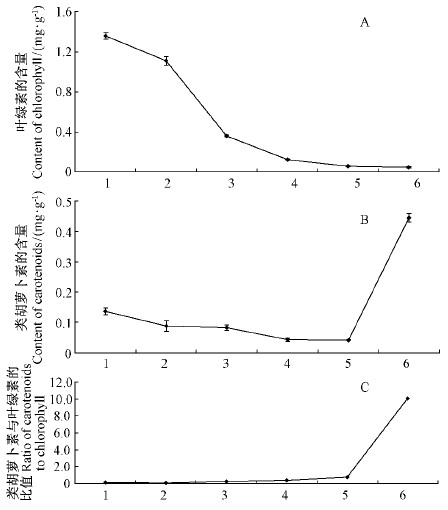 |
图 4 金银花不同花发育期叶绿素的含量(A)、类胡萝卜素的含量(B)及其两者的比值(C)
Fig. 4 Variation of chlorophyll(A)and carotenoid(B)contents in L. japonica and the ratio(C)of carotenoid to chlorophyll during different flowering stages
A:可见光下Visible light;B:紫外光下Uv light. |
2)总黄酮含量 依据1.3.4中的方法制作芦丁的标准曲线,得到芦丁标准浓度Y(mg·mL-1)与吸光度X之间线性回归方程Y=0.532 4 X-0.007,R2=0.999 8,根据回归方程计算金银花的花在不同发育期总黄酮含量(图 5)。结果显示,金银花的花中总黄酮含量在初蕾期最高,为107.992mg·g-1,随着发育时间的推移其含量逐渐降低,在金花期含量最低,为58.893 mg·g-1。
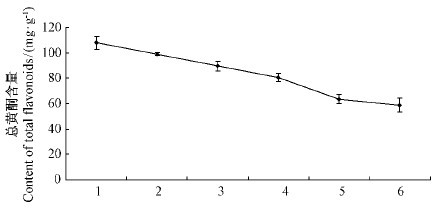 |
图 5 金银花不同花发育期的总黄酮含量变化
Fig. 5 Variation of flavonoids content in L. japonica during the different flowering stages
|
1)木犀草苷的含量 图 6显示,木犀草苷含量的变化趋势为:从初蕾期到绿蕾期有小幅的升高,在绿蕾期其含量达到1.679 mg·g-1,为整个花发育期的最高值;然后快速的下降,到金花期其含量降到整个花发育期的最低值,仅有0.105 mg·g-1。
 |
图 6 金银花不同花发育期的木犀草苷的含量变化
Fig. 6 Variation of luteoloside content in L. japonica during the different flowering stages
|
2)单体酚的含量 金银花甲醇萃取液的高效液相色谱检测结果显示,绿原酸的含量随着花的发育而不断降低(表 2)。在整个发育过程中,绿原酸含量降低的程度不同,即花发育前期(初蕾期、绿蕾期、小白期)下降的幅度较小,到了花发育后期(大白期、银花期、金花期)则呈现急剧下降的趋势,绿原酸含量在初蕾期为金花期的40倍;金银花中,呈现黄色的黄酮或黄酮醇等单体酚物质木犀草素、芦丁、槲皮素的含量都随着花的发育而降低,而山奈酚的含量基本保持不变。
|
|
金银花6个花发育期细胞原液的pH值处在5.30~5.50(图 7),表明金银花在不同花发育期内其酸碱度基本保持不变。
 |
图 7 金银花不同花发育期细胞原液的的pH值
Fig. 7 The pH of cytochylema in L. japonica
during the different flowering stages
|
在金银花的不同花发育期,检测到叶绿素、类胡萝卜素、木犀草苷、绿原酸及其他单体酚类物质。叶绿素、绿原酸与总黄酮的含量变化趋势均为:初蕾期>绿蕾期>小白期>大白期>银花期>金花期;木犀草苷的含量变化趋势为:绿蕾期>初蕾期>小白期>大白期>银花期>金花期;而类胡萝卜素的含量变化趋势初期为:初蕾期>绿蕾期>小白期>大白期>银花期,但到了金花期其含量则急剧增加。
自然界中使植物呈现绿色的色素主要是叶绿素(赵昶灵等,2005),而使植物花呈现黄色的主要色素包括类胡萝卜素、甜菜黄素、类黄酮中的黄酮、黄酮醇、查尔酮、橙酮及其衍生物等(Forkmann et al.,2001),花色呈现红色、紫色的主要色素为花青苷色素(Shinzo et al.,2004)。
金银花在初蕾期和绿蕾期叶绿素含量达到1.355 mg·g-1左右,且其与类胡萝素的相对含量较高(图 4),这导致其在初蕾期与绿蕾期呈现绿色;在小白期、大白期、银花期,随着花的发育,金银花中叶绿素、类胡萝卜素、木犀草苷的含量均逐渐降低,这导致了其颜色从最初的绿色逐渐变为浅绿色、白色。同时可以看到,金银花在大白期、银花期并非纯白色,而是稍带黄色(图 1),这应该是因为其中存在少量类胡萝卜素、木犀草素和木犀草苷所导致的;从银花期到金花期,花由白色变为黄色,在这个过程中,木犀草苷、山奈酚、槲皮素等黄酮和黄酮醇物质含量在整个花发育期呈下降趋势,所以黄酮类物质有可能对金花期的黄色形成起到辅助作用,但不是金银花从银花期的白色到金花期的黄色变化的主要原因。在金花期,类胡萝卜素含量比银花期增加了10倍,而叶绿素的含量降低到最低,且类胡萝卜素与叶绿素的比值达到最高(图 4)。因此,类胡萝卜素的生物合成急剧增加应该是其颜色从白色变为黄色的主要原因。白新祥等(2006)对菊花(Chrysanthemum morifolium)不同品种花色素成分的分析结果表明,其主要呈色色素为类胡萝卜素,与本试验金银花呈黄色为同一种色素。
肉眼能够感知的黄色花色素主要有类黄酮和类胡萝卜素两大色素类群,有的植物只含类黄酮或类胡萝卜素其中一类;有的则是类黄酮和类胡萝卜素两者并存(周琳等,2009;Davies et al.,2006)。本研究结果表明:金银花在金花期时类胡萝卜素的含量(0.444 mg·g-1)比银花期含量(0.042 mg·g-1)高10倍以上。而金银花从银花期过渡到金花期只有2~3天的时间,其花内类胡萝卜素的含量在短期内急剧提高,从这个角度来看,金银花可以作为类胡萝卜素次生代谢及相关生物合成基因转录表达研究的优良试验材料。
植物细胞体内的pH值也是影响花色的重要因素之一。类黄酮中花色苷的稳定性就受到pH值变化的很大影响,它会随着pH值的升高而降低(Strack et al.,1989),而黄酮和黄酮醇则是随着酸性的减弱,黄色就会变得越强,从而影响花色;但是类胡萝卜素的颜色却不受pH值大小的影响(赵昶灵等,2005)。本试验结果显示,金银花在不同花期内,其pH值保持不变(图 7),也说明了其花色变化与pH值变化无关。
金银花在不同花发育期的化学成分检测结果显示,绿原酸在初蕾期(38.726 mg·g-1)、绿蕾期(31.765 mg·g-1)、小白期(28.018 mg·g-1)的含量都达到了《中国药典》(≥15 mg·g-1)的要求,但其在大白期、银花期和金花期含量均低于《中国药典》的标准。木犀草苷的含量在初蕾期(1.408 mg·g-1)、绿蕾期(1.679 mg·g-1)、小白期(1.116 mg·g-1)、大白期(0.829 mg·g-1)的含量均达到《中国药典》(2010年)(≥0.5 mg·g-1)标准,但在大白期其含量略低于《中国药典》(2005年)(≥1.0 mg·g-1)的标准;在银花期和金花期,木犀草苷含量均低于两部药典的标准。因此,为获得合格的药材,应采摘大白期以前的金银花花苞。同理,也可以根据金银花的颜色来判断其品质的好坏:也就是浅绿色(小白期及以前)的药材要优于淡黄色和黄色(大白期及以后)的药材。另外,现在市场上有些不法商贩用硫磺熏蒸金银花,使其呈现鲜艳亮丽的黄色,以提高售价,但金银花被硫磺熏蒸后会影响其药用成分的活性(马晓青等,2012)。本试验结果显示,就金银花中总黄酮、绿原酸、木犀草苷等活性成分而言,黄色比浅绿色的含量都要低;因此不管是硫磺熏蒸后呈现黄色还是本身就是黄色,其质量均不如呈现浅绿色的药材。所以,本试验结果有望为打击不法商贩、杜绝金银花硫磺熏蒸现象的发生提供有效帮助。
随着花的发育,金银花中绿原酸的含量呈迅速下降趋势(表 2)。如果在金银花的初蕾期、绿蕾期和小白期采收,虽然绿原酸的含量比较高,但其生药产量偏低;而在大白期(及以后)采收,绿原酸的含量又不达标,这样金银花的质量和产量就很难同时达到要求。Peng等(2010)发现,金银花中HQT基因编码蛋白能够催化绿原酸的合成,其基因表达水平与其绿原酸的含量呈正相关;苯丙氨酸解氨酶(PAL)能够催化L-苯丙氨酸生成反式肉桂酸,从而进入苯丙烷代谢途径,进一步生成香豆酸、绿原酸和包括木犀草苷在内的类黄酮等物质(程水源等,2003);Chang等(2009)在烟草(Nicotiana tobacum)中过量表达AtPAL2和NtHQT基因,使其绿原酸与芦丁的含量较野生种提高了数倍。因此,可以考虑通过基因工程调控金银花中PAL和HQT基因的表达,增加金银花大白期(及以后)的绿原酸和类黄酮含量,求得质量与产量的统一。
| [1] |
白新祥, 胡 可, 戴思兰, 等. 2006. 不同花色菊花品种花色素成分的初步分析. 北京林业大学学报, 28(5):84-89.( 1) 1)
|
| [2] |
程水源, 陈坤松, 刘卫红, 等. 2003. 植物苯丙氨酸解氨酶基因的表达调控及研究展望. 果树学报, 20(5):351-357.( 1) 1)
|
| [3] |
方建新. 2006. 安徽忍冬科野生植物资源与利用. 中国农学通报, 22(5):412-415.( 1) 1)
|
| [4] |
高俊凤. 2000. 植物生理学实验技术.杨凌: 西北农林科技大学出版社,101-102.( 2) 2)
|
| [5] | 韩科厅, 胡 可, 戴思兰. 2008. 观赏植物花色的分子设计. 分子植物育种,6(1):16-24. |
| [6] | 郝近大. 2010. 中国药典辅助说明. 北京: 中国中医药出版社. |
| [7] |
李 娟, 张鲁刚, 张 昱. 2007. 橙色大白菜球叶总黄酮提取与测定方法的研究. 园艺学报, 34(4):923-928.( 1) 1)
|
| [8] |
刘 飞, 谢镇远. 2005. 吸光光度法测定荞麦花叶中总黄酮. 理化检验: 化学分册, 41(1):93-95.( 1) 1)
|
| [9] |
马晓青, 蔡 浩, 刘 晓, 等. 2012. 硫磺熏蒸前后金银花的HPLC指纹图谱比较和聚类分析. 中国新药杂志, 21(1): 92-103.( 1) 1)
|
| [10] |
孟晓岩, 丁 勇. 2012. 高效液相色谱法同时对金银花中5种有效成分含量的测定. 实用药物与临床, 15(2):93-95.( 1) 1)
|
| [11] |
宋学英, 杨 华, 张 枫, 等. 2002. 用薄层层析法分离菠菜中的色素. 首都医科大学学报, 23(1):78-79.( 2) 2)
|
| [12] | 唐前瑞, 陈有云, 周朴华. 2003. 红檵木花色素苷稳定性及叶片细胞液pH值变化的研究. 湖南林业科技,30(4):24-25. |
| [13] |
张 超, 陈 光, 李严慧.2012. 二乔玉兰开花过程中花色变化的生理生化机制. 西北植物学报, 32(4):716-721.( 1) 1)
|
| [14] |
赵昶灵, 郭维明, 陈俊瑜. 2003. 植物花色呈现的生物化学、分子生物学机制及其基因工程改良. 西北植物学报, 23(6): 1024-1035.( 1) 1)
|
| [15] |
赵昶灵, 郭维明, 陈俊愉. 2005. 植物花色形成及其调控机理. 植物学通报, 22(1):70-81.( 2) 2)
|
| [16] |
郑 敏, 彭敬东, 王丽芳. 2009. 金银花与金银花露中绿原酸和4种黄酮含量的测定. 西南大学学报, 31(1): 45-48.( 1) 1)
|
| [17] |
周 琳, 王 雁, 彭镇华. 2009. 黄色花形成机制及基因工程研究进展.林业科学, 45(2):112-119.( 1) 1)
|
| [18] |
Chang J L, Luo J, He G Y. 2009. Regulation of polyphenols accumulation by combined overexpression/silencing key enzymes of phyenylpropaniod pathway. Acta Biochim Biophys Sin, 41(2):123-130.( 1) 1)
|
| [19] |
Devies M K, Marshall G B, Marie Bradley, et al. 2006. Characterisation of aurone biosynthesis in Antirrhinum majus. Physiologia Plantarum, 128(4):593-603.( 1) 1)
|
| [20] |
Forkmann G, Martens S. 2001. Metabolic engineering and applications of flavonoids. Curren Opinion in Biotechnology, 12(5):155-160.( 1) 1)
|
| [21] |
Li H, Flachowsky H, Fischer T C, et al. 2007. Maize Lc transcription factor enhances biosynthesis of anthocyanins, distinct proanthocyanidins and phenylpropanoids in apple (Malus domestica Borkh.). Planta, 226(5):1243-1254.( 5) 5)
|
| [22] |
Peng X X, Li W D, Wang W Q, et al. 2010. Cloning and characterization of a cDNA coding a hydroxycinnamoyl-CoA quinate hydroxycinnamoyl transferase involved in chlorogenic acid biosynthesis in Lonicera japonica. Plant Medica, 76(16):1921-1926.( 1) 1)
|
| [23] |
Seo O N, Kim G S, Park S, et al. 2012. Determination of polyphenol components of Lonicera japonica Thunb. using liquid chromatography-tandem mass spectrometry:Contribution to the overall antioxidant activity. Food Chemistry, 134(1):572-577.( 1) 1)
|
| [24] |
Shang X F, Pan H, Li M X, et al. 2011. Lonicera japonica Thunb.: Ethnopharmacology, phytochemistry and pharmacology of an important traditional Chinese medicine. Journal of Ethnopharmacology, 138(1):1-21.( 1) 1)
|
| [25] |
Shinzo T, Yuko F, Noriko N, et al. 2004. Flower color modification of Petunia hydrida commercial varieties by metabolic engineering. Plant Biotechnology, 21(5):377-386.( 1) 1)
|
| [26] |
Strack D, Wray V. 1989. Anthocyanins//Harborne J B, Dey P M. Method in Plant Biochemistry,Vol 1. London: Academic Press, 325-356.( 1) 1)
|
| [27] |
Tanaka Y, Tsuda S, Kusumi T. 1998. Metobolic engineering to modify flower color. Plant Cell Physiol, 39(11):1119-1126.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

