文章信息
- 马闯, 张文辉, 吴敏, 马莉薇, 周建云, 薛瑶芹
- Ma Chuang, Zhang Wenhui, Wu Min, Ma Liwei, Zhou Jianyun, Xue Yaoqin
- 栓皮栎幼苗根系发育对环境异质性的响应
- Root Growth of Quercus variabilis Seedlings in Response to the Environmental Heterogeneity
- 林业科学, 2013, 49(10): 58-65
- Scientia Silvae Sinicae, 2013, 49(10): 58-65.
- DOI: 10.11707/j.1001-7488.20131010
-
文章历史
- 收稿日期:2013-01-14
- 修回日期:2013-03-08
-
作者相关文章
从种子萌芽到定居成功的幼苗阶段是其生活史最脆弱的时期,该阶段根系的形态和生长情况反映了幼苗的生存能力和对环境的适应能力(Vogt et al.,1986;Gill et al.,2000)。国外有学者指出,林火干扰、森林间伐、遮荫、土壤施氮肥、大气CO2等因素会对幼苗根系的生物量分配、根系长度以及比根长产生影响(Pregitzer et al.,2000;Ostonen et al.,2007;Brown et al.,2009;Diiorio et al.,2011)。Markesteijn等(2009)对62种木本植物幼苗根系研究发现,生长在湿润地区的幼苗根系可以通过增加根系长度和分支比例,提高获得资源的能力。Sayer等(2005)研究发现,土壤温度上升5 ℃,长叶松(Pinus palustris)幼苗根系表面积增加约80%,而国内学者对木本植物幼苗阶段根系发育的研究较少。刘莹等(2010)采用根序分类和径级分类的方法研究秦岭北坡2年生油松(Pinus tabulaeformis)幼苗的根系,夏菲等(2012)研究了黄土高原地区1~3年生辽东栎(Quercus liaotungensis)幼苗根系的形态。这些研究往往在单一的地理区域上开展,而不同分布区的气候、资源差异对幼苗根系影响的研究却罕见报道。因此,本研究选择物种分布的不同地理区域,探讨根系形态和生长发育与环境因素的关系,对阐明幼苗适应力和生存力具有重要意义。
栓皮栎(Quercus variabilis)是我国暖温带和亚热带的主要成林树种,地理分布范围广阔(24°—42°N,96°—140° E)。秦岭南麓、巴山北坡以及大别山一脉是其分布的核心区,而黄土高原地区被认为是种群分布的边缘区(周建云等,2010;Kang et al.,2011)。由于栓皮栎具有重要的经济价值,长期的过度利用造成栓皮栎林退败严重,种群实生苗更新困难(罗伟祥等,2009)。研究表明: 1~4年生栓皮栎幼苗死亡率达到80%以上,而环境胁迫和外界干扰成为阻碍幼苗生长的主要因素(张文辉等,2002)。栓皮栎幼苗的数量和生长是种群有序更新的基础,而根系正常发育是幼苗存活的关键(韩照祥等,2004)。因此,本研究沿栓皮栎分布核心区到边缘区,按纬度梯度和海拔梯度选择5个研究地点,设置样地,调查了1~4年生栓皮栎幼苗主根和侧根形态及干质量,对比不同生境下栓皮栎幼苗侧根的数量、长度和表面积差异,采用主成分PCA双序轴和Pearson相关系数,分析生境因子对栓皮栎幼苗根系生长的影响,以期探明不同分布区的栓皮栎幼苗根系形态和能量分配规律,为其种群持续发育和林分更新提供理论依据。
1 材料与方法 1.1 研究区概况在野外踏查的基础上,分别在陕西省黄土高原南部黄龙白马滩林区(边缘区,Ⅰ),秦岭南坡商州林区红升村(核心区,Ⅱ),秦岭北坡太白山林区中山寺(高海拔,Ⅲ)和大沟村(中海拔,Ⅳ),楼观台林区殿镇(低海拔,Ⅴ)选择典型栓皮栎林分,设置研究样地,形成从分布核心区秦岭南坡到边缘区黄土高原由南向北的纬度梯度和秦岭北坡从低海拔到高海拔的垂直梯度。黄土高原南部和秦岭北坡地区属于暖温带落叶阔叶林区,土壤为森林褐色土;秦岭南坡属于亚热带常绿落叶阔叶混交林区,土壤为黄棕壤。在上述地区,栓皮栎是当地地带性植被建群种,有大面积纯林和混交林。伴生树种主要有槲栎(Quercus aliena)、麻栎(Quercus acutissima),灌木有黄栌(Cotinus coggygria)、达乌里胡枝子(Lespedezadavurica)等。样地设置地区环境因子如表 1所示。
|
|
在上述5个地点,选择林相均匀,阳坡、半阳坡生境,人为干扰较少的栓皮栎纯林(栓皮栎占林分90%以上),设置20 m×20 m固定样地,每个样点的样地设3个重复。于2010年9月选择在各样点的样地,采集生长较好。无病虫害或动物啃食的1~4年生栓皮栎幼苗。根据主茎上的芽鳞痕、茎干颜色确定栓皮栎幼苗个体年龄(马莉薇等,2010)。采集时,先用手铲将幼苗周边表层土挖开,再沿根系分布轻轻挖掘,同时用水冲洗根部,使其从土壤中露出,以保护侧根不掉落。选取根系完整的植株装入塑料袋,编号带回实验室测量根系形态和干质量。每个样地,各年龄栓皮栎幼苗采集4~10株,共采集幼苗389株。
1.2.2 生境因子调查研究区气温和降雨数据分别由黄龙林场、楼观台林场、南五台林场、眉县林业局、商州区林业局提供,以近10年平均值作为环境因子分析(表 1)。研究区海拔和地理坐标采用GPS(MagellanGPS315)测定。坡度、坡向用罗盘仪测定。每个样地沿对角线等距离设置3个土壤取样点,每个取样点土壤剖面按10 cm划分成5层,分层取样,测定湿质量后,在105 ℃下烘干至恒量,计算0~50cm土壤平均含水率。所取土壤样品在遮阳通风处阴干,测定土壤有机质(重铬酸钾法)、速效磷(NaHCO3浸提-钼蓝比色法)、速效钾(火焰光度法)、速效氮(碱解扩散法)以及土壤pH值(ZD-2型电位滴定计测定);土壤密度测量采用100 cm3环刀方法。将测得同一研究地点的各样地环境因子的平均值作为该地区环境因子指标(表 1)。
1.2.3 幼苗根系形态和干质量测定在室内,测定不同采集地点不同年龄的栓皮栎幼苗根系。主根长为根基部至主根根尖的距离。将每株幼苗主根上的全部侧根剪下,使用EPSON TWAIN PRO根系扫描仪(32 bit,加拿大Regent Instrument Inc公司)扫描。在根系研究中,一般将细根划分为ϕ≤1 mm的根(finest root)和1<ϕ≤2 mm的根(very fine root)(Xiao et al.,2008)。由于在本研究中栓皮栎幼苗ϕ≥2 mm侧根较少。因此,根据直径大小划分为3个等级: ϕ≤0.5 mm、0.5<ϕ≤1 mm和ϕ≥1 mm。将扫描图像输入WINRhizo系统,自动统计每株幼苗不同直径等级侧根数量、表面积和长度。扫描过后,将每株幼苗全部侧根样品以及主根在80 ℃下烘干24 h,称量干物质质量。侧根比根长(specific rootlength,SRL)按每株幼苗全部侧根长度与总干质量之比计算,单位为m·g-1。
1.3 数据处理计算同一地点同一年龄幼苗根系各项指标的平均值。采用Shapiro-Wilk方法检验数据的正态性;对同一年龄不同采集地的栓皮栎幼苗各项测量指标进行单因素方差分析(One-way ANOVA),并采用Duncan多重比较(P<0.05)。所得结果以平均值±标准误表示(mean±SE)。使用SPSS18.0统计软件进行数据分析,使用Origin7.5作图。
在较大地理尺度上分析环境因子对栓皮栎幼苗生长的影响,很难确定其主要因子。采用主成分分析的方法,对多个环境因子降维,利用原变量线性关系建立新主分量来表示事物的主要方面(张金屯,2011)。采用CANOCO4.5建立环境因子与幼苗形态和干质量的PCA双序轴,以反映每个环境因子对新主分量的负荷量,表明环境因子与幼苗各构件生长的不同作用(Lepš et al.,2003)。先以每个样地为单位,对该样地幼苗根系指标和环境因子的平均值进行中心化和标准化,再计算特征根和特征向量,最后通过Canodraw软件以前4个主分量为排序坐标作图,图中向量夹角余弦值表示各因子间相关性,所处象限表示与主分量的作用方向,向量顶点到坐标轴的投影距离表示对该主分量贡献。
2 结果与分析 2.1 幼苗主根长和干质量不同分布区的栓皮栎1~4年生幼苗主根长和主根干质量变化规律相同(图 1),按纬度从南向北,最大值出现在秦岭南坡,而最小值出现在黄土高原,秦岭北坡居中;在秦岭北坡随着海拔升高,主根长度和干质量均减少。其中,与秦岭南坡核心区相比,黄土高原地区1~4年生幼苗主根长分别下降了54.4%,40.5%,46.2%和49.8%,而主根干质量分别降低了83.5%,89.7%,83.9%和82.8%,差异显著(P<0.05)。在秦岭北坡,高海拔地区幼苗主根长与低海拔相比有所下降,但无明显差异(P>0.05)(2年生幼苗除外)。而1~4年生幼苗主根干质量与低海拔相比,分别下降了35.5%,66.6%,62.2%和67.6%,差异明显(P<0.05)(1年生幼苗除外)。同一地点不同年龄比较发现,与1年生幼苗相比,秦岭北坡低海拔4年生幼苗主根长增加了128.1%,主根干质量增加了942.2%,而高海拔地区4年生幼苗分别增加了85.2%和423.5%,增长最慢。
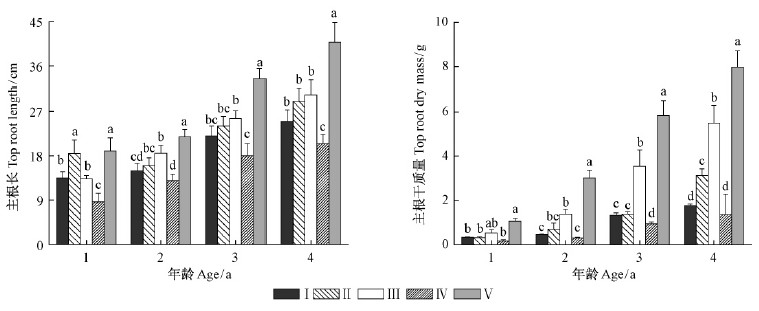 |
图 1 不同分布区栓皮栎1~4年生幼苗主根长和主根干质量
Fig. 1 Top root length and dry mass of Q. variabilis seedlings in the different distribution areas
Ⅰ代表秦岭北坡高海拔;Ⅱ代表秦岭北坡中海拔;Ⅲ代表秦岭北坡低海拔;Ⅳ代表黄土高原;Ⅴ代表秦岭南坡。在 Ⅰ for the high altitude in the northern slope of QinlingMountains;Ⅱ for the medium altitude in the northern slope of Qinling Mountains;Ⅲ for the low altitude in the northernslope of Qinling Mountains;Ⅳ for Loess Plateau;Ⅴ for the southern slope of Qinling Mountains. The different lettersindicate the significant difference at |
总体来看,幼苗侧根数量按秦岭南坡、秦岭北坡和黄土高原由南向北的纬度梯度逐渐减少,而在秦岭北坡随着海拔升高,侧根数量也呈现下降趋势(表 2)。同一地区侧根的数量随着幼苗年龄的增加而增加,但不同地区增加程度不同。与1年生幼苗相比,秦岭北坡高海拔4年生幼苗侧根总数增加了131.8%,而低海拔增加了151.8%。而同一年龄不同直径等级的细根中,ϕ≤0.5 mm侧根数最多。以秦岭南坡为例,1~4年生幼苗ϕ≤0.5 mm侧根数分别占全部侧根数量的77.1%,75.6%,75.2%和76.1%。而与秦岭南坡地区相比,黄土高原1~4年生栓皮栎幼苗ϕ≤0.5 mm侧根数量分别下降了73.6%,58.1%,67.2%和77.9%,而0.5<ϕ≤1mm侧根数量分别下降了70.5%,61.5%,59.2%和55.8%,差异均显著(P<0.05)。ϕ>1 mm侧根数量最大值出现在秦岭北坡低海拔地区,但与秦岭南坡无明显差异。秦岭北坡高海拔地区1年生和2年生栓皮栎幼苗侧根直径均小于1 mm。
|
|
侧根表面积按纬度梯度由南向北减少,而在秦岭北坡,最小值出现在高海拔地区(表 2)。随着年龄的增长,不同地区的幼苗侧根表面积增加程度不同。其中,秦岭北坡高海拔4年生幼苗侧根总面积与1年生幼苗相比增加429.1%,而低海拔地区增加548.6%。不同地区幼苗的侧根表面积差异较大。与秦岭南坡相比,黄土高原1~4年生栓皮栎幼苗ϕ≤0.5 mm侧根表面积分别下降了87.5%,75.0%,51.7%和64.8%,差异显著(P<0.05)(3年生幼苗除外)。而0.5<ϕ≤1 mm的侧根表面积分别下降了84.8%,81.1%,77.3%和58.3%,差异均显著(P<0.05)。ϕ>1 mm侧根表面积最大值出现在秦岭北坡低海拔,最低值出现在高海拔,二者差异明显(P<0.05)。
幼苗侧根长度总体由大到小排序为秦岭南坡、秦岭北坡低海拔、中海拔、黄土高原和秦岭北坡高海拔(表 2)。同一地区侧根长度随着幼苗年龄的增加而增加,但不同地区增加程度不同。其中,与1年生幼苗相比,秦岭北坡高海拔地区4年生幼苗侧根总长度增加了260.9%,而低海拔地区增加了423.7%。与秦岭南坡相比,黄土高原1~4年生栓皮栎幼苗ϕ≤0.5 mm侧根长度下降了95.1%,89.2%,67.4%和57.2%,而0.5<ϕ≤1 mm侧根长度下降了88.3%,78.7%,77.2%和61.3%,差异均显著(P<0.05)。而ϕ>1 mm的侧根长度按纬度由南向北和海拔由低到高而减少,最小值出现在秦岭北坡高海拔。
2.3 幼苗侧根总干质量和比根长栓皮栎幼苗的侧根总干质量按纬度由南向北,最大值出现在秦岭南坡,最小值出现在黄土高原;在秦岭北坡最低值出现在高海拔地区,而中海拔和低海拔地区无显著差异(P>0.05)(2年生幼苗除外)(图 2)。与1年生幼苗相比,秦岭北坡高海拔4年生幼苗侧根干质量增加了460%,而低海拔地区增加了718.9%。不同地区幼苗侧根干质量差异较大。其中,与秦岭南坡相比,黄土高原1~4年生栓皮栎幼苗的侧根总干质量分别下降了77.1%,68.1%,58.3%和44.9%,差异明显(P<0.05)。总体来看,幼苗侧根比根长最大值出现在秦岭北坡高海拔,其次为秦岭北坡低海拔地区,最小值出现在黄土高原地区(图 2)。同一地区随着幼苗年龄的增加,侧根比根长逐渐下降。与1年生幼苗相比,秦岭北坡高海拔4年生幼苗侧根比根长下降了35.7%,低海拔地区下降了36.1%。不同地区的幼苗侧根比根长差异较大。其中,与秦岭北坡高海拔相比,黄土高原1~4年生幼苗侧根比根长分别下降了81.3%,74.1%,74.2%和74.8%,差异明显(P<0.05)。
 |
图 2 不同分布区栓皮栎1~4年生幼苗侧根总干质量和比根长
Fig. 2 Lateral root dry mass and specific root length(SRL)of Q. variabilis seedlings in the different distribution areas
|
采用PCA分析,建立幼苗根系特征与环境因子双序图(图 3),前3个主分量累计方差贡献率达到85.2%。其中,对第1主分量贡献较高的环境因子包括pH值(相关系数-0.965 4)、土壤氮含量(0.923 5)、土壤含水量(0.851)、≥10 ℃有效积温(0.831 6)、土壤密度(-0.786 3)、土壤钾(0.768 2)以及年均降雨量(0.326 7),而年均温(-0.794 0)对第2主分量贡献较大,土壤有机质(0.691 7)对第3主分量贡献较大。通过双序轴发现,年均温和≥10 ℃年有效积温分别与主根干质量、长度以及侧根干质量的向量方向一致,夹角较小,表明具有较强正相关。而土壤中氮、磷、钾等矿质元素和土壤有机质含量,分别与侧根长度、表面积、数量和比根长具有较强正相关。
 |
图 3 幼苗根系特征与环境因子PCA双序图
Fig. 3 PCA biplot of environmental factors and root morphologic of Q. variabilis seedlings
幼苗根系特征TRL:主根长;TRW:主根干质量;LRW:侧根干质量;LRN:侧根数量;LRS:侧根表面积;LRL:侧根长度;SRL:侧根比根长.环境因子PRE:降雨;TEM:年均温; T: ≥10 ℃年有效积温;M:土壤含水率;O:土壤有机质;P:速效磷;K:速效钾;N:速效氮;pH:土壤pH;B:土壤密度。 Seedlings root characteristics TRL: top rootlength;TRB: top root dry mass;LRB: lateral root dry mass;LRN: lateral root number;LRS: lateral root surface area;LRL:lateral root length;SRL: lateral root SRL. Environmental factors PRE: annual precipitation;TEM: annual mean temperature;T: ≥10℃ annual accumulated temperature;M: soil moisture;O: soil organic matter;P: available phosphorus;K: availablepotassium;N: available nitrogen;pH: soil pH;B: soil bulk density. |
采用Pearson相关系数反映各环境因子对幼苗根系不同特征的影响(表 3),也发现幼苗主根长与年均温正相关性较大,而主根干质量主要与≥10 ℃年有效积温有关。侧根干质量、数量以及长度均与土壤pH值呈明显负相关,与土壤氮含量呈明显正相关。而侧根表面积与土壤密度负相关性最大。土壤速效磷含量分别与侧根表面积和比根长的正相关性显著。
|
|
生物对环境的适应,决定了其分布的范围和分布规模(Heino,2005)。在分布的核心区,物种受到较少的环境压力,而越接近边缘区环境对物种的生存压力越大,主要表现为构件生长受到抑制(Lomolino et al.,2006)。本研究发现,随着年龄的增长,秦岭南坡和北坡低海拔地区的1~4年生幼苗根系生长较快,而高海拔地区和黄土高原幼苗生长较慢。说明受环境影响,栓皮栎幼苗的根系生长呈现出沿纬度由南向北和海拔升高逐渐下降的趋势。与其他栎类乔木相比,栓皮栎对热量有较高的需求,其在温带的垂直海拔分布一般在1 500 m以下(罗伟祥等,2009)。王婧等(2010)认为栓皮栎在中国大陆的分布区的年均气温为15.3 ℃,年均降水量为411~2 000 mm。因此,在秦岭南坡和秦岭北坡低海拔地区的栓皮栎根系形态指标和生物量高于其他地区,可能与该地区年均温和有效积温较高有关。适宜的水热条件,更有利于栓皮栎幼苗的物质积累和能量分配。
木本植物的主根和较粗的侧根主要起到支撑和物质转运的作用,而水和无机盐的吸收通过较细的根进行(Markesteijn et al.,2009;Domenicano et al.,2011)。在研究森林细根储量和周转时,通常将直径小于2 mm的根定义为细根,直径越小,呼吸速率和吸收能力越强(Pregitzer et al.,2002;Xiao et al.,2008)。本研究将1~4年生栓皮栎幼苗侧根按直径大小划分为ϕ≤0.5 mm、0.5<ϕ≤1 mm和ϕ>1mm 3个等级,发现多数幼苗的侧根直径ϕ≤2 mm,ϕ≤0.5 mm侧根数量占侧根总数的55%~80%。幼苗的侧根较细,有利于水和矿质元素的吸收,从而满足地上部分快速生长的需求。刘莹等(2010)通过对2年生油松根系研究,发现大部分根系直径ϕ≤1.5 mm。夏菲等(2012)对黄土高原辽东栎1 ~3年生幼苗根系研究发现,ϕ≤2 mm的根系长度占总长度的92%以上。在本研究中,随着纬度自核心区由南向北以及海拔的升高,栓皮栎幼苗的侧根总数逐渐下降,在分布边缘区黄土高原达到最低。而对侧根按不同直径划分后发现,秦岭北坡高海拔地区1年生和2年生幼苗侧根均小于1 mm(表 2)。说明该地区低温环境导致幼苗侧根维管束直径和皮层厚度的增加缓慢(陈海波等,2010)。
根长和根表面积是反映根系吸收能力的重要指标(Ostonen et al.,2007)。研究发现,随着纬度由南向北,栓皮栎幼苗的侧根根长和表面积逐渐减少。说明在水热条件较好和营养充足的栓皮栎分布核心区和主要分布区,幼苗有足够的侧根表面积和长度满足其对水分和矿质营养的吸收。这也是该地区幼苗生长良好,聚集强度较大,种群密度大的原因(张文辉等,2002;丁惠萍等,2007)。而在分布的边缘区黄土高原,幼苗侧根长度和表面积较小(表 2),主要由于该地区降雨少、土壤含水量低,限制了根系的生长(Pregitzer et al.,2000)。这与Di lorio等(2011)的研究结论一致,其认为干旱能够显著降低柔毛栎(Quercus pubescens)顶端细根的数量和长度。
比根长越大,说明用于构建和维持单位长度根系所需碳水化合物越少,更多的能量用于吸收作用(Guo et al.,2008)。在本研究中,栓皮栎1~4年生幼苗的侧根比根长最小值出现在黄土高原地区,而秦岭北坡高海拔地区的幼苗侧根比根长最大,但干质量最小(图 2)。说明在高海拔地区,侧根生长倾向于增加单位质量的长度,使更多能量用于水和矿质元素的吸收。武高林等(2008)对4种风毛菊属(Saussurea)植物研究后发现,植物在恶劣条件下会通过增加比根长来更有效地吸收土壤中的养分。但也有试验表明:在养分含量高的土壤中,根系的比根长要明显大于贫瘠土壤(陈海波等,2010)。在本研究中的秦岭北坡高海拔地区,年均温和有效积温均较低,限制了栓皮栎幼苗侧根干物质的积累,但土壤中矿质元素含量较高,能够促进比根长的增加,增强吸收能力,从而形成了栓皮栎幼苗适应高海拔地区的生存策略。
3.2 影响幼苗根系发育的环境因子分析5个采样地区的气候、土壤差异较大,对栓皮栎幼苗生长的影响也不相同。因此,对多个相互关联的影响因子降维,从而找到起决定作用的因素是采用PCA分析的关键(Legendre et al.,2001)。研究发现,温度、降雨量以及土壤理化性质能够解释影响幼苗生长因素的85.2%,而对第1主分量贡献率较高的前3个环境因子分别是土壤pH值、土壤氮含量和含水率。张文辉等(2004)在对川西北泡沙参(Adenophora potaninii)种群根系生长与环境因子主成分分析研究中,也发现组成第1主分量的环境因子中,土壤pH值和土壤湿度贡献率较高,这与本研究结论一致。但10个环境因子降维后,发现多数因子对第1主分量贡献较高,而年均温对第2主分量贡献较高。这可能由于温度随着所选样地由南向北和海拔升高而逐渐降低,表现出明显的梯度趋势。
PCA双序轴和Pearson相关系数均表明:年均温和有效积温与主根和侧根的干质量呈较高的正相关性,而土壤中速效磷含量的增加能够提高侧根比根长和表面积,速效氮含量增加能够促进侧根增长(表 3)。说明幼苗根系的生物量积累和形态建成受不同的环境因子影响。王国梁等(2009)采用逐步回归的方法发现黄土高原丘陵区退耕地根长密度和根面积密度与土壤有效磷、有效氮以及土壤水分含量有关。于立忠等(2007)研究发现,施用磷肥后日本落叶松(Larix kaempferi)人工林的细根比根长显著增加。因此,在栓皮栎林经营过程中,幼苗抚育要充分考虑立地条件,通过有效施用氮肥和磷肥,可以改善土壤质量,促进幼苗根系生长,提高幼苗存活率。
| [1] |
陈海波, 卫 星, 王 婧, 等. 2010. 水曲柳苗木根系形态和解剖结构对不同氮浓度的反应. 林业科学,46(2): 61-66.( 2) 2)
|
| [2] |
丁惠萍, 钱克红, 杨运经. 2007. 陕西栓皮栎种群分布格局的分形特征. 西北林学院学报, 22(6): 7-9.( 1) 1)
|
| [3] |
韩照祥, 张文辉, 李军乔, 等. 2004. 陕西不同地区栓皮栎种群年龄结构动态模型的研究. 西北植物学报,24(2): 254-258.( 1) 1)
|
| [4] |
刘 莹, 王国梁, 刘国彬, 等. 2010. 不同分类系统下油松幼苗根系特征的差异与联系. 植物生态学报,34(12): 1386-1393.( 2) 2)
|
| [5] |
罗伟祥, 张文辉, 黄一钊. 2009. 中国栓皮栎. 北京: 中国林业出版社.( 2) 2)
|
| [6] |
马莉薇, 张文辉, 薛瑶芹, 等. 2010. 秦岭北坡不同生境栓皮栎实生苗生长及其影响因素. 生态学报,30(23): 6512-6520.( 1) 1)
|
| [7] |
王国梁,周 东. 2009. 黄土丘陵区退耕地先锋群落演替过程中细根特征的变化. 西北植物学报,29(2): 356-364.( 1) 1)
|
| [8] | 王 婧, 王少波, 康宏樟, 等. 2009. 东亚地区栓皮栎的地理分布格局及其气候特征. 上海交通大学学报:农业科学版,27(3): 237-241. |
| [9] |
武高林, 陈 敏, 杜国祯. 2008. 营养和光照对不同生态幅风毛菊属植物幼苗形态可塑性的影响. 应用生态学报,19(8): 1708-1713.( 1) 1)
|
| [10] |
夏 菲, 王孝安, 郭 华, 等. 2012. 不同龄级辽东栎幼苗根系形态对幼苗生长的影响. 中国农学通报,28(10): 32-36.( 2) 2)
|
| [11] |
于立忠, 丁国泉, 史建伟, 等. 2007. 施肥对日本落叶松人工林细根直径、根长和比根长的影响. 应用生态学报,18(5): 957-962.( 1) 1)
|
| [12] |
张金屯. 2011. 数量生态学. 2版. 北京: 科学出版社.( 1) 1)
|
| [13] |
张文辉, 刘祥君, 刘国彬, 等. 2004. 川西北泡沙参种群根系生长动态及其与环境因素关系研究. 应用生态学报,15(1): 39-43.( 1) 1)
|
| [14] |
张文辉, 卢志军, 李景侠, 等. 2002. 陕西不同林区栓皮栎种群空间分布格局及动态的比较研究. 西北植物学报,22(3): 476-483.( 2) 2)
|
| [15] |
周建云, 林 军, 何景峰, 等. 2010. 栓皮栎研究进展与未来展望. 西北林学院学报,25(3): 43-49.( 1) 1)
|
| [16] |
Brown A L P, Day F P, Stover D B. 2009. Fine root biomass estimates from minirhizotron imagery in a shrub ecosystem exposed to elevated CO2. Plant and Soil, 317(1/2): 145-153.( 1) 1)
|
| [17] |
Di lorio A, Montagnoli A, Scippa G S, et al. 2011. Fine root growth of Quercus pubescens seedlings after drought stress and fire disturbance. Environmental and Experimental Botany, 74: 272-279.( 1) 1)
|
| [18] |
Domenicano S, Coll L, Messier C, et al. 2011. Nitrogen forms affect root structure and water uptake in the hybrid poplar. New Forests, 42(3): 347-362.( 1) 1)
|
| [19] |
Gill R A, Jackson R B. 2000. Global patterns of root turnover for terrestrial ecosystems. New Phytologist, 147(1): 13-31.( 1) 1)
|
| [20] |
Guo D L, Xia M X, Wei X, et al. 2008. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species. New Phytologist, 180(3): 673-683.( 1) 1)
|
| [21] |
Heino J. 2005. Positive relationship between regional distribution and local abundance in stream insects: a consequence of niche breadth or niche position? Ecography, 28(3): 345-354.( 1) 1)
|
| [22] |
Kang H Z, Liu C J, Yu W J, et al. 2011. Variation in foliar delta-N15 among oriental oak(Quercus variabilis)stands over eastern China: Patterns and interactions. Journal of Geochemical Exploration, 110(1): 8-14.( 1) 1)
|
| [23] |
Legendre P, Gallagher E D. 2001. Ecologically meaningful transformations for ordination of species data. Oecologia, 129(2): 271-280.( 1) 1)
|
| [24] |
Lepš J, Šmilauer P. 2003. Multivariate Analysis of Ecological Data Using CANOCO. New York: Cambridge University Press.( 1) 1)
|
| [25] |
Lomolino M V, Riddle B R, Brown J. 2006. Biogeography. 3rd ed. Sunderland, Massachusetts: Sinauer Associates Inc.( 1) 1)
|
| [26] | Markesteijn L, Poorter L. 2009. Seedling root morphology and biomass allocation of 62 tropical tree species in relation to drought-and shade-tolerance. Journal of Ecology, 97(2): 311-325. |
| [27] |
Ostonen I, Lohmus K, Helmisaari H S, et al. 2007. Fine root morphological adaptations in Scots pine, Norway spruce and silver birch along a latitudinal gradient in boreal forests. Tree Physiology, 27(11): 1627-1634.( 2) 2)
|
| [28] |
Pregitzer K S, DeForest J L, Burton A J, et al. 2002. Fine root architecture of nine North American trees. Ecological Monographs, 72(2): 293-309.( 1) 1)
|
| [29] |
Pregitzer K S, King J A, Burton A J, et al. 2000. Responses of tree fine roots to temperature. New Phytologist, 147(1): 105-115.( 2) 2)
|
| [30] |
Sayer M A S, Brissette J C, Barnett J P. 2005. Root growth and hydraulic conductivity of southern pine seedlings in response to soil temperature and water availability after planting. New Forests, 30(2/3): 253-272.( 1) 1)
|
| [31] |
Vogt K A, Grier C C, Vogt D. 1986. Production, turnover, and nutrient dynamics of above-and belowground detritus of world forests. Advances in Ecological Research, 15: 303-377.( 1) 1)
|
| [32] |
Xiao C W, Sang W G, Wang R Z. 2008. Fine root dynamics and turnover rate in an Asia white birch forest of Donglingshan Mountain, China. Forest Ecology and Management, 255(3/4): 765-773.( 2) 2)
|
 2013, Vol. 49
2013, Vol. 49

