文章信息
- 魏海蓉, 陈新, 宗晓娟, 王甲威, 张庆霞, 张道辉, 刘庆忠
- Wei Hairong, Chen Xin, Zong Xiaojuan, Wang Jiawei, Zhang Qingxia, Zhang Daohui, Liu Qingzhong
- 甜樱桃矮化砧‘吉塞拉6号’扦插过程中氧化酶活性和碳氮含量变化
- Fluctuations of Oxidase Activities and Carbon and Nitrogen Content during the Rooting Process of Sweet Cherry Dwarf Rootstock ‘Gisela 6’ Softwood Cuttings
- 林业科学, 2013, 49(9): 172-177
- Scientia Silvae Sinicae, 2013, 49(9): 172-177.
- DOI: 10.11707/j.1001-7488.20130925
-
文章历史
- 收稿日期:2013-06-16
- 修回日期:2013-07-08
-
作者相关文章
2. 陇东学院农林科技学院 庆阳 745000
2. College of Agroforestry Sci-Tech, Longdong University Qingyang 745000
甜樱桃(Prunus avium)矮化砧‘吉塞拉6号’(Prunus cerasus×P. canescens)是由酸樱桃(Prunus cerasus)与灰毛叶樱桃(Prunus canescens)种间杂交育成的三倍体杂种,用作砧木材料具有矮化、早实、丰产、抗性强、适应范围广等优点(刘庆忠等,2006)。由于其为三倍体无性系砧木,须采用无性繁殖才能保持其性状稳定。采用常规压条、硬枝扦插很难生根,组织培养对技术水平要求较高,需要一定的设备,投资大,繁殖成本高,限制了其推广应用,不能满足生产需要。嫩枝扦插能够有效解决‘吉塞拉6号’快速繁育问题(刘庆忠等,2008)。目前关于吉塞拉砧木扦插繁育技术的研究较多,而有关扦插过程中生理生化代谢的研究尚未开展,不定根形成与发育的调控机制不明确导致生产技术缺乏理论指导。植物扦插过程中不定根的发生受多种内外因素的影响,其中生长素类物质起着重要的调控作用(Ahkami et al.,2013; Singh et al.,2011)。外源IBA和IAA已被广泛应用于扦插过程中诱导不定根的发生,但是针对不同树种和品种其施用方法和作用效果存在较大差异(Baul et al.,2011; Raju et al.,2010; Swamy et al.,2002)。一些对植物生长、发育起重要调节作用的酶类,如过氧化物酶(POD)、多酚氧化酶(PPO)和吲哚乙酸氧化酶(IAAO)与不定根的发育有着密切的关系(Rout,2006; Wei et al.,2010)。在生根过程中插穗内糖类、氮等代谢组分也发生了相应变化并且在根系形态建成过程中起到重要作用(da Costa et al.,2013;Husen et al.,2008)。本文对‘吉塞拉6号’嫩枝扦插生根过程中相关酶活性变化和碳氮代谢规律及外源IBA 的调控作用进行了研究,分析嫩枝扦插生根与相关生理生化代谢的关系,为了解其嫩枝扦插生根机制、提升嫩枝扦插繁殖技术水平提供理论基础。
1 材料与方法 1.1 试验材料试验于2012年9—10月在山东省果树研究所甜樱桃矮化砧木繁育基地进行。以甜樱桃矮化砧木‘吉塞拉6号’为试材。选取当年移栽到大田,苗高约60 cm、粗约0.5~0.8 cm的健壮植株,剪取半木质化枝条顶端的新梢作为插穗,穗长10~15cm。扦插前去除基部5~7cm区段内的叶片。
1.2 试验设计试验采用完全随机区组设计,3次重复,每个区组将对照及分别采用500,1000,2000mg·L-13种质量浓度的IBA处理的插穗各插500条,3个区组总计扦插6 000条。
1.3 扦插方法和插后管理扦插试验在塑料大棚中进行。插穗分别采用500,1 000,2 000 mg·L-13种质量浓度的IBA溶液浸沾插穗基部10 s,以清水处理作为对照。将IBA处理后的插穗的基部1/3插入河沙基质中,株行距5 cm×5 cm。扦插后,采用遮荫网遮荫(遮光率为50%),自动弥雾设施增加湿度,大棚内前期空气湿度控制在90%~100%,生根后湿度逐渐降低到60%~80%,温度控制在20~35 ℃。扦插后每周喷1次杀菌剂预防病害发生。
1.4 取样及样品处理扦插后每隔3天采样1次,每次随机采集各处理插穗30条,取出插穗后立即用清水冲掉泥沙,吸水纸擦干后剥取基部2 cm茎段范围内韧皮部,剪碎混合均匀,并用液氮速冻,在-80 ℃条件下保存,用于测定相关生理生化指标。结合取样调查和统计不定根发生和发育情况,扦插后30天统计生根率、生根数和平均根长。每个重复随机抽取30株进行调查。
1.5 指标测定方法以邻苯二酚为反应底物,比色法测定多酚氧化酶(PPO)活性(李合生等,2000);过氧化物酶(POD)、吲哚乙酸氧化酶(IAAO)、可溶性总糖和总氮采用张志良等(2003)的方法测定。PPO以每g鲜样每min吸光度每变化0.01为1个酶活性单位(U·mg-1 FW); POD以每mg 鲜样每min 改变1个OD值为1个酶活性单位(U·mg-1FW); IAAO以每mg鲜样在1 h内分解IAA的μg数表示1个酶活性单位(U·mg-1 FW)。
2 结果与分析 2.1 ‘吉塞拉6号’扦插生根特性观察统计发现: 对照组‘吉塞拉6号’插穗愈伤组织在第9天出现,随后逐渐增大并慢慢黄化,第18天后才有少量插穗有不定根发生; 大多数插穗基部愈伤组织褐化没有不定根发生; IBA处理后,在第6天即有大量愈伤组织产生(图 1a),随后愈伤组织逐渐增大,不发生黄化现象,第12天时开始有不定根产生(图 1b),第18天后不定根大量发生,此后不定根迅速伸长(图 1c)。‘吉塞拉6号’插穗不定根的形成大致可以分为: 不定根诱导阶段(0~12天)、不定根发生阶段(12~18天)和不定根伸长(18~30天)3个阶段。
 |
图 1 ‘吉塞拉6号’插穗不定根的形成
Fig. 1 The adventitious roots formation of‘Gisela6’cuttings
a.不定根诱导Adventitious roots induction; b.不定根发生Adventitious roots initiation; c.不定根伸长Adventitious roots
elongation. |
从表 1中可以看出: 不同质量浓度的IBA处理均明显提高了‘吉塞拉6号’扦插生根率、生根数和平均根长,与对照差异达极显著水平(P<0.01)。3种质量浓度处理中,1 000 mg·L-1 IBA处理后插穗生根率最高,为81.2%,比对照增加了133.3%; 500 mg·L-1 IBA处理次之,且与1 000 mg·L-1 IBA处理无显著差异; 2 000 mg·L-1 IBA处理后生根率虽与对照相比明显增加,但在3种处理中最低,并与1 000 mg·L-1 IBA处理有显著差异。1 000 mg·L-1 IBA处理后生根数和平均根长2项指标均极显著高于另外2种处理,其单株生根数多达10.5条,平均根长为2.95 cm,分别比对照增加了262.1%和45.3%。综合生根率、生根数和平均根长3项指标,1 000 mg·L-1 IBA处理‘吉塞拉6号’扦插生根效果最佳。
|
|
1)PPO活性变化PPO活性呈现出先升高后降低的有规律变化(图 2)。1 000 mg·L-1 IBA处理和对照组插穗中PPO活性的变化趋势相同,在不定根诱导阶段和不定根发生阶段(前18天)逐渐上升,在第18天达到高峰,此后在不定根伸长阶段(18~30天)逐渐降低。IBA处理与对照组在扦插初期PPO活性无显著差异,随着不定根的发生,IBA处理明显增强了插穗中PPO活性,在不定根发生阶段(12~18天),IBA处理与对照之间PPO活性的差异达到显著水平(P<0.05),这表明高活性的PPO可能与根系的大量发生有密切关系。
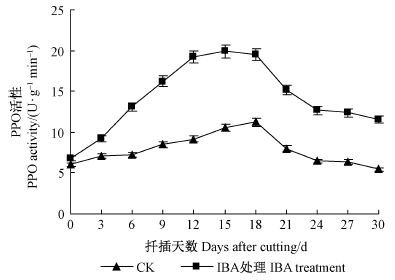 |
图 2 ‘吉塞拉6号’扦插生根过程中PPO 活性变化
Fig. 2 Changes of PPO activitiy in the rooting region
of cuttings during the rooting process of‘Gisela6’
|
2)POD活性变化POD活性的变化趋势与PPO相同(图 3)。IBA处理和对照组插穗中POD活性的变化趋势基本一致,但IBA处理显著提高了插穗中POD活性,两者差异达到显著水平(P<0.05),这说明高活性的POD在一定程度上有利于不定根的发生。
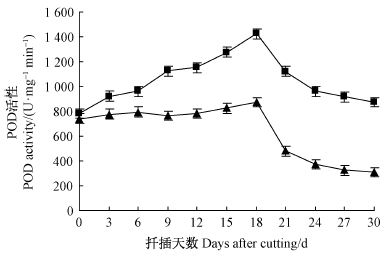 |
图 3 ‘吉塞拉6号’扦插生根过程中POD活性变化
Fig. 3 Changes of POD activitiy in the rooting region of
cuttings during the rooting process of‘Gisela6’
|
3)IAAO活性变化从图 4中可以看出: IAAO活性在不定根诱导阶段和不定根发生阶段(18天之前)持续降低,在不定根伸长阶段(18~30天)缓慢回升。IBA处理显著降低了插穗基部IAAO活性,且在整个不定根发生过程中始终低于对照,特别是在6~21天处理与对照之间IAAO活性差异达显著水平(P<0.05)。IAAO的一个主要生理功能就是氧化分解IAA,以调节植物体内IAA含量,因此IAAO活性大小与不定根的发生有密切关系。在‘吉塞拉6号’扦插生根过程中,IBA处理在根系诱导和发生阶段降低插穗体内IAAO活性,进一步减缓了IAA的氧化分解,使插穗体内IAA含量保持在较高水平,有利于不定根的发生。在根系伸长阶段,IAAO活性上升,使体内IAA含量保持在较低水平,有利于不定根的伸长。
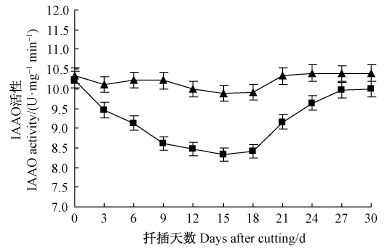 |
图 4 ‘吉塞拉6号’扦插生根过程中IAAO活性变化
Fig. 4 Changes of IAAO activitiy in the rooting region of
cuttings during the rooting process of‘Gisela6’
|
1)可溶性总糖的变化由图 5可知: ‘吉塞拉6号’扦插生根过程中,可溶性总糖含量在不定根诱导阶段(9天之前)先升高,在第9天达到最大值,之后持续降低。IBA处理明显提高了‘吉塞拉6号’嫩枝扦插生根过程中可溶性总糖含量,使其变化幅度也大于对照。由此推测,可溶性总糖含量与不定根的发生有密切关系。
 |
图 5 ‘吉塞拉6号’扦插生根过程中可溶性总糖的变化
Fig. 5 Changes of total soluble sugar in the rooting region of
cuttings during the rooting process of‘Gisela6’
|
2)全氮、总糖/全氮(C/N)的变化‘吉塞拉6号’扦插生根过程中插穗内全氮含量呈缓慢降低的变化趋势(图 6)。全氮含量的变化趋势与总糖基本同步,表明扦插生根期间不仅需要消耗大量的糖类物质,还需要一定量的氮素营养。IBA处理对‘吉塞拉6号’插穗全氮含量的影响不显著。从图 7可以看出C/N值的变化趋势与总糖的基本相同,C/N值的变化基本取决于总糖含量的变化。在插穗生根期间,呈现出在不定根诱导阶段(0~9天)逐渐升高,在不定根发生阶段(9~15天)迅速降低,在不定根伸长阶段(18~30天)趋于缓和。说明高C/N值有利于‘吉塞拉6号’扦插不定根的发生。
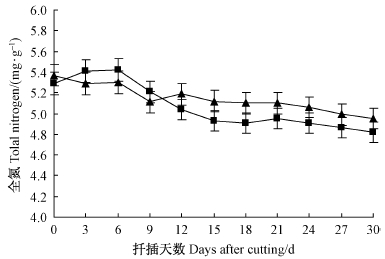 |
图 6 ‘吉塞拉6号’扦插生根过程中全氮含量的变化
Fig. 6 Changes of total nitrogen in the rooting region of
cuttings during the rooting process of‘Gisela6’
|
 |
图 7 ‘吉塞拉6号’扦插生根过程中C/N值的变化
Fig. 7 Changes of C/N ratio in the rooting region of
cuttings during the rooting process of‘Gisela6’
|
PPO和POD参与植物体内多种生理生化过程,在细胞分裂、分化及根原基的形成和生长过程中起重要作用(Hayrullah et al.,2003)。PPO的一个重要作用就是催化酚类物质与IAA生成“IAA-酚酸复合物”,这是一种生根辅助因子,能够促进不定根的生成(Bassuk et al.,1981; 付喜玲等,2009)。POD可以使某些阻碍不定根发生的抑制物质受到破坏,在不定根诱导阶段和发生阶段,POD活性升高是插穗有生根能力的标志(扈红军等,2007;Rout,2006; Garspar et al.,1992)。本试验中,PPO和POD活性的变化趋势相同,在不定根诱导阶段和发生阶段持续上升,在不定根伸长阶段下降。IBA处理显著提高了插穗体内PPO和POD 活性,从而有效地促进了‘吉塞拉6号’嫩枝扦插生根。
前人研究表明: IAAO的一个重要生理功能是促进不定根的发生和发育,IAAO可以氧化IAA,因此与不定根发生有密切关系(Bagatharia et al.,1998)。在不定根诱导和发生阶段,较低活性的IAAO有利于插穗IAA的积累,以促进不定根的诱导和发生(Nag et al.,2001)。本试验中,IBA处理组与对照组的IAAO活性具有相似的变化趋势,均在不定根诱导和发生阶段持续降低,而在根系伸长阶段缓慢回升。与对照相比,IBA处理显著降低了插穗基部IAAO活性,并且使不同阶段IAAO活性差异达到显著水平,有利于根系的诱导和发生,这与Rout(2006)在茶(Camellia sinensis)嫩枝扦插上的研究结果类似。
3.2 ‘吉塞拉6号’嫩枝扦插不定根发生与营养物质代谢的关系不定根的发生是一个高耗能的过程,可溶性和贮藏性碳水化合物在不定根发生和发展过程中作为物质基础和能量来源而起到非常重要的作用,其中可溶性总糖是不定根发生所必需的营养物质(Husen et al.,2007; 赵晓敏等,2007)。前人研究表明: 激素处理可以提高柚木(Tectona gr and is)插穗可溶性总糖含量,同时也提高不定根发生频率(Husen,2008)。本试验,‘吉塞拉6号’在扦插初期,由于插穗受到剪切损伤,呼吸作用增强,水解淀粉形成可溶性总糖的速度大于消耗,可溶性总糖含量增加。不定根发生和伸长阶段,大量根源基的分化和不定根的产生及生长,可溶性总糖利用加快,插穗可溶性总糖含量降低。‘吉塞拉6号’插穗可溶性总糖的这种变化趋势与Husen等(2007)的结论一致。IBA处理在扦插初期能明显提高插穗可溶性糖的积累,促进不定根的形成。
氮素化合物也是不定根发生所不可缺少的营养物质(Druege et al.,2000)。本试验中‘吉塞拉6号’扦插生根过程中全氮含量呈持续缓慢下降的趋势,说明插穗生根过程也需要消耗一定量的氮类物质,这与楸树(Catalpa bungei)扦插的结论一致(王新建等,2009),但在四倍体刺槐(Robinia pseudoacacia)扦插过程中全氮含量与生根无相关关系(王小玲等,2012)。IBA处理对‘吉塞拉6号’插穗全氮含量的影响不显著,说明植物全氮含量与扦插不定根发生关系较为复杂,有待进一步研究。
许多研究认为,插穗不定根发生与碳水化合物(C)和含氮化合物(N)的比值有密切关系。C/N值越高,插穗生根能力越强(Wei et al.,2010; Batish et al.,2008; 王新建等,2009)。本试验中IBA处理显著提高了‘吉塞拉6号’插穗C/N值,从而提高了生根率。
在‘吉塞拉6号’嫩枝扦插生根过程中,IBA处理能显著提高其生根率和生根质量,其中1 000 mg·L-1 IBA效果最佳。PPO,POD和IAAO活性及可溶性总糖含量、C/N值都呈现出有规律的变化,与不定根的发生关系密切。IBA处理显著影响了以上指标的变化,从而影响了生根,但是它们在生根过程中的相互作用关系如何,有待进一步研究。
| [1] |
付喜玲, 郭先锋, 康晓飞, 等. 2009. IBA对芍药扦插生根的影响及生根过程中相关酶活性的变化. 园艺学报,36 (6): 849-854.( 1) 1)
|
| [2] |
扈红军, 曹帮华, 尹伟伦, 等. 2007. 不同处理对欧榛硬枝扦插生根的影响及生根过程中相关氧化酶活性的变化. 林业科学, 43(12): 70-75.( 1) 1)
|
| [3] |
李合生,孙群,赵士杰,等.2000.植物生理生化实验原理和技术.北京: 高等教育出版社,213-214.( 1) 1)
|
| [4] |
刘庆忠, 张力思, 李勃, 等. 2006. 甜樱桃矮化砧木新品种'吉塞拉6号'. 园艺学报, 33 (1): 213.( 1) 1)
|
| [5] |
刘庆忠, 魏海蓉, 艾呈祥, 等. 2008. 甜樱桃矮化砧木吉塞拉嫩枝扦插技术研究. 落叶果树, (4): 22-24.( 1) 1)
|
| [6] |
王小玲, 赵忠, 高柱. 2012. 四倍体刺槐插条不定根发生的营养物质变化. 江西农业大学学报, 34(4): 724-729.( 1) 1)
|
| [7] |
王新建, 何威, 张秋娟, 等. 2009. 豫楸1号扦插生根过程中营养物质含量及氧化酶类活性的变化.林业科学, 45(4): 156-161.( 2) 2)
|
| [8] |
张志良, 瞿伟菁. 2003. 植物生理学实验指导. 北京: 高等教育出版社, 123-124, 188-189.( 1) 1)
|
| [9] |
赵晓敏, 霍常富, 沈海龙. 2007. 影响林木插条生根的内部及环境因子研究综述.世界林业研究, 20(5): 12-16.( 1) 1)
|
| [10] | Ahkam A H, Melzer M, Ghaffari M R, et al. 2013. Distribution of indole-3-acetic acid in Petunia hybrida shoot tip cuttings and relationship between auxin transport, carbohydrate metabolism and adventitious root formation. Planta, 238(3):499-517. |
| [11] |
Bagatharia S B, Chanda S V.1998. Changes in peroxidase and IAA oxidase activities during cell elongation in Phaseolus hypocotyls. Acta Physiol Plant,20(1): 9-13.( 1) 1)
|
| [12] |
Bassuk N L, Hunter L D, Howard B H. 1981.The apparent of polyphenol oxidase and phloridzin in the production of apple rooting cofactors. J Hort Sci,56(4): 313-322.( 1) 1)
|
| [13] |
Batish D R, Singh H P, Kaur M, et al. 2008.Caffeine affects adventitious rooting and causes biochemical changes in the hypocotyl cuttings of mung bean(Phaseolus aureus Roxb.).Acta Physiol Plant, 30(3): 401-405.( 1) 1)
|
| [14] |
Baul T K, Hossain M M, Mezbahuddin M, et al. 2011. Vegetative propagation of Litsea monopetala, a wild tropical medicinal plant: effects of indole-3-butyric acid (IBA) on stem cuttings. J Forestry Res,22(3): 409-416.( 1) 1)
|
| [15] |
da Costa C T, de Almeida M R, Ruedell C M, et al. 2013. When stress and development go hand in hand: main hormonal controls of adventitious rooting in cuttings.Front Plant Sci, doi: 10.3389/fpls.2013.00133. ( 1) 1)
|
| [16] |
Druege U, Zerche S, Kadner R, et al. 2000. Relation between nitrogen status, carbohydrate distribution and subsequent rooting of chrysanthemum cuttings as affected by preharvest nitrogen supply and cold-storage. Ann Bot,85(5): 687-701.( 1) 1)
|
| [17] | Graspar T, Kevers C, Hausman J F, et al. 1992. Total practical uses of peroxidase activity as a predictive maker of rooting per formance of micropropagation. Agronomic, 12: 757-765. |
| [18] |
Hayrullah Y, Tuncer T, Birol O. 2003. Polyphenol oxidase activity during rooting in cuttings of grape(Vitis vinifera L.) varieties.Turk J Bot,27(6): 495-498.( 1) 1)
|
| [19] |
Husen A. 2008. Stock-plant etiolation causes drifts in total soluble sugars and anthraquinones, and promotes adventitious root formation in teak (Tectona grandis L. f.) coppice shoots. Plant Growth Regul,54(1): 13-21.( 2) 2)
|
| [20] |
Husen A, Pal M. 2007. Metabolic changes during adventitious root primordium development in Tectona grandis Linn. f. (teak) cuttings as affected by age of donor plants and auxin (IBA and NAA) treatment. New Forest, 33(3): 309-323.( 2) 2)
|
| [21] |
Nag S, Saha K,Choudhuri M A. 2001. Role of auxin and polyamines in adventitious root formation in relation to changes in compounds involved in rooting. J Plant Growth Regul,20(2): 182-194.( 1) 1)
|
| [22] |
Raju N L, Prasad M N. 2010. Influence of growth hormones on adventitious root formation in semi-hardwood cuttings of Celasturs paniculatus Willd.: A contribution for rapid multiplication and conservation management. Agroforestry Systems,79(2): 249-252.( 1) 1)
|
| [23] |
Rout G R. 2006. Effect of auxins on adventitious root development from single node cuttings of Camellia sinensis (L.) Kuntze and associated biochemical changes. Plant Growth Regul,48(2): 111-117.( 3) 3)
|
| [24] |
Singh B, Yadav R, Bhatt B P. 2011. Effects of mother tree ages,different rooting mediums,light conditions and auxin treatments on rooting behaviour of Dalbergia sissoo branch cuttings. J Forestry Res,22(1): 53-57.( 1) 1)
|
| [25] |
Swamy S L, Puri S, Singh A K. 2002. Effect of auxins (IBA and NAA) and season on rooting of juvenile and mature hardwood cuttings of Robinia pseudoacacia and Grewia optiva. New Forests,23(2): 143-157.( 1) 1)
|
| [26] |
Wei B L, Hong L X, Mei L Z. 2010. Effect of nitric oxide and hydrogen peroxide on adventitious root development from cuttings of ground-cover chrysanthemum and associated biochemical changes.J Plant Growth Regul,29(3): 338-348.( 2) 2)
|
 2013, Vol. 49
2013, Vol. 49

