文章信息
- 杨秀艳, 张华新, 张丽, 刘正祥, 杨升, 武香
- Yang Xiuyan, Zhang Huaxin, Zhang Li, Liu Zhengxiang, Yang Sheng, Wu Xiang
- NaCl胁迫对唐古特白刺幼苗生长及离子吸收、运输与分配的影响
- Effects of NaCl Stress on Growth and Absorption, Transportation and Distribution of Ions in Nitraria tangutorum
- 林业科学, 2013, 49(9): 165-171
- Scientia Silvae Sinicae, 2013, 49(9): 165-171.
- DOI: 10.11707/j.1001-7488.20130924
-
文章历史
- 收稿日期:2013-04-07
- 修回日期:2013-07-09
-
作者相关文章
2. 国家林业局盐碱地研究中心 北京 100091;
3. 内蒙古赤峰市林业科学研究院 赤峰 024006
2. Research Center of Saline and Alkali Land of State Forestry Administration Beijing 100091;
3. Chifeng Academy of Forestry Chifeng 024006
土壤盐渍化已成为土壤退化三大主因(土壤盐渍化、有机质减少和土壤污染)之一。目前,世界范围内的盐渍土壤面积接近8.31亿hm2(Ghassemi et al.,1995),我国盐渍土总面积约为3 600万hm2(王佳丽等,2011)。盐胁迫是限制盐碱土上植物生长的重要环境因素。高盐胁迫造成植物体内的渗透胁迫和离子失衡,进而导致养分亏缺、氧化胁迫等次生伤害,使植物正常生理代谢受到干扰,生长受阻,甚至死亡。植物在盐渍环境中维持自身细胞离子平衡的能力与其耐盐性密切相关。一般认为,高盐胁迫(高浓度Na+)可以诱导植物组织内K+含量降低(Shabala et al.,2008),从而抑制以K+为辅助因子的酶活性; 高盐浓度产生的离子毒害还会抑制植物体内其他酶的活性,破坏细胞膜的完整性,损害细胞内细胞器的功能,对植物造成危害。Cl-作为植物必需的微量元素对植物正常生长发育起到重要作用,但过高浓度的Cl-对植物会造成毒害作用(於丙军等,2004)。还有研究表明: 盐碱地上植物根际土壤中Na+,Cl-和(或)SO42-离子增多,会造成植物增加对有毒重金属的吸收和在体内的积累(Ondrasek et al.,2009a; 2009b; Khoshgoftar et al.,2004)。高盐胁迫还会抑制植物对Ca2+的吸收(赵可夫等,2000)。Ca2+对植物细胞的结构和生理功能有重要作用,并在细胞内起第二信使的作用; 外源施Ca2+对盐胁迫具有缓解作用(张乃华等,2005)。因此,维持和重建细胞内的离子平衡对植物在盐胁迫环境下细胞的正常功能具有重要意义。
唐古特白刺(Nitraria tangutorum)是白刺属植物,为中国特有种(潘晓云等,2002),分布在西北广阔的沙区及盐碱地区。作为一种真盐生植物,唐古特白刺具有很强的耐盐碱、抗旱能力,且生长快易繁殖,是我国盐碱地区及沙区优良的先锋植物。其果实营养丰富,含有氨基酸、维生素等多种营养成分,具有很高的营养保健价值,有“沙漠樱桃”之美誉;果实和枝叶等均可提取黄酮类化合物,具有降血脂、抗氧化等功效(李红等,2006)。因此,唐古特白刺具有在重度盐碱地上推广应用的巨大潜力和明显的生态价值。目前,白刺耐盐性研究主要集中在生理响应方面(闫永庆等,2010;陈建英等,2011;陈志强等,2011;高瞑等,2011;倪建伟等,2012),而对盐胁迫下其体内离子运转情况鲜有研究(陈贵林等,2009;武香等,2012)。本文以唐古特白刺为材料,研究不同浓度盐胁迫下其生长表现和体内离子分布情况,以探明其耐盐性与盐胁迫下离子吸收、运输和分配的关系,并为其在盐碱地植被构建中的合理利用提供理论参考。
1 材料与方法 1.1 试验材料与试验设计供试材料为盐生植物唐古特白刺2年生实生苗。采用盆栽方法,营养钵为直径、高度均为30 cm的塑料盆(底带托盘),每盆中加入等量的基质(5 000 g±50 g)。基质成分为腐殖质土、草炭和珍珠岩,按照1∶3∶1(体积比)混合,装盆前用多菌灵进行消毒处理。小苗移植入盆后缓苗2个月,之后选择大小均匀的健康植株进行试验。
验采用单因素完全随机设计,盐胁迫设置5个处理水平,NaCl浓度含量依次为(以基质干质量计算)0(CK),2.34,4.68,7.02和9.36 g·kg-1。每个处理水平重复3次,每个重复9株苗,参试苗共计135株。具体做法是分别采用浓度为100,200,300,400 mmol·L-1 NaCl溶液浇灌试验苗,每天1次,分4次将上述盐溶液施入各盆中以达到预定的土壤含盐量,并确保盆内盐分分布均匀,对照只浇等体积的水(为叙述方便,文中盐浓度标注以100,200,300,400 mmol·L-1分别代替2.34,4.68,7.02和9.36 g·kg-1)。为保证盐处理期间苗木需水且盆中盐分不流失,定期对试验苗浇等量水,浇水后将托盘内渗出的水倒回至处理盆中。NaCl处理40天后进行各指标测定,每处理重复3次。试验在普通塑料温室大棚中进行,以避免自然降雨的影响。
1.2 试验方法1)生长性状测定株高生长量的测定: NaCl处理前后分别测量参试苗木的株高H1和H2,计算得出株高绝对生长量H0和株高相对生长量。NaCl处理40天后,选取各处理生长中等的试验苗各3株,分别取根、茎、叶装入信封中编号放入烘箱中,105 ℃杀青1 h,杀青后调至70 ℃烘至恒质量(DW),进行称量并记录数据,用于计算单株生物量。计算公式如下:
1)株高绝对生长量(H0): H0=H2-H1;
(2)株高相对生长量(%)=H0/H1×100;
(3)单株生物量=根生物量+茎生物量+叶生物量;
(4)根冠比=根生物量/(茎生物量+叶生物量)。
2)离子含量的测定参照王宝山等(1995)和於丙军等(2001)的方法。样品经105 ℃杀青30 min后,于70~80 ℃烘干至恒质量,磨碎过40目筛后各称取1.0 g,加入30 mL去离子水,摇匀后置沸水浴中2 h,冷却后定容至50 mL备测。其中,Na+,K+和Ca2+采用原子吸收分光光度计法测定; Cl-采用自动滴定法测定。按下列公式计算不同器官对离子吸收和运输选择性系数( SX,Na)(郑青松等,2001):
运输能力SX,Na=库器官[X/Na+]/源器官[X/Na+](X代表K+和Ca2+的浓度,SX,Na值越大表示库器官选择性运输能力越强)。
1.3 数据处理数据均采用Excel 2003处理,采用SPSS 11.5统计软件对数据进行方差分析及差异显著性检验。
2 结果与分析 2.1 盐胁迫对白刺生长的影响盐处理40天后,唐古特白刺株高相对生长量在低盐浓度(100 mmol·L-1)下有显著增加,之后随着盐胁迫的增长呈现出下降趋势,表明白刺高生长受到了高盐胁迫的抑制。从生物量累积的变化来看,唐古特白刺单株生物量在低浓度NaCl胁迫下有少量增加,但与对照无显著差异。随着NaCl浓度的升高其单株生物量逐渐降低,400 mmol·L-1 NaCl胁迫下其单株生物量比对照时下降24.5%。随着NaCl浓度的升高,唐古特白刺的根冠比呈降低趋势,在400 mmol·L-1 NaCl处理下的根冠比与对照的差异达到显著水平。总体来看,唐古特白刺表现出对盐胁迫环境具有很强的生长适应性,但高浓度盐胁迫对其株高生长、生物量累积和根系生长均表现出抑制作用。
|
|
1)NaCl胁迫下白刺器官中Na+,Cl-含量的变化随着NaCl处理浓度的升高,唐古特白刺根系中的Na+和Cl-含量呈现上升趋势(图 1A): 根系中Na+含量最大值出现在400 mmol·L-1 NaCl 处理时,为7.68mg·g-1 DW; Cl-含量在根系中的最大值则出现在300 mmol·L-1 NaCl处理时,为0.34 mg·g-1 DW(图 2A)。茎中的Na+含量随着NaCl处理浓度的上升比对照也有明显增加(图 1B),最大值出现在300mmol·L-1盐处理时,为10.41 mg·g-1 DW。茎中Cl-含量峰值也出现在300 mmol·L-1 NaCl处理时,为0.49 mg·g-1 DW,随后出现下降并维持平稳状态(图 2B)。叶片中Na+和Cl-含量分别在200和100 mmol·L-1 NaCl处理时达到峰值,之后下降(图 1C,2C)。从各器官中离子绝对量的分布情况来看,叶片中的Na+,Cl-含量最高,茎中的含量略高于根系。
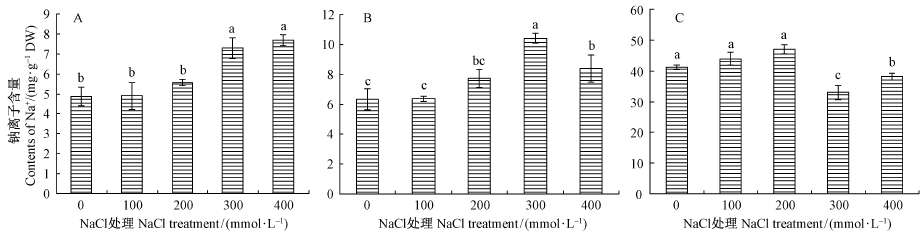 |
图 1 不同浓度NaCl胁迫对唐古特白刺根(A) 、茎(B) 和叶(C)中钠离子含量的影响
Fig. 1 Effects of different NaCl concentrations on Na+ content in roots (A) , stems (B) and leaves (C) of N. tangutorum
|
 |
图 2 不同浓度NaCl胁迫对唐古特白刺根(A) 、茎(B) 和叶(C)中氯离子含量的影响
Fig. 2 Effects of different NaCl concentrations on Cl- content in roots (A), stems (B) and leaves (C) of N. tangutorum
|
2)NaCl胁迫下白刺器官中K+含量的变化从图 3中可知,唐古特白刺根、茎、叶中K+含量随着盐浓度的增加变化相对平稳。随着盐胁迫地增强,唐古特白刺根系对K+的吸收没有降低,在400mmol·L-1 NaCl浓度下比对照增加了22.6%。茎中的K+含量在100 mmol·L-1 NaCl浓度处理时出现显著上升,随后回落至对照水平。叶片中的K+含量在NaCl处理下均高于对照水平。总体上,盐胁迫环境下白刺根系对K+的吸收增加,向地上部分的运输也未受到抑制
 |
图 3 不同浓度NaCl胁迫对唐古特白刺根(A) 、茎(B)和叶(C)中钾离子含量的影响
Fig. 3 Effects of different NaCl concentrations on K+ content in roots (A) , stems (B) and leaves (C) of N. tangutorum
|
3)NaCl胁迫下白刺器官中Ca2+含量的变化在盐胁迫下,唐古特白刺各营养器官中Ca2+含量均随盐浓度的增加而降低(图 4)。与对照相比,当NaCl浓度为400 mmol·L-1时白刺体内Ca2+含量最低: 根中的Ca2+含量降低了35.3%,茎中下降4.6%,叶片中下降26.0%,叶片中Ca2+含量降低幅度低于根中的下降幅度; 这表明白刺在盐胁迫下因对Na+离子的吸收增加导致了对Ca2+离子的吸收受阻,随之导致茎和叶中钙离子含量减少。
 |
图 4 不同浓度NaCl胁迫对唐古特白刺根(A) 、茎(B) 和叶(C)中钙离子含量的影响
Fig. 4 Effects of different NaCl concentrations on Ca2+ content in roots (A), stems (B) and leaves (C) of N. tangutorum
|
4)NaCl胁迫下白刺器官中K+/Na+和Ca2+/Na+的变化及对离子的选择吸收与运输从图 5可知: 随着土壤中NaCl浓度的增加,唐古特白刺根、茎中的K+/Na+略有下降,叶片及整株幼苗中K+/Na+一直保持平稳,且比值均低于1,说明叶片中Na+含量要高于K+。与对照相比,整个植株维持较稳定的K+/Na+,表明盐胁迫下唐古特白刺吸收Na+增加的同时加强了对K+的吸收,从而保持体内K+的平衡。Ca2+/Na+在根、茎、叶和整株则均呈下降趋势,根中下降的最为明显,进一步表明根系对Na+吸收增加阻碍了对Ca2+的吸收。
 |
图 5 不同浓度NaCl 胁迫对唐古特白刺根、茎和叶中K+/Na+(A)和Ca2+/Na+(B)离子比值的影响
Fig. 5 Effects of different NaCl concentrations on ion ratio of K+/Na+( A) and Ca2+/Na+(B) in roots, stems and leaves of N. tangutorum
|
从离子的运输方向来看(图 6和7),Ca2+从根系向地上部分的运输随着盐胁迫的加深而增强,表明白刺茎、叶片加强了对Ca2+的选择性运输和吸收。K+离子的运输情况与Ca2+有所差别,主要表现为从茎到叶的运输随盐胁迫的增强而上升,说明白刺叶片在高盐环境对K+的选择性吸收增强。
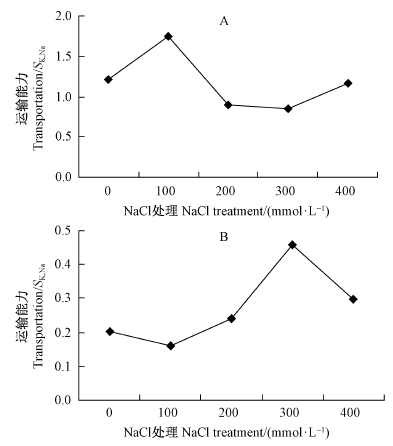 |
图 6 NaCl 胁迫下唐古特白刺地上部分对K+的选择性运输
Fig. 6 Selective transportation of K+ in above-ground organs of N. tangutorum under different NaCl concentrations
|
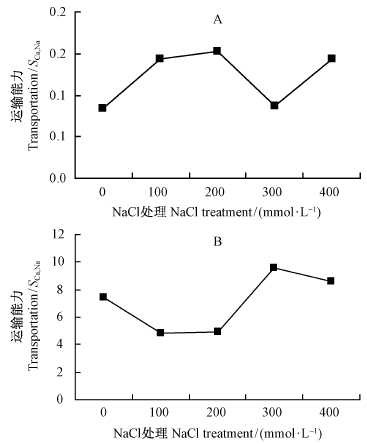 |
图 7 NaCl胁迫下唐古特白刺地上部分对Ca2+的选择性运输
Fig. 7 Selective transportation of Ca2+ in above-ground organs of N. tangutorum under different NaCl concentrations
|
本研究结果表明: 作为真盐生植物,低浓度盐胁迫可以促进唐古特白刺的生长。株高生长和生物量在低浓度NaCl 处理时比对照有所提高,在高浓度NaCl 处理(400mmol·L-1)时受到抑制,这一结果与其他一些盐生植物的情况相似; 例如,低于400 mmol·L-1 NaCl处理使木碱蓬(Suaeda dendroides)(Khan et al.,2000)地上生物量鲜质量和干质量都较无盐情况下增加,但在600 mmol·L-1及更高NaCl环境下其生长被抑制。盐地碱蓬(S. salsa)(Song et al.,2009)同样表现出在低浓度(200 mmol·L-1 NaCl)盐胁迫下生物量增加、高浓度(600 mmol·L-1 NaCl)盐胁迫下生物量降低的情形。与木碱蓬相似,唐古特白刺在低盐环境下(100 mmol·L-1 NaCl)植株高生长、生物量较对照增加,但高浓度盐处理(≥200mmol·L-1 NaCl)会阻碍植株生长。低浓度盐分能够促进盐生植物生长(株高及生物量),一般认为这是由于Na是多数盐生植物必需的矿质元素,或是盐生植物通过快速生长来降低体内盐分的一种适应性反应(Brownell et al.,1972; 赵可夫等,2005)。盐胁迫下唐古特白刺的根冠比呈减小趋势,表明根系对盐胁迫的敏感程度高于地上部分,这与对碱蓬(S. glauca)、盐角草(Salicornia europaea)等盐生植物的研究结果相一致(弋良朋等,2011),可能是高盐胁迫抑制地上部分光合作用,光合产物减少导致向地下部分运输的养分减少,从而造成地下根系生物量的降低。
3.2 NaCl胁迫对白刺体内离子分配的影响双子叶盐生植物的无机渗透调节剂以Na+,Cl-占主导地位(赵可夫等,2000),而盐离子的区隔化是耐盐植物维持细胞内离子平衡的途径之一(Yang et al.,2006)。本研究中,唐古特白刺根系中Na+和Cl-含量随盐浓度的增加而增加,但叶片中盐离子的峰值出现在中等盐浓度处理条件下而不是浓度最大时,推测唐古特白刺将较多的盐离子贮存在根部液泡中而减少向地上部分的运输(陈贵林等,2009)。同时,叶片中Na+,Cl-的绝对含量在各器官中最高,说明唐古特白刺利用盐离子作为无机渗透调节物来增大地上部分和根部的渗透势差,促进水分的吸收和向上运输。有研究表明: 盐生植物通过在细胞质内合成有机渗透调节物质(如甜菜碱)来平衡与液泡的高盐环境(Khan et al.,2000)。本研究也表明:高盐胁迫下唐古特白刺体内积累无机阳离子的同时,脯氨酸和可溶性蛋白含量较对照有显著增加(杨升等,2012; 倪建伟等,2012),这2种有机渗透调节物质可能对平衡白刺细胞质与液泡间的渗透势起作用。
随着NaCl 浓度不断提高,唐古特白刺各器官中K+的含量保持平稳或升高,各器官内K+/Na+变化也较平稳。特别是白刺根系中K+的含量随盐浓度的升高显著增加,由于的Na+和K+水合半径相似,白刺可能通过增强对K+的吸收来抑制根系过多的吸收Na+,从而在一定范围内来保持体内离子的相对稳定。由于Na+对K+,Ca2+等植物必需营养离子的拮抗作用,盐离子的大量进入无疑会导致植物体内的离子失衡。有研究认为,盐生植物除了将体内积累的大量无机离子作为渗透调节物质进入液泡,另一方面在细胞质中的钠离子可以通过~COOH+Na+→~COONa+H+反应合成有机酸以降低钠的积累(Meychik et al.,2005),从而保持细胞内的相对离子平衡状态。盐生植物碱蓬、盐地碱蓬和碱地肤(Kochia scoparia var. sieversiana)在盐碱环境中的渗透调节与离子平衡维持主要以Na+,Cl-和有机酸为主(Yang et al.,2012)。唐古特白刺体内是否发生类似的响应还有待进一步研究。
许多研究表明: 适度盐胁迫一般不会影响,甚至会增加盐生植物对钾的吸收,但会抑制对钙的吸收与积累(赵可夫等,2000; 张海燕,2002; 杨成龙等,2010),本研究结果与此一致。引起这一现象的原因可能是过量的Na+会取代细胞膜上的Ca2+离子,引起细胞内的Ca2+外流,影响植物细胞中的Ca2+积累。众所周知,Ca2+是植物必需的矿质元素,同时作为植物信号传导中重要的第二信使,Ca2+参与植物抗逆信号传导,特别是传导盐胁迫信号已有证据(章文华等,2000)。钙离子还可提高植物耐盐性,采用150 mmol·L-1 NaCl盐处理造成菊芋(Helianthus tuberosus)SOD活性显著下降且鲜质量比对照下降73.9%,通过外施Ca2+可以提高菊芋胁迫下体内SOD酶活性,增强抗盐能力(薛延丰等,2006),说明钙对植物耐盐性具有重要作用。本研究中,唐古特白刺在盐胁迫不断增强的过程中,其根与叶中的Ca2+含量不断降低,但Ca2+由根向茎和由茎向各叶的运输却在增加,表明高浓度盐胁迫造成白刺根对Ca2+的吸收降低,为避免生理代谢受阻,白刺通过加强叶片对Ca2+选择性吸收,增强Ca2+从根部向地上部分的选择性运输,以尽量降低因吸收受阻造成的不利影响,维持地上部相对稳定的Ca2+/Na+比值。
3.3 白刺对NaCl胁迫的适应机制唐古特白刺是真盐生植物,与甜土植物不同,其正常生长需要一定浓度的NaCl(赵可夫等,2005),但过多的盐分仍会干扰其生长和体内的离子平衡。综合本研究结果认为,高盐胁迫下,唐古特白刺采用将较多的盐离子(Na+,Cl-等离子)聚集于液泡的策略,一方面降低盐离子的毒害,另一方面有利于维体内持较低的细胞水势和渗透调节。在聚Na+的同时,唐古特白刺通过加强对K+,Ca2+等植物必需营养离子的选择性吸收及运输来维持地上部较稳定的离子含量和K+/Na+,Ca2+/Na+比值,从而维持盐胁迫下体内正常的生理代谢,这是白刺对高盐胁迫具有较强适应性的重要原因。
| [1] |
陈贵林, 王晨霞,陈建英. 2009. NaCl胁迫对白刺试管苗渗透调节物质及离子含量的影响.西北植物学报,29(6): 1233-1239.( 2) 2)
|
| [2] |
陈建英,陈贵林. 2011. NaCl胁迫对白刺幼苗体内游离态亚精胺和精胺含量的影响.西北植物学报,31(1): 130-136.( 1) 1)
|
| [3] |
陈志强,李庆贱,时瑞亭,等. 2011.苏打盐碱胁迫对西伯利亚白刺光合和生长的影响.北京林业大学学报,33(3): 31-37.( 1) 1)
|
| [4] |
高瞑,李毅,种培芳,等. 2011.渗透胁迫下不同地理种源白刺的生理响应.草业科学,20(3): 99-106.( 1) 1)
|
| [5] |
李红,章英才,张鹏. 2006. 白刺属植物研究综述.农业科学研究,27(4): 61-64.( 1) 1)
|
| [6] |
倪建伟,武香,张华新,等. 2012. 3种白刺耐盐性的对比分析.林业科学研究,25(1): 48-53.( 2) 2)
|
| [7] |
潘晓云,曹琴东,尉秋实,等. 2002. 白刺属的系统进化和生物多样性研究进展.中国医学生物技术应用,(4): 1-6,56.( 1) 1)
|
| [8] |
王宝山,赵可夫.1995. 小麦叶片中Na、K提取方法的比较. 植物生理学通讯,31(1): 50-52.( 1) 1)
|
| [9] |
王佳丽,黄贤金,钟太洋,等. 2011. 盐碱地可持续利用研究综述.地理学报, 66(5): 673-684.( 1) 1)
|
| [10] |
武香,倪建伟,张华新,等. 2012. 盐胁迫对3种白刺渗透调节物质的影响.东北林业大学学报,40(1): 44-47,69.( 1) 1)
|
| [11] |
薛延丰,刘兆普. 2006. 钙离子对盐胁迫下菊芋幼苗的生长、生理反应和光合能力的影响理论.农业工程学报,22(9): 44-47.( 1) 1)
|
| [12] |
闫永庆,刘永亮,王崑,等. 2010. 白刺对不同浓度混合盐碱胁迫的生理响应.植物生态学报, 34(10): 1213-1219.( 1) 1)
|
| [13] |
杨成龙,段瑞军,李瑞梅,等. 2010. 盐生植物海马齿耐盐的生理特性.生态学报,30(17): 4617-4327.( 1) 1)
|
| [14] |
杨升,张华新,刘涛. 2012. 盐胁迫对16种幼苗渗透调节物质的影响.林业科学研究, 25(3): 269-277.( 1) 1)
|
| [15] |
弋良朋,王祖伟. 2011. 盐胁迫下3种滨海盐生植物的根系生长和分布.生态学报,31(5): 1195-1202.( 1) 1)
|
| [16] |
於丙军,刘友良. 2004. 植物中的氯、氯通道和耐氯性.植物学通报,21(4): 402-410.( 1) 1)
|
| [17] |
於丙军,罗庆云,曹爱忠,等. 2001. 栽培大豆和野生大豆耐盐性及离子效应的比较.植物资源与环境学报,10(1): 25-29.( 1) 1)
|
| [18] |
张海燕. 2002. 盐胁迫下盐地碱蓬体内无机离子含量分布特点的研究.西北植物学报,22(1): 12-135.( 1) 1)
|
| [19] |
张乃华,高辉远,邹琦. 2005. Ca2+缓解NaCl胁迫引起的玉米光合能力下降的作用.植物生态学报,29(2): 324-330.( 1) 1)
|
| [20] |
章文华,陈亚华,刘友良. 2000. 钙在植物细胞盐胁迫信号转导中的作用.植物生理学通讯,36(2): 146-153.( 1) 1)
|
| [21] |
赵可夫,范海. 2000. 盐胁迫下盐生植物与泌盐植物的渗透调节物质及其贡献的比较研究.应用与环境生物学报,6(2): 99-105.( 3) 3)
|
| [22] |
赵可夫,范海. 2005. 盐生植物及其对盐渍生境的适应生理.北京: 科学出版社.( 2) 2)
|
| [23] |
郑青松,王仁雷,刘友良. 2001. 钙对盐胁迫下棉苗离子吸收分配的影响.植物生理学报,27(4): 325-330.( 1) 1)
|
| [24] |
Brownell P E,Crossland C J.1972. The requirement for sodium as a micronutrient by species having C4 diacarboxylic photosynthetic pathway. Plant Physiology,49(5): 794-797.( 1) 1)
|
| [25] |
Ghassemi F, Jakeman A J, Nix H A. 1995. Salinisation of Land and Water Resources-Human Causes, Extent, Management and Case Studies (1st Edition). Sydney: University of New South Wales Press Ltd.( 1) 1)
|
| [26] |
Khan M A, Ungar I A, Showalter A M. 2000. The effect of salinity on the growth, water status, and ion content of a leaf succulent perennial halophyte, Suaeda fruticosa (L.) Forssk. J Arid Environ, 45(1): 73-84.( 2) 2)
|
| [27] |
Khoshgoftar, A H, Shariatmadari H, Karimian N, et al. 2004. Salinity and Zinc application effects on phytoavailability of Cadmium and Zinc. Soil Sci Soc Am J, 68(6): 1885-1889.( 1) 1)
|
| [28] |
Meychik N R, Nikolaeva J I, Yermakov I P. 2005. Ion exchange properties of the root cell walls isolated from the halophyte plants (Suaeda altissima L.) grown under conditions of different salinity. Plant and Soil, 277(1/2): 163-174.( 1) 1)
|
| [29] |
Ondrasek G, Rengel Z, Romic D, et al. 2009b. Accumulation of non/essential elements in radish plants grown in salt-affected and cadmium-contaminated environment. Cereal Research Communications, 37(1): 9-12.( 1) 1)
|
| [30] |
Ondrasek G, Romic D, Rengel Z, et al. 2009a. Cadmium accumulation by muskmelon under salt stress in contaminated organic soil. Sci Tot Enviro, 407(7): 2175-2182.( 1) 1)
|
| [31] |
Shabala S, Cuin T A. 2008. Cellular mechanisms of potassium transport in plants. Physiol Plant, 133: 651-669.( 1) 1)
|
| [32] |
Song J, Chen M, Feng G, et al. 2009. Effect of salinity on growth, ion accumulation and the roles of ions in osmotic adjustment of two populations of Suaeda salsa. Plant and Soi, 314(1/2): 133-141.( 1) 1)
|
| [33] |
Yang C W, Zheng S S, Huang H L. 2012.Comparison of osmotic adjustment and ion balance strategies in nineteen alkali-tolerant halophyte species during adaptation to salt-alkalinized habitats in northeast China. Australian Journal of Crop Science, 6(1): 141-148.( 1) 1)
|
| [34] |
Yang S H, Ji J,Wang G. 2006. Effects of salt stress on plants and the mechanism of salt tolerance. World Sci-Tech R & D, 28(4): 70-76.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

