文章信息
- 刘辉, 吴小芹, 任嘉红, 陈丹
- Liu Hui, Wu Xiaoqin, Ren Jiahong, Chen Dan
- 一株荧光假单胞菌的溶磷特性及其对杨树的促生效果
- Phosphate-Dissolving Characteristics and Growth Promoting Effect of Pseudomonads fluorescent JW-JSI on Poplar Seedlings
- 林业科学, 2013, 49(9): 112-118
- Scientia Silvae Sinicae, 2013, 49(9): 112-118.
- DOI: 10.11707/j.1001-7488.20130916
-
文章历史
- 收稿日期:2012-09-02
- 修回日期:2013-04-15
-
作者相关文章
2. 安徽师范大学环境科学与工程学院 芜湖 241003
2. College of Environmental Science and Engineering, Anhui Normal University Wuhu 241003
磷是植物生长发育的重要物质基础,植物吸磷量与植物的生物量呈显著正相关。在我国约有74% 的耕地土壤缺磷,土壤中95% 的磷素为无法吸收的难溶性磷; 因此,如何提高植物对土壤中难溶性磷的吸收利用具有重要的科研和应用价值(任嘉红等,2012)。土壤微生物的活动是土壤养分转化和循环的动力(向文良等,2009)。许多研究表明,土壤中分布有大量具有溶磷能力的微生物(Bojinova et al.,2008; Oliveira et al.2009; 朱培淼等,2007)。一般将能溶解无机磷酸盐的细菌称溶磷细菌(phosphate-solubilizing bacteria,PSB)(Chung et al.,2005)。这类细菌能够促进磷灰石[Ca3(PO4)2]等难溶物质释放出磷,以供植物吸收利用。PSB 可明显提高土壤中可溶性磷的营养水平,增加植物对磷元素的吸收,从而促进植物的生长(Hameeda et al.,2008)。因此,溶磷微生物的研究一直受到科学家的重视,并期望通过生物肥料的途径提高土壤难溶性磷的有效性和磷肥的利用效率。
溶磷微生物溶解难溶性磷酸盐的能力主要受菌株遗传特性的影响,同时也与其生长环境有关,如培养基中的碳源(Narsian et al.,2000; 王光华等,2004; 刘文干等,2012)、氮源(Illmer et al.,1992;Wenzel et al.,1994; 王光华等,2003; 刘文干等,2012)、碳氮比(赵小蓉等,2002; Xiao et al.,2008)、无机盐(Beever et al.,1981)及环境条件(温度、初始 pH、溶氧量等)(Xiao et al.,2008)等均能显著影响溶磷微生物的溶磷能力。荧光假单胞菌(Pseudomonads fluorescent)是微生物肥料和生防制剂生产中最常见也是最重要的菌种之一(葛诚,2000)。本课题组在前期研究中从杨树根际筛选出一株荧光假单胞菌 JW-JS1,该菌株对磷酸三钙具有较强的溶磷能力,有望为开发高效杨树微生物磷肥提供优良种质资源(Liu et al.,2011),而有关该菌株的溶磷特性和对杨树的促生效应有待进一步研究;因此,本研究以荧光假单胞菌 JW-JS1为研究对象,在液体培养条件下,通过测定碳源、氮源、碳氮比和环境条件(温度、初始 pH、溶氧量及 NaCl 质量浓度)等因素的改变对 JW-JS1菌株溶磷能力的影响来阐明其溶磷特性,并采用温室盆栽试验测定该菌株对杨树苗期生长的影响。该研究将为杨树高效专用生物肥料的研制提供理论基础和技术支撑,对杨树产业的可持续发展具有重要意义。
1 材料与方法 1.1 材料 1.1.1 供试菌株荧光假单胞菌 JW-JS1,分离自江苏省泗洪县陈圩林场2年生351杨(P. deltoides cv. Harvard × P. deltoides cv. Lux)根际土壤中,已保藏于中国典型培养物保藏中心(CCTCC)(Liu et al.,2011)。
1.1.2 供试培养基国际植物研究所磷酸盐生长培养基(NBRIP): 葡萄糖10 g,MgCl2 5 g,MgSO4·7H2O 0.25 g,KCl 0.2 g,(NH4)2SO4 0.1 g,Ca3(PO4)2 5 g,蒸馏水1 L,pH 7.0; 牛肉膏蛋白胨培养基(NB): 牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 L,pH 7.2~7.4。以上培养基均于121 ℃条件下灭菌20 min。
1.1.3 供试植物NL-895杨(P. × euramericanaCL‘NL-895’)扦插苗和美洲黑杨(Populus deltoides)实生苗,其中,NL-895杨插穗采自江苏省泗洪县陈圩林场苗圃,美洲黑杨种子采自南京林业大学实验基地。基质土壤采自南京林业大学校园后山。土壤、砂子与蛭石按2:1:1比例混合均匀后在1.01 ×106 Pa 压力下灭菌120 min 后备用。
采用0.5% 高锰酸钾水溶液浸泡 NL-895杨插穗和美洲黑杨种子10 min 进行杀菌。将 NL-895杨插穗扦插至塑料花盆,每盆3根,压实土壤,浇水;将美洲黑杨种子均匀播种至塑料花盆,浇水,置于植物生长室统一培养,备用。
1.2 方法 1.2.1 不同碳源、氮源和碳氮比对 JW-JS1菌株溶磷能力的影响将 NBRIP 培养基中碳源(葡萄糖)分别改为蔗糖、果糖、麦芽糖、甘露醇和可溶性淀粉,氮源(硫酸铵)分别改为蛋白胨、酵母膏、牛肉膏、硝酸钾和硝酸铵; 以最适碳源和氮源,将 NBRIP 培养基的碳氮比调到100:1,50:1,33:1,25:1和20:1。各处理均设3个重复,180 r·min-1培养72 h 后,发酵液离心10 min(4 ℃,10 000 r·min-1),取上清液采用钼锑抗比色法测定其可溶性磷含量(鲁如坤,2000)。
1.2.2 不同环境条件对 JW-JS1菌株溶磷能力的影响NBRIP 培养基,按1%(V / V)接种量接入 JW-JS1种子液,设定温度分别为20,25,30,35,40 ℃ ; 用1 mol·L-1 HCl 或 NaOH 溶液调节 NBRIP培养基 pH 至4,5,6,7,8,9和10; 100 mL 三角瓶中分别装入20,40,60和80 mL NBRIP 培养基使其体积比分别为1 /5,2 /5,3 /5,1 /2和4 /5; 调节 NBRIP培养基的 NaCl 质量浓度分别为0,2.5,5,10和20g·L-1。各处理均设3个重复,180 r·min-1培养72 h后,发酵液离心10 min(4 ℃,10 000 r·min-1),发酵液可溶性磷含量测定计算同1.2.1。
1.2.3 JW-JS1菌株对杨树促生效应测定将 JW-JS1菌株活化2~3次后,用接种环挑取少量菌体接种于含有50 mL NB 培养基的100 mL 三角瓶中,30 ℃,180 r·min-1振荡培养72 h。发酵液(4 ℃,
6 000 r·min-1)离心5 min,用无菌生理盐水润洗菌体2~3次后,用无菌生理盐水调节菌悬液浓度(7 × 108~8 × 108 cfu·mL-1)制成接种菌剂。采用灌根的方式分别接种 NL-895杨和美洲黑杨(苗龄60天),以等量无菌生理盐水为对照,接种量为扦插苗15 mL·株-1、实生苗5 mL·株-1。每处理6个重复,置温室中培养,光照通过遮阳网得到一定控制,不使用人工光源,适时浇水。接种处理的 NL-895杨和美洲黑杨生长120天后,测定苗高和地径。然后将植株从塑料花盆中取出,洗净,测定其鲜质量,并在105 ℃下杀青30 min,75 ℃烘干至恒质量,测定其干质量。样品经粉碎机粉碎后过0.5 mm 筛,称取0.100 0 g 样品,H2SO4-H2O2消煮,采用等离子发射光谱 ICP-AES(Optima 2100DV,Perkin ElmerUS)测定植株体内矿质元素含量。
2 结果与分析 2.1 碳源对 JW-JS1菌株溶磷能力的影响碳源可明显地影响 JW-JS1菌株溶解磷酸三钙的能力(图 1)。在以葡萄糖为碳源时,其溶解磷酸三钙的能力最强,溶磷量达到580.72 mg·L-1,溶磷率为11.61% ; 其次为甘露醇,溶磷量达到150.82mg·L-1; 而以蔗糖、麦芽糖或果糖为碳源时,菌株的溶磷量大幅度降低,尤其是当供给可溶性淀粉时,该菌株几乎不表现出任何溶磷活性,其溶磷量仅为3.26 mg·L-1,溶磷率为0.07% 。因此,葡萄糖为 JW-JS1菌株溶磷功能发挥的最适碳源。
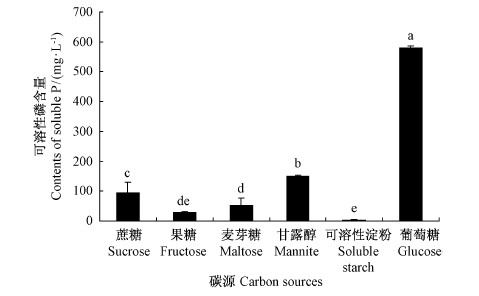 |
图 1 不同碳源对荧光假单胞菌 JW-JS1溶磷能力的影响
Fig. 1 The effect of P. fluorescent JW-JS1on phosphate-dissolving capacity at different C sources
|
从图 2可以看出: 不同的氮源可显著影响 JW-JS1菌株的溶磷能力。当以(NH4)2SO4为氮源时,JW-JS1菌株的溶磷能力最强,溶磷量高达708.34mg·L-1; 其次为 KNO3和NH4NO3,溶磷量分别为651.95和639.70 mg·L-1,溶磷率分别为13.04%和12.80% ; 而以牛肉膏、酵母膏和蛋白胨为氮源时,JW-JS1菌株的溶磷能力明显下降,尤其是以蛋白胨作为氮源时,其溶磷能力最弱,溶磷量仅为410.57mg·L-1,溶磷率仅为8.21% 。因此,硫酸铵为 JW-JS1菌株溶磷功效发挥的最适氮源。
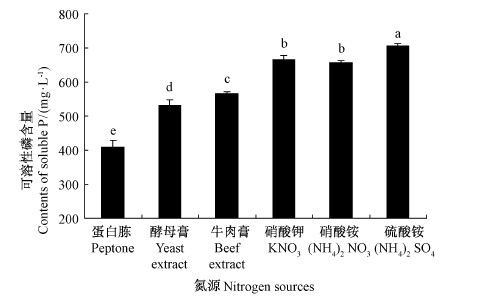 |
图 2 不同氮源对荧光假单胞菌 JW-JS1溶磷能力的影响
Fig. 2 The effect of P. fluorescent JW-JS1 onphosphate-dissolving capacity at different N source
|
在以葡萄糖为碳源和硫酸铵为氮源的条件下,测定培养基中碳氮比对 JW-JS1菌株溶磷能力的影响。图 3表明: 培养基中不同碳氮比显著影响 JW-JS1菌株的溶磷能力。随着碳氮比减小,JW-JS1菌株的溶磷能力显著降低(P<0.05)。当碳氮比为100:1时,JW-JS1菌株的溶磷能力最强,发酵液中可溶性磷含量高达608.97 mg·L-1,而在碳氮比为20:1时溶磷能力最低,发酵液中可溶性磷含量为504.56 mg·L-1,前者约为后者的1.2倍。
 |
图 3 不同碳氮比对荧光假单胞菌 JW-JS1溶磷能力的影响
Fig. 3 The effect of P. fluorescent JW-JS1 onphosphate-dissolving capacity at different C / N115
|
不同的培养温度对 JW-JS1菌株的溶磷能力有显著影响。图 4表明: 在20~40 ℃温度范围内,JW-JS1菌株均能溶解难溶性磷酸三钙,但不同温度条件其发酵液中可溶性磷含量之间具有显著差异(P<0.05)。JW-JS1菌株在30 ℃培养3天后溶磷能力最强,发酵液可溶性磷含量达562.89 mg·L-1; 高于或低于此温度均不利于 JW-JS1菌株溶磷能力的发挥,其中,在40 ℃时 JW-JS1菌株的溶磷能力显著降低,发酵液可溶性磷含量仅为10.61 mg·L-1,约为30 ℃时的1 /50,几乎不表现溶磷能力。
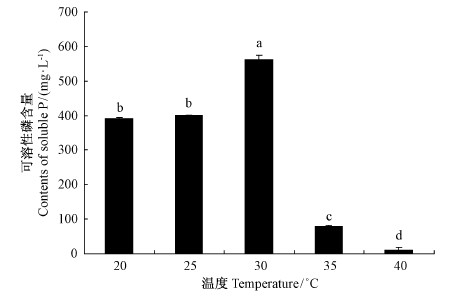 |
图 4 不同温度对荧光假单胞菌 JW-JS1溶磷能力的影响
Fig. 4 The effect of P. fluorescent JW-JS1 onphosphate-dissolving capacity at different temperature
|
培养基初始 pH 对 JW-JS1菌株的溶磷能力有较大影响。从图 5可看出: 随着 pH 的升高,JW-JS1菌株的溶磷能力呈先增长后降低的趋势。当初始 pH 为6和7时,JW-JS1菌株的溶磷能力最高,两者差异不显著,其中,当 pH 为7时,发酵液中可溶性磷含量高达594.58 mg·L-1,说明该菌株适合在中性偏酸的环境中生长和发挥溶磷功能,酸性和碱性环境中则不利于其生长和溶磷功能的发挥。当初始 pH 为10时,JW-JS1菌株的溶磷能力最差,发酵液中可溶性磷含量仅为134.75 mg·L-1,其溶磷量约为初始 pH 为7时的1 /5; 而在初始 pH 为4时,发酵液中可溶性磷含量虽然达到571.62 mg·L-1,但此时 JW-JS1菌株的生长状况很差,而且较高的可溶性磷含量是由于酸性条件造成大量磷酸三钙的溶解而非溶磷细菌 JW-JS1作用的结果。因此,JW-JS1菌株在初始 pH 为7的条件下溶磷能力最强。
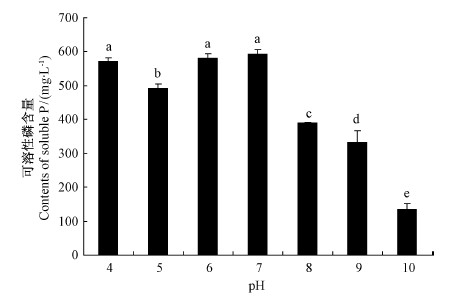 |
图 5 不同初始 pH 对荧光假单胞菌 JW-JS1溶磷能力的影响
Fig. 5 The effect of P. fluorescent JW-JS1 onphosphate-dissolving capacity at different initial pH
|
装液量是影响微生物培养过程中溶解氧含量的一个重要因素,装液量越大,则溶解氧含量越低。在同一规格和型号的100 mL 三角瓶中添加不同体积的培养基,根据培养基体积按比例接种 JW-JS1菌株菌悬液,结果如图 6所示。不同的装液量 JW-JS1菌株均具有一定的溶磷能力,但其溶磷量不同,发酵液中可溶性磷含量在549.68~638.62 mg·L-1之间。装液量40,50,60 mL 时溶磷能量没有差异,装液量80 mL 溶磷能力最差,装液量为20 mL,即1/5的装液量为本研究条件下 JW-JS1的最适装液量,发酵液中可溶性磷含量高达638.62 mg·L-1,此时 JW-JS1菌株的溶磷能力最强。以上结果说明该菌株对氧的需求量较大,充足的氧气是其溶磷的必要条件。
 |
图 6 不同装液量对荧光假单胞菌 JW-JS1溶磷能力的影响
Fig. 6 The effect of P. fluorescent JW-JS1 onphosphate-dissolving capacity at different liquid volume in flask
|
JW-JS1菌株对盐分的适应性结果如图 7所示: 在所测试的 NaCl 质量浓度(0~20 g·L-1)范围内,JW-JS1菌株均能生长,但不同质量浓度的盐分对溶磷细菌的溶磷能力的影响有一定差异。溶磷菌 JW-JS1的溶磷量随着 NaCl 质量浓度的增加而降低,不同质量浓度处理差异显著(P<0.05)。在 NaCl 浓度为0时,JW-JS1的溶磷量最大,发酵液中可溶性磷含量高达527.82 mg·L-1,随着 NaCl 质量浓度不断增加,JW-JS1菌株的溶磷量呈不断下降的趋势,这可能主要是因为Na+改变了培养液的渗透压而影响了菌株的生长和代谢活动,使得 JW-JS1菌株溶磷能力产生了相应变化。当 NaCl 质量浓度达到20 g·L-1,JW-JS1菌株溶磷量虽然最低,但其溶磷量仍能达到313.19 mg·L-1,这也表明该菌株具有在盐碱地造林应用的潜力。
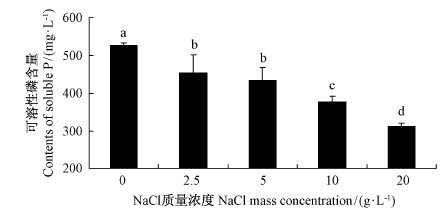 |
图 7 不同 NaCl 浓度对荧光假单胞菌 JW-JS1溶磷能力的影响
Fig. 7 The effect of P. fluorescent JW-JS1 on phosphate-dissolving capacity at different mass concentration of NaCl
|
NL-895杨扦插苗和美洲黑杨实生苗接种 JW-JS1菌株的生长情况如表 1所示: 接种 JW-JS1菌剂对 NL-895杨扦插苗和美洲黑杨实生苗的生长具有明显的促进作用,显著提高了苗高、地径、鲜质量和干质量(P<0.05); NL-895杨扦插苗的苗高、地径、鲜质量和干质量分别比 CK 增长了21.96%,5.04%,57.33%和54.36%,而美洲黑杨实生苗则分别比 CK 增长了51.66%,1.98%,150.18%和168.49% 。
|
|
从表 1中可看出: 接种 JW-JS1菌株显著提高了 NL-895杨扦插苗和美洲黑杨实生苗植株 P、K、Ca和Mg 矿质元素的含量(P<0.05)。与 CK 相比,NL-895杨扦插苗植株内 P、K、Ca和Mg 含量分别增长了25.16%,19.75%,17.12%和10.10%,而美洲黑杨实生苗植株内 P,K,Ca和Mg 含量分别增长了27.55%,125.53%,55.47%和102.94% 。
3 结论与讨论不同的生态系统中由于土壤特性和植被的差异,土壤中溶磷微生物溶磷特性可能存在很大的差异(向文良等,2009)。为了发挥不同溶磷微生物的溶磷性能,开展不同溶磷微生物的最适溶磷特性研究是非常有必要的。
1)碳水化合物是所有异养微生物的能源物质,供给不同形态的碳水化合物,不仅影响到微生物的生长繁殖,而且还影响其生理生化代谢。例如,Aspergillus aculeatus 能利用11种不同的碳源,但以阿拉伯糖为碳源时溶磷效率最高,其次为葡萄糖,而当以蔗糖为碳源时溶磷活性相对较低(Narsian et al.,2000)。 赵小蓉等(2002)发现溶磷曲霉(Aspergillus sp.)2TCiF2在以蔗糖和葡萄糖为唯一碳源时,其溶解磷矿粉的能力较强,而供给糖蜜或淀粉时菌株的溶磷量大幅度降低,其中,以淀粉为碳源时2TCiF2不表现出任何磷活性; 而溶磷节杆菌(Arthrobacter sp.)1TCRi7在以葡萄糖为碳源时才具有较高的溶磷活性,而在供给蔗糖、淀粉和糖蜜时也几乎不表现出任何溶磷活性。刘文干等(2012)发现洋葱伯克霍尔德氏菌(Burkholderia cepacia)C5-A在以麦芽糖为碳源时,其溶磷效果最佳。以上研究表明不同溶磷菌株的溶磷特性存在明显区别。本研究发现荧光假单胞菌 JW-JS1的溶磷能力受所供给碳源物质的影响较大,当供给葡萄糖时溶磷活性最强,而供给其他碳源时,该菌株的溶磷能力均显著降低; 因此,以葡萄糖为碳源时溶磷细菌 JW-JS1的溶磷效果最佳。
2)许多研究表明氮源的改变对溶磷微生物的溶磷能力也具有显著的影响。草酸青霉(Penicilliumoxalicum)在NO3--N 存在条件下的溶磷效率要高于NH4+-N 处理(范丙全等,2001)。 Wenzel等(1994)发现一株溶磷杆菌,只有在NH4+存在时才具有较强的溶磷能力,但当供给NO3--N 时,几乎不表现任何溶磷活性。洋葱伯克霍尔德氏菌 C5-A在以草酸铵为氮源时溶磷效果最佳(刘文干等,2012)。本研究中的供试荧光假单胞菌JW-JS1菌株的溶磷能力也受所供给氮源种类的显著影响,其中,硫酸铵为氮源时,溶磷能力显著高于其他氮源,是该菌溶磷功能发挥的最适氮源。
另据报道,不同碳源和氮源对溶磷微生物产生有机酸的种类和浓度有很大影响,进而影响其溶磷量(Reyes et al.,1999)。刘文干等(2012)发现洋葱伯克霍尔德氏菌 C5-A 在铵态氮与硝态氮溶液中只分别产生乙酸和草酸,在尿素溶液中产生草酸、苹果酸、柠檬酸、琥珀酸和多种未知有机酸,且各种有机酸的含量各不相同。 Whitelaw(1999)报道 P.radicum 在NH4+-N培养基中比在NO3--N 培养基中分泌出更多的葡萄糖酸等有机酸。本研究供试溶磷细菌 JW-JS1在供给不同碳源和氮源时分泌有机酸的种类和数量以及与溶磷能力大小的关系有待进一步研究。
3)微生物的溶磷能力不仅受到供给碳源、氮源种类的影响,而且还受到碳氮比的影响。Illmer等(1992)发现增加或降低氮的浓度,溶磷微生物可能会释放更多的磷,这一方面是由于不适宜的碳氮比可能会阻碍磷的吸收,另一方面是由于NH4+可能4代替K+,从而对磷的吸收起重要作用。赵小蓉等(2002)发现培养基中碳氮比极大地影响微生物的溶磷活性,但不同菌株反应差异非常大。培养基的碳氮比越高,2株曲霉(Aspergillus sp.)2TCiF2、4TCiF6和欧文氏杆菌(Erwinia sp.)4TCRi22的溶磷活力越高,而青霉(Penicillium sp.)1TCRiF5、2TCRiF4和肠杆菌(Enterobacter sp.)1TCRil5则在碳氮比最低时,溶磷活力最强。本研究发现,培养基的碳氮比越高,荧光假单胞菌 JW-JS1的溶磷能力越强。当碳氮比为100:1时,荧光假单胞菌 JW-JS1菌株溶磷能力最强,为该菌溶磷能力发挥的最适碳氮比,这与赵小蓉(2002)关于曲霉和欧文氏杆菌的研究结果相同,但与青霉和肠杆菌的结果相悖,其原因有待于进一步研究。
4)环境条件的改变能显著影响溶磷微生物的生长和溶磷功效的发挥。本研究结果表明,荧光假单胞菌 JW-JS1分别在30 ℃、pH 7.0、1 /5的装液量和不含 NaCl(即质量浓度0%)的情况下溶磷能力最强,这为该菌株将来的应用提供了一定的参考依据。
5)溶磷微生物作为生物肥料,可以提高土壤中磷的利用效率,改善植物营养条件,提高作物产量(Zaidi et al.,2003),但一些溶磷微生物施用后对植物的促生效果不好或不稳定,通常是由于其在植物根际竞争能力差造成的; 因此,筛选能较好地在植物根际土壤中生存及抵抗不良环境,从而发展成优势种群的菌株是利用溶磷微生物改善植物磷营养和促进植物生长的关键(Rodríguez et al.,1999)。本研究供试溶磷细菌 JW-JS1分离自杨树根际土壤,具备在杨树根际发展成为优势种群的前提。将荧光假单胞菌 JW-JS1制成菌剂接种处理杨树苗木,结果表明该菌株能显著促进 NL-895杨扦插苗和美洲黑杨实生苗的生长和植株体内 P、K、Ca和Mg 的含量; 因此,可将该菌株作为杨树根际溶磷细菌的重点资源菌株作进一步的研究。溶磷细菌能够促进植物生长的主要机制是溶解土壤难溶磷化物和促进植物对磷素的吸收(Hameeda et al.,2006),从而促进了植物的生长发育,这与本研究的试验结果一致。另据报道,溶磷细菌也能够分泌植物生长激素,刺激植物生长与发育(Artursson et al.,2006; Hameeda et al.,2008)。本研究中供试菌株 JW-JS1能显著促进杨树的生长,该菌株是否具有分泌植物激素的功能,还有待进一步研究。另外,为更好地揭示该菌株对杨树的促生机制,其在杨树根际的定殖动态也有待于深入研究。
| [1] |
范丙全. 2001.北方石灰性土壤中青霉菌P8(Penicillium oxalicum)活化难溶磷的作用和机理研究.北京:中国农业科学院博士学位论文.( 1) 1)
|
| [2] |
葛诚. 2000.微生物肥料生产应用基础.北京:中国农业科技出版社.( 1) 1)
|
| [3] |
刘文干,何园球,张坤,等. 2012.一株红壤溶磷菌的分离、鉴定及溶磷特性.微生物学报,52(3): 326-333.( 5) 5)
|
| [4] |
鲁如坤. 2000.土壤农业化学分析方法.北京:中国农业科技出版社.( 1) 1)
|
| [5] |
任嘉红,刘辉,吴晓蕙,等. 2012.南方红豆杉根际溶无机磷细菌的筛选、鉴定及其促生效果.微生物学报,52(3): 295-303.( 1) 1)
|
| [6] |
王光华,周可琴,金剑,等. 2003.不同氮源对3种溶磷真菌溶解磷矿粉能力的影响.农业系统科学与综合研究,19(4): 260-263.( 1) 1)
|
| [7] |
王光华,周可琴,金剑,等. 2004.不同碳源对三种溶磷真菌溶解磷矿粉能力的影响.生态学杂志,23(2): 32-36.( 1) 1)
|
| [8] |
向文良,冯炜,郭健华,等. 2009.一株解磷中度嗜盐菌的分离鉴定及解磷特性分析.微生物学通报,36(3): 320-327.( 2) 2)
|
| [9] |
赵小蓉,林启美,李保国. 2002. C、N源及C/N比对微生物溶磷的影响.植物营养与肥料学报,8(2): 197-204.( 4) 4)
|
| [10] |
朱培淼,杨兴明,徐阳春,等. 2007.高效溶磷细菌的筛选及其对玉米苗期生长的促进作用.应用生态学报,18(1): 107-112.( 1) 1)
|
| [11] |
Artursson V,Finlay R D,Jansson J K. 2006. Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth. Environmental Microbiology,8(1): 1-10.( 1) 1)
|
| [12] |
Beever R E,Burns D J W. 1981. Phosphorus uptake,storage and utilization by fungi. Advances in Botanical Research,8: 127-219.( 1) 1)
|
| [13] |
Bojinova D,Velkova R,Ivanova R. 2008. Solubilization of Morocco phosphorite by Aspergillus niger. Bioresource Technology,99: 7348-7353.( 1) 1)
|
| [14] |
Chung H,Park M,Madhaiyan M,et al. 2005. Isolation and characterization of phosphate-solubilizing bacteria from the rhizosphere of crop plants of Korea. Soil Biology & Biochemistry,37: 1970-1974.( 1) 1)
|
| [15] |
Hameeda B,Harini O P,Rupela O P,et al. 2008. Growth promotion of maize by phosphate-solubilizing bacteria isolated from composts and macrofauna. Microbiological Research,163(2): 234-242.( 2) 2)
|
| [16] |
Hameeda B,Rupela O P,Reddy G,et al. 2006. Application of plant growth-promoting bacteria associated with composts and macrofauna for growth promotion of Pearl millet(Pennisetum glaucum L.). Biology and Fertility of Soils,43(2): 221-227.( 1) 1)
|
| [17] |
Illmer P,Schinner F. 1992. Solubilization of inorganic phosphates by microorganisms isolated from forest soil. Soil Biology and Biochemistry,24: 389-395.( 2) 2)
|
| [18] |
Liu H,Wu X Q,Ren J H, et al. 2011. Isolation and identification of phosphobacteria in poplar rhizosphere from different regions of China. Pedosphere,21(1): 90-97.( 2) 2)
|
| [19] |
Narsian V,Patel H H. 2000. Aspergillus aculeatus as rock phosphate solubilizer. Soil Biology & Biochemistry,32: 559-565.( 2) 2)
|
| [20] |
Oliveira C A,Alves V M C,Marriel I E, et al. 2009. Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome. Soil Biology and Biochemistry,41: 1782-1787.( 1) 1)
|
| [21] |
Reyes I,Bernier L,Simard R R,et al. 1999. Effect of nitrogen source on the solubilization of different inorganic phosphates by an isolate of Penicillium rugulosum and two UV-induced mutants. FEMS Microbiology Ecology,28(3): 281-290.( 1) 1)
|
| [22] |
Rodríguez H,Fraga R. 1999. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnology Advances,17: 319-339.( 1) 1)
|
| [23] |
Wenzel C L,Ashford A E,Summerell B A. 1994. Phosphate-solubilizing bacteria associated with proteoid roots of seedlings of waratah. New Phytologist,128: 487-496.( 2) 2)
|
| [24] |
Whitelaw M A. 1999. Growth promotion of plants inoculated with phosphate-solubilizing fungi. Advances in Agronomy,69: 99-151.( 1) 1)
|
| [25] |
Xiao Chunqiao,Chi Ru'an, Huang Xiaohui,et al. 2008. Optimization for rock phosphate solubilization by phosphate-solubilizing fungi isolated from phosphate mines. Ecological Engineering,33: 187-193.( 1) 1)
|
| [26] |
Zaidi A,Khan M S,Amil M D. 2003. Interactive effect of rhizotrophic microorganisms on yield and nutrient uptake of Chickpea (Cicer arietinum L.). European Journal of Agronomy,19(1): 15-21.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

