文章信息
- 刘振坤, 田帅, 唐明
- Liu Zhenkun, Tian Shuai, Tang Ming
- 不同树龄刺槐林丛枝菌根真菌的空间分布及与根际土壤因子的关系
- Spatial Distribution of Arbuscular Mycorrhizal Fungi and Its Relationship with Soil Factors in the Rhizosphere of Robinia pseudoacacia at Different Ages
- 林业科学, 2013, 49(8): 89-95
- Scientia Silvae Sinicae, 2013, 49(8): 89-95.
- DOI: 10.11707/j.1001-7488.20130813
-
文章历史
- 收稿日期:2012-08-10
- 修回日期:2012-12-20
-
作者相关文章
2. 西北农林科技大学林学院 杨凌 712100
2. College of Forestry, Northwest A&F University Yangling 712100
丛枝菌根(arbuscular mycorrhiza,AM)真菌是一类广泛分布的土壤有益微生物,能够与陆地上80% 的植物形成共生体(Smith et al., 2008)。AM 真菌可以有效地促进植物生长,提高植物在逆境中的抗性Sheng et al., 2008; Zhang et al., 2010)。许多研究表明,AM 真菌的侵染和分布在很大程度上依赖于环境而不是宿主植物(Allen et al., 1995),AM 真菌的侵染、产孢和生理效应受各种生态因子的制约,其中土壤因子较为突出(Gong et al., 2012)。盛敏等(2011)研究了土壤因子对西北地区盐碱土中AM 真菌的影响,Guo等(2012)论述了内蒙古浑善达克沙地土壤因子对AM 真菌侵染、产孢和分布的影响。
刺槐(Robinia pseudoacacia)是黄土高原丘陵区的主要造林树种,对该地区植被恢复和生态重建发挥着不可替代的作用(Wang et al., 2012)。杜小刚等(2008)研究了黄土高原不同树龄刺槐丛枝菌根与根际微生物的群落多样性,付淑清等(2011)研究了施氮和接种AM 真菌对刺槐生长及营养代谢的影响。但关于黄土高原AM 真菌空间分布及其影响因素的研究鲜见报道。本试验旨在通过测定不同树龄刺槐林 AM 真菌和根际土壤因子的空间分布,分析“植物- 土壤- 微生物”三者之间的内在联系,为AM 真菌资源在黄土高原生态恢复中的合理利用提供理论依据。
1 材料与方法 1.1 研究区概况研究区位于陕西省安塞县中国科学院安塞水土保持综合试验站。该区地形破碎、沟壑纵横,属黄土高原丘陵沟壑地貌,海拔1 010 ~ 1 400 m,年均气温 8. 8 ℃,年均降雨量505. 3 mm; 土壤为黄土母质上发育的黄绵土,质地疏松,抗蚀性能差; 植被类型处于暖温带落叶阔叶林向干草原过渡的森林草原带(薛萐等,2007)。试验站自20 世纪50 年代以来在不同坡地营造了不同恢复年限的刺槐人工林(杜小刚等,2008)。
1.2 样品采集采用时空互代法,选择营造和管理方法一致、坡向坡位相似、树龄为11,16,21,26,31,36 年人工刺槐林作为样地,每个样地设置2 个10 m × 10 m 的样方,在每个样方内随机选择3 株刺槐。在距刺槐主干0 ~ 30 cm 范围内,除去土壤表面动植物残体,在0 ~ 20 cm和20 ~ 40 cm 土层的土壤中采集带有细根的根系,轻轻抖落附在根上的土壤,将剩余根系和土壤在无菌自封袋中轻轻抖动约1 min,作为根际土样(Clegg et al., 1997)。每个样地各土层共采集6 份根际土样,每份约100 g,编号后带回实验室,用于土壤因子和孢子密度测定。将根样编号后置于装有FAA 固定液中的小瓶中,4 ℃冰箱内保存,用于菌根侵染率测定。采样于2011 年10 月进行。采样地状况如表 1 所示。
|
|
菌根侵染率按Phillips等(1970)方法测定。采用湿筛倾析法(Ianson et al., 1986)分离真菌孢子,在体视显微镜下记录AM 真菌的孢子数量,统计孢子密度。
1.3.2 土壤理化性质测定土壤含水量采用烘干法测定,PHS-3B 型精密pH 计测定土壤pH 值(水土质量比为2. 5∶ 1),土壤有机碳含量采用重铬酸钾氧化法测定,碱解氮含量用碱解扩散法测定,速效磷含量用碳酸氢钠- 钼锑抗比色法测定,速效钾含量采用乙酸铵- 火焰光度计法测定(鲁如坤,2000)。
1.3.3 土壤酶活性和球囊霉素含量测定土壤脲酶采用靛酚比色法测定,活性以1 h 后1 g 土壤中的 NH3-N 量(mg)表示; 碱性磷酸酶采用磷酸苯二钠比色法测定,活性以1 h 后1 g 土壤中含有的苯酚量(mg)表示; 过氧化氢酶采用高锰酸钾滴定法测定,活性以20 min 后1 g 土壤消耗0. 02 mol·L - 1 的 KMnO4 量(mL)表示; 蔗糖酶采用磷钼酸比色法测定,活性以1 h 后1 g 土壤中含有的葡萄糖量(mg)表示(关松荫,1986)。总球囊霉素(total glomalin,TG)和易提取球囊霉素(easily extractable glomalin,EEG)含量按照Wright等(1996)和改进后的Janos等(2008)方法测定。
1.4 数据处理数据经Excel(V2003)处理后,采用SPSS(V17. 0)生物统计软件进行方差分析,并进行 Person 法两两相关分析和主成分分析,用Excel(V2003)绘图。
2 结果与分析 2.1 AM 真菌状况和球囊霉素含量的空间分布 2.1.1 AM 真菌状况的空间分布如图 1a 所示,刺槐林0 ~ 20 cm和20 ~ 40 cm土层的菌根侵染率均随着树龄的增大先增加后降低,分别在树龄21 年和26 年时最高(81%和69%)。20 ~ 40 cm土层的孢子密度随树龄的变化趋势与菌根侵染率相同,而0 ~ 20 cm 土层的孢子密度随树龄增加在出现2 次高峰后逐渐降低(图 1b)。相同树龄刺槐林的孢子密度与菌根侵染率均为0 ~ 20 cm 土层高于20 ~ 40 cm 土层(图 1)。双因素方差分析表明侵染率和孢子密度在树龄之间、土层之间差异显著,并且它们之间的交互作用显著(表 2)。
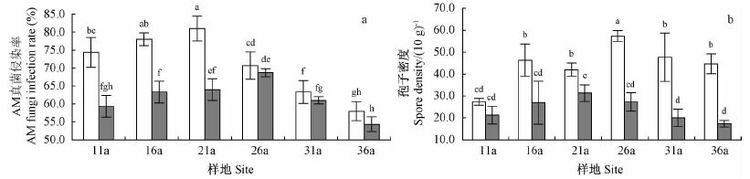
|
图1 不同树龄刺槐AM 真菌侵染率( a) 和孢子密度( b) 的空间分布① Fig.1 The spatial distribution of AM fungi infection rate ( a) and spore density of R. pseudoacacia ( b) at different ages □ 0 - 20 cm; ■ 20 - 40 cm. 下同The same below. 不同字母表示在P < 0. 05 水平差异显著。 Different letters show significant differences at P < 0. 05 level. |
|
|
如图 2a 所示,刺槐林上下土层TG 含量分别在树龄31 年和26 年最高,EEG 含量在树龄21 年时相差最小,而36 年时相差最大(图 2b)。相同树龄刺槐林的TG和EEG 含量也表现出0 ~ 20 cm 土层高于20 ~ 40 cm 土层(图 2)。双因素方差分析表明: TG和EEG 含量在树龄之间、土层之间差异显著,并且它们之间的交互作用显著(表 2)。
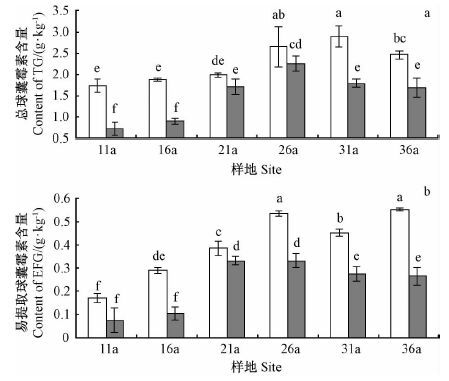
|
图2 不同树龄刺槐球囊霉素含量的空间分布 Fig.2 The spatial distribution of glomalin content of R. pseudoacacia at different ages |
由表 3 可知,相同树龄刺槐林的土壤含水量和pH 值表现出0 ~ 20 cm土层低于20 ~ 40 cm 土层,但土壤碱解氮、速效磷、速效钾和有机碳含量表现出0 ~ 20 cm 土层高于20 ~ 40 cm 土层。上下土层土壤含水量分布在14. 67% ~ 19. 07% 之间,土壤pH 值在8. 18 ~ 8. 83,碱解氮、速效磷、速效钾和有机碳含量均随着树龄的增大表现出先增加后降低的趋势。双因素方差分析表明: 速效磷、速效钾和有机碳在树龄之间、土层之间均差异显著,但它们之间的交互作用均不显著(表 2)。
|
|
如图 3 所示,除树龄36 年样地的过氧化氢酶外(图 3c),4 种酶的活性在土层分布上均表现出0 ~ 20 cm 土层高于20 ~ 40 cm土层。上下土层的脲酶和碱性磷酸酶活性均在树龄26 年时最高(图 3a和图 3d),蔗糖酶活性随着树龄的增大逐渐增加(图 3b)。双因素方差分析表明: 4 种土壤酶活性在树龄之间、土层之间均差异显著,但脲酶和蔗糖酶活性在树龄和土层之间的交互作用不显著,而过氧化氢酶和碱性磷酸酶活性在树龄和土层之间的交互作用显著(表 2)。
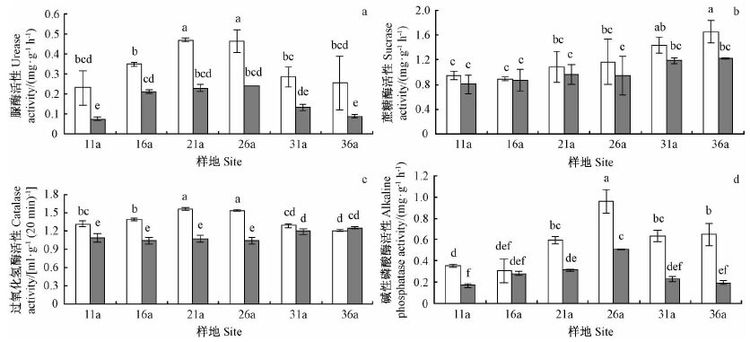
|
图3 不同树龄刺槐土壤酶活性的空间分布 Fig.3 The spatial distribution of soil enzyme activity of R. pseudoacacia at different ages |
由表 4 可知,菌根侵染率与脲酶活性极显著正相关,与过氧化氢酶活性显著正相关,与含水量显著负相关。孢子密度与碱解氮、速效磷、脲酶、碱性磷酸酶活性极显著正相关,与pH 极显著负相关,与速效钾、有机碳和过氧化氢酶活性显著正相关。TG和EEG 均与有机碳和碱性磷酸酶活性极显著正相关,与pH 极显著负相关。
|
|
主成分载荷矩阵特征值及贡献率见表 5。对10 个土壤因子进行主成分分析,根据相关矩阵特征值大于1、方差累积贡献率大于85%的原则,入选2 个主成分。第1 主成分反映的信息量占总体信息量的 59. 41%,第2 主成分仅占26. 51%。由于第1 主成分所含信息量在2 个主成分中较高,所以碱解氮、速效磷、速效钾和碱性磷酸酶(权重在0. 860 ~ 0. 903)是主要因子,能够反映黄土高原丘陵区的营养状况。
|
|
综合主成分得分结果如表 6 所示。通过2 个主成分的综合评价得到各树龄刺槐林土壤因子的状况顺序31 a > 26 a > 36 a > 21 a > 16 a > 11 a。
|
|
黄土高原人工刺槐林AM 真菌能够与其根系形成良好的共生关系,并且AM 真菌有明显的空间分布规律,表现出0 ~ 20 cm 土层优于20 ~ 40 cm 土层。这可能是由于浅层土壤透气性较好,土壤养分充足且酶活性较高,更有利于AM 真菌的定殖和产孢(Guo et al., 2012)。刺槐根系的发育具有浅层性和均匀性的特点,主根不发达且伴有大量水平细根(刘秉正等,1987),同时AM 真菌侵染的最初部位正是植物的细根,因此刺槐根系和菌根真菌的生物学特征也决定了浅层土壤具有较高的侵染率和孢子密度。本研究表明刺槐在树龄21 年时菌根侵染率最高,但树龄26 年时孢子密度最大,说明菌根侵染率与孢子密度并无严格的对应关系,这可能与植物的发育状况、根际微环境以及真菌产孢特性等因素有关(Fontenla et al., 1998)。
3.2 树龄对AM 真菌的影响国外很多学者对树龄和菌根状况的关系进行了大量的研究,如Schreiner等(2009)研究发现美国俄勒冈州葡萄(Vitis vinifera)的AM 真菌多样性随着树龄的增加而降低,Muleta等(2008)调查表明埃塞俄比亚西南部小粒咖啡(Coffee arabica)的AM 真菌孢子密度与树龄表现出负相关关系,Cheng等(2005)研究表明加拿大魁北克市糖枫(Acer saccharum)的菌根侵染率与树龄呈负相关; 但国内关于树龄对菌根状况影响的研究鲜见报道,本研究表明菌根侵染率随着树龄的增大先增加后降低,其原因可能是幼龄树根较老龄根系统具有发达的细根(Baddeley et al., 2005),并且具有大量薄壁细胞和发达的细胞间隙,因而表层阻力小,更有利于AM 真菌的侵染。
3.3 AM 真菌与土壤因子的关系大量研究表明,AM 真菌状况与土壤因子关系密切(Bai et al., 2009; 盛敏等,2011),其中土壤pH 值对菌根真菌的生命活动可产生重大影响,本研究也证实土壤pH 值与孢子密度极显著负相关,这可能是由于土壤酸碱度主要通过影响孢子的萌发、菌丝的生长等方式影响AM 真菌孢子的发育(盖京苹等,2004)。同时本研究表明,在黄土丘陵区贫瘠土壤中,碱解氮、速效磷、速效钾和碱性磷酸酶是影响 AM 真菌活性的主要土壤因子。AM 侵染宿主植物后,能够吸收大量无机氮,这些无机氮既可以参与孢子的形成过程(Hodge et al., 2010),又可以在根外菌丝中转化为精氨酸并转移至根内菌丝,然后进一步转化为NH4+ 参与氮代谢(Hawkins et al., 2000)。 因此,黄土高原丘陵区偏低的碱解氮会影响AM 真菌对氮的吸收和利用,同时黄土高原的低磷环境通过影响AM 真菌的菌丝体分泌碱性磷酸酶,进而影响有机磷向无机磷的分解转化(刘润进等,2007),改变了植物和AM 真菌的磷环境。由此可见,在黄土高原贫瘠的土壤中,适当地提高土壤养分,有助于提高AM 真菌的发育。
土壤酶活性与菌根真菌的发育具有密切的关系,这主要是因为菌根真菌对宿主植物的侵染会影响宿主植物并促使丛枝菌根分泌土壤酶,或者通过根外菌丝分泌土壤酶(Bedini et al., 2010); 其中,脲酶能够将有机氮转化为孢子形成过程中所需的无机氮(Hodge et al., 2010),无机氮经过细根和菌丝的吸收、转移才能为孢子萌发所用,孢子密度和侵染率与脲酶活性呈极显著正相关也证明了这一点。而碱性磷酸酶是菌根共生系统中的一种特异性的酶,其活性的大小能够反映菌根真菌活性的强弱(Tisserant et al., 1993)。本研究中,碱性磷酸酶活性与孢子密度极显著正相关,说明碱性磷酸酶与孢子形成及其活性有密切联系。
3.4 球囊霉素与AM 真菌、土壤有机碳的关系球囊霉素是一类产生于AM 真菌菌丝体和孢子壁的糖蛋白,并且是菌根真菌与土壤环境相互作用的重要媒介物质(Purin et al., 2007)。球囊霉素还是土壤有机碳库的重要组成部分,能够促进土壤团聚体的形成和稳定,进而影响土壤碳储量和有效防止土壤碳的流失(Rillig et al., 2006)。Comis(2002)研究发现,AM 真菌产生的球囊霉素与土壤碳库关系密切,并且球囊霉素的含量是土壤腐殖质含量的 2 ~ 24倍,可占到土壤有机碳的27%。本研究表明球囊霉素与有机碳极显著正相关,说明AM 真菌产生的球囊霉素能够提高土壤碳库的含量(Qian et al., 2012)。由此可见,在生态脆弱的黄土高原地区,各生态要素相互影响和制约,而AM 真菌在生态系统的信息传递和能量转换中起到桥梁作用。
| [1] |
杜小刚,唐 明,陈 辉,等. 2008. 黄土高原不同树龄刺槐丛枝菌根与根际微生物的群落多样性. 林业科学,44(4): 78-82.( 2) 2)
|
| [2] |
付淑清,屈庆秋,唐 明,等. 2011. 施氮和接种AM真菌对刺槐生长及营养代谢的影响. 林业科学,47(1): 95-100.( 1) 1)
|
| [3] |
盖京苹,冯 固,李晓林. 2004. 我国北方农田土壤中AM真菌的多样性. 生物多样性, 12(4): 435-440.( 1) 1)
|
| [4] |
关松荫. 1986. 土壤酶及其研究方法. 北京: 农业出版社, 274-330.( 1) 1)
|
| [5] |
刘秉正,王幼民,李凯荣,等. 1987. 人工刺槐林改良土壤的初步研究. 西北林学院学报, 2(1): 48-57.( 1) 1)
|
| [6] |
刘润进,陈应龙. 2007. 菌根学. 北京: 科学出版社, 292-293.( 1) 1)
|
| [7] |
鲁如坤. 2000. 土壤农业化学分析方法. 北京: 中国农业科技出版社.( 1) 1)
|
| [8] |
盛敏,唐 明,张峰峰,等. 2011. 土壤因子对甘肃、宁夏和内蒙古盐碱土中AM真菌的影响. 生物多样性, 19(1): 85-92.( 2) 2)
|
| [9] |
薛萐,刘国彬,戴全厚,等. 2007. 侵蚀环境生态恢复过程中人工刺槐林(Robinia pseudoacacia)土壤微生物量演变特征. 生态学报, 27(3): 909-917.( 1) 1)
|
| [10] |
Allen E B,Allen M F,Helm D J,et al. 1995. Patterns and regulation of mycorrhizal plant and fungal diversity. Plant and Soil, 170(1): 47-62.( 1) 1)
|
| [11] |
Baddeley J A,Watson C A. 2005. Influences of root diameter, tree age, soil depth and season on fine root survivorship in Prunus avium. Plant and Soil, 276(1/2): 15-22.( 1) 1)
|
| [12] |
Bai C M,He X L,Tang H L,et al. 2009. Spatial distribution of arbuscular mycorrhizal fungi, glomalin and soil enzymes under the canopy of Astragalus adsurgens Pall. in the Mu Us sandland, China. Soil Biology and Biochemistry, 41(5): 941-947.( 1) 1)
|
| [13] |
Bedini S,Turrini A,Rigo C,et al. 2010. Molecular characterization and glomalin production of arbuscular mycorrhizal fungi colonizing a heavy metal polluted ash disposal island, downtown Venice. Soil Biology and Biochemistry, 42(5): 758-765.( 1) 1)
|
| [14] |
Cheng S,Widden P,Messier C. 2005. Light and tree size influence belowground development in yellow birch and sugar maple. Plant and Soil, 270(1): 321-330.( 1) 1)
|
| [15] |
Clegg S,Gobran G R. 1997. Rhizospheric P and K in forest soil manipulated with ammonium sulfate and water. Canadian Journal of Soil Science, 77(4): 515-523.( 1) 1)
|
| [16] |
Comis D. 2002. Glomalin:Hiding place for a third of the world's stored soil carbon. Agricultural Research, 50(9): 4-7.( 1) 1)
|
| [17] |
Fontenla S,Godoy R,Rosso P,et al. 1998. Root associations in Austrocedrus forests and seasonal dynamics of arbuscular mycorrhizas. Mycorrhiza, 8(1): 29-33.( 1) 1)
|
| [18] |
Gong M G,Tang M,Zhang Q M,et al. 2012. Effects of climatic and edaphic factors on arbuscular mycorrhizal fungi in the rhizosphere of Hippophae rhamnoides in the Loess Plateau, China. Acta Ecologica Sinica, 32(2): 62-67.( 1) 1)
|
| [19] |
Guo H J,He X L,Li Y P. 2012. Spatial distribution of arbuscular mycorrhiza and glomalin in the rhizosphere of Caragana korshinskii Kom. in the Otindag sandy land, China. African Journal of Microbiology Research, 6(28): 5745-5753.( 2) 2)
|
| [20] |
Hawkins H J,Johansen A,George E. 2000. Uptake and transport of organic and inorganic nitrogen by arbuscular mycorrhizal fungi. Plant and Soil, 226(2): 275-285.( 1) 1)
|
| [21] |
Hodge A,Helgason T,Fitter A H. 2010. Nutritional ecology of arbuscular mycorrhizal fungi. Fungal Ecology, 3(4): 267-273.( 2) 2)
|
| [22] |
Ianson D C,Allen M F. 1986. The effects of soil texture on extraction of vesicular-arbuscular mycorrhizal fungal spores from arid sites. Mycologia, 78(2): 164-168.( 1) 1)
|
| [23] |
Janos D P,Garamszegi S,Beltran B. 2008. Glomalin extraction and measurement. Soil Biology and Biochemistry, 40(3): 728-739.( 1) 1)
|
| [24] |
Muleta D,Assefa F,Nemomissa S,et al. 2008. Distribution of arbuscular mycorrhizal fungi spores in soils of smallholder agroforestry and monocultural coffee systems in southwestern Ethiopia. Biology and Fertility of Soils, 44(4): 653-659.( 1) 1)
|
| [25] |
Phillips J M,Hayman D S. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society, 55(1): 158-161.( 1) 1)
|
| [26] |
Purin S,Rillig M C. 2007. The arbuscular mycorrhizal fungal protein glomalin: Limitations, progress, and a new hypothesis for its function. Pedobiologia, 51(2): 123-130.( 1) 1)
|
| [27] |
Qian K M,Wang L P,Yin N N. 2012. Effects of AMF on soil enzyme activity and carbon sequestration capacity in reclaimed mine soil. International Journal of Mining Science and Technology, 22(4): 553-557.( 1) 1)
|
| [28] |
Rillig M C,Mummey D L. 2006. Mycorrhizas and soil structure. New Phytologist, 171(1): 41-53.( 1) 1)
|
| [29] |
Schreiner R P,Mihara K L. 2009. The diversity of arbuscular mycorrhizal fungi amplified from grapevine roots (Vitis vinifera L.) in Oregon vineyards is seasonally stable and influenced by soil and vine age. Mycologia, 101(5): 599-611.( 1) 1)
|
| [30] |
Sheng M,Tang M,Chen H,et al. 2008. Influence of arbuscular mycorrhizae on photosynthesis and water status of maize plants under salt stress. Mycorrhiza, 18(6/7): 287-296.( 1) 1)
|
| [31] |
Smith S E,Read D J. 2008. Mycorrhizal symbiosis. 3rd ed. London, UK: Academic Press.( 1) 1)
|
| [32] |
Tisserant B,Gianinazzi-Pearson V,Gianinazzi S,et al. 1993. In planta histochemical staining of fungal alkaline phosphatase activity for analysis of efficient arbuscular mycorrhizal infections. Mycological Research, 97(2): 245-250.( 1) 1)
|
| [33] |
Wang B,Liu G B,Xue S. 2012. Effect of black locust (Robinia pseudoacacia) on soil chemical and microbiological properties in the eroded hilly area of China's Loess Plateau. Environmental Earth Science, 65(3): 597-607.( 1) 1)
|
| [34] |
Wright S F,Franke-Snyder M,Morton J B,et al. 1996. Time-course study and partial characterization of a protein on hyphae of arbuscular mycorrhizal fungi during active colonization of roots. Plant and Soil, 181(2): 193-203.( 1) 1)
|
| [35] |
Zhang H H,Tang M,Chen H,et al. 2010. Effect of inoculation with AM fungi on lead uptake, translocation and stress alleviation of Zea mays L. seedlings planting in soil with increasing lead concentrations. European Journal of Soil Biology, 46(5): 306-311.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

