文章信息
- 程红, 严善春
- Cheng Hong, Yan Shanchun
- 柳蛎盾蚧危害与丁香防御蛋白活力的关系
- Relationship between the Lepidosaphes salicina-Caused Damages and Activities of Leaf Defensive Proteins of Syringa spp.
- 林业科学, 2013, 49(8): 81-88
- Scientia Silvae Sinicae, 2013, 49(8): 81-88.
- DOI: 10.11707/j.1001-7488.20130812
-
文章历史
- 收稿日期:2012-12-21
- 修回日期:2013-06-26
-
作者相关文章
丁香属(Syringa spp.)植物适应性强,是药用、 园林绿化的重要树种,其经济价值不断被开发(明军等,2007)。随着丁香属植物在城区栽植面积的 不断扩大,丁香的虫害问题也逐渐显现(程红等,2011),其中危害最广泛且较严重的为柳蛎盾蚧(Lepidosaphes salicina),其寄生密度最大,可达32 头·cm - 2。该虫以口针刺入树木韧皮部吸取汁液,危害严重时可使丁香枝条枯死或整株死亡,给城市 绿化造成巨大的损失。程红等(2013)研究表明,丁 香中单宁、酚酸类物质的含量及其在危害盛期上升 的幅度与抗虫性有关。以往研究指出次生性抗虫物 质的形成和积累前后,一定会发生次生代谢相关酶 活性的变化(鲁艺芳等,2012; Wu et al., 2009)。有 关丁香抗虫性与次生代谢相关酶活性关系的研究尚 未见报道。过氧化物酶(peroxidase,POD)、超氧化 物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、多酚氧化酶(polyphenol oxidase,PPO)、苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)、胰蛋白酶抑制剂(trypsin inhibitor,TI)、 胰凝乳蛋白酶抑制剂(chymotrypsin inhibitor,CI)与 植物抗性密切相关,可以作为抗虫性指标(Li et al., 2010; 严善春等,2011)。程红等(2011)野外调查 时发现柳蛎盾蚧在丁香叶上发育正常,能够完成其 生活史。为了探讨不同品种丁香对柳蛎盾蚧抗性的 强弱与其防御蛋白活性的关系,笔者对13 种(品 种)丁香的保护酶(POD,SOD,CAT)、防御酶(PPO,PAL)、蛋白酶抑制剂(TI、CI)进行研究,根据柳蛎盾 蚧的不同危害期,测定5—8 月丁香叶中的各种酶和蛋白酶抑制剂的时序变化,为深入研究丁香属植物 抗柳蛎盾蚧机制和品种选育提供理论基础。
1 材料与方法 1.1 样品采集在哈尔滨市黑龙江省森林植物园丁香园、黑龙 江中医药大学校园、东北林业大学校园内,选择人行 道旁、向阳的丁香植株为研究对象。依据6—7 月柳 蛎盾蚧平均虫口密度的不同将13 种(品种)丁香分 为4 类: 第1 类为高抗类,包括不感虫丁香[什锦丁 香(S. chinensis)、小叶丁香(S. microphylla)、关东丁 香(S. velutina)、暴马丁香(S. reticulata var. m and shurica)]和感虫丁香[小花重瓣洋丁香(S. vulgaris‘Xiaohua’)、紫叶重瓣洋丁香(S. vulgaris ‘Zihong’)、朝鲜丁香(S. dilatata)]; 第2 类为中抗 类[西南丁香(S. emodi)、大花重瓣洋丁香(S. vulgaris‘Dahua’)、洋丁香(S. vulgaris)]; 第3 类为易感类[紫丁香(S. oblata)和白丁香(S. oblata var. alba)]; 第4 类为高感类[红丁香(S. villosa)]。分 别在柳蛎盾蚧的未危害期(5 月末)、危害盛期(6 月 末)、危害弱期(7 月末)、危害末期(8 月末)采集丁 香叶片。每种丁香选择15 株样树,每5 株为1 个重 复。采样时,红丁香树龄为12 年生,其余品种均为 13 年生; 各样株树势良好,未见枯死枝条,无其他 病虫害。在样株树冠上中下3 个层次的东西南北 4 个方位,采摘长势良好的叶片,混合后作为1 株的 样品。将采集的叶片装入冰盒,带回实验室,于 - 40 ℃冰箱中保存。柳蛎盾蚧虫口密度调查、危害 时期划分等参见程红等(2013)。
1.3 酶活性的测定方法称取1.0 g 鲜叶,在液氮冷冻条件下充分碾碎,依据测定酶的不同,进行不同处理。
1.3.1 保护酶保护酶包括POD,CAT,SOD,其测 定方法参照严善春等(2011),其中POD 活性以1 min 内OD470 变化0. 1 的酶量为1 个酶活力单位(U· g-1FW)。
1.3.2 防御酶PAL 活性测定采用苯丙氨酸比色法(Zong et al., 2007),以1 min 内OD290 变化0. 1 的 酶量为1 个酶活力单位(U·g-1 FW)。PPO 活性测 定采用咖啡酸比色法(Felton et al., 1992; 刘艳等,2005),以1 min 内OD470 变化0. 1 的酶量为1 个酶 活力单位(U·g-1FW)。
1.3.3 蛋白酶抑制剂蛋白酶抑制剂包括TI,CI,其活力测定参照王琪等(2008),以1 min 内蛋白酶 抑制剂活力降低0. 1 的酶量为1 个酶活力单位(U· g-1FW)。
1.4 数据分析数据处理使用SPSS18. 0 软件,采用one-way ANOVA(单因素差异显著性分析法)中的LSD 法(最小显著法)在α = 0. 05 水平下检验柳蛎盾蚧不 同危害期对POD,CAT,SOD,PAL,PPO,TI和CI 7 种 蛋白活性的影响。以Univariate 法(单因变量的多 因素方差分析法)分析危害期时期、丁香种(品种)对各防御蛋白的影响,α = 0. 05。
2 结果与分析 2.1 种类(品种)和危害时期对丁香叶内7 种防御蛋白活力的影响不同丁香种(品种)对7 种蛋白的活性均有极 显著影响(P < 0. 01),柳蛎盾蚧的不同危害时期对7 种蛋白的活性亦均有极显著影响(P < 0. 01)(表 1)。
|
|
由表 2 可见,POD 活性,在未危害期,未表现出 与抗虫性相关的差异性,只有小花重瓣洋丁香显著 高于其他种类; 而在危害盛期,高抗类、中抗类丁香 显著升高(P < 0. 05),高抗类除小花重瓣洋丁香外 增幅均在100%以上,中抗类增幅为69% ~ 89%,其 中,虫害较重的则降低(高感类)或持平(易感类); 易感、高感类略有升高(P > 0. 05)或显著降低,二者 分别在危害弱期、危害末期才显著升高。可见,POD 活性的高低和变化程度与丁香对柳蛎盾蚧的抗虫性 水平高低密切相关。CAT 活性,在危害盛期高抗类 中的感虫丁香和中抗类丁香均无显著变化(P < 0. 05),易感和高感类显著高于其他种(品种)(P < 0. 05),增幅为153% ~ 1 685%; 危害弱期又都显著 降低,降幅为70% ~ 89%。SOD 活性,高抗类丁香 在危害盛期无显著变化(P > 0. 05),中抗、易感、高 感类均显著下降,其中易感、高感类降幅(67% ~ 81%)较中抗类(41% ~ 48%)高; 危害弱期除关东 丁香外都显著升高,而危害末期多表现出降低趋势。 可见,SOD 活性在未危害期及整个危害期内均未表 现出与抗虫性相关的变化规律。
|
|
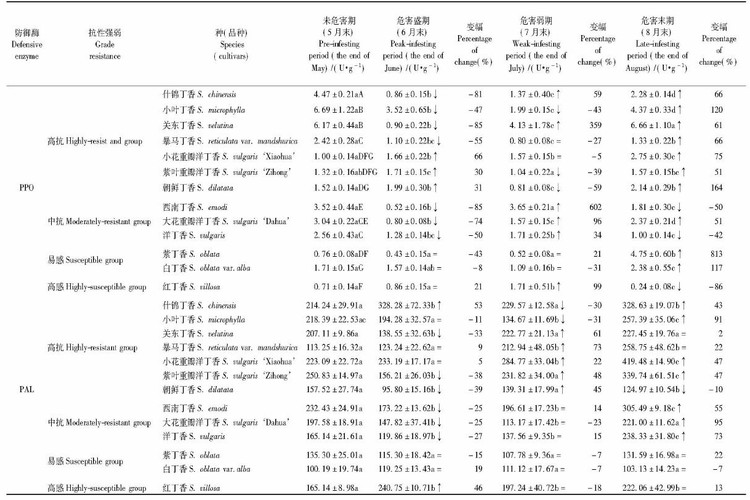
由表 3 可见,PPO 活性,在未危害期高感类丁香 最低,高抗类的不感虫丁香和中抗类丁香均显著高 于易感、高感和高抗类中的感虫丁香(P < 0. 05); 在危害盛期,高抗类感虫丁香显著升高,增幅为 29% ~ 66%,而中抗类显著降低,降幅为50% ~ 85%,易感和高感类则变化不显著; 在危害末期,易 感类丁香显著升高,而高感类末显著升高。可见,丁 香抗虫性与PPO 初始含量有关,也与虫害盛期诱导 表达的强弱有关。PAL 活性,在危害盛期,高抗的什 锦丁香、高感类的红丁香显均著升高,其余种(品 种)显著降低或与未危害期持平; 易感类5—8 月没 有显著变化,而中抗类6 月显著下降,7 月无明显变 化,8 月显著升高。这与以往有研究认为植物组织 越嫩PAL 活性越高的观点不同,也可能是丁香抗虫 的原因。
|
|
由表 4 可见,TI 活性,高感类丁香在未危害期 显著高于其他种(品种),但在危害盛期却显著降 低; 高抗、中抗类在危害盛期显著升高(P < 0. 05),但二者升高幅度差异不明显; 易感类略有升高(P > 0. 05); 危害弱期、危害末期各抗性丁香TI 活性显 著降低或持平。CI 活性,在未危害期易感、高感类 显著高于其他丁香(P < 0. 05); 在危害盛期易感、 高感类显著下降,而高抗、中抗类均显著升高,其中,高抗感虫丁香升高幅度为102% ~ 117%,中抗为 38% ~ 71%; 在危害弱期,易感和高感类显著升高,高抗和中抗类未表现出与抗性明显相关的规律; 在 危害末期各类丁香的CI 活性持平或显著降低。可 见,柳蛎盾蚧未危害期TI,CI 活性的高低与抗虫性没 有明显的相关性,虫害后升高的幅度与抗虫性相关。
|
|
昆虫的入侵可以诱导植物产生大量的活性氧(刘裕强等,2005),而活性氧会损害植物的细胞膜、 核酸、叶绿素,大量积累会引起植物氧化代谢失衡,从而激发植物的抗氧化体系(Wang et al., 2011)。 SOD,POD,CAT 是植物体内重要的抗氧化酶,它们 可以降低活性氧对植物细胞的侵害,维持体内氧化 代谢的平衡,并且对诱导防御信号的产生起重要作 用(谭永安等,2010)。本研究结果表明,在未危害 期,POD,CAT和SOD 活性与丁香对柳蛎盾蚧的抗 虫性不相关,而在危害盛期,其应激反应不同,有可 能存在协同作用: POD 活性,高抗和中抗类显著升 高,易感和高感类持平或下降; CAT 活性,易感和高 感类显著升高,而高抗和中抗类丁香无显著变化; SOD 活性,高抗类无显著变化,中抗、易感、高感类 则显著降低。POD 活性的大幅增加还有利于聚合 酚酸,促进细胞壁木质化,加快损伤愈合(毛红等,2011)。笔者的系列相关研究也表明: 在危害盛期,POD 活性与丁香总酚酸含量呈正相关,二者在高 抗、中抗类丁香中均显著升高,且高抗感虫丁香的升 高幅度要高于中抗类,而易感、高感类均未显著升高(程红等,2013)。CAT 在易感和高感类丁香抗虫性 上起主导作用,对丁香来说CAT 变化可能存在防御 阈值,只有虫口达到一定密度时才启动应激反应。
防御酶在植物形成抗虫性次生物质如多酚类、 黄酮类、异黄酮和木质素等的过程中起重要作用(张宽朝等,2008; 谭永安等,2010)。本研究表明: 丁香抗虫性与PPO 初始活性高低有关,也与虫害盛 期诱导表达的强弱有关。未危害期高感类丁香PPO 活性最低,高抗类不感虫丁香和中抗类丁香PPO 活 性均显著高于易感、高感类和高抗类中的感虫丁香(P < 0. 05)。在危害盛期,抗虫种(品种)比感虫种(品种)PPO 的活性上升快,高抗类感虫丁香增幅为 29% ~ 66%,其余感虫种(品种)下降,这与毛红等(2011)对绿盲蝽(Apolygus lucorum)取食棉花(Gossypium)的研究结果一致。相对PPO,PAL 的反 应相对迟缓: 高抗类丁香危害盛期PPO 活性显著升 高,PAL 活性危害弱期才显著升高; 中抗类PPO 活 性危害弱期显著升高,PAL 活性危害末期才显著升 高。酚酸是丁香的主要抗虫物质,危害盛期高抗和中抗类丁香总酚酸含量均显著升高(程红等,2013),但此期用于合成各种酚酸的PAL 活性却没 有表现出明显的升高趋势。PAL 可能更多地用于合 成酚酸类的防御物质,其消耗可能大于合成,故在危 害盛期表现出降低趋势。
CI,TI 是与植物抗虫性关系最为密切的2 种丝 氨酸蛋白酶抑制剂,它们与昆虫消化道内的蛋白消 化酶相互作用,使昆虫厌食,从而降低昆虫的体质量和生长速率(刘会香等,2005),但本研究中未危害 期TI,CI 的高活性并未体现出高抗性,危害盛期高 抗、中抗类丁香均显著升高,同时易感和高感类持平 或显著下降,说明危害盛期2 种蛋白酶抑制剂升高 幅度与抗虫性相关。易感、高感类丁香CI 活性在危 害盛期不升反降,这可能与其虫口密度过大有关,危 害盛期紫丁香、白丁香、红丁香的虫口密度分别为 30. 84,24. 70,51. 83 头·cm - 2(程红等,2013)。刘宽余等(1997)研究表明柳蛎盾蚧对杨树(Populus)的防治阈值为37. 39 头·cm-2,而丁香是灌木,其防 治阈值可能较乔木(杨树)低。虫口密度激增的时 期,丁香会权衡资源分配,可能启动更为有效的防御 措施。危害盛期,高抗的感虫丁香和中抗类丁香 TI,CI 活性均显著升高,且CI 的增幅要明显大于 TI,而易感和高感显著降低或持平。可见,CI 在丁 香抗性方面的作用可能高于TI。
总之,在13 种(品种)丁香的7 种防御蛋白中,只有PPO 未危害期活性高低与抗虫性相关,POD,PPO,TI和CI 虫害盛期诱导表达的强弱与抗虫性相关。受柳蛎盾蚧危害后,丁香产生的诱导抗虫性在 其抗虫性中占有重要地位,亦是影响柳蛎盾蚧种群 数量消长的主导因素之一。丁香叶中保护酶、防御 酶和蛋白酶抑制剂的活性变化能够反映这种诱导抗 性强弱及在不同类型种(品种)间的差异。
| [1] |
程红, 严善春.2011.危害丁香属植物的昆虫种类.东北林业大学学报,39(3): 113-116.( 2) 2)
|
| [2] |
程红,严善春.2013.柳蛎盾蚧危害与丁香不同种(品种)间单宁、酚酸含量的关系.林业科学,49(6): 97-106.( 5) 5)
|
| [3] |
刘会香,张星耀.2005.植物蛋白酶抑制剂及其在林木抗虫基因工程中的应用.林业科学,41(3): 148-157.( 1) 1)
|
| [4] |
刘宽余,刘军侠,严善春,等.1997.柳蛎蚧防治阈值的研究.东北林业大学学报,25(5): 1-4.( 1) 1)
|
| [5] |
刘 艳,郝燕燕,刘艳艳,等.2005.机械伤害和茉莉酸对豌豆幼苗膜脂过氧化的影响.中国农业科学, 38(2): 388-393( 1) 1)
|
| [6] |
刘裕强,江玲,孙立宏.2005.褐飞虱刺吸诱导的水稻一些防御性酶活性的变化.植物生理与分子生物学学报, 31(6): 643-650.( 1) 1)
|
| [7] |
鲁艺芳,石蕾,严善春.2012.不同光照强度对兴安落叶松几种主要防御蛋白活力的影响.生态学报,32(11): 3621-3627.( 1) 1)
|
| [8] |
毛红,陈瀚,刘小侠,等.2011.绿盲蝽取食与机械损伤对棉花叶片内防御性酶活性的影响.应用昆虫学报,48(5): 1431-1436.( 2) 2)
|
| [9] |
明军,顾万春,刘春,等.2007.丁香属植物种子资源研究概况.世界林业研究,20(3): 20-26.( 1) 1)
|
| [10] |
谭永安,柏立新,肖留斌,等.2010.绿盲蝽危害对棉花防御性酶活性及丙二醛含量的诱导.棉花学报,22(5): 479-485.( 2) 2)
|
| [11] |
王琪,严善春,王艳军,等.2008.剪叶及昆虫取食对兴安落叶松蛋白酶抑制剂的影响.昆虫学报,51(8): 798-803.( 1) 1)
|
| [12] |
严善春,门丽娜,石蕾,等.2011.杂种落叶松不同子代针叶内抗氧化酶活性的比较.林业科学,47(10): 111-115.( 2) 2)
|
| [13] |
张宽朝,金青,蔡永萍,等.2008.苯丙氨酸解氨酶与其在重要次生代谢产物调控中的作用研究进展.中国农学通报,24(12): 59-62.( 1) 1)
|
| [14] |
Felton G W, Donato K K, Broadway R M, et al. 1992.Impact of oxidized plant phenolics on the nutritional quality of dietary protein to a noctuid herbivore, Spodoptera exigua. Journal of Insect Physiology,38(4): 277-285.( 1) 1)
|
| [15] |
Li Dongxiao, Li Cundong, Sun Hongchun, et al. 2010. Effects of drought on soluble protein content and protective enzyme system in cotton leaves. Frontiers of Agriculture in China,4(1): 56-62.( 1) 1)
|
| [16] |
Wang Qi, Yan Shanchun, Shi Lei, et al. 2011.Effects of manual cutting and larval herbivory on systemic induction of antioxidant defense enzymes in Larix gmelinii. Scandinavian Journal of Forest Research,26(1): 61-68.( 1) 1)
|
| [17] |
Wu J Q, Baldwin I T. 2009.Herbivory-induced signalling in plants: perception and action. Plant, Cell and Environment,32(9): 1161-1174.( 1) 1)
|
| [18] |
Zong Na, Wang Chenzhu. 2007.Larval feeding induced defensive responses in tobacco: comparison of two sibling species of Helicoverpa with different diet breadths. Planta,226(1): 215-224.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49