文章信息
- 蔡春菊, 范少辉, 刘凤, 曹帮华
- Cai Chunju, Fan Shaohui, Liu Feng, Cao Banghua
- 毛竹种子人工老化过程中生理生化变化
- Physiological and Biochemical Changes of Moso Bamboo (Phyllostachys edulis) seeds in Artificial Aging
- 林业科学, 2013, 49(8): 29-34
- Scientia Silvae Sinicae, 2013, 49(8): 29-34.
- DOI: 10.11707/j.1001-7488.20130805
-
文章历史
- 收稿日期:2012-08-21
- 修回日期:2013-06-04
-
作者相关文章
2. 山东农业大学林学院 泰安 271018
2. College of Forestry, Shandong Agricultural University Tai'an 271018
种子活力在种子发育过程中形成,生理成熟期达到最高,生理成熟后开始出现不可逆转的质量下降变化总称为“劣变”(seed deterioration)或老化(aging)(陶嘉龄等,1991)。伴随着种子劣变过程,发生着一系列的生理生化变化,包括膜透性(王彦荣等,2002;杨永青等,2004)、酶活性(王彦荣等,2001)、脂质过氧化(Trawatha et al., 1995; Aiazzi et al., 1996)、修复机制(孙群等,2007)等多个方面,在农作物、花卉和草本植物种子中已经开展了大量研究。研究并认识种子劣变过程中的生理生化变化,对于探索种子活力测定和质量评价的适宜方法、寻找有效减缓种子活力下降的措施具有重要指导意义。
毛竹(Phyllostachys edulis)是我国分布最广、面积最大、经济价值最高的竹种。毛竹开花周期长且难以预测,开花零散,自然结实率低,种子难以获得。毛竹种子为典型的短命种子,自然条件下贮藏1 年几乎完全丧失发芽能力(周芳纯等,1998; 江泽慧,2002),这极大限制了毛竹种子在种质保存及科学生产中的应用。目前,国内外关于毛竹种子活力的研究还不多,已有GA3(刘凤等,2009)、60Co γ 射线(蔡春菊等,2007)、贮藏温度和含水量(蔡春菊等,2009; 2010)对毛竹种子活力及种质保存的影响等方面研究,而有关毛竹种子劣变及其生理生化变化的研究较少。本文以人工老化的毛竹种子为试验材料,探讨毛竹种子老化过程中生理生化变化及与种子活力的关系,以期揭示种子劣变机制,为探寻毛竹种子及种质的保存方法提供参考。
1 材料与方法 1.1 试验材料供试材料为2010 年9 月收获的毛竹种子,试验于2010 年12 月在竹藤科学与技术重点实验室进行。种子平均净度为62.03%,千粒质量为(22.5 ±0.35)g,平均含水量为8.97%,种子初始发芽率为(80.33 ± 4.16)%。
1.2 试验方法 1.2.1 种子处理方法采用高温高湿法,将毛竹种子用纱网袋封装好后,均匀摆放在预先平衡好的密封的恒温恒箱中(温度40 ℃、相对湿度95%),分别处理2,4,6,8,10,12 天后,分期取出老化种子,以未经老化处理的作为对照,置于室内阴凉处风干。
1.2.2 测定指标及方法1)种子发芽试验采用《林木种子检验规程》(GB 2772—1996)标准发芽率测定方法并略加改进(蔡春菊,2010)。滤纸发芽床,重复4 次,每重复50 粒。
2)超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法,可溶性糖含量测定采用蒽酮法,可溶性蛋白含量测定采用考马斯亮蓝G-250 染色法,过氧化物酶(POD)活性测定采用愈创木酚法,过氧化氢酶(CAT)活性测定采用紫外分光光度法,丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)比色法(李合生等,2000; 邹琦,2003)。重复4 次,每重复30 粒。
3)电导率测定采用电导率仪法(张宪政等,1994)。重复4 次,每重复30 粒。
4)种子内源激素(IAA,ABA,GA3)含量测定采用HPLC 法(曹帮华等,2006)。
1.2.3 数据处理用SAS(Ver. 9.0)软件进行方差分析、LSD 多重比较和相关性分析。
2 结果与分析 2.1 人工老化对毛竹种子活力的影响人工老化处理后,毛竹种子发芽率、发芽指数和活力指数均呈下降趋势,并分为快速下降和缓慢下降2 个阶段(表 1)。在老化前期2 ~ 4 天种子发芽率和活力指数快速下降,第6 ~ 12 天缓慢下降,老化第2,4,6天毛竹种子发芽率、发芽指数和活力指数均显著和极显著低于对照(P < 0.01),第6 ~ 12 天相邻2 处理间种子发芽率、发芽指数和活力差异不显著(P > 0.05)。
|
|
在人工老化过程中,毛竹种子发芽率、发芽指数和活力指数3 个指标变化表现出一致性,但下降速率不同,种子活力指数下降最快,其次是发芽指数和发芽率。当老化第4 天时,活力指数已下降63%,发芽指数和发芽率分别下降50%和44%; 老化第6 天时,活力指数下降了72%,发芽指数和发芽率分别下降了68%和51%; 当老化第12 天时,发芽率和活力降低了72%和90%,种子活力基本丧失。
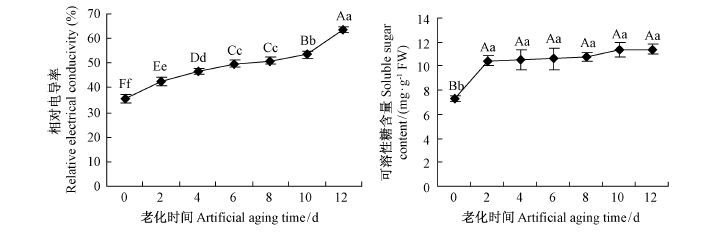
2.2 老化过程中种子浸出液电导率和可溶性糖含量的变化种子在老化过程中,种子活力下降,细胞膜功能受损,膜透性增加。种子浸泡液相对电导率和可溶性糖泄漏能客观反映种子细胞膜的完整性(Mitrović et al., 2005; 郭永清等,2007)。
从毛竹种子浸泡液相对电导率的动态变化(图 1)来看,老化初期第2 ~ 6 天和后期第8 ~ 12 天上升速度较快,老化中期第6 ~ 8 天上升速度较缓,与种子活力的变化趋势一致。方差分析和多重比较表明,老化2 ~6 天后,毛竹种子浸出液相对电导率间差异极显著(P <0.01),老化6 与8 天间差异不显著,老化8 ~12 天相邻处理间差异极显著(P <0.01)。种子可溶性糖的泄漏随着种子老化程度的加深先急剧升高,后缓慢升高,老化第2 天时可溶性糖含量与对照差异显著,其余各处理间变化差异不显著(图 1)。
|
图1 老化处理对毛竹种子浸出液相对电导率及可溶性糖含量的影响 Fig.1 Effects on relative conductivity and soluble sugar content in artificial aging |
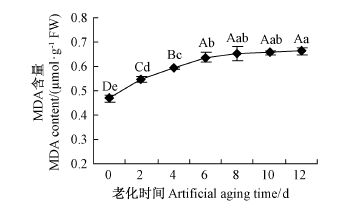
种子劣变过程中,种子内部自动氧化或由于氧化酶的催化作用产生的自由基攻击脂类物质造成膜脂的过氧化,MDA 作为膜脂过氧化的主要终产物之一常用于指示种子老化程度。
随着老化时间的增加,毛竹种子MDA 含量也经历了先迅速上升后缓慢上升的过程(图 2)。老化处理种子MDA 含量均极显著高于对照,老化0 ~ 6天间MDA 含量差异极显著(P < 0.01),老化后期第6 ~ 12 天间毛竹种子内MDA 含量差异不显著(P >0.05),这与前述种子发芽、相对电导率的测定结果一致,也与其他种子的研究结果一致(汤学军等,1996; McDonald,1999)。说明随着种子老化程度的加深,膜脂过氧化程度也随之加深,MDA 不断积累,以致对种子生物膜造成严重损伤,种子活力急剧下降,老化6 天时种子活力已下降72%。
|
图2 老化处理毛竹种子内MDA 含量的变化 Fig.2 Changes of MDA content in Ph. edulis seeds in artificial aging |
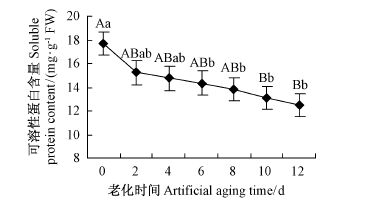
毛竹种子内可溶性蛋白含量随着种子老化程度的加深呈缓慢下降趋势(图 3)。老化6 ~ 8 天可溶性蛋白含量均显著低于对照(P < 0.05),老化10 ~12 天极显著低于对照(P < 0.01),相邻老化处理间可溶性蛋白含量差异不显著(P > 0.05)。
|
图3 老化处理毛竹种子内可溶性蛋白的变化 Fig.3 Changes of soluble protein content in Ph. edulis seeds in artificial aging |
POD,SOD和CAT 是活性氧清除酶系统的重要保护酶,3 种酶协调作用能够有效抑制高浓度活性氧的积累,防止膜脂过氧化,与种子老化密切相关(杨淑慎等,2001; Goel et al., 2003; Mitrović et al., 2005)。
随着种子老化程度的加深,POD,SOD和CAT酶活性下降,老化处理后3 种酶活性均极显著低于对照(P < 0.01)。其中,SOD和CAT 酶活性变化与种子活力的变化趋势表现出高度一致性。在老化初期第2和4 天,SOD 活性变化快,处理间差异极显著(P < 0.01),CAT 活性差异显著(P < 0.05),老化6天后2 种酶活性相邻处理间差异不显著(P >0.05),说明老化6 天后清除活性氧、防止膜脂过氧化作用已经显著降低(表 2)。
|
|
POD 活性则与SOD和CAT 酶活性的变化不同,在老化早期第2 天就表现为急剧下降而后基本保持稳定状态(表 2)。这可能与杨淑慎等(2001)提出的植物中存在2 种POD 机制有关,而毛竹种子POD 活性在老化初期表达,恰与保护效应机制相符。
2.6 老化过程中内源激素的变化种子老化往往伴随着体内激素的变化,通常赤霉素类(GA)、CTK 及乙烯等诱发种子萌发的激素物质减少,脱落酸类(ABA)物质增加(Harrington,1973)。
随着毛竹种子老化程度的加深,种子内源GA3和IAA 含量降低,ABA 含量升高,GA3 /ABA 比值降低,且均极显著低于对照(P < 0.01)。老化种子内GA3和IAA,ABA 含量以及GA3 /ABA 方差分析和多重比较结果表现出一致性,表现为前期变化快,老化6 天以后趋于缓慢,与种子活力变化吻合。老化0 ~ 6 天相邻处理间GA3,IAA和ABA 含量及GA3 /ABA均表现出极显著差异(P < 0.01),老化6 ~12 天毛竹种子相邻处理间GA3和IAA 含量及GA3 /ABA则差异不显著(P > 0.05)(表 3)。
|
|
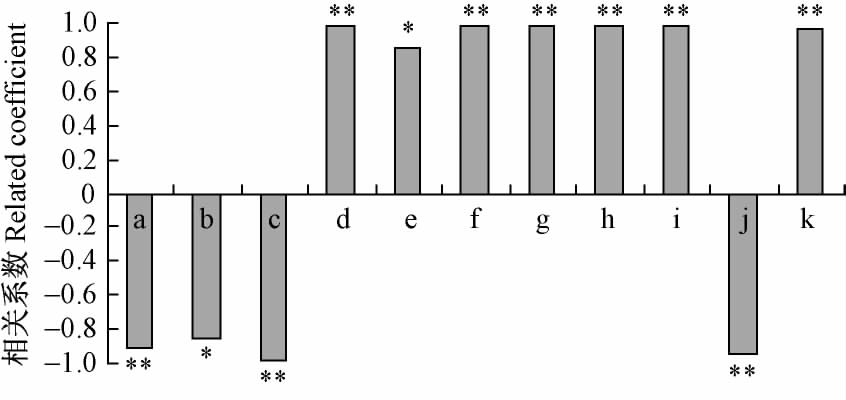
对测定的种子老化相关的11 个生理生化指标与种子活力指数进行相关分析(图 4),与种子活力密切相关的指标可以分为3 类: 第1 类包括SOD 活性、CAT 活性、可溶性蛋白和GA3,IAA,GA3 /ABA,与种子活力指数呈极显著正相关(P < 0.01),相关系数分别为0.983 8,0.990 0,0.980 8,0.978 3,0.988 2,0.969 6; 第2 类包括种子浸出液相对电导率、MDA和ABA,呈极显著负相关(P < 0.01),相关系数分别为0.907 6,0.990 0,0.948; 第3 类为种子浸出液可溶性糖含量、POD 活性,与种子活力指数呈显著正相关(P < 0.05),相关系数分别为0.861和0.849。其中,可溶性糖泄漏、POD 活性在种子老化初期反应灵敏,种子活力快速下降初期就已经发生显著变化,可用来作为毛竹种子劣变的敏感指标;而种子浸出液相对电导率、MDA 含量,CAT,SOD 活性以及内源激素IAA,ABA,GA3,GA3 /ABA 的变化与种子活力变化非常吻合,是判断毛竹种子劣变阶段的很好指标。
|
图4 人工老化毛竹种子生理生化指标与种子活力的相关分析 Fig.4 The correlation analysis on the vigor of Ph. edulis seeds and physiological and biochemical indexes in artificial aging a: 相对电导率Relative electrical conductivity; b: 可溶性糖含量Soluble sugar content; c: MDA 含量MDA content; d: SOD 活性SOD activity; e: POD 活性POD activity; f: CAT 溶性CAT activity; g: 可溶性蛋白含量Soluble protein content; h: GA3 含量GA3 content; i: IAA 含量IAA content; j: ABA 含量ABA content; k: GA3 /ABA. **1%显著水平; * 5%显著水平。**Represented significant at the level of 1%,* represented significant at the level of 5%. |
与毛竹种子的自然老化过程相比,人工加速老化大大缩短了老化持续期的时间,在老化第2 天持续期已经完成,并转向急速下降期,表现为随着老化时间的增加,毛竹种子发芽率、发芽指数和活力指数均呈先快速下降后缓慢下降趋势。在整个老化过程中,活力指数下降先于发芽率和发芽指数,种子活力指数变化与种子老化相关的11 个生理生化指标呈极显著或显著相关,能更好地表征人工老化毛竹种子活力变化的过程。
毛竹种子活力的变化均伴随着细胞膜透性和膜脂过氧化产物的变化。本研究中,老化种子活力的降低与膜脂过氧化产物损害细胞膜的完整性相关,表现为伴随膜脂过氧化而丙二醛含量增加,膜脂过氧化的中间产物自由基和最终产物MDA 严重损伤了生物膜的完整性,电解质外渗增多,这与大豆(Glycine max)(Sung,1996; 吴聚兰等,2011)、玉米(Zea May)(Zhang et al., 1995)、莲子(Nelumbinissemen)(汤学军等,1997)、大白菜(Brassica campestris)(唐祖君等,1999)等种子老化过程中研究结果一致。本文中种子活力指数与种子浸出液相对电导率、MDA 含量呈极显著负相关也印证了这一结果。随着老化程度的加深,保护酶系统也相应发生了变化。SOD和CAT 活性降低,不能有效清除自由基,种子内自由基的产生与清除失衡,膜脂发生过氧化而分解,膜透性增加,溶质外渗; 同时,反应过程中伴随着MDA 的产生,与蛋白质结合使酶钝化,又致使SOD和CAT 活性降低。如此恶性循环,导致膜脂过氧化程度加剧,细胞膜的完整性受损,最终导致毛竹种子活力的下降乃至丧失。
毛竹种子老化过程中,GA3,IAA 含量降低,ABA 含量增加,GA3 /ABA 比值下降,表现出的内源激素失衡也是种子劣变过程中伴随的生化反应或引起毛竹种子劣变的主要原因之一。种子活力与蛋白质的关系已成为当前种子研究工作的重点之一,特别是种子活力与贮藏蛋白、热激蛋白、泛肽和钙调蛋白等某些特定蛋白的关系密切(王文军等,2005)。可溶性糖的泄漏与种子活力相关性已有的研究结论不一致。目前认为,可溶性糖的泄漏还应该与在特定时间种子内总可溶性糖相联系,有关可溶性糖的泄漏与毛竹种子活力的关联性以及种子活力与蛋白质的关系有待于在毛竹种子劣变机制研究中深入开展。
| [1] |
蔡春菊, 高 健,牟少华. 2007.60Co γ辐射对毛竹种子活力及早期幼苗生长的影响.核农学报,21(5): 436-440.( 1) 1)
|
| [2] |
蔡春菊,刘 凤,高 健,等.2009.贮藏温度和种子含水量对毛竹种子生活力的影响.安徽农业大学学报,36(4): 607-611.( 1) 1)
|
| [3] |
蔡春菊,刘 凤,郭起荣,等. 2010.毛竹种子种质保存对含水量的响应. 江西农业大学学报,32(2): 312-317.( 1) 1)
|
| [4] |
曹帮华,蔡春菊. 2006.银杏种子后熟生理与内源激素变化的研究.林业科学,42(2): 32-37.( 1) 1)
|
| [5] |
郭永清,沈永宝,喻方圆,等. 2007.北美鹅掌楸种子老化过程中的生理生化变化.西部林业科学,39(3): 80-84.( 1) 1)
|
| [6] |
江泽慧. 2002.世界竹藤.沈阳: 辽宁科学技术出版社.( 1) 1)
|
| [7] |
李合生,孙群.2000.植物生理生化实验原理和技术.北京: 高等教育出版社,164-169.( 1) 1)
|
| [8] |
刘凤,曹帮华,蔡春菊. 2009. GA3提高毛竹种子活力的机理探索.西南林学院学报,29(1): 22-25.( 1) 1)
|
| [9] |
孙群,王建华,孙宝启.2007.种子活力的生理和遗传机理研究进展.中国农业科学,40(1): 48-53.( 1) 1)
|
| [10] |
汤学军,傅家瑞,黄上志,等.1996.决定种子寿命的生理机制研究进展.种子,(6): 29-32.( 1) 1)
|
| [11] |
汤学军,傅家瑞,黄上志,等.1997.人工老化对莲子活力及抗氧化能力的影响.中山大学学报:自然科学版,36(2):1-4.( 1) 1)
|
| [12] |
唐祖君,宋 明.1999.大白菜种子人工老代及劣变的生理生代分析.园艺学报,26(5):319-322.( 1) 1)
|
| [13] |
陶嘉龄,郑光华. 1991.种子活力.北京: 科学出版社,74-87.( 1) 1)
|
| [14] |
王文军,景新明.2005.种子蛋白质与蛋白质组的研究.植物学通报,22 (3): 257-266.( 1) 1)
|
| [15] |
王彦荣,刘友良,沈益新.2001.种子劣变的生理学研究进展综述.草地学报,9(8): 160-164.( 1) 1)
|
| [16] |
王彦荣,余 玲,刘友良,等. 2002.数种牧草种子劣变的生活力与膜透性的关系.草业学报,11(3): 85-91.( 1) 1)
|
| [17] |
吴聚兰,周小梅,范玲娟,等. 2011.人工老化对大豆种子活力和生理生化特性的影响.中国油料作物学报,33(6): 582-587.( 1) 1)
|
| [18] |
杨淑慎,高俊凤. 2001.活性氧、自由基与植物的衰老.西北植物学报,21(2): 215-220.( 2) 2)
|
| [19] |
杨永青,汪晓峰. 2004.种子活力与生物膜的研究现状.植物学通报,21(6): 641-648.( 1) 1)
|
| [20] |
张宪政,陈凤玉,王荣福.1994.植物生理学实验技术.沈阳: 辽宁技术出版社,212.( 1) 1)
|
| [21] |
周芳纯. 1998.竹林培育学.北京:中国林业出版社,124-126.( 1) 1)
|
| [22] |
邹琦. 2003.植物生理学实验指导.北京:中国农业出版社,129-130.( 1) 1)
|
| [23] |
Aiazzi M T,Arguello J A,Perez A,et al .1996. Deterioration in Atriplex cordobensis (Gansoger et Stuckert) seeds: natural and accelerated ageing. Seed Science and Technology,25(1): 147-155.( 1) 1)
|
| [24] |
Harrington J F.1973. Biochemical basis of seed longevity. Seed Science and Technology, 1: 453-461.( 1) 1)
|
| [25] |
Goel A, Goel A K, Sheoran I S.2003.Changes in oxidative stress enzymes during artificial ageing in cotton ( Gossypium hirsutum L.) seeds.Journal of Plant Physiology,160(9): 1093-1100.( 1) 1)
|
| [26] |
McDonald M B.1999.Seed deterioration: physiology,repair and assessment. Seed Science and Technology,27(1): 177-237.( 1) 1)
|
| [27] |
Mitrović A, Dučić T J, Liri I, et al . 2005.Changes in Chenopodium rubrum seeds with aging. Ann N Y Acad Sci, 1048(1): 505-508.( 1) 1)
|
| [28] |
Sung J M.1996. Lipid peroxidation and peroxide-scavenging in soybean seeds during aging. Physiologia Plantarum, 97(1): 85-89.( 1) 1)
|
| [29] |
Trawatha S E,TeKrony D M,Hildebrand D F.1995.Relationship of soybean seed quality to fatty acid and C6-aldehyde levels during storage.Crop Science,35(5): 1415-1422.( 1) 1)
|
| [30] |
Zhang M, Nakamaru Y, Tsuda S, et al . 1995. Enzymatic conversation of volatile metadolites in dry seeds during storage. Plant Cell Physiology, 36(1): 157-164.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

