文章信息
- 尹立伟, 池玉杰
- Yin Liwei, Chi Yujie
- 猴头菌菌株CB1的系统发育分析与木质素降解酶的检测
- Phylogenetic Analysis and Detection on the Major Ligninolytic Enzymes of Hericium erinaceum Strain CB 1
- 林业科学, 2013, 49(6): 129-134
- Scientia Silvae Sinicae, 2013, 49(6): 129-134.
- DOI: 10.11707/j.1001-7488.20130618
-
文章历史
- 收稿日期:2012-09-06
- 修回日期:2013-01-05
-
作者相关文章
猴头菌(Hericium erinaceum)既是一种家喻户晓的珍贵食、药用真菌,又是一种木材白腐菌。猴头菌因其味香、肉嫩、鲜美可食,属中国传统的名贵菜肴之一。猴头菌性平味甘,利五脏、助消化、具滋补身体等营养功效,因此近年来在我国各地区已广泛栽培,其栽培料多是由一定比例的木屑辅以其他材料组成(冯改静等,2007)。研究猴头菌的木质素降解酶系统具有重要意义,可为研究其分解木质素酶系统的作用机制及其相关酶基因的表达等机制奠定基础,也可为进一步构建猴头菌的工程菌株提供参考依据。目前国内外对猴头菌的营养功效(Yim et al.,2007; 王晓玉等,2010; 彭瀛等,2012)、多糖提取(Zhang et al.,2007; 张安强,2006)、抗病机制及栽培特性(Siwulski et al.,2009; 李好,2010)等都有较多的研究,但对其木质素降解酶系统及其基因的研究还尚属空白。本研究首先对猴头菌菌株CB1进行了培养特性观察,对其ITS序列进行了扩增并与猴头菌属的5个种进行了基于ITS序列的系统发育分析。明确了该菌株CB1的分类地位后,采用低氮天冬酰胺-琥珀酸(LNAS)培养基,分别在没有Mn2+、含有Mn2+及添加2,6-DMP和木屑2种底物的情况下,对其进行了木质素降解酶系统的检测。旨在弄清猴头菌菌株CB1与猴头菌属其他菌株间的亲缘关系以及猴头菌分解木质素的主要酶系与培养基的成分及其酶作用底物等之间的关系。
1 材料与方法 1.1 菌种来源猴头菌菌株CB1(H. erinaceum CB1)自长白山野生猴头菌分离得到,保存在东北林业大学森林病虫病理实验室。
1.2 培养基马铃薯加富培养基(L-1): 马铃薯200 g,葡萄糖20 g,蛋白胨0.5%,琼脂20 g,加蒸馏水定容至1 000 mL,pH值自然。
产酶基础培养基(L-1): 低氮天冬酰胺-琥珀酸培养基(LNAS,low nitrogen asparagine succinicacid)(Kirk et al.,1978; Hatakka et al.,1983),是一种营养成分有限的基础产酶培养基。
1.3 培养特性的试验与观察将8 mm2PDA加富培养基斜面上的菌种接种到同样培养基的平板培养皿中心,6个重复,然后将接种后的培养皿放在28 ℃恒温培养箱中培养13~15天,在此期间每3天观察一次菌落的生长速度、颜色、结构与质地等宏观培养特性。在13~15天时将灭菌的载玻片45°倾斜插入培养基内,待菌丝生长一夜后取出,盖上盖片在显微镜上观察菌丝的类型与分隔情况、厚垣孢子的有无等微观培养特性(池玉杰,2002)。
1.4 猴头菌的ITS序列扩增与系统发育分析刮取在PDA加富平板培养基上生长的猴头菌菌落边缘新鲜菌丝,利用TIANGEN公司的DNAquick快捷型植物基因组非离心柱型试剂盒提取猴头菌基因组DNA。使用琼脂糖凝胶电泳和核酸检测仪分别检测猴头菌DNA的纯度和大小,将DNA稀释至终浓度为100 ng·μL-1进行PCR反应。采用真菌通用引物对SR6R(5’-AAGWAAAAGTCGTAACAAGG-3’)和LR1(5’-GGTTGGTTTCTTTTCCT-3’)扩增含有完整ITS1、5.8S、ITS2及部分18S和28S的rDNA序列的基因片段(陈凤毛,2007)。ITS-PCR扩增体系如下: 10×PCR Buffer5 μL,dNTP(2.5 mmol·L-1)4 μL,SR6R和LR1引物(10 μmol·L-1)各1 μL,rTaq DNA聚合酶(5 U·μL)0.25 μL,模板DNA 1 μL,用蒸馏水补足至50 μL。PCR扩增参数如下: 94 ℃ 5 min,94 ℃ 30 s,55 ℃45 s,72 ℃ 2 min,共30个循环,72 ℃10 min,终止在4 ℃。PCR产物经1.2%琼脂糖凝胶电泳检测。将目的PCR产物回收测序获得ITS区序列,将获得的猴头菌CB1的ITS序列提交到NCBI的GenBank中,与相似菌种的ITS序列进行BLAST比对,使用ClustalX1.83软件对相似序列进行分析,运用软件MEGA 4.1中的NJ法构建系统发育树(Lu et al.,2002)。
1.5 产酶培养方式与酶活性测定方法产酶培养方式与酶活性测定方法均按照闫洪波(2009)进行。分别采用4种不同培养方式进行菌种培养: 1)LNAS培养基不含Mn2+,即矿物元素溶液中不添加MnSO4·H2O; 2)LNAS培养基含Mn2+(2.67×10-3 mmol·L-1),即矿物元素溶液中添加MnSO4·H2O; 3)LNAS 培养基含Mn2+(2.67×10-3mmol·L-1),并加入2 g大青杨(Populus ussuriensis)木屑为产酶底物; 4)LNAS 培养基含Mn2+(2.67×10-3 mmol·L-1),并加入10 mmol·L-1 2,6-二甲氧基苯酚(2,6-DMP)0.1 mL为产酶底物。每项试验设3个重复。培养至3,5,7,9,11,13,15,17,19,21天提取胞外酶液,测定木质素降解酶酶活性并绘制产酶活性时间曲线图,利用PASS软件数据处理系统对4种不同的培养液产生MnP、漆酶和LiP的活性进行方差分析。
2 结果与分析 2.1 猴头菌菌株CB1的培养特性菌落生长较慢,2周时生长半径4.0 cm,接近生长到平板边缘。生长新区不均匀。菌落白色,略呈微黄色,毛毡状,表面有很多不规则的球形隆起,气生菌丝体羊毛状。平板背面自菌落中心逐渐由白色转变为黄色、黄褐色,变色逐渐扩大并加深。随着培养时间的延长,从培养基的正面也可明显看到菌丝颜色变黄。培养物没有明显的气味(图 1A,B)。一些营养菌丝深入到培养基中。气生菌丝透明,薄壁,时常分枝,锁状联合很多,也有简单分隔,直径1.5~5.0 μm。厚垣孢子较多,无色,内部原生质稠密,卵形至椭圆形,大小为(3.5~10.0)μm×(5.0~13.5)μm(图 1C,D)。
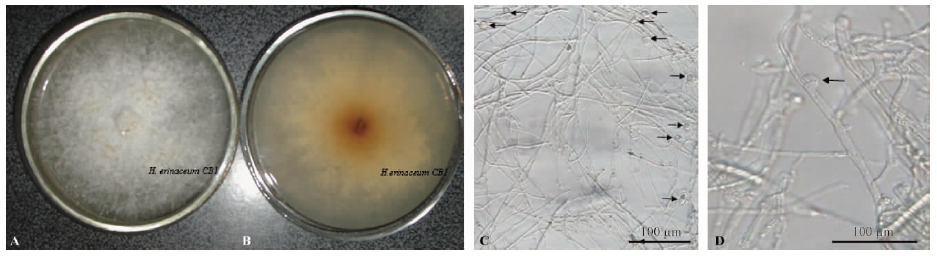 |
图 1 猴头菌菌株CB1菌落的宏观形态和显微形态特征
Fig. 1 The appearance and microscopic characteristics of H. erinaceum CB1
A. 菌株CB1 菌落正面Colonies positive of strain CB1; B. 菌株CB1 菌落反面Colonies negative of strain CB1; C. 图中箭头所示菌株CB1 的厚垣孢子The arrow points to the chlamydospores of strain CB1; D. 图中箭头所示菌株CB1 菌丝上的锁状联合The arrow points to the clamp connections in mycelia of strain CB1. |
猴头菌菌株CB1 ITS区域的PCR产物测序得到了802 bp的核苷酸序列,将该序列提交到GenBank(NCBI accession number: GU584100)的鉴定结果表明,1~63 bp为18S rDNA,64~242 bp为ITS1序列,243~392 bp为5.8S rDNA序列,393~745 bp为ITS2序列,746~802 bp为28S序列。在GenBank中,菌株CB1与99个菌株的BLAST比对结果表明,菌株CB1与来自中国广东的H. erinaceum He-1菌株亲缘关系最为密切,二者提交的ITS序列覆盖率(query coverage)为100%,相似性达到99%。与其他54个H. erinaceum的不同菌株,提交的ITS序列覆盖率为75%~78%,相似性为98%~99%。与7个冷杉猴头菌(H. abietis)菌株序列覆盖率为61%~77%,相似性为97%~98%。与6个高山猴头菌(H. alpestre)菌株序列覆盖率为60%~72%,相似性为97%~99%。与3个美国猴头菌(H. americanum)菌株序列覆盖率为59%~67%,相似性为98%~99%。与6个珊瑚状猴头菌(H. coralloides)菌株序列覆盖率为67%~78%,相似性为93%~98%。与1个猴头菌科的Creolophus cirrhatus菌株序列覆盖率为78%,相似性为98%。从100个菌株中选取了17个猴头菌属相关菌株,另外选择了1个松杉灵芝(Ganoderma tsugae ATCC64795)菌株,按照NJ聚类法进行菌株间遗传距离分析,构建的系统发育树见图 2。从图 2可以看出,图中的18个菌株遗传相似系数范围在0.003 82~0.387 01之间,分为2个类群。17个猴头菌属菌株聚成1个大类群,它们之间最大遗传相似系数仅为0.063 84,表明猴头菌属不同种间的遗传距离很接近。1个松杉灵芝菌株ATCC64795构成外类群(outgroup),该菌株与17个猴头菌属菌株的遗传相似系数为0.387 01,远大于猴头菌属菌株之间的遗传相似系数,表明该菌株与猴头菌属的遗传距离较远。
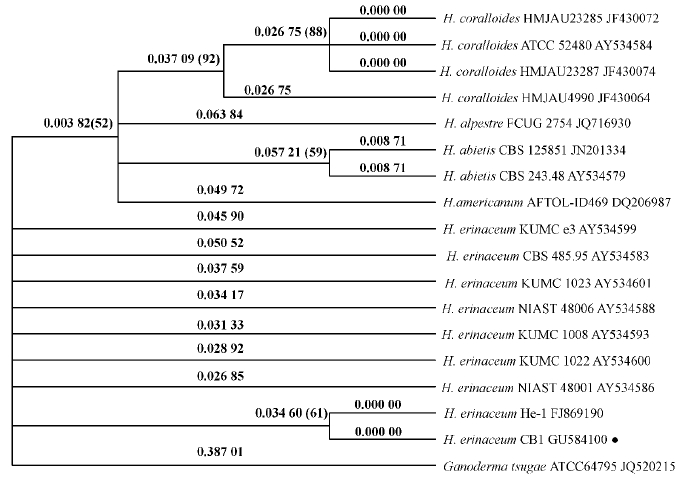 |
图 2 基于ITS序列的猴头菌CB1及猴头菌属NJ聚类法系统发育树
Fig. 2 Phylogenetic trees using NJ clustering method based on ITS sequence of H. erinaceum CB1 and Hericium
分支节点上的数字表示Bootstrap的遗传相似系数。Numbers above nodes are bootstrap genetic similarity coefficients. |
猴头菌菌株CB1在21天的培养过程中,经以藜芦醇为底物的测定方法,在4种不同的培养方式中于310 nm处均未检测到LiP的活性。在培养方式1中,提取的胞外酶液未检测到MnP的活性,漆酶的活性在第9天达到最大分泌量,酶活性仅为2.16 U·L-1; 在培养方式2中,检测胞外酶液有MnP的酶活性变化,但酶活性很低,15天酶活性达到分泌高峰,最大酶活性仅为3.23 U·L-1,漆酶在9天时达最大分泌量,酶活性为2.41 U·L-1。对比2种培养方式1,2的检测结果表明,Mn2+作为诱导条件是猴头菌产生MnP的必要因子,在诱导MnP的产生过程中起着关键作用,而漆酶的产生不受Mn2+的限制。在培养方式3中,提取的胞外酶液检测到MnP的酶活性变化,MnP在13天酶活性达到最大分泌量,酶活性为45.56 U·L-1,漆酶还是在第9天达到最大分泌量,酶活性为61.85 U·L-1; 在培养方式4中,提取的酶液也检测到MnP的活性变化,MnP在15天达到最大分泌量,酶活性为4.84 U·L-1,漆酶仍在9天达到最大分泌量,酶活性为5.74U·L-1。对比2种培养方式3,4 MnP和漆酶的结果表明,分别添加底物木屑和底物2,6-DMP都可以提高MnP和漆酶的分泌量,底物对于猴头菌木质素降解酶系统可产生诱导作用。MnP和漆酶以底物木屑的产生量明显要高于以底物2,6-DMP的产生量,其吸收峰分别在470和420 nm处峰值变化最明显,而MnP和漆酶的其他3种培养方式的吸光度和吸收峰的变化不明显。培养21天的猴头菌菌丝在4种不同的培养方式中产生MnP和漆酶的情况见图 3,图中标注其3组重复数值的误差线。
 |
图 3 猴头菌4种LNAS培养液中MnP和漆酶活性随时间的变化
Fig. 3 MnP and laccase activity of 4 kinds of different LNAS culture method
|
方差分析结果表明,MnP和漆酶的培养方式、培养时间的显著性水平Sig.值=0.000都小于0.05,表明不同的培养方式、不同的培养时间MnP和漆酶的酶活性差异都很显著(表 1)。MnP和漆酶的培养方式3与1的均值差值最大。在培养方式3中,随着时间的变化,MnP在15天的均值与3天的均值差值最大为154.81; 漆酶在9天的均值与3天的均值差值最大为263.238。
|
|
对猴头菌菌株CB1进行的培养特性研究结果表明,菌株的宏观培养特性与猴头菌子实体的颜色和形态非常相似。微观培养特性表明菌株能产生较多的厚垣孢子,厚垣孢子是一种无性孢子,猴头菌能产生厚垣孢子的特性增强了菌株在自然界中的生存与繁殖能力,其无性繁殖是有意义的。过去的真菌分类学教材上常提到“担子菌的无性繁殖时,除少数种类进行无性繁殖外,而大多数担子菌在自然条件下不进行无性繁殖”(邵力平等,1984),但是近年来对大型多孔菌、伞菌较细致的培养特性研究表明,很多多孔菌与伞菌都会产生厚垣孢子、分生节孢子等无性孢子,这种无性繁殖也占据了其生活史的一个阶段,对其在自然界中的生存与繁殖能力都具有重要意义。
王俊等(2011)对中国猴头菌属的真菌进行了基于ITS序列的系统发育分析,将中国的猴头菌属分为猴头菌、冷杉猴头菌和珊瑚状猴头菌3个种。Park等(2004)对于7种猴头菌属真菌冷杉猴头菌、美国猴头菌、高山猴头菌、珊瑚状猴头菌、猴头菌与H. erinaceum、假猴头菌(H. laciniatum),进行了基于rDNA-ITS序列的系统发育分析研究,结果表明基于ITS1与ITS2序列的系统发育树能确切地将猴头菌属的不同种类与菌株区分开来。但是,假猴头菌为珊瑚状猴头菌的同物异名,猴头菌与H. erinaceum 也是同物异名。因此,Park等(2004)文中的7种猴头菌属真菌实际上为5个种。本研究对包括猴头菌菌株CB1在内的5种猴头菌属的17个菌株进行基于ITS序列的系统发育分析,其中菌株H. coralloides ATCC 52480在Park等(2004)文中作为H. laciniatum ATCC 52480,而菌株H. erinaceum CBS 485.95作为H. erinaceus CBS 485.95,表明猴头菌菌株CB1与来自中国广东的猴头菌菌株亲缘关系最近; 猴头菌的多个菌株与冷杉猴头菌的亲缘关系较近,而与珊瑚状猴头菌的亲缘关系较远。总的来看,这5种猴头菌属真菌的亲缘关系都较近。
对猴头菌菌株CB1进行了主要木质素降解酶系统检测的结果表明,猴头菌可同时产生MnP和漆酶。猴头菌MnP和漆酶的活性变化是有规律可循的。在4种不同培养液中,MnP都是在3天后可检测到酶活性,酶活性逐渐地提升,第13~15天时达到最高量,之后酶活性又迅速下降,17天后酶活性会很低。在4种不同培养液中,漆酶也都是在3天之后可检测到酶活性,酶活性迅速上升,第9~11天时达到最高量,之后酶活性又迅速下降,17天后酶活性会很低。通过MnP和漆酶酶活性的检测,同时获得了木质素降解酶的产生与培养基的成分及其酶作用底物等条件的关系。分析猴头菌4种培养方式的酶活性,结果表明,Mn2+作为诱导条件是猴头菌产生MnP的必要因子,而漆酶的产生则不受诱导条件的限制,这与尹立伟等(2010)对灰树花(Grifola frondosa)的研究结果一致。在培养方式3和4内分别添加了酶作用的底物木屑和2,6-DMP,提高了MnP和漆酶的分泌产量,结果表明不同的底物对于培养过程中酶的产生也有影响,本研究发现猴头菌添加底物木屑比添加底物2,6-DMP的菌丝生长明显速度快、生物量高,MnP和漆酶的产量也高得多,而添加底物2,6-DMP比不添加底物的菌丝生长没有明显的区别,如2,6-DMP的浓度高到一定程度时对猴头菌的菌丝生长还具有抑制作用,也阻碍了酶的分泌量较多地上调。由于能产生MnP和漆酶,因此猴头菌具有降解木质素成分的能力。
对菌株CB1主要木质素降解酶系统的检测,4种培养方式均未检测到LiP的活性,表明CB1不产生LiP,但并不表明猴头菌没有LiP基因,这还有待后续试验进一步研究。
| [1] |
陈凤毛.2007.真菌ITS区序列结构及其应用.林业科技开发, 21(2): 5-7.( 1) 1)
|
| [2] |
池玉杰.2002.10种针阔叶树上常见的木材腐朽菌的培养特性.菌物系统, 21(1): 116-119.( 1) 1)
|
| [3] |
冯改静,李守勉, 李明,等.2007.不同碳氮比栽培料对猴头菌菌丝及子实体生长的影响.华北农学报, 22 (增刊): 13 1-135.( 1) 1)
|
| [4] |
李好.2010.富硒猴头栽培及其药理活性初探.合肥: 安徽农业大学硕士学位论文.( 1) 1)
|
| [5] |
彭瀛,宋晓琳,沈明花. 2012.猴头菌多糖对小鼠H22肝癌移植瘤的抑制作用.食品科学,33 (9): 244-246.( 1) 1)
|
| [6] |
邵力平, 沈瑞祥, 张素轩,等.1984.真菌分类学.北京: 中国林业出版社, 158.( 1) 1)
|
| [7] |
王俊,图力古尔,高兴喜.2011.中国猴头菌属真菌分子系统学研究.中国食用菌,30 (4): 51-53, 60.( 1) 1)
|
| [8] |
王晓玉, 蒋秋燕, 凌沛学,等.2010.猴头菌活性成分及药理作用研究进展.中国生化药物杂志, 31(1): 70-72.( 1) 1)
|
| [9] |
闫洪波. 2009.偏肿拟栓菌锰过氧化物酶cDNA基因克隆及在毕赤酵母中的表达.哈尔滨: 东北林业大学博士学位论文.( 1) 1)
|
| [10] |
尹立伟, 池玉杰,王雪童.2010.灰树花迁西菌株的系统发育分析和主要木质素降解酶的测定.林业科学研究, 23(4): 574-580.( 1) 1)
|
| [11] |
张安强. 2006.猴头菌子实体多糖的分离纯化、结构鉴定、结构修饰和生物活性研究.南京: 南京农业大学博士学位论文.( 1) 1)
|
| [12] | Eggert C,Temp U, Eriksson K E.1996.The ligninolytic system of the white-rot fungus Pycnoporus cinnabarinus: purification and characterization of the laccase.Applied and Environmental Microbiology,62(4): 1151-1158. |
| [13] |
Hatakka A, Uusi-Rauva A K.1983.Degradation of 14C-labelled poplar wood lignin by selected white-rot fungi.Eur J Appl Microbiol Biotechnol, 17(4): 235-242.( 1) 1)
|
| [14] |
Kirk T K,Schultz E,Conors W J, et al.1978.Influence of culture parameters on lignin metabolism by Phanerochaete chrysosporium.Arch Microbiol, 117(3): 277-285.( 1) 1)
|
| [15] |
Lu L,Li J,Cang Y.2002.PCR-based sensitive detection of medicinal fungi Hericium species from ribosomal internal transcribed spacer (ITS) sequences.Biol Pharm Bull, 25(8): 975-980.( 1) 1)
|
| [16] |
Park H K, Ko H G,Kim S H,et al.2004.Molecular identification of Asian isolates of medicinal mushroom Hericium erinaceum by phylogenetic analysis of nuclear ITS rDNA.J Microbiol Biotechnol, 14(4): 816-821.( 3) 3)
|
| [17] |
Siwulski M,Sobieralski K,Wojniowicz M.2009.Comparison of mycelium growth and yielding of selected strains of Hericium erinaceus (Bull. Fr.) Pers.on sawdust substrates with the glucose addition. Herba Polonica,55(3): 267-272.( 1) 1)
|
| [18] | Tien M,Kirk T K.1988.Lignin peroxidase of Phanerochaete chrysosporium. Methods in Enzymology, 161: 238-249. |
| [19] | Wariishi H,Valli K,Gold M H.1992.Manganese (II) oxidation by manganese peroxidase from the basidiomycete Phanerochaete chrysosporium Kinetic mechanism and role of chelators.Journal of Biological Chemistry, 267 (33): 23688-23695. |
| [20] |
Yim M H,Shin J W,Son J Y,et al.2007.Soluble components of Hericium erinaceum induce NK cell activation via production of interleukin-12 in mice splenocytes.Acta Pharmacol Sin, 28( 6): 901-907.( 1) 1)
|
| [21] |
Zhang A, Sun P, Zhang J, et al. 2007. Structural investigation of a novel fucoglucogalactan islated from the fruiting bodies of the fungus Hericum erinaceus. Carbohydr Res, 104(2): 451-456.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

