文章信息
- 杨明秀, 宋瑞清
- Yang Mingxiu, Song Ruiqing
- 中国金黄壳囊孢菌的致病性分化及遗传多样性
- Pathogenic Differentiation and Genetic Diversity of Cytospora chrysosperma in China
- 林业科学, 2013, 49(6): 115-121
- Scientia Silvae Sinicae, 2013, 49(6): 115-121.
- DOI: 10.11707/j.1001-7488.20130616
-
文章历史
- 收稿日期:2012-08-21
- 修回日期:2012-12-13
-
作者相关文章
2. 东北农业大学农学院 哈尔滨 150030
2. Agricultural School, Northeast Agricultural University Harbin 150030
杨树烂皮病是杨树的主要病害之一,病原菌为金黄壳囊孢菌(Cytospora chrysosperma),有性型为污黑腐皮壳菌(Valsa sordida)。杨树烂皮病在国内杨树栽植区内发生十分普遍,主要分布于东北、西北、华北,以东北地区尤为严重(杨春杰等,2010)。随着杨树抗病品种的大面积推广,定向选择压力导致金黄壳囊孢菌群体遗传结构分化,出现新的致病型和基因型(崔磊等,2005; 张星耀等,2007)。因此,研究各地区的杨树烂皮病菌的遗传多样性,对杨树的遗传改良具有重要的理论指导意义。
1 材料与方法 1.1 菌株来源46个金黄壳囊孢菌供试菌株由中国林业科学研究院森林生态环境与保护研究所中国林业微生物菌株保藏管理中心提供。菌株来源涵盖国内11个省(区)31个市县(表 1)。
|
|
剪取2年生银中杨枝条,水培15天后在距根部1/3处烫成闭口伤,将培养5天的金黄囊壳孢菌丝块(1 cm × 0.5 cm,PDA平板培养)贴接在烫伤处,用蘸灭菌水的脱脂棉包裹,再用保鲜膜保湿。每菌株接种30个枝条,置于室温25 ℃下培养(赵仕光等,1999)。接种后第3天取下脱脂棉,分别于接种后7,10,13,17天调查发病情况,以确定不同菌株的潜育期,30天调查接种杨树枝条子实体产生情况和病害等级。病害分级标准(张忠华等,2005)见表 2。统计后用非加权平均连锁法(UPGMA)进行聚类分析(Vidal et al.,1999),并构建系统进化图。
|
|
RAPD分子标记是以DNA多态性为基础的遗传标记,国内外已在黄瓜枯萎病(Fusarium oxysporum)(Vakalounakis et al.,1999)、扁豆枯萎病(Fusarium oxysporum f. sp. lentis)(Lakhdar et al.,2004)、咖啡枯萎病(Gibberella xylarioides)(Adugna et al.,2005)、木豆枯萎病(Fusarium udum)(Mesapogu et al.,2012)、草莓炭疽病(Glomerella cingulata)(Denoyes-Rothan et al.,2003)、松干锈病(Cronartium spp.)(田呈明等,2000)、葡萄灰霉病(Botrytis cinerea)(陈林凤等,2009)、大豆疫霉根腐病(Phytophthora soja)(陈宏宇等,2006; Meng et al.,1999)等多种植物病原菌遗传多样性的研究上应用并获得成功。本研究拟通过基因组DNA多态性的分析来检测金黄壳囊孢菌菌株间的遗传分化。
1.3.1 DNA提取DNA提取参照肖智祥等(2009)和Darine等(2007)的方法,并在此基础上稍加改进。取100 "150 mg菌丝,加液氮研磨至粉状,加到装有1 mL预热提取液[2%(W/V)CTAB; 100mmol·L-1 Tris-HCl,pH8.0; 20 mmol·L-1EDTA,pH8.0; 1.4 mol·L-1NaCl]的1.5 mL离心管中,振荡混匀后于65 ℃水浴60 min(每10 min 混匀1次),12 000 r·min-1下离心10 min,取上清液加入等体积的酚: 氯仿: 异戊醇(25: 24: 1)抽提,12 000 g离心10 min,取上清液加入加氯仿: 异戊醇(24: 1)抽提,12 000 g离心10 min,取上清液加入1.5倍体积的异丙醇和1/10体积的NaAC 混合,-20 ℃静置2 h沉淀DNA,然后12 000 g下离心10 min,沉淀用70%的乙醇和无水乙醇依次漂洗后,室温晾干,加50 μL TE溶解DNA,20 ℃保存备用。
1.3.2 PCR扩增和反应体系扩增反应体系:10 ng DNA模板,10 μmol·L-1随机引物,10 μLPremix Taq Version 2.0(购自TaKaRa),加超纯水至20 μL。
反应程序: 94 ℃ 5 min,然后94 ℃ 1 min,退火温度1 min,72 ℃2 min,反应35个循环,最后72 ℃延伸10 min。扩增产物在含有溴化乙锭(0.5μg·mL-1)的1.5%琼脂糖胶中电泳检测分析。退火温度是PCR反应条件中最关键的一步,设置40,41,42,43,44,45 ℃6个梯度,选取最适退火温度(吴燕民等,2000; Ye et al.,1996)。
1.3.3 数据分析对电泳谱带进行记录,同一位置有带的记为1,无带的记为0,统计各菌株的扩增条带数,用NTSYS( Version 2.10)软件进行聚类分析(Bayraktar et al.,2009),并构建系统进化图。
2 结果与分析 2.1 致病性测定结果46个金黄壳囊孢菌株分别接种银中杨枝条后,病情指数最小为6.67,最大为24.67(表 1)。为了更细致地区分各菌株的致病性,在参照张忠华等(2005)的病害分级标准基础上,对病害严重度分级标准进行了细化: 1级病情指数为0,2级病情指数为<10,3级病情指数为10~20,4级病情指数为>20。接种结果表明: 致病性较弱(病害等级为2级)的菌株有7株,包括杨树上的C11(陕西绥德)和C12(辽宁新民),桂花上的C33(四川成都温江)、C34(四川成都郫县)、C35(四川资阳),以及垂柳上的C36和C37(辽宁新民)。致病性较强(病害等级为4级)的菌株有9株,毛白杨上的C1、C2(北京)和C26(陕西杨凌),山杨上的C3(内蒙古呼和浩特)、银白杨上的C10(北京平谷)、银中杨上的C14(内蒙古加格达齐),小叶杨×黑杨上的C13(内蒙古加格达齐)和小叶杨×青杨上的C15(黑龙江大庆),青杨上的C30(内蒙古乌兰察布)。
46个菌株中有23个菌株(C1、C2、C3、C4、C5、C7、C8、C9、C10、C13、C14、C15、C16、C20、C25、C26、C27、C30、C38、C42、C44、C45、C46)产生子实体。
潜育期试验结果显示: 接种后7天发病的有28个菌株(C1、C2、C3、C4、C5、C6、C7、C10、C13、C14、C15、C16、C17、C20、C21、C23、C24、C25、C27、C28、C29、C30、C31、C37、C38、C43、C44和C45),接种后10天发病的有6个菌株(C8、C9、C19、C22、C39和C40),接种后13天发病的有6个菌株(C18、C26、C32、C41、C42、C46); 接种后17天发病的有6个菌株(C11、C12、C33、C34、C35和C36)。
致病性聚类分析结果表明,46个菌株分为2大类群,第1大类群又分为5个小类群,第1小类群包括3个北京菌株,4个内蒙古菌株,黑龙江和陕西各1个菌株; 第2小类群包括内蒙古、北京、甘肃、青海和陕西各1个菌株; 第3小类群包括新疆、黑龙江、甘肃各2个菌株; 第4小类群包括四川、山东、内蒙古各2个菌株,陕西、新疆、黑龙江、甘肃各1个菌株; 第5小类群包括甘肃、青海各2个菌株、吉林、山东、内蒙古、黑龙江、四川、辽宁各1个菌株。第2大类群包括3个四川菌株和2个辽宁菌株和1个陕西菌株(图 1)。
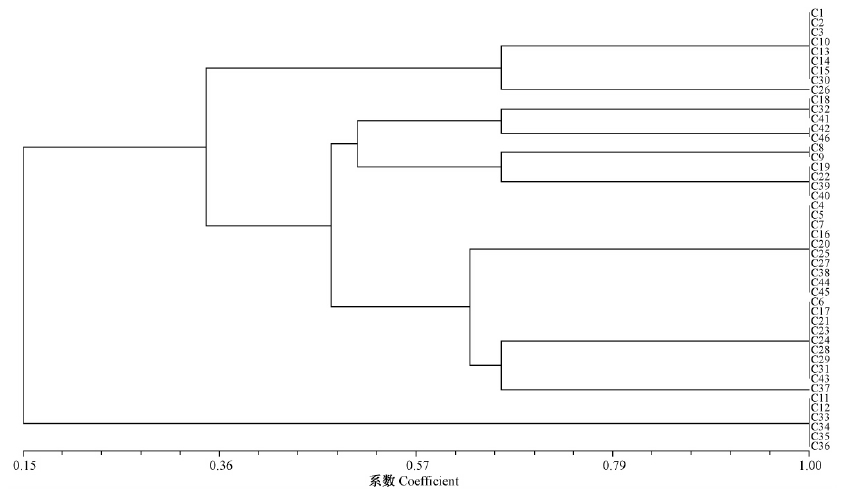 |
图 1 金黄壳囊孢菌46个菌株致病性聚类分析
Fig. 1 Clustering analysis of pathogenicity for 46 Cytospora chrysosperma strains
|
从试验结果可以看出,金黄壳囊孢菌的致病性与其寄主种类有一定的关系,如致病性较强的菌株均是由杨树(毛白杨、山杨、银白杨、小叶杨×黑杨、银中杨、小叶杨×青杨、青杨)寄主上分离得到的,致病性较弱的菌株大部分是由非杨树(桂花、垂柳)寄主上分离得到的。金黄壳囊孢菌的致病性与地理来源无明显关系,6个内蒙古菌株分属4个小类群,如C3和C29菌株间的相似性为0.333,新疆的4个菌株分属3个小类群,如C7和C8菌株间的相似性为0.667,黑龙江的5个菌株分属4个小类群,如C15和C16菌株间致病性的相似性为0.670(图 1)。
选取40,41,42,43,44,45 ℃6个梯度的温度对8个DNA模板进行退火温度的筛选,结果见图 2。退火温度在40,41,42 ℃时,条带亮度微弱,退火温度在43 ℃时,条带亮度增强,但条带数不多,退火温度在度为44 ℃时,8个菌株具有较多且较亮条带,退火温度为45 ℃时,部分条带较亮,但是仍有部分条带较暗或模糊。因此44 ℃为最佳退火温度。选取北京、内蒙古、四川、新疆、黑龙江、甘肃、山东和青海各1个菌株采用70个随机引物进行PCR扩增,根据电泳结果选出9个重复性好、特异性强且谱带清楚的随机引物(表 3)。
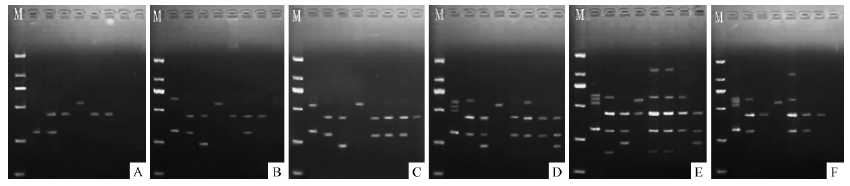 |
图 2 不同退火温度下DNA的扩增图谱
Fig. 2 RAPD patterns under different annealing temperature
A. 40 ℃ ; B. 41 ℃ ; C. 42 ℃ ; D. 43 ℃ ; E. 44 ℃ ; F. 45 ℃ |
|
|
用9个随机引物对46个菌株进行RAPD扩增,产生的54条DNA带均呈现多态性,多态性带数占总带数的100%。扩增带数为3~8条。扩增片段在400"1 800 kb之间(图 3)。试验表明中国金黄壳囊孢菌具有丰富的遗传多样性。
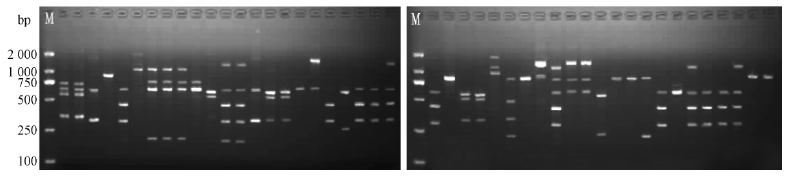 |
图 3 引物Cy-5对46种金黄壳囊孢菌DNA的扩增电泳图谱
Fig. 3 RAPD patterns of 46 C. chrysosperma strains produced by primer Cy-5
|
本研究选取的46个金黄壳囊孢菌来自国内11个省(区)31个市(县),涵盖了全国杨树烂皮病发生及金黄壳囊孢菌株存在的大部分地区,在树种及地理分布上均具有一定的代表性,基本上反映了我国杨树烂皮病发生的实际情况。
供试菌株在寄主上的致病性聚类分析树状图与其各遗传距离划分的RAPD指纹组之间的相关性分析表明,金黄壳囊孢菌的致病性与地理来源无明显关系。致病性测定的接种植物采用的是银中杨,这是因为银中杨对烂皮病抗性较强,能将金黄壳囊孢菌不同菌株的致病性强弱分出等级。测定结果表明,从杨树上分离得到的菌株致病性强,而从桂花、旱柳等其他寄主植物上分离的致病性弱。这可能与致病性测定采用的接种植物为杨树有一定关系,有待进一步试验证明。
金黄壳囊孢菌的遗传多样性与地理来源有一定的联系,各省份的菌株基本被分到一个大类群中,如黑龙江的2个菌株C15和C16菌株间遗传多样性存在较高的相似性0.940(图 4),但2菌株的致病性的相似性则较低为0.670(图 1)。说明病原菌的致病性与病菌本身的DNA遗传分化之间有较大差异,RAPD标记的DNA多态性与菌株的毒性多态性相关性并不明显。
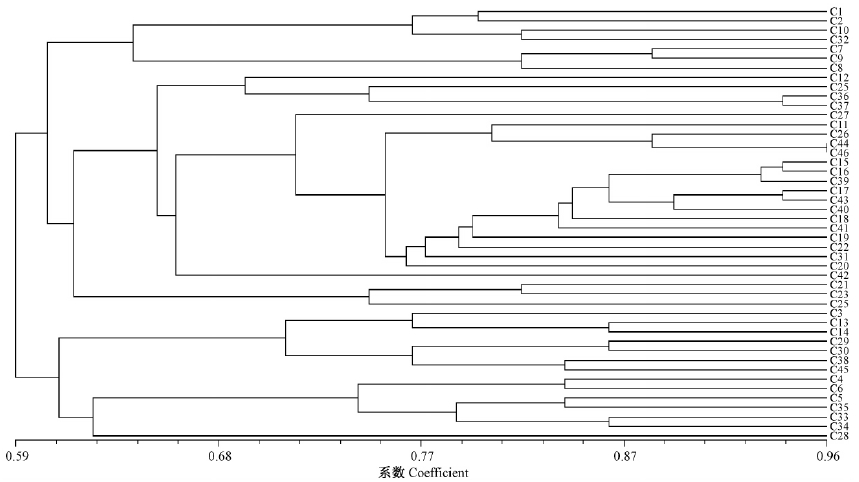 |
图 4 46 株不同地理来源金黄壳囊孢菌亲缘性聚类分析
Fig. 4 4 Clustering analysis of relationship for 46 C. chrysosperma strains in different geographic origin
|
xRAPD分析表明,金黄壳囊孢菌遗传多样性分组与供试菌株的地理来源呈较明显的相关性。所有来源的46个菌株分为2大类群: 第1类群包括北京、新疆、辽宁、陕西、吉林、青海、甘肃、黑龙江的全部菌株和山东2个菌株、内蒙古1个菌株,第2类群包括四川的全部菌株、内蒙古7个菌株和山东1个菌株。第1类群又可分为5个小类群,分别为北京类群、新疆类群、辽宁类群、甘肃青海混合类群和黑吉青陕甘混合类群,第2类群可分为2个小类群,分别为内蒙古类群和四川类群。遗传多样性研究结果表明,东北地区的金黄壳囊孢菌菌株聚为1个大类群,与张星耀等(2007)的研究结果一致,四川省与内蒙古自治区在地理位置上并不邻近,而遗传相似度较高,可能与2省间杨树引种有关。
RAPD分析是以基因组DNA随机位点的差异为基础,而致病性则与致病基因编码的基因组相联系(包括多个致病基因及同一致病基因的不同位点),并受寄主基因组的强烈选择作用。采用RAPD技术快速有效地检测出了国内金黄壳囊孢菌基因组DNA的变化,为快速监测金黄壳囊孢菌的种群遗传变异提供了方便有效的手段,并对分析种内的亲缘关系以及病害发生与流行等都具有重要的指导意义。
| [1] |
陈林凤. 2009. 新疆灰霉菌遗传多样性研究及三种生防菌对灰霉菌的拮抗作用初探. 乌鲁木齐:新疆农业大学硕士学位论文.( 1) 1)
|
| [2] |
陈宏宇,文景芝. 2006.大豆疫霉菌遗传多样性的RAPD分析.中国油料作物学报, 28(3): 330-334.( 1) 1)
|
| [3] |
崔磊. 2005. 杨树品种抗烂皮病相关基因的RAPD分析. 哈尔滨: 东北林业大学硕士学位论文.( 1) 1)
|
| [4] |
田呈明,康振生,李振岐,等. 2000.落叶松-杨栅锈菌遗传分化的RAPD分析. 林业科学,36(9): 54-58.( 1) 1)
|
| [5] |
吴燕民,裴东,奚声珂,等. 2000. 运用RAPD对核桃属种间亲缘关系的研究. 园艺学报, 27(1): 17-22.( 1) 1)
|
| [6] |
肖智祥,白冠章,张玲,等. 2009. 改进的CTAB法提取胡杨(Populus euphratica)总DNA. 塔里木大学学报, 21(2):29-32.( 1) 1)
|
| [7] |
杨春杰,王云华. 2010.杨树烂皮病药剂筛选及防治技术. 林业科技,35(3): 27-29.( 1) 1)
|
| [8] |
赵仕光,朱玮,岳红艳.1999. 溃疡病菌在杨树树皮组织中的扩展和对寄主细胞超微结构的影响. 林业科学研究, 12(2): 118-126.( 1) 1)
|
| [9] |
张星耀,陈海燕,梁军,等. 2007. 金黄壳囊孢菌(Cytospora chrysosperma)的培养性状和营养体亲和性. 西北农林科技大学学报,35(3): 99-105.( 2) 2)
|
| [10] |
张忠华,董希文,闫敦良,等. 2005. 25种杨树感发烂皮病程度的研究. 防护林科技,67(4): 28-29.( 2) 2)
|
| [11] |
Adugna G, Hindorf H, Steiner U, et al.2005. Genetic diversity in the coffee wilt pathogen (Gibberella xylarioides) populations: Differentiation by host specialization and RAPD analysis. Journal of Plant Diseases and Protection, 112 (2): 134-145.( 1) 1)
|
| [12] |
Bayraktar H, Dolar F S. 2009. Genetic diversity of wilt and root rot pathogens of chickpea, as assessed by RAPD and ISSR. Turk J Agric,33: 1-10.( 1) 1)
|
| [13] |
Denoyes-Rothan B, Guérin G, Délye C, et al. 2003. Genetic diversity and pathogenic variability among isolates of Colletotrichum species from Strawberry. Phytopathology, 93(2): 219-228.( 1) 1)
|
| [14] |
Darine T, Allagui M B, Rouaissi M, et al. 2007. Pathogenicity and RAPD analysis of Phytophthora nicotianae pathogenic to pepper in Tunisia. Physiological and Molecular Plant Pathology,70:142-148.( 1) 1)
|
| [15] |
Lakhdar B, Michael B, Fortas Z, et al. 2004. Pathogenic and genetic characterization of Algerian isolates of Fusarium oxysporum f. sp. lentis by RAPD and AFLP analysis. African Journal of Biotechnology, 3 (1): 25-31. ( 1) 1)
|
| [16] |
Meng X Q, Shoemaker R C, Yang X B. 1999. Analysis of pathogenicity and genetic variation among Phytophthora sojae isolates using RAPD. Mycological Research, 103(2):173-178.( 1) 1)
|
| [17] |
Mesapogu S, Bakshi A, Babu B K, et al. 2012. Genetic diversity and pathogenic variability among Indian isolates of Fusarium udum infecting pigeonpea (Cajanus cajan (L.) Millsp.). International Research Journal of Agricultural Science and Soil Science, 2(1): 51-57.( 1) 1)
|
| [18] |
Vakalounakis D J, Fragkiadakis G A. 1999. Genetic diversity of Fusarium oxysporum isolates from cucumber: Differentiation by pathogenicity, vegetative compatibility,and RAPD fingerprinting. Phytopathology, 89(2):161-168.( 1) 1)
|
| [19] |
Vidal J R, Moreno S, Gogorcena Y, et al. 1999. On the genetic relationships and origins of six grape cultivar of Galicia (Spain) using RAPD markers. Amer of Enology and Viticulture, 50(1):69-75.( 1) 1)
|
| [20] |
Ye G N, Hemmat M, Lodhi M A, et al.1996. Long primers for RAPD mapping and fingerprinting of grape and pear. Biotechniques, 20(3): 368-371.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

