文章信息
- 薛会英, 罗大庆
- Xue Huiying, Luo Daqing
- 藏东南冷杉林采伐迹地土壤线虫群落特征
- Characteristics of Soil Nematode Community in Clear Cutting Slash of Fir Forests in Southeast Tibet
- 林业科学, 2013, 49(6): 107-114
- Scientia Silvae Sinicae, 2013, 49(6): 107-114.
- DOI: 10.11707/j.1001-7488.20130615
-
文章历史
- 收稿日期:2012-05-16
- 修回日期:2012-12-22
-
作者相关文章
2. 西藏大学农牧学院高原生态研究所 林芝 860000
. 2. Institute of Plateau Ecology, College of Agriculture and Animal Husbandry,Tibet University Linzhi 860000
西藏东南部森林覆盖率约26.5%(李文华,1985),是西藏的主要林区。由于青藏高原特殊的地理、气候条件,使得藏东南森林生态系统具有独特的组成和特点,对青藏高原甚至东南亚的大气环流、水汽输送、气候变化和生态平衡均起着巨大的调节作用。在该区域亚高山地带分布的急尖长苞冷杉(Abies georgei var. smithii)暗针叶林,极具区域典型代表性。20世纪70,80年代由于森林采伐形成了一定面积的采伐迹地,对于高海拔区域的生态环境造成了一定的负面影响。近年来,围绕该森林生态系统进行了大量研究,一些报道涉及到急尖长苞冷杉林及其林隙、采伐迹地的植物多样性研究(边巴多吉等,2004; 杨小林,2007; 潘刚等,2007; 茹广欣等,2008; 朱登强等,2008),但至今未见有关该生态系统采伐迹地土壤线虫群落结构及多样性的报道(薛会英等,2012)。土壤线虫是土壤生态系统的重要组成部分,它们在土壤物质循环和能量流动方面起着重要作用,同时也能够提供土壤腐屑食物网机能方面的信息(Moore et al.,1991); 因此,从20世纪80年代开始,国外应用土壤线虫群落来指示土壤所受干扰程度、恢复水平以及生态过程的研究逐渐受到重视(Bongers,1990; Wasilewska,1997;Yeates et al.,1999; Bakonyi et al.,2007; Freckman et al.,1999)。国内则从20个世纪90年代开始有相关报道(胡锋等,1999; 李辉信等,2002; 李琪等,2007; 焦向丽等,2008; 佟富春等,2009)。本文以藏东南色季拉山急尖长苞冷杉林采伐迹地为主要研究对象,研究土壤线虫群落结构、生物多样性等方面的响应特征,为探索藏东南森林生态系统采伐迹地植被恢复过程中的土壤生态学过程以及利用土壤线虫群落指示土壤生态系统中的变化提供依据。
1 研究方法 1.1 研究区域概况研究区域位于西藏自治区林芝县境内色季拉山东坡森林生态系统定位研究站永久固定标准样地内,地理坐标为94°49'E,29°48'N。该区域属典型的亚高山温带半湿润气候,海拔3 800~3 900 m,年均温-0.7 ℃,最暖月(7月)平均气温9.2 ℃,最冷月(1月)平均气温-14.0 ℃,年均日照时数1 150.6 h,年均降水量1 134.1 mm,雨季6—9月的降水量占全年的75.0%~82.0%。土壤类型主要为山地暗棕壤,pH4.0~5.0。
选取1985年前后的皆伐迹地为样地,坡度20°,坡位中,植被以草本和灌木为主。主要植物有杂色钟报春(Primula alpicola)、柔毛马先蒿(Pedicularis mollis)、直立悬钩子(Rubus stans)、杜鹃( Rhododeneron spp.)、陇塞忍冬(Lonicera tangutica)、香薷(Elsholtzia ciliata)、荽叶委陵菜(Potentilla cori and rifolia)等,有少量急尖长苞冷杉幼树; 苔藓层不发达。样地大小为100 m×100 m。对照样地大小100 m×100 m,设置在保存完好的急尖长苞冷杉原始林内,林龄200年左右。林内灌木层主要有西南花楸(Sorbus rehderiana)、杜鹃(Rh.spp.)及忍冬(L. spp.)等; 草本层主要以西南草莓(Fragaria moupinensis)、凉山悬钩子(Ru. fockeanus)等为主,藓类盖度80%~100%(罗大庆等,2010)。
1.2 土壤线虫采集与分离2010年7,11月,2011年1,4月,在每个样地随机选取4个有代表性的样点(1 m×1 m),沿土壤剖面采集0~5 cm,5~10 cm,10~15 cm,15~20 cm,20~25 cm,25~30 cm土层原状土样约2 kg,装入聚乙烯袋中贴上标签,带回实验室。4个季节共收集土壤样品192个。
采样当天,每个土壤样品称取30.0 g,用浅盘法室温分离48 h,重复3次(毛小芳,2004); 解剖镜下计数、制片。依据Bongers(1988)、尹文英(1998)、谢辉(2005)和吴纪华(1999)文献中的方法,利用体视显微镜按科、属对线虫进行分类。
依据食性将线虫分划为食细菌性线虫(Bacterivores)、食真菌性线虫(Fungivores)、植物寄生性线虫(Plant-parasites)和杂食-捕食性线虫(Omnivores-Predators)4个营养类群(Yeates et al.,1993)。
土壤含水率采用烘干法(105 ℃)测定(鲁如坤,1999)。将30 g鲜土分离得到的线虫个体数量转换成每100 g干土中含有的线虫个体数量。
1.3 数据分析各类群数量优势度的划分: 优势类群(+ + +)为个体数占总捕获量10%以上; 常见类群(+ +)为个体数占总捕获量1%~10%; 稀有类群(+)为个体数占总捕获量1%以下。
土壤线虫群落结构分析采用以下指标。
1)Shannon-Wiener多样性指数:$H' = -\sum\limits_{i = 1}^S {{n_i}/N} \times \ln \left({{n_i}/N} \right)$,ni 为第i类群的个体数,N为群落所有类群的个体总数,S 为类群数;
2)Pielou均匀度指数: J' = H'/lnS,H'为Shannon-Wiener指数,S为类群数;
3)Simpson优势度指数:$\lambda = {\sum {\left({{n_i}/N} \right)} ^2},{n_i}$ 为第i 类群的个体数,N 为所有类群的个体总数;
4)Margalef丰富度指数: SR=(S-1)/lnN,S为类群数,N为所有类群的个体总数;
5)成熟度指数(maturity index,MI,不包括植物寄生类线虫): MI=Σc(i)×pi;
植物寄生线虫指数(plant parasite index,PPI):PPI=Σc(i)×pi。
式中,c(i)为土壤线虫第i类群colonizer-persister值(Yeates et al.,1993),pi为土壤线虫第i类群的个体数占群落总个体数的比例。
6)线虫通路比值(nematode channel ratio,NCR): NCR=Ba/(Ba+Fu),Ba、Fu分别为食细菌类、食真菌类线虫数量。
用SPSS13.0软件进行单、双因素方差分析来估测不同季节、不同深度土层以及两者交互作用对土壤线虫群落各参数的影响。用Excel 绘图。
2 结果与分析 2.1 采伐迹地土壤线虫群落组成采伐迹地土壤线虫共分离获得14 496条,个体密度10~6 490条·(100 g)-1干土,平均个体密度为989条·(100 g)-1干土。通过制片鉴定线虫6 913条,分属于2纲6目65属,优势属为散香属、螺旋属(表 1)。
|
|
春季共获得土壤线虫3 202条,个体密度19~4 735条·(100 g)-1干土,平均937条·(100 g)-1干土。优势属散香属的个体数量占本季总数的55.89%; 螺旋属等11属为常见属,个体数量占总数的33.60%; 真滑刃属等40属为稀有属,占总数的10.51%。
夏季共获得土壤线虫4 766条,个体密度119~6 111条·(100 g)-1干土,平均1 500条·(100 g)-1干土。垫刃属、垫咽属、牙咽属为优势属,3属个体数量占总数的36.14% ; 真滑刃属等14属为常见属,个体数量占总数的58.64% ; 头叶属等23属为稀有属,占总数的5.23%。
秋季共获得土壤线虫4 222条,个体密度124~6 490条·(100 g)-1干土,平均1 178条·(100 g)-1干土。螺旋属、散香属、垫咽属为优势属,个体数量占总数的59.70%; 厚唇属等15属为常见属,占总数的32.91%; 真滑刃属等27属为稀有属,占总数的7.38%。
冬季共获得土壤线虫2 306条,个体密度10~1 682条·(100 g)-1干土,平均340条·(100 g)-1干土。螺旋属、垫咽属、散香属、头叶属为优势属,个体数量共占总数的44.90%; 小杆属等19属为常见属,占总数的50.22%; 棱咽属等14属为稀有属,共占总数的4.82%。
林内对照样地4个季节共捕获线虫7 915条,个体密度12~9 615条·(100 g)-1干土,平均620条·(100 g)-1干土,隶属于线虫动物门的2纲6目67属。垫咽属、螺旋属及绕线属为优势属,个体数量占线虫总数的49.09%; 常见属18个,占线虫总数的40.33%,稀有属共46个属,仅占总数的10.55%。
采伐迹地样地不同季节间的土壤线虫数量及构成均存在差异。与林内相比,采伐迹地土壤线虫群落在数量和组成上产生了一定的分异。
2.2 采伐迹地土壤线虫群落特征 2.2.1 土壤线虫时空分布采伐迹地土壤线虫个体数量在不同季节的垂直分布情况如图 1所示。0~5 cm土层线虫个体数量占6个土层线虫总数的48.60%,表聚性明显; 4个季节的线虫个体数量,夏季>秋季>春季>冬季。方差分析结果表明: 夏季0~5 cm土层线虫个体数量与5~10 cm土层差异显著(P<0.05),与其他4个土层间的差异均达到了极显著水平(P<0.01); 冬季和秋季,0~5 cm土层线虫个体数量与其他5个土层间的差异均达到了极显著水平(P<0.01); 春季各土层间没有明显差异(P>0.05)。季节间比较,夏季与春季差异不明显(P>0.05),夏季与秋、冬2季的差异均极显著(P<0.01),春秋冬3个季节间无明显差异(P>0.05)。
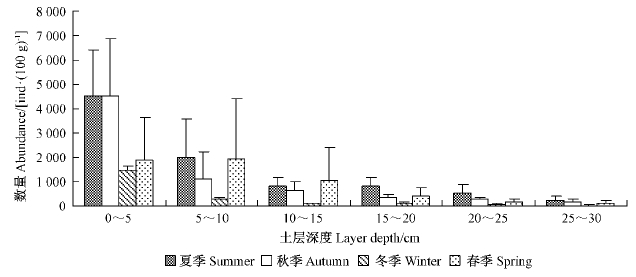 |
图 1 土壤线虫个体数量的垂直分布及季节变化
Fig. 1 Vertical distribution and seasonal change of individual density of soil nematode
|
林内0~5 cm土层的线虫数量占线虫总数的56.85%,表聚性与采伐迹地一致; 4个季节的线虫个体数量,春季>夏季>秋季>冬季。方差分析结果显示,0~5 cm土层的线虫数量与其他5个土层的差异均极显著(P<0.01),0~5 cm土层之外的5个土层间差异不显著(P>0.05); 季节间差异不明显。
2.2.2 土壤线虫的多样性采用多样性指数H'、均匀度指数J'、优势度指数λ及丰富度指数SR来说明急尖长苞冷杉林采伐迹地土壤线虫群落多样性特征,结果见表 2。对于H',夏季>冬季>秋季>春季; 对于J',冬季>秋季>夏季>春季>; 对于λ,春季>秋季>冬季>夏季; 对于SR,冬季>夏季>秋季>春季。生物多样性指数在季节间存在一定的差异,方差分析结果显示,H'、J'、λ3个指数均在冬季的变化较大,与春季的差异最为显著(P<0.05),SR季节间无明显差异。
|
|
不同土层间,0~5 cm土层与25~30 cm土层的4个指数值均差异明显(P<0.05); H'、SR值随土层加深而减小,J'、λ值则随土层加深而增大。
林内的土壤线虫群落生态指数除了MI、NCR均值与采伐迹地差异较大外,H',J',λ,SR值未表现出明显的差异。
2.3 土壤线虫营养功能团土壤线虫群落的各营养功能团数量在不同季节的垂直分布情况如图 2 所示。
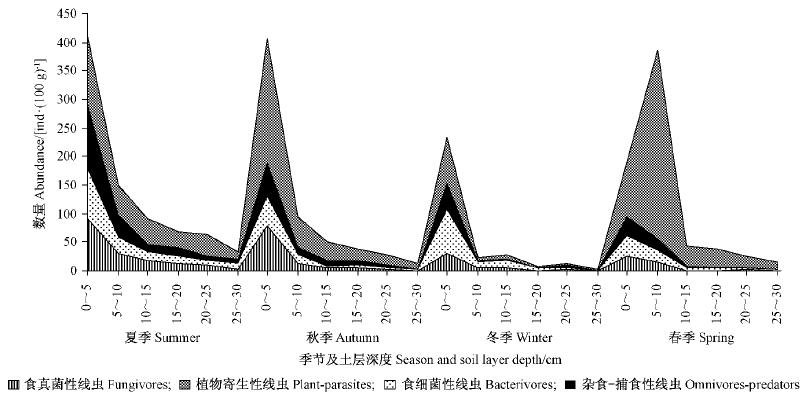 |
图 2 土壤线虫群落营养类群个体数量在土壤中的垂直分布和季节变化
Fig. 2 Vertical distribution and seasonal change of abundance of soil nematode trophic groups
|
根据调查结果,4个季节土壤线虫群落各营养功能团个体数量的大小顺序为: 植食性线虫(Pp)>食细菌性线虫(Ba)>杂食-捕食性线虫(Op)>食真菌性线虫(Fu),植食性线虫个体数量占总数的52.04%,食细菌性线虫、杂食/捕食性线虫及食真菌性线虫个体数量则分别占总数的16.96%,16.56%及14.44%。
不同季节各营养功能团个体数量及营养群落构成等均存在一定的差异。春季植食性线虫数量最多,占当季各类群线虫总数的75.18%,其他3种营养类群数量均低于当季线虫总数的10%,大小顺序为: 植食性线虫>食细菌性线虫>杂食-捕食性线虫>食真菌性线虫; 夏季植食性线虫>杂食-捕食性线虫>食真菌性线虫>食细菌性线虫,植食性线虫个体数量占当季线虫总数的36.67%; 秋季植食性线虫>食真菌性线虫>杂食/捕食性线虫>食细菌性线虫,植食性线虫占当季线虫总数的55.94%; 冬季食细菌性线虫>植食性线虫>杂食-捕食性线虫>食真菌性线虫,食细菌性线虫占当季线虫总数的34.97%。
从图 2可以看出,4个营养功能团的个体数量均具有明显的表聚性,在夏秋冬3个季节,各营养功能团主要聚集在0~5 cm土层; 春季的植食性线虫则主要分布在5~10 cm土层,占本季各土层植食性线虫总数的62.79%,0~5 cm土层植食性线虫仅占18.13%。
营养结构特征主要用MI指数、PPI指数及NCR指数来表示,计算结果见表 3。总体来说,夏季的MI值最高,其次是秋季,冬季最低; 不同土层间,MI最大值出现在0~5 cm层,25~30 cm层则最低。PPI最大值出现在秋季,夏季最低; 不同土层间,与MI的变化趋势相似。方差分析显示,4个季节间的MI值无显著性差异(P>0.05); 夏季的PPI值和其他季节相比差异极显著(P<0.01),0~5 cm土层的MI与25~30 cm土层间差异显著(P<0.05); 而不同土层的PPI值相比,5~15 cm土层与25~30 cm土层间差异显著(P<0.05)。不同季节、不同土层的NCR值均高于0.5。
林内NCR 均值低于0.5,植食性线虫>食真菌性线虫>食细菌性线虫>杂食-捕食性线虫。
3 讨论采伐迹地土壤线虫群落的组成及结构特征反映出植被变化对土壤生态变化过程的影响,以及土壤线虫群落对植被恢复过程的响应。
藏东南色季拉山急尖长苞冷杉林采伐迹地土壤线虫个体密度10~6 490条·(100 g)-1干土,平均989条·(100 g)-1干土,明显高于东北次生林生态系统皆伐后撂荒地(焦向丽等,2008),也高于本区域急尖长苞冷杉林。类群属数(65属)高于长白山暗针叶林(32属)(佟富春等,2009),与本区域急尖长苞冷杉林(67属)差异极小。森林采伐导致土壤线虫个体密度增大,而类群数量并没有因干扰而减少。
将采伐迹地与本区域急尖长苞冷杉原始林土壤线虫群落H'、SR值进行比较,两者差异并不明显,因此,可以得出以下结论: 藏东南急尖长苞冷杉林采伐后植被的改变并没有使土壤线虫多样性发生明显改变,采伐迹地在恢复演替过程中线虫群落多样性处于保持或恢复状态,这与前人的研究结果一致(Panesar et al.,2001; Thornton et al.,2002)。
本研究中采伐迹地的MI值远远低于林内,这表明森林砍伐导致土壤生态系统的稳定性下降,抗干扰能力降低; PPI值则略高于林内。与MI相反,PPI越大说明生态系统的稳定性和抗干扰能力越低。此结果表明MI指示森林生态系统的皆伐干扰程度比PPI更灵敏。
采伐迹地土壤线虫群落中食细菌性线虫的比例略高于食真菌性线虫,这与林内食真菌性线虫较高的情况不同,说明急尖长苞冷杉林土壤有机质的分解途径以真菌途径为主; 而采伐后的初级演替阶段,土壤有机质的分解则兼有细菌降解途径和真菌降解途径,并有细菌降解途径逐渐占主导的趋势,使土壤有机质降解更有效率。NCR结果与此一致。
森林采伐在改变地上植被的同时,也使土壤生态系统的光照、水分等环境条件发生改变。土壤线虫在数量、MI指数及PPI指数上对采伐后植被的初级演替作出响应,显示出土壤线虫群落指示森林生态系统演替过程及所受干扰程度的潜力。
| [1] |
边巴多吉, 郭泉水, 次柏, 等.2004. 西藏冷杉原始林林隙对草本植物和灌木树种多样性的影响. 应用生态学报, 15(2): 191-194.( 1) 1)
|
| [2] |
佟富春, 肖以华, 王庆礼. 2009. 长白山次生林演替过程中土壤线虫群落结构特点.华南农业大学学报, 30(3): 63-68.( 2) 2)
|
| [3] |
胡锋, 李辉信,谢涟琪,等. 1999. 土壤食细菌线虫与细菌的相互作用以及对N、P 矿化生物固定的影响及机理.生态学报, 19(6): 914-920.( 1) 1)
|
| [4] |
焦向丽,朱教君,张金鑫,等. 2008. 干扰对东北次生林生态系统土壤线虫群落的影响. 生态学杂志,27(12): 2129-2135.( 2) 2)
|
| [5] |
李辉信, 刘满强, 胡锋, 等.2002. 不同植被恢复方式下红壤线虫数量特征.生态学报, 22(11): 1882-1889.( 1) 1)
|
| [6] |
李琪,梁文举,欧伟.2007.潮棕壤线虫群落对土地利用方式的响应.生物多样性,15(2):173-181.( 1) 1)
|
| [7] |
李文华.1985. 西藏森林.北京: 科学出版社.( 1) 1)
|
| [8] |
鲁如坤. 1999.土壤农业化学分析方法. 北京: 中国农业科技出版社.( 1) 1)
|
| [9] |
罗大庆, 王军辉, 任毅华, 等. 2010. 西藏色季拉山东坡急尖长苞冷杉林的结实特性. 林业科学, 46(7): 30-35.( 1) 1)
|
| [10] |
毛小芳, 李辉信, 陈小云, 等. 2004.土壤线虫三种分离方法效率比较. 生态学杂志, 23(3), 149-151.( 1) 1)
|
| [11] |
潘刚,罗大庆,边巴多吉.2007.西藏的花楸属植物资源及开发前景.林业实用技术, 9: 31-32.( 1) 1)
|
| [12] |
茹广欣,朱登强,王军辉,等.2008. 西藏色季拉山急尖长苞冷杉林地的物种多样性与土壤养分特征.河南农业大学学报, 42(5): 511-515.( 1) 1)
|
| [13] |
吴纪华.1999. 中国淡水和土壤线虫的研究. 武汉:中国科学院水生生物研究所博士学位.( 1) 1)
|
| [14] |
谢辉.2005. 植物线虫分类学2版. 北京: 高等教育出版社.( 1) 1)
|
| [15] |
薛会英, 罗大庆, 于宝政. 2012. 西藏色季拉山急尖长苞冷杉林土壤线虫群落特征. 应用生态学报, 23(12), 3402-3408.( 1) 1)
|
| [16] |
杨小林.2007.西藏色季拉山林线森林群落结构与植物多样性研究. 北京: 北京林业大学博士学位论文.( 1) 1)
|
| [17] |
尹文英.1998. 中国土壤动物检索图鉴. 北京: 科学出版社.( 1) 1)
|
| [18] |
朱登强, 王军辉, 张守攻, 等.2008.西藏色季拉山西坡急尖长苞冷杉林物种多样性及群落结构的垂直分布格局. 西北林学院学报, 23(5): 1-6.( 1) 1)
|
| [19] |
Bakonyi G,Nagy P,Kovacs-Lang E,et al.2007.Soil nematode community structure as affected by temperature and moisture in a temperate semiarid shrubland.Applied Soil Ecology,37(2): 1-10.( 1) 1)
|
| [20] |
Bongers T. 1988. De Nematoden Van Nederland. Stichting Uitgeverij Koninklijke Nederlandse Natuurhistorische Vereniging.( 1) 1)
|
| [21] | Bongers T, Bongers M.1998.Functional diversity of nematodes. Applied Soil Ecology, 10(3):239-251. |
| [22] | Freckman D W,Baldwin J G.1990. Nematoda//Dindal D L.Soil Biology Guide. John Wiley & Sons, New York, 155-200. |
| [23] |
Moore J C,de Ruiter P C. 1991.Temporal and spatial hetero-geneity of trophic interactions within belowground food webs. Agriculture, Ecosystems and Environment, 34(1-4): 371-397.( 1) 1)
|
| [24] |
Panesar T S, Marshall V G, Barclay H J. 2001. Abundance and diversity of soil nematode in chronosequences of coastal Douglas-fir forests on Vancouver island, British Columbia. Pedobiologia, 45(3): 193-212.( 1) 1)
|
| [25] |
Thornton C W, Matlack G R. 2002. Long-term disturbance effects in the nematode communities of south Mississippi woodlands. Journal of Nematology, 34(2): 88-97.( 1) 1)
|
| [26] |
Wasilewska L. 1997.Soil invertebrates as bioindicators, with special reference to soil inhabiting nematodes.Russian Journal of Nematology, 5(2): 113-126.( 1) 1)
|
| [27] |
Yeates G W,Bonges T,de Goede R G M,et al. 1993. Feeding habits in soil nematode families and genera—Anoutline for soil ecologists. Journal of Nematology, 25(3): 315-331.( 2) 2)
|
| [28] |
Yeates G W, Wardle D A,Watson R.1999.Responses of soil nematode populations, community structure diversity and temporal variability to agricultural intensification over a seven-year period. Soil Biology and Biochemistry, 31(12): 1721-1733.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49