文章信息
- 袁志林, 陈益存, 毛黎娟, 章初龙, 陈连庆
- Yuan Zhilin, Chen Yicun, Mao Lijuan, Zhang Chulong, Chen Lianqing
- 3株产气内生真菌的水果防腐活性及其气体成分分析
- Activity of Three Volatile-Producing Endophytic Muscodor Strains in Controlling Fruit Postharvest Disease and Analysis of the Volatile Components
- 林业科学, 2013, 49(6): 83-89
- Scientia Silvae Sinicae, 2013, 49(6): 83-89.
- DOI: 10.11707/j.1001-7488.20130612
-
文章历史
- 收稿日期:2012-04-17
- 修回日期:2013-04-18
-
作者相关文章
2. 浙江大学农生环分析测试中心 杭州 310058;
3. 浙江大学生物技术研究所水稻生物学国家重点实验室 杭州 310058
2. Analysis Center of Agrobiology and Environmental Science, Zhejiang University Hangzhou 310058;
3. State Key Laboratory for Rice Biology, Institute of Biotechnology, Zhejiang University Hangzhou 310058
内生真菌(endophytic fungi)是一类特殊的植物共生体,在物种多样性、种类组成、侵染特征、化学物质多样性等方面都区别于菌根真菌(mycorrhizal fungi)。内生真菌群落结构特征、生态学功能(促生、协同植物抗逆和分解凋落物等)和天然活性产物开发是当前的主要研究方向。从“生物勘探”(bioprospecting)角度看,挖掘特殊新颖的内生真菌菌物资源无论在基础理论创新还是应用开发都具有重要的科学意义。安德鲁紫杉霉(Taxomyces and reanae)(Stierle et al.,1993)、白色气霉菌(Muscodor albus)(Worapong et al.,2001)、印度梨形孢(Piriformospora indica)(Varma et al.,1999)和管突弯孢霉(Curvularia protuberata)(Redman et al.,2002)是其中最典型的例子。
发现这些功能特殊的内生真菌有一定的偶然性,但通过优化分离培养方法和技术可以最大程度获得植物所蕴含内生真菌类群组成的全貌,避免将一些生长缓慢或稀有的物种“过滤”掉。笔者在2009年对分布在浙江省庆元县的我国特有濒危植物百山祖冷杉(Abies beshanzuensis)的内生真菌资源进行研究。通过整合分离培养方法获得了极为丰富的真菌类群,将近1/3类群的ITS,LSU或RPB2基因序列的相似性与GenBank 数据库的相似性在82%~94%范围内,至少说明这些可能是稀有种或是潜在的新种(Yuan et al.,2011)。基于多基因序列的BALST比对结果和形态学特征(试验条件下不产生繁殖结构; 菌丝高度捆绑、缠绕形成绳索结构),笔者发现并鉴定了6个菌株属于产气霉属(Muscodor)(Yuan et al.,2011; 2012)。Muscodor是2001年建立的1个新属,属子囊菌的炭角菌科(Xylariaceae),其主要特征是能产生强烈的挥发性小分子物质,对多种病原菌具有杀伤性。鉴于其独特的生物学特性,本文将研究产气霉纯培养物对3种引起水果腐烂变质病原真菌的拮抗活性以及发酵菌剂对水果防腐的功效; 同时采用固相微萃取和气质联用分析技术对不同菌株的气体成分进行定性定量分析; 对产气霉真菌开发成新型生物熏蒸制剂的可行性及存在的问题进行讨论。
1 材料与方法 1.1 内生真菌和病原真菌菌株产气霉菌株保存在中国普通微生物保藏中心(中国科学院微生物研究所)和本实验室: Muscodor fengyangensis M153(菌株编号: CGMCC 5559)、M.fengyangensis M112-2(菌株编号: CGMCC 5560)和Muscodor sp. M25(菌株编号: CGMCC 5571)。供试水果腐烂病原真菌: 草莓灰霉菌(Botrytis cinerea)、苹果轮纹病菌(Physalospora pyricola)和油桃褐腐病菌(Monilinia fructicola)均购自中国农业微生物菌种保藏管理中心。
1.2 产气霉挥发性气体的抑菌活性评价将产气霉菌株接种在PDA(马铃薯固体培养基)平板,25 ℃培养7~14天,用直径0.5 cm的打孔器取1块菌饼接种在含有PDA的分隔塑料培养皿(two-section Petri dish)中的一侧(直径9 cm,2个分隔室没有物质交换和流动,但上面有一层间隙能让气体流通)。在25 ℃培养5天后,分别接种上述供试病原真菌(0.5 cm菌饼)于分隔培养皿的另一侧,用双层Parafilm封口膜封住平皿,在25 ℃培养1周后,观察病原真菌的生长情况并测量菌落直径,重复3次。病原真菌的生长状况用菌落扩展直径表示。测量完毕后,再将病原真菌转接至新鲜PDA平板上培养数天,观察其存活能力。对照组只将病原真菌接种在分隔培养皿的一侧,另一侧没有产气霉菌株。
1.3 产气霉固体发酵菌剂对采收后水果的防腐功效 1.3.1 产气霉发酵菌剂制备将3块直径0.5 cm的产气霉菌饼接入150 mL的PDB马铃薯液体培养基中。在25 ℃,180 r·min-1条件下振荡培养7天(M25菌株生长速度较快,培养96 h后即可收获菌丝)。移取20 mL发酵菌丝体接种至固体大麦粒培养基(500 mL三角瓶放入200 g大麦粒和200 mL蒸馏水,121 ℃高压灭菌25 min),25 ℃黑暗培养14天(可适当补加无菌水),将长满菌丝的大麦粒取出后置于超净台过夜风干,用锡箔纸包裹好后放入4 ℃冷藏箱保存备用。
1.3.2 发酵菌剂对水果腐烂真菌的防治功效选取采收后无伤口和病虫害的水果,用无菌水清洗干净后置于保鲜盒中(可密封),用手术刀轻轻划一伤口,在伤口上接入上述病原菌,同时在保鲜盒底部放2层湿滤纸片用于保湿。将预先制备的大麦粒活性菌剂(每50 g)用铝箔纸包裹后放置于保存盒内,用于抑制病原菌的生长,加盖密封,放入25 ℃的人工气候箱,12 h光照/12 h黑暗培养。每处理3重复,以不加菌剂为空白对照,3~5天后取出水果,调查发病情况、拍照记录并计算抑制率。抑制率(%)=100%×(对照组发病数-处理组发病数)/对照组发病数。
1.4 固相微萃取(SPME)与气质联用(GC-MS)分析产气霉的抑菌气体成分用SPME 注射器(美国Supelco公司)萃取产气霉菌丝产生的挥发性气体物质,采用SPME 涂层萃取头StableFlex(50/30 μm DVB /CAR/PDMSDivinylbenzene/Carboxen/Polydimethylsiloxane)。在萃取挥发性气体前,将StableFlex萃取头在GC色谱仪中240 ℃维持20 min(以氦气为流动相)。用SPME注射器穿过无菌塑料培养皿盖子上的小孔,迅速把萃取头置入菌丝生长的空间范围内,维持45 min。然后将SPME注射器插入GC色谱仪的进样口,吸附萃取头上的气体样品30 s。随后取出GC色谱仪的进样口中的萃取头和SPME注射器。气相色谱质谱仪型号: Agilent 6890N-5975B。数据分析与处理采用质谱化学工作站软件分析(MSDChemStation G1701DA,安捷伦公司)。用HP-5MS型毛细管柱(涂层: 5% Phenyl Methyl Siloxane,30.0 m×0.25 mm,涂层厚度: 0.25 μm)来分离挥发性气体,氮气为载气。毛细管柱升温程序如下:30 ℃维持2 min,再以5 ℃ / min的速率升温至220 ℃; post run 270 ℃维持1 min。质谱扫描速率为: 3.35 scans·s-1; 质谱范围: 20~450 amu(原子质量单位,atomic mass unit)。通过比较质谱仪中的NIST05数据库来鉴定挥发性物质。在对照组中(只含PDA的平皿)检测到的峰形,将在处理组中获得的峰图中进行扣除。
2 结果与分析 2.1 产气霉菌株对水果腐烂病原真菌的抑制作用采用分隔培养皿研究3株产气霉菌株对水果腐烂病原真菌生长的影响。为了保证产气菌可在培养皿空间中形成一定浓度的挥发性气体,将产气菌单独培养5天后接种靶标菌。结果表明: 经过7天的共培养,产气霉对病原菌具有明显的抑制作用,不同菌株产生的挥发性气体对3种病原菌生长的抑制率均达到100%(图 1和表 1)。随后,将熏蒸过的病原菌菌块转接至新鲜PDA培养基,观察其存活情况。从表 1可知: 经产气霉M25菌株处理后,3种病原菌均能重新恢复生长,但M112-2和M153菌株对病原菌具有很强的毒杀作用,经气体熏蒸后病原菌不能在新鲜PDA培养基上生长,表明M112-2和M153对3种病原菌具有致死效应。以上结果证明3株产气霉菌株对病原菌具有明显的抑制作用,在试验条件下,M112-2和M153菌株产生的挥发性气体的活性高于M25。
 |
图 1 在共培养条件下3 株产气霉菌株对水果腐烂病原真菌生长的影响
Fig. 1 Effects of three isolates of Muscodor species on the growth of fruit diseases under the co-culture system
A: 苹果轮纹病菌Physalospora pyricola; B: 草莓灰霉菌Botrytis cinerea; C: 油桃褐腐病菌Monilinia fructicola |
|
|
在本试验中,笔者利用液-固两相发酵法制备了产气霉菌株固体发酵菌剂。在对照组中,接种病原菌后3~7天,在水果伤口处可形成明显的病斑和腐烂症状(图 2)。发酵菌剂对水果腐烂病原菌的抑制率在78%~97%(表 1)。在M112-2和M153菌株发酵菌剂处理组中,无病症或明显扩散趋势,挥发性气体对病原菌的生长具有抑制作用; 而M25发酵菌剂的防治功效稍弱,这与M25菌株本身抑菌活性较差有关。
 |
图 2 产气霉固体发酵菌剂(M112-2)对草莓(A)、油桃(B)和苹果(C)霉变腐烂的防治作用
Fig. 2 Biocontrol of postharvest decay of strawberry (A), peach ( B), and apple ( C) by
using solid-state fermented M. fengyangensis agent (M112-2)
|
为研究产气霉菌株发挥生物学功能的物质基础,采用固相微萃取技术收集挥发性气体,进而利用气质联用对气体成分进行检测。经NIST05质谱库检索,结合保留时间及相关文献鉴定色谱峰(Ezra et al.,2004)。由表 2和图 3可知: 3株产气霉菌株产生气体的化学成分有明显差异,其中M112-2和M153能产生30多种小分子化合物,而M25菌株的气体成分最为简单(只检测到4种物质)。2-甲基丙酸(propanoic acid,2-methyl-)和2-甲基-丙酸甲酯(propanoic acid,2-methyl-,methyl ester)是共有、含量较高的小分子物质; M112-2和M25菌株能产生较高含量的β-水芹烯(β-phellandrene),而在M153菌株中未检测到。此外,M112-2和M153菌株在保留时间20~35 min范围内成分区别较大,M112-2的色谱峰度通常较高。
|
|
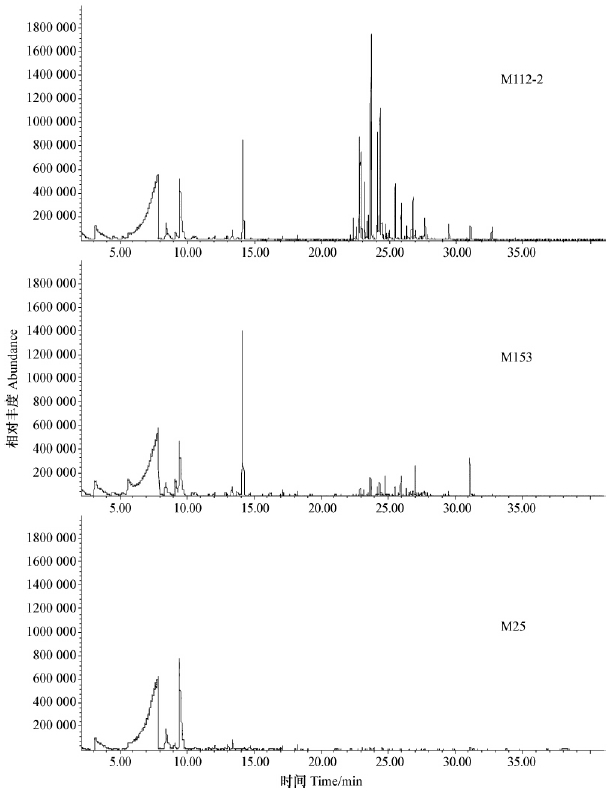 |
图 3 3株产气霉菌株挥发性气体物质气相色谱-质谱总离子流量
Fig. 3 GC/MS total ion current chromatogram of the volatiles from three Muscodor isolates
|
林木内生真菌是一类未被充分发掘的菌物资源,是全球真菌生物多样性的重要组成部分。产气内生菌(volatile-producing endophytes,VPEs)是一类特殊的真菌类群,其主要特征是产生挥发性的小分子香味物质。某些VPEs种类产生的挥发性抑菌物质对很多病原菌的生长具有广谱抗性。近来有很多关于VPEs的研究报道(Yuan et al.,2012)。例如从一种樟科植物(Persea indica)中分离到一株产气内生炭团菌(Hypoxylon sp.)(Tomsheck et al.,2010);从热带铁苋菜(Acalypha indica)分离到产气漆斑菌(Myrothecium inunduatum)(Banerjee et al.,2010);在榄仁树(Terminalia catappa)也分离到一种产气粉孢菌(Oidium sp.)(Strobel et al.,2008),这些真菌产生的挥发性气体均能有效抑制或杀死多种病原微生物。从林木中筛选VPEs为开发新型真菌源熏蒸剂提供了一条新途径。
蒙大拿州立大学Strobel教授研究小组在热带雨林植物中发现的白色产气霉(Muscodor albus)(Worapong et al.,2001)是研究较为透彻的VPEs。至今已有8个产气霉属物种被记录和定名(Kudalkar et al.,2012; Yuan et al.,2012)。产气霉最明显的生物学特性就是能产生强烈的挥发性物质,对多种病原体(如真菌、细菌和线虫等)具有明显的抑制甚至是致死作用; 尚未发现其有性和无性繁殖结构。美国生物农药公司AgraQuest已将M. albusCZ-620开发成商业化菌剂,应用于收获后果实、种子和作物土传病虫害防治(Mercier et al.,2010)。
本课题组在百山祖冷杉内生真菌资源勘探过程中意外地分离到6株内生产气霉。基于核糖体转录间隔区ITS 序列的产气霉系统发育分析(Yuan et al.,2012)表明: 其中5株可鉴定为凤阳山产气霉(3),但在基因序列和表型等方面与已报道的凤阳山产气霉菌株仍有一定的差异(Zhang et al.,2010); 另外1株(M25)尚不能鉴定到种(疑似新种)。由试验结果分析,PDA平板上共培养的3个产气菌菌株产生的挥发性物质均能完全抑制3种可引起水果腐烂病的病原真菌的生长,其中M112-2和M153菌株对病原菌有致死作用,而M25菌株只有抑制作用。水果防腐试验也证明M112-2和M153菌剂的防治效果优于M25菌剂。推测这种活性差异与其挥发性成分组成之间有一定联系。二甲酯丙酸、甲基-2-甲基丙酸酯这2种成分可能是产气霉抑菌活性最重要的物质基础,其他小分子物质对提高挥发性物质对靶标菌的抑菌和致死活性具有协同增效作用。由于大多数小分子物质人工合成有难度,故目前尚不能确定哪几类化合物起关键作用。目前仅3-甲基-1-丁醇乙酸酯(1-butanol,3 methyl-,acetate)被报道具有较强的生物活性,多数单个小分子物质无明显抑菌活性(Strobel et al.,2001)。此外,尽管M112-2和M153在成分和含量方面也有差异,但它们的活性相当,说明菌株特异性气体物质对维持其拮抗性能是不可或缺的。
产气霉商品CZ-620气体成分与本研究中的3个菌株存在明显的差异,CZ-620不产生二甲酯丙酸,但含有较多的2-甲基丁醇乙酸酯(1-butanol,2-methyl-,acetate)、2-乙酸苯乙酯(acetic acid,2-phenylethyl ester)、壬酮(Nonanone)和乙醇(Ethanol)等,这些成分在上述菌株中含量极少或检测不到(Ezra et al.,2004)。由此可知产气霉真菌释放的小分子挥发性物质的化学结构极其丰富多样,多种关键性分子决定其生物活性的强弱。
水果防腐保鲜剂主要是利用化学合成药物或天然抗菌剂(以植物、动物和微生物天然产物为主要原料)防止霉菌和其污染菌滋生繁殖(聂继云等2007; 袁兵兵等2011)。以微生物为活体的保鲜剂产品也显示出良好的应用前景,如利用膜醭毕赤酵母(Pichia membranaefaciens)、罗伦隐球酵母(Cryptococcus laurentii)、季也蒙假丝酵母(Candida guilliermondii)和红酵母(Rhodotorula glutinis)等拮抗菌可以有效防止水果腐烂变质(Zhang et al.,2005; Xu et al.,2008; Zong et al.,2010)。但以活菌产挥发性抑菌物质的保鲜产品还鲜见报道。从应用开发角度看,活体产气霉菌剂具备以下优势和潜力:首先,活体菌剂制备工艺相对简单,包装后直接使用,不涉及化合物提取纯化等生化加工过程,因此成本较廉价; 其次,产气霉挥发性物质具有广谱抗性和较强渗透性特点,防腐效果明显,可广泛应用于各种瓜果蔬菜; 最后,活体菌剂与水果无直接接触,没有任何化学物质残留物,因此使用方法简单、可行。
本研究仅对产气霉菌株在水果防腐中的功效进行初步研究,要实现商业化生产需进一步开展大量研究工作。如菌剂生产工艺的优化、廉价培养基的筛选、不同剂量和温度对防治功效的影响等。从微生物制剂安全性角度考虑,产气霉挥发性气体对人体是否具有毒性以及对水果蔬菜的品质是否有影响也需要经过严格的论证。
| [1] |
聂继云, 李静,李海飞,等. 2007. 我国水果防腐保鲜剂的使用及其检测方法. 植物保护, 33(6): 26-30.( 1) 1)
|
| [2] |
袁兵兵,杨姗姗,陈静. 2011. 微生物源槐糖脂对水果致腐真菌的抑制作用. 应用与环境生物学报, 17 (3): 330-333.( 1) 1)
|
| [3] |
Banerjee D, Strobel G A, Booth E, et al. 2010. An endophytic Myrothecium inundatum producing volatile organic compounds. Mycosphere, 1(3): 229-240.( 1) 1)
|
| [4] |
Ezra D, Hess W M, Strobel G A. 2004. New endophytic isolates of Muscodor albus, a volatile-antibiotic-producing fungus. Microbiology, 150(12): 4023-4031.( 2) 2)
|
| [5] |
Kudalkar P, Strobel G,Riyaz-Ul-Hassan S, et al. 2012. Muscodor sutura, a novel endophytic fungus with volatile antibiotic activities. Mycoscience, DOI: 10.1007/s10267-011-0165-9.( 1) 1)
|
| [6] |
Mercier J, Lego S F, Smilanick J L.2010. In-package use of Muscodor albus volatile-generating sachets and modified-atmosphere liners for decay control in organic table grapes under commercial conditions. Fruits, 65(1): 31-38.( 1) 1)
|
| [7] |
Redman R S, Sheehan K B, Stout R G, et al. 2002. Thermotolerance generated by plant/fungal symbiosis. Science, 298(5598): 1581.( 1) 1)
|
| [8] |
Stierle A, Strobel G, Stierle D. 1993. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew. Science, 260 (5105): 214-216.( 1) 1)
|
| [9] |
Strobel G A, Spang S, Kluck K,et al. 2008. Synergism among volatile organic compounds resulting in increased antibiosis in Oidium sp. FEMS Microbiology Letters, 283(2): 140-145.( 1) 1)
|
| [10] |
Strobel G A, Dirksie E, Sears J,et al. 2001. Volatile antimicrobials from Muscodor albus, a novel endophytic fungus. Microbiology, 147(11): 2943-2950( 1) 1)
|
| [11] |
Tomsheck A R, Strobel G A, Booth E,et al. 2010. Hypoxylon sp., an endophyte of Persea indica, producing 1, 8-cineole and other bioactive volatiles with fuel potential. Microbial Ecology, 60(4): 903-914.( 1) 1)
|
| [12] |
Varma A, Savita Verma, Sudha,et al. 1999. Piriformospora indica, a cultivable plant-growth-promoting root endophyte. Applied and Environmental Microbiology, 65(6): 2741-2744. ( 1) 1)
|
| [13] |
Worapong J, Strobel G A, Ford E,et al. 2001. Muscodor albus anam. gen. et sp. nov., an endophyte from Cinnamomum zeylanicum. Mycotaxon, 79: 67-79.( 2) 2)
|
| [14] |
Xu X B, Qin G Z, Tian S P. 2008. Effect of microbial biocontrol agents on alleviating oxidative damage of peach fruit subjected to fungal pathogen. International Journal of Food Microbiology, 126: 153-158.( 1) 1)
|
| [15] |
Yuan Z L, Rao L B, Chen Y C, et al. 2011. From pattern to process: species and functional diversity in fungal endophytes of conifer Abies beshanzuensis. Fungal Biology, 115(3): 197-213.( 2) 2)
|
| [16] |
Yuan Z L, Chen Y C, Xu B G,et al. 2012. Current perspectives on the volatile-producing fungal endophytes. Critical Reviews in Biotechnology, 32(4): 363-373.( 4) 4)
|
| [17] |
Zhang C L, Wang G P, Mao L J,et al. 2010. Muscodor fengyangensis sp. nov. from southeast China: morphology, physiology and production of volatile compounds. Fungal Biology, 114(10): 797-808.( 1) 1)
|
| [18] |
Zhang H Y, Zheng X D, Fu C X,et al. 2005. Postharvest biological control of gray mold rot of pear with Cryptococcus laurentii. Postharvest Biology and Technology, 35(1): 79-86.( 1) 1)
|
| [19] |
Zong Y Y, Liu J, Li B Q,et al. 2010. Effects of yeast antagonists in combination with hot water treatment on postharvest diseases of tomato fruit. Biological Control, 54(3): 316-321.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

