文章信息
- 杨玲, 王佳男, 边磊, 沈海龙
- Yang Ling, Wang Jianan, Bian Lei, Shen Hailong
- 外源NO对花楸树胚胎萌发和幼苗发育初期活性氧积累的影响
- Effects of Exogenous Nitric Oxide on Embryo Germination and ROS Accumulation in Seedling Growth Initial Stage of Sorbus pohuashanensis
- 林业科学, 2013, 49(6): 60-67
- Scientia Silvae Sinicae, 2013, 49(6): 60-67.
- DOI: 10.11707/j.1001-7488.20130609
-
文章历史
- 收稿日期:2012-08-14
- 修回日期:2013-01-23
-
作者相关文章
花楸树(Sorbus pohuashanensis),又名百花花楸、臭山槐、山槐树、臭檀木、绒花树等,为蔷薇科(Rosaceae)苹果亚科(Maloideae)花楸属(Sorbus)落叶小乔木(Yang et al.,2011 ; 2012)。花楸树具有较强的耐性,可在冷(云)杉林中弱光下的腐殖土中萌发,同时它具有很高的观赏价值和木材使用价值。花楸树春季满树银花,夏季羽叶秀丽,秋冬季红果满枝,冬季果实可宿存(Yang et al.,2011)。在一些含有长寿命树种的稠密树林中,花楸树的遗传多样性可能受到威胁。花楸树为生长在小分裂群体中的伴生树种,对高强度的种间竞争比较敏感。该树种的更新能力较弱,最终可能局部消失(郑健等,2007 ;许建伟等,2010)。因此,需要采取有效措施以保存花楸树的种质资源。
目前关于花楸树繁殖研究的报道以有性繁殖为主,组织培养(杨玲等,2010 ; Yang等,2012)、扦插(苏喜廷等,2005)、嫁接(刘玮等,2006)方面的研究较少。生产实践中多以播种育苗的方式繁殖花楸树苗木。花楸树种子的深休眠特性增加了其播种育苗的难度(沈海龙等,2006 ; 杨玲等,2008 a)。花楸树种子经过2~5 ℃低温层积105天(低温密封贮藏的种子)至120天(新采收成熟种子)才能萌发(杨玲等,2008 a)。在2~5 ℃低温层积过程中,花楸树种皮内 ABA 含量显著降低,种皮和胚胎内各种生长促进物质的相对含量显著增加(杨玲等,2008 b)。将花楸树种子用200 mg·L-1 6 -BA 溶液浸泡2天后在25 ℃和5 ℃变温条件下萌发,可缩短种子萌发起始时间,提高种子发芽率和发芽势(杨玲等,2009)。
关于 NO 调节种子休眠打破和萌发的研究已有报道(Bethke et al.,2004 ; Giba et al.,2007 ;Gniazdowska et al.,2007)。人们认为 NO 可能是由亚硝酸盐和硝酸盐分解产生的(Renata et al.,2006)。已有报道证明外源含氮化合物处理可以代替植物生长调节剂促进种子萌发和幼苗生长。如大麦(Hordeum vulgare)谷粒、拟南芥(Arabidopsis thaliana)种子和一些树木种子经过外源含氮化合物处理后,种子生活力和萌发率均可得到提高(Beligni et al.,2000 ; Bethke et al.,2004 ; Gniazdowska et al.,2010)。更多关于 NO 功能的研究来自 NO 供体、NO 抑制剂和特殊的抑制物的药理学研究。最常用到的 NO 供体是硝普钠(SNP)。 SNP 可以促进许多植物种子萌发(Gniazdowska et al.,2010)。 SNP 对光下吸胀的种子萌发的促进效应可以被 NO 抑制剂(PTIO 或 cPTIO)解除(Bethke et al.,2004)。 Gniazdowska等(2007)认为 NO 打破休眠与乙烯合成的增强相关,即 NO 作为一种调控因子通过调节乙烯生物合成解除苹果(Malus domestica)胚休眠。进一步的研究表明: NO和氢氰酸(HCN)对休眠的苹果胚萌发的促进效应与胚中和萌发各个阶段中H2O2和超氧阴离子含量的增加相关(Gniazdowska et al.,2010)。推测活性氧和NO 在种子萌发中与传统的植物激素一起作为第二信使起作用(Gniazdowska et al.,2010)。
本文以我国东北地区野生花楸树成熟合子胚胎为材料,利用室内培养皿发芽法研究外源 NO 供体(SNP)、NO 合成抑制剂(PTIO)、脱落酸(ABA)以及乙烯受体抑制剂(NBD)对花楸树胚胎萌发和幼苗发育初期活性氧(ROS)积累的影响。研究结果为了解 NO 在花楸树种子休眠解除和幼苗初期发育过程中的调控作用及其与植物内源激素的关系奠定基础,为生产中改进花楸树播种育苗方法、提高苗木产量提供理论依据。
1 材料与方法 1.1 材料来源试验材料于2011年9月下旬采自黑龙江省山河屯林业局凤凰山林场,选取1株生长良好的野生成年母树采集成熟果实,采回后调制出种子。种子调制方法同沈海龙等(2006)。
1.2 方法 1.2.1 种子前期处理试验前选取籽粒饱满、质地均匀的休眠种子(平均千粒质量为1.95 g,平均含水量为8.39 %,平均生活力为99.0 %),在20 ℃± 5℃下的蒸馏水中吸胀48 h。将吸胀后的种子用0.2 %(V/V)NaClO 溶液搅拌浸泡10~15 min 后用清水冲洗干净。在冰上剥除种皮,用裸胚进行试验。
1.2.2 NO 对胚萌发的效应试验1)SNP 预处理试验 参照Gniazdowska等(2010)的方法。在500 mL 烧杯中放置一张用5 mL 0.05 mol·L-1 Hepes-KOH(pH 值7.0)充分浸湿的滤纸,上面放90个剥离的胚胎。然后在同一烧杯里面再放置一个内含5 mL 5 mmol·L-1 SNP 溶液(现用现配)的小烧杯,最后用保鲜膜将500 mL 烧杯的口封好。气态 NO 可以直接从 SNP 溶液中释放出来。胚胎暴露在25℃、光下(光照强度为60 μmol·m-2 s-1)SNP 溶液的蒸汽中3 h。处理后,用蒸馏水冲洗胚胎并放置在被蒸馏水浸湿的滤纸上。对照为不经过 SNP 预处理的裸胚。对照和预处理的胚胎在直径9 cm 的培养皿中(每皿30个胚)在培养室内的光照条件下萌发。萌发培养条件同前述预处理过程。对照和处理均设置3个重复。
2)SNP 与 PTIO 组合处理试验 胚胎在5 mmol·L-1 SNP 溶液的蒸汽中处理(预处理过程同上)3 h 后,在被3 mL 300 μmol·L-1 PTIO 溶液浸湿的滤纸上吸胀。对照胚胎为不经过 SNP 预处理,直接在含有3 mL 300 μmol·L-1 PTIO 溶液的滤纸上吸胀。萌发培养条件同上。对照和处理均设置3个重复。
3)SNP 与 ABA 组合处理试验 胚胎在5 mmol·L-1 SNP 溶液的蒸汽中处理(预处理过程同上)3 h 后,在含有3 mL 不同浓度 ABA(0.1,0.3,1.0,3.0 μmol·L-1)溶液浸湿的滤纸上吸胀。对照胚胎为不经过 SNP 预处理,直接在含有上述不同浓度 ABA 溶液的滤纸上吸胀。萌发培养条件同上。对照和处理均设置3个重复。
4)SNP 与 NBD 组合处理试验 胚胎在5 mmol·L-1 SNP 溶液的蒸汽中处理(预处理过程同上)3 h 后,在含有3 mL 1 mmol·L-1 NBD 溶液浸湿的滤纸上吸胀。对照胚胎为不经过 SNP 预处理,直接在含有3 mL 1 mmol·L-1 NBD 溶液的滤纸上吸胀。萌发培养条件同上。对照和处理均设置3个重复。
5)观察和试验记录 每天观察并记录。以2片子叶均变绿、胚轴和胚根均伸长为种子正常萌发的标志。统计不同处理后的胚胎萌发起始时间; 萌发试验第1,2,3,4,5,6,7,8天…,直到萌发结束时的每天的发芽率和各处理的最终发芽率。
1.2.3 幼苗活性氧(ROS)积累的检测试验1 :胚胎在5 mmol·L-1 SNP 溶液的蒸汽中处理(预处理过程同上)3,27,51,75 h 后,在含有3 mL 蒸馏水的滤纸上吸胀。对照胚胎为不经过 SNP 预处理,直接在含有3 mL 蒸馏水的滤纸上吸胀。萌发培养方法和条件同上。对照和处理均设置3个重复。
试验2 : 胚胎在5 mmol·L-1 SNP 溶液的蒸汽中处理(预处理过程同上)3 h 后,在含有3 mL 300 μmol·L-1 PTIO 溶液浸湿的滤纸上吸胀。对照胚胎为不经过 SNP 预处理,直接在含有3 mL 300 μmol·L-1 PTIO 溶液的滤纸上吸胀。萌发培养方法和条件同上。对照和处理均设置3个重复。
分别在试验1和试验2的第8天时取萌发形成的幼苗进行生理分析。将发芽测定结束后各处理胚胎萌发形成的叶片与初生根分别剪开,分成上部叶片(不接触发芽床的子叶萌发形成的叶片)、下部叶片(接触发芽床的子叶萌发形成的叶片)和根(初生根)3部份。然后各部分等量分成3份并称量,用于下列指标的测定。
1)叶绿素含量的测定 将约0.05 g 的叶片用2:1体积比的丙酮乙醇混合液在25 ℃下暗中浸提8h,然后用3层滤纸过滤,测652 nm 下滤液的吸光值。结果用每 g 鲜质量材料在652 nm 下的吸光度值表示。用 U 表示一个 OD 值,叶绿素含量以 U·g-1mL-1作单位。
2)H2O2含量的测定 称取约0.05 g 的叶片用2 mL 0.1 %(W/V)冷 TCA 在冰上匀浆。浸提液在4 ℃下15 000 g 离心15 min。取上清液0.5 mL,加入0.5 mL 10 mmol·L-1磷酸钾缓冲液(pH 值7.0),在390 nm 下测定吸收值。H2O2含量用每 g 鲜质量材料在390 nm 下的吸光度值表示。用 U 表示一个OD 值,H2O2含量以 U·g-1 mL-1作单位。
3)超氧阴离子的含量 提取材料分别为胚胎萌发后形成的上部叶片、下部叶片和初生根。提取方法同上。将1.5 mL 上清液在1 mL 1 mmol·L-1盐酸羟胺(配制在50 mmol·L-1磷酸钾缓冲液中,pH值7.8)溶液中、25 ℃暗中孵化30 min。取混合液0.5 mL,连同0.5 mL 17 mmol·L-1磺胺,0.5 mL 7mmol·L-1甲萘胺溶液一起在25 ℃暗中孵化30 min。将混合液在14 000 g离心10 min 后,在540 nm下测定吸光值。用NaNO2溶液制作标准曲线。利用标准曲线方程,将 OD 值转换成 NO2-1浓度,用 U表示一个NO2-1值,超氧阴离子含量以 U·g-1 mL-1为单位。
1.2.4 数据处理和分析采用 Excel 2003软件进行数据处理和绘图,采用 DPS(唐启义等,2002)数据处理系统进行方差分析、Duncan 多重比较和相关性分析。百分数在统计分析前进行反正弦转换。图表中数据均为3次重复平均值,“±”之后为标准差。
2 结果与分析 2.1 NO 对胚胎萌发的影响 2.1.1 SNP和PTIO 对胚胎萌发的影响SNP 预处理对花楸树胚胎萌发的影响如图 1所示,各处理对胚胎萌发影响的差异达到显著水平(P<0.05)。萌发培养的第1天和第2天为子叶张开、子叶扩展和子叶变绿的过程。从第3天开始,部分胚胎的胚轴开始伸长。随着萌发培养时间延长,正常萌发的胚胎比例增加。培养第8天时,SNP + PTIO 处理的胚胎萌发率最高为86.67 %(与对照的萌发率70.09 %差异不显著),其次是 PTIO 处理(萌发率为75.17 %,与对照差异不显著)。而 SNP + H2O处理的胚胎萌发率最低(为56.67 %,与对照差异不显著)。从图 1可知,SNP + PTIO 组合处理的胚胎萌发速度较快,在培养的第3天胚胎萌发率即可达到51.11 %(约达到最终萌发率的60 %),而其他处理的胚胎萌发速度与对照基本一致。 SNP + PTIO 组合处理的胚胎最终萌发率分别高于 SNP 或 PTIO 单独处理的萌发率。说明 NO 的短期预处理可以影响花楸树的胚胎萌发,过多的外源 NO 抑制了胚胎的萌发。SNP 预处理可以逆转 NO 清除剂 PTIO 对胚胎萌发的抑制作用。
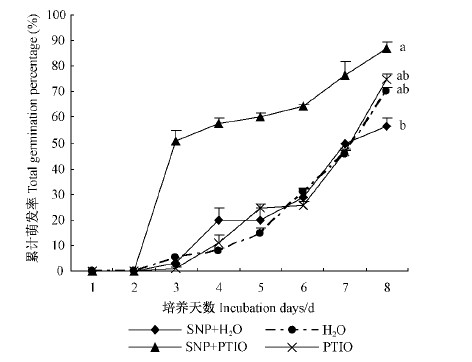 |
图 1 SNP 预处理对花楸树胚胎萌发的影响
Fig.1 Effects of SNP pretreatment on embryo germinationof S. pohuashanensis
Duncan 多重比较结果如图所示 ,数据点上不同小写字母表示种子萌发率在0.05水平上差异显著 . Means within a datapoint of germination percantge followed by different lowercase letters are significantly different from each other at P = 0.05 level of significance using the Duncan's Multiple Range Test. |
ABA 处理对花楸树胚胎萌发的影响见图 2 。培养第8天时,不同浓度 ABA 处理对胚胎萌发的影响达到极显著水平(P<0.01)。较高浓度的 ABA 处理抑制花楸树的胚胎萌发。培养第8天时,3.0 μmol·L-1 ABA处理的胚胎萌发率最低(为4.00 %,与对照差异极显著,P<0.01),其次是1.0 μmol·L-1 ABA(为34.32 %,与对照差异显著,P<0.05)。0.1μmol·L-1 ABA和0.3 μmol·L-1 ABA 处理的胚胎萌发率分别为63.47 %和86.96 %(二者与对照差异不显著,P>0.05)。
 |
图 2 ABA 处理对花楸树胚胎萌发的影响
Fig.2 Effects of ABA treatment on embryo germinationof S. pohuashanensis
Duncan 多重比较结果如图所示 ,数据点上不同大写字母表示种子萌发率在0.01水平上差异显著 . Means within a datapoint of germination percentage followed by different capitals are significantly different from each other at P = 0.01 level of significance using the Duncan's Multiple Range Test. |
SNP 与不同浓度(0.1,0.3,1.0,3.0 μmol·L-1)ABA 组合处理对花楸树胚胎萌发的影响见图 3 。胚胎从第3天开始萌发。培养第8天时,与对照相比,各处理对胚胎萌发的影响差异不显著(P>0.05)。 SNP + 0.1 μmol·L-1 ABA 处理的胚胎萌发率略高于对照(70.47 %),SNP + 0.3 μmol· L-1 ABA,SNP + 1.0 μmol·L-1 ABA,SNP + 3.0 μmol·L-1 ABA处理的胚胎萌发率略低于对照(分别为58.38 %,57.89 %和46.66 %)。比较图 2和图 3可知,SNP预处理削弱 ABA 对胚胎萌发的抑制作用。推测 SNP 预处理可能减小胚胎对 ABA 的敏感性,从而削弱 ABA 对胚胎萌发的抑制作用,并且 SNP 的作用位点可能在 ABA 作用位点的上游。
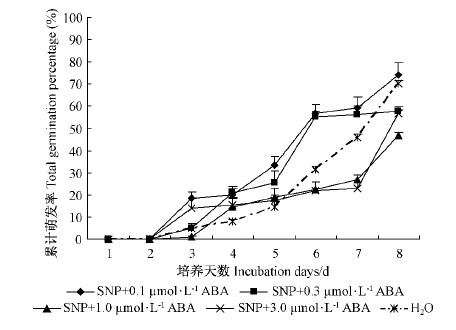 |
图 3 SNP 和 ABA 组合处理对花楸树胚胎萌发的影响
Fig.3 Effects of treatment of SNP and ABA combination on embryo germination of S. pohuashanensis
|
NBD,SNP与 NBD 组合处理对花楸树胚胎萌发的影响见图 4 。胚胎从第3天开始萌发。培养第8天时,与对照相比,各处理对胚胎萌发影响的差异不显著(P>0.05)。NBD 单独处理、SNP + NBD 处理的胚胎萌发率均低于对照(分别为45.46 %和42.18 %)。由图 4可知,NBD 处理抑制花楸树胚胎萌发,SNP 预处理不能削弱 NBD 对胚胎萌发的抑制作用。说明花楸树胚胎休眠的解除与乙烯具有密切的相关性。 SNP 与 NBD 组合处理不能提高胚胎发芽率,推测是由于 SNP 的作用位点处于 NBD 作用位点下游的原因。
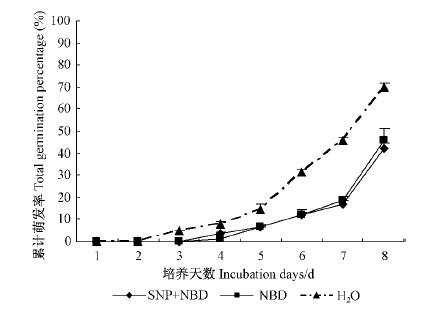 |
图 4 SNP 和 NBD 组合处理对花楸树胚胎萌发的影响
Fig.4 Effects of treatment of SNP and NBD combinationon embryo germination of S. pohuashanensis
|
1)SNP 预处理对叶绿素含量的影响 方差分析结果表明: SNP 预处理对胚胎上下部叶片的叶绿素含量和总叶绿素含量的影响均达到极显著水平(P<0.01)。多重比较结果表明: 不同 SNP 处理时间对上下部叶片中叶绿素含量和总叶绿素含量的影响均达到极显著水平(P<0.01)(表 1)。相关分析结果表明:上下部叶片中的叶绿素含量呈极显著的正相关关系(r=0.99),但与 SNP 处理时间的负相关关系不显著(r=-0.26)。各处理中,上下部叶片中叶绿素含量最多的均是 SNP 处理3 h。与对照相比,SNP 处理3 h的上部叶片中叶绿素含量增加8.88 %,下部叶片中的叶绿素含量增加24.51 % 。这些差异均达到极显著水平(P<0.01)。说明 SNP 短时间(3 h)预处理胚胎可以显著增加幼苗叶片中叶绿素含量。
|
|
2)SNP 与 PTIO 组合处理对叶绿素含量的影响 方差分析结果表明: SNP 与 PTIO 组合处理对胚胎上、下部叶片的叶绿素含量和叶绿素总含量的影响均达到极显著水平(P<0.01)。各种处理间的多重比较结果见表 2 。与 SNP 单独处理相比,SNP 与PTIO 组合处理对上部叶片中叶绿素含量影响不显著(P>0.05),但极显著增加下部叶片中的叶绿素含量和总叶绿素含量(与对照的差异也达到极显著水平,P<0.01)。与 SNP + PTIO 组合处理相比,PTIO 单独处理的胚胎萌发后其上部叶片中的叶绿素含量显著增加(21.14 %)(P<0.01),但下部叶片中的叶绿素含量则显著减小(约减小35.01 %)(P<0.01),二者的总叶绿素含量差异不显著(P>0.05)。说明 SNP 预处理使幼苗叶片中总叶绿素含量增加的效应不能被NO 清除剂 PTIO 所削弱。 NO 清除剂 PTIO 同样可以增加幼苗叶片中总叶绿素含量。推测胚胎萌发形成幼苗后,叶片中叶绿素含量与NO 含量相关不密切。
|
|
1)SNP 预处理对H2O2含量的影响 方差分析结果表明: SNP 预处理对胚胎上部叶片H2O2含量的影响不显著(P>0.05),对下部叶片细胞中的H2O2含量和总H2O2含量的影响均极显著(P<0.01)。多重比较结果见表 3 。相关分析结果表明: 上、下部叶片中的H2O2含量不相关,二者与 SNP 处理时间的正相关关系不显著(r= 0.48)。各处理中,SNP 处理75 h 的上、下部叶片中的H2O2含量均为最多。与对照相比,SNP处理75 h 的上部叶片中H2O2含量增加0.45 %,下部叶片中H2O2含量增加1 260.75 % 。 SNP 处理75 h 的上下部叶片中差异达到极显著水平(P<0.01)。说明 SNP 预处理可以显著引起幼苗叶片中H2O2含量增加。
|
|
2)SNP 与 PTIO 组合处理对H2O2含量的影响 方差分析结果表明: SNP 与 PTIO 组合处理对胚胎上下部叶片的H2O2含量和总H2O2含量的影响差异不显著(P>0.05)(表 4)。与 SNP 单独处理相比,SNP 预处理后的 PTIO 处理减少上、下部叶片中H2O2含量,总H2O2含量相应减少。与 SNP + PTIO 组合处理相比,胚胎一直在 PTIO 中吸胀的处理,使上部叶片细胞中的H2O2含量增加34.04%,但显著减小下部叶片中的H2O2含量(约51.94%),总H2O2含量也被减小。说明 SNP 预处理引起的幼苗叶片中H2O2含量增加可以被 NO 清除剂 PTIO 所减少。
|
|
1)SNP 预处理对超氧阴离子含量的影响 方差分析结果表明: SNP 预处理对胚胎上部叶片超氧阴离子含量的影响不显著(P>0.05),下部叶片及根系中超氧阴离子含量的影响均极显著(P<0.01),对总超氧阴离子含量的影响极显著(P<0.01)。多重比较结果见表 5 。相关分析结果表明: 上、下部叶片、上部叶片与根系中超氧阴离子含量的正相关关系显著(P>0.05),下部叶片与根系中超氧阴离子含量的正相关关系极显著(r= 0.94),根系中超氧阴离子含量与 SNP 处理时间的负相关关系显著(r=- 0.84),但上、下部叶片中超氧阴离子含量与 SNP处理时间不相关。各处理中,SNP 处理3 h 的上、下部叶片及根系中超氧阴离子含量均为最多。与对照相比,SNP 处理3 h 的上部叶片中超氧阴离子含量增加0.41 %,下部叶片中的超氧阴离子含量增加19.57 %,根系中超氧阴离子含量减少22.26 % 。说明 SNP 短时间预处理可以增加幼苗下部叶片中超氧阴离子含量,随着处理时间延长,则使幼苗各部分构件中的超氧阴离子含量以及总超氧阴离子含量减少。
|
|
2)SNP 与 PTIO 组合处理对超氧阴离子含量的影响 方差分析结果表明: SNP 与 PTIO 组合处理对胚胎上、下部叶片及根系的超氧阴离子含量以及超氧阴离子总含量的影响均不显著(P>0.05)(表 6)。与 SNP 单独处理相比,SNP 预处理后的 PTIO处理增加上部叶片及根系中超氧阴离子含量,但使下部叶片中的超氧阴离子含量减少。与 SNP + PTIO 组合处理相比,胚胎一直在 PTIO 中吸胀的处理,使上部叶片细胞中的超氧阴离子含量增加4.01 %,下部叶片中的超氧阴离子含量增加21.86 %,使根系中的超氧阴离子含量下降34.71 % 。说明 PTIO 处理可抑制 SNP 预处理引起的下部叶片中超氧阴离子含量增加。 PTIO 对根部超氧阴离子含量的抑制作用可以被 SNP 预处理削弱。
|
|
本研究结果表明,SNP 短时间预处理可以影响花楸树胚胎萌发。NO 清除剂(PTIO)具有抑制胚胎的萌发作用,这种抑制效应可以被 SNP 预处理逆转。研究结果支持 NO 能够影响种子休眠解除的结论。NO 抑制剂的试验说明 NO 是一种种子休眠的内源性调节阀。 NO 能够促进许多植物种子的萌发,特别是光敏感种子的萌发(Giba et al.,2007)。 NO 对植物种子萌发的作用具有浓度效应,低浓度的 NO 对种子萌发有促进作用,高浓度 NO 则抑制种子萌发(Giba et al.,2007)。本研究中使用5 mmol·L-1 SNP 预处理3 h 的试验方法是参考Gniazdowska等(2007)报道的用于苹果胚胎萌发研究所使用的浓度。在培养第8天时统计胚胎萌发率,结果发现 SNP + PTIO 处理的花楸树胚胎萌发率最高(86.67 %,高于对照),而 SNP + H2O处理的胚胎萌发率最低(56.67 %,低于对照)。说明5 mmol·L-1 SNP 预处理3 h 对于花楸树裸胚来说处理浓度过高,因此当使用 PTIO 清除掉多余的 NO 后,胚胎萌发率得到提高。这提示在今后进一步的研究中应该适当降低 SNP 处理浓度或是减少 SNP 处理时间。同时,本研究结果也间接证明了 NO 对植物种子萌发具有浓度效应的结论。
较高的 ABA 含量是维持花楸树种子休眠的重要调控因子(杨玲等,2008 b)。花楸树新采收并调制干燥后的种子中含有较高的 ABA 含量,在2~5℃低温层积过程中花楸树种皮内 ABA 含量显著降低(杨玲等,2008 b)。本研究发现,较高浓度外源 ABA 抑制花楸树胚胎萌发,SNP 预处理可以削弱 ABA 对胚胎萌发的抑制作用。推测 SNP 预处理可能减小胚胎对 ABA 的敏感性,从而削弱 ABA 对胚胎萌发的抑制作用,并且 SNP 的作用位点可能在 ABA 作用位点的上游。该研究结果提示可在苗木培育中用 SNP 作为花楸树种子催芽处理的预处理剂,以使种子提早萌发,提高苗木产量。
Gniazdowska等(2007)认为 NO 打破种子休眠与乙烯的产生具有密切的相关性,乙烯合成抑制剂 AOA 可以逆转 NO 对胚胎萌发的促进效果。本研究发现,乙烯受体抑制剂(NBD)可以抑制花楸树胚胎萌发。说明花楸树胚胎休眠的解除与乙烯具有密切的相关性。SNP 预处理不能削弱 NBD 对胚胎萌发的抑制作用。推测是由于 SNP 的作用位点处于 NBD 作用位点下游的原因。
Gniazdowska等(2010)认为 NO和HCN 对休眠的苹果胚萌发的有益影响是与胚中和萌发的各个阶段中H2O2和超氧阴离子含量增加相关。本文的研究结果支持了这个结论。 SNP 短时间(3 h)预处理胚胎可以显著增加花楸树幼苗叶片中叶绿素含量。这种增加效应不能被 PTIO 削弱。 PTIO 同样可以增加幼苗叶片中总叶绿素含量。推测胚胎萌发形成幼苗后,叶片中叶绿素含量与 NO 含量相关不密切。 SNP 预处理可以显著引起花楸树幼苗叶片中H2O2含量增加。这种增加效应可以被 PTIO 削弱。同样的,SNP 短时间(3 h)预处理可以增加花楸树幼苗下部叶片中超氧阴离子含量,但随着处理时间延长,则使幼苗各部分构件中的超氧阴离子含量以及总超氧阴离子含量减少。 PTIO 处理抑制 SNP 预处理引起的下部叶片中超氧阴离子含量增加。 PTIO 对根部超氧阴离子含量的抑制作用可以被 SNP 预处理削弱。说明 NO 可以对花楸树胚胎中和萌发各个阶段中的叶绿素合成、H2O2和超氧阴离子的代谢起到一定调节作用。SNP 短时间预处理对花楸树胚胎萌发的影响可能与胚胎中和萌发各个阶段中的H2O2和超氧阴离子含量的增加存在密切的相关性。
本文的研究结果不仅揭示了 NO 在花楸树胚胎休眠解除和幼苗初期发育过程中的调控作用及其与植物内源激素的关系,而且为生产中改进花楸树播种育苗方法、提高苗木产量提供了理论依据。
| [1] |
刘玮,李长海,宿宗艳.2006.花揪引种及繁育技术研究.黑龙江生态工程职业学院学报,(1): 18-19.( 1) 1)
|
| [2] |
沈海龙,杨玲,张建英,等.2006.花楸种子休眠影响因素与萌发特性研究.林业科学, 42(10): 133-138.( 2) 2)
|
| [3] |
苏喜廷,王国义,张淑华,等.2005.黑龙江省主要阔叶树种绿枝扦插的效果.东北林业大学学报, 33(5): 13-18.( 1) 1)
|
| [4] |
唐启义,冯光明.2002.实用统计分析及其DPS数据处理系统.北京:科学出版社, 156-157.( 1) 1)
|
| [5] |
许建伟,沈海龙,张秀亮,等.2010.花楸树种子散布、萌发与种群天然更新的关系.应用生态学报, 21(10): 2536-2544.( 1) 1)
|
| [6] |
杨玲,崔晓涛,沈海龙.2009.外源激素与温度对花楸树种子萌发的影响.植物生理学通讯, 45(6): 555-560.( 1) 1)
|
| [7] |
杨玲,刘春苹,沈海龙.2008a.低温层积时间和发芽温度对花楸种子萌发的影响.种子, 27(10): 20-23, 25.( 2) 2)
|
| [8] |
杨玲,沈海龙,梁立东,等.2008b.人工干燥和冷层积过程中的花楸树种子中内源激素含量变化.植物生理学通讯, 44(4): 682-688.( 3) 3)
|
| [9] |
杨玲,沈海龙,刘春苹,等.2010.花楸合子胚诱导体细胞胚胎发生研究.植物研究, 30(2): 174-179.( 1) 1)
|
| [10] |
郑健,郑勇奇,吴超,等.2007.花楸树的地理分布及天然更新方式.林业科学, 43(12): 86-93.( 1) 1)
|
| [11] |
Beligni M V, Lamattina L.2000.Nitric oxide stimulates seed germination and de-etiolation, and inhibits hypocotyls elongation, three light-in duciblere sponses in plants. Planta, 210(2): 215-221.( 1) 1)
|
| [12] |
Bethke P, Gubler F, Jacobsen J V,et al.2004.Dormancy of Arabidopsis seeds and barley grains can be broken by nitric oxide. Planta, 219(5): 847-855.( 3) 3)
|
| [13] |
Giba Z, GrubišiåD, Konjev ï R.2007.Seeking the role of NO in breaking seed dormancy. Plant Cell Monographs, 25(6): 91-111.( 2) 2)
|
| [14] |
Gniazdowska A, Dobrzyjska U,Babajczyk T, et al.2007.Breaking the apple embryo dormancy by nitric oxideinvolves the stimulation of ethylene production. Planta, 225(4): 1051-1057.( 4) 4)
|
| [15] |
Gniazdowska A, Krasuska U, Czajkowska K, et al.2010.Nitric oxide, hydrogen cyanide and ethylene are required in the control of germination and undisturbed development of young apple seedlings. Plant Growth Regulation, 61(1): 75-84.( 4) 4)
|
| [16] |
Renata B, Agnieszka G.2006.Nitric oxide and HCN reduce deep dormancy of apple seeds. Acta Physiologiae Plantarum, 28(3): 281-287.( 1) 1)
|
| [17] |
Yang L, Li Y H, Shen H L.2012.Somatic embryogenesis and plant regeneration from immature zygotic embryo cultures of mountain ash(Sorbus pohuashanensis). Plant Cell, Tissue and Organ Culture, 109(3): 547-556.( 2) 2)
|
| [18] |
Yang L, Shen H L.2011.Effect of electrostatic field on seed germination and seedling growth of Sorbus pohuashanesis. Journal of Forest Research, 22(1): 27-34.( 2) 2)
|
 2013, Vol.49
2013, Vol.49

